Digitoxin Awd 0,07
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Digitoxin AWD 0,07 0,07 mg/Tablette
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Digitoxin
Jede Tablette enthält 0,07 mg Digitoxin.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM Tablette
Die Bruchkerbe dient nicht zum Teilen der Tablette.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- manifeste chronische Herzinsuffizienz (auf Grund systolischer Dysfunktion)
- Tachyarrhythmia absoluta bei Vorhofflimmern/Vorhofflattern
- paroxysmales Vorhofflimmern/Vorhofflattern
4.2 Dosierung und Art der Anwendung
Wegen der geringen therapeutischen Breite von Digitoxin ist eine sorgfältig überwachte Einstellung auf die individuelle therapeutische Dosis notwendig.
Die Höhe der individuellen Dosierung hängt vom Glykosidbedarf sowie von der Eliminationsgeschwindigkeit ab.
Die Dosierung sollte individuell - vor allem nach dem Behandlungserfolg - festgelegt werden. Häufig ist eine tägliche Erhaltungsdosis von 0,07-0,1 mg Digitoxin ausreichend, um effektive DigitoxinSerum-Konzentrationen zu erreichen.
Für die Entscheidung über eine eventuelle Dosiserhöhung kann die Bestimmung der Digitoxin-SerumKonzentration hilfreich sein. Allerdings sollte bedacht werden, dass der Assay auch auf andere Glykoside anspricht und somit falsch positive Messergebnisse liefern kann. Eine Beobachtung des Patienten während eines vorübergehenden Absetzens der Dosierung von Digitoxin könnte daher geeigneter sein.
Patienten mit einigen besonderen Krankheitsbildern müssen mit reduzierter Glykosiddosierung und unter sorgfältiger ärztlicher Überwachung behandelt werden (siehe auch entsprechende Hinweise im Abschnitt 4.3 - Gegenanzeigen).
Eine regelmäßige Kontrolle des klinischen Bildes bei gleichzeitigem Monitoring der Digitoxin-SerumKonzentrationen ist zu empfehlen.
Im Allgemeinen wird in Abhängigkeit vom Glykosidbedarf in der Praxis mit einer mittelschnellen Sättigungsbehandlung begonnen. Dafür wird bei Erwachsenen drei Tage lang 0,2-0,3 mg Digitoxin gegeben. Ab dem 4. Tag erfolgt die Erhaltungsbehandlung mit 0,07-0,1 mg Digitoxin.
Folgende Empfehlungen können als Anhaltspunkte für die Einleitung der Behandlung (Aufsättigung) und Dauertherapie dienen:
a) Bei Patienten über 60 Jahre, außer bei stark Muskulösen, bei denen wie unter b) dosiert wird: mittelschnelle Sättigungsbehandlung über 3 Tage:
z. B. 3-mal täglich 1 Tablette Digitoxin AWD 0,07 (entsprechend 0,21 mg Digitoxin/Tag).
Erhaltungsbehandlung ab 4. Tag:
z. B. 1-mal täglich 1 Tablette Digitoxin AWD 0,07
(entsprechend 0,07 mg Digitoxin/Tag).
Für höhere Dosierungen (z. B. 0,08 mg, 0,1 mg) sind Darreichungsformen mit geeigneterem Wirkstoffgehalt einzusetzen.
b) Bei Patienten unter 60 Jahren, außer bei Untergewichtigen, bei denen wie unter a) dosiert wird, empfiehlt sich eine höhere Dosierung:
z. B. Sättigungsdosis:
3-mal täglich 0,1 mg Digitoxin über 3 Tage.
Erhaltungsdosis:
1-mal täglich 0,1 mg Digitoxin.
Es stehen entsprechende Darreichungsformen mit höherem Wirkstoffgehalt zur Verfügung. Eingeschränkte Leber- und/oder Nierenfunktion
Bei gleichzeitig bestehender schwerer Leber- und Niereninsuffizienz kann der Digitoxinbedarf vermindert sein.
Auch wird empfohlen, den Digitoxinbedarf bei Patienten mit sehr schwerer Niereninsuffizienz (GFR < 10 ml/min) insbesondere zu Beginn der Therapie zu überprüfen und ggf. die Dosierung zu vermindern.
Umstellung von Digoxin auf Digitoxin
Eine vorausgegangene Behandlung mit anderen Herzglykosiden ist bei der Digitoxin AWD 0,07-Dosierung zu berücksichtigen. Bei vorangegangenen Gaben von Digoxin und seinen Derivaten oder anderen Herzglykosiden ist bei der Umstellung auf die oben genannte Digitoxin AWD 0,07-Form bei Nierengesunden eine Behandlungspause von 2 Tagen bzw. bei Patienten mit gestörter Nierenfunktion (z. B. älteren Patienten) eine Behandlungspause von 3 Tagen oder länger einzuhalten.
Bereits mit Herzglykosiden vorbehandelte Patienten sollten bei Umstellung auf Digitoxin besonders engmaschig kontrolliert werden.
Über die Dauer der Anwendung entscheidet der behandelnde Arzt.
Die Digitalis-Bedürftigkeit des Patienten sollte bei Langzeittherapie durch kontrollierte Auslassversuche überprüft werden.
Die Tabletten sind nicht zur Teilung vorgesehen!
Digitoxin AWD 0,07 sollte vorzugsweise nach einer Mahlzeit unzerkaut mit ausreichend Flüssigkeit eingenommen werden.
Es ist unbedingt darauf zu achten, dass dieses Arzneimittel regelmäßig in der vom Arzt verordneten Menge eingenommen wird.
Überwachung der Serumspiegel
Digitoxin-Serum-Spiegel können mittels Radioimmunoassay bestimmt werden. Die Blutentnahme sollte vor der täglichen Gabe erfolgen. Die therapeutischen Serumkonzentrationen im steady state liegen in der Regel zwischen 10 und 30 ng/ml; höhere Werte insbesondere über 35 ng/ml können mit toxischen Erscheinungen einhergehen.
Andere Glykoside, Spironolacton und dessen Metaboliten sowie die Metaboliten von Digitoxin können mit den Radioimmunoassays interferieren. Daher sollten Messwerte, die mit dem klinischen Zustand des Patienten nicht im Einklang stehen, mit Vorsicht interpretiert werden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegenüber Digitoxin, anderen herzwirksamen Glykosiden oder einem der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Verdacht auf Digitalis-Intoxikation
- Kammertachykardie oder Kammerflimmern
- AV-Block II. oder III. Grades, pathologische Sinusknotenfunktion (ausgenommen bei Schrittmacher-Therapie)
- vorgesehene elektrische Kardioversion
- akzessorische atrioventrikuläre Leitungsbahnen (z. B. WPW-Syndrom) oder Verdacht auf solche
- Carotissinussyndrom
- Hypokaliämie
- Hyperkalziämie, Hypomagnesiämie
- hypertrophe Kardiomyopathie mit Obstruktion
- thorakales Aortenaneurysma
- gleichzeitige intravenöse Gabe von Kalziumsalzen (siehe Abschnitt 4.5 - Wechselwirkungen)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei
- Bradykardie infolge von Erregungsbildungs- und/oder -leitungsstörungen, AV-Block I. Grades
- Hyperkaliämie, da vermehrt Erregungsbildungs- und -leitungsstörungen auftreten können
- älteren Patienten oder wenn anzunehmen ist, dass die renale Clearance von Digitoxin vermindert ist (siehe auch Abschnitt 4.2 - Dosierung)
- Schilddrüsenerkrankungen (bei einer Hypothyreose sollten Aufsättigungs- und Erhaltungsdosis verringert werden; bei einer Hyperthyreose kann eine Dosiserhöhung erforderlich sein)
- akutem Myokardinfarkt (Patienten mit akutem Myokardinfarkt sind z. B. häufig hypokaliämisch und/oder neigen zu Herzrhythmusstörungen)
- akuter Myokarditis, Cor pulmonale oder Hypoxämie infolge schwerer Atemwegserkrankung, da eine erhöhte Empfindlichkeit gegenüber Digitalis-Glykosiden besteht
- Patienten, die in den vorangegangenen 2 Wochen Herzglykoside erhalten haben. Hier kann eine verringerte Aufsättigungsdosierung nötig sein.
Hinweise:
Es bestehen erhebliche interindividuelle Unterschiede der Glykosidempfindlichkeit.
Eine erhöhte Glykosidempfindlichkeit besteht z. B. bei Patienten höheren Lebensalters, Hypothyreose, Hypoxämie, Myokarditis, akutem Myokardinfarkt, Störungen des Säure-, Basen- und Elektrolythaushaltes. Entsprechende Patienten bzw. Krankheitsbilder sollten mit reduzierter Glykosiddosierung behandelt und sorgfältig überwacht werden.
Eine Digitoxin-Toxizität kann sich durch das Auftreten von Arrhythmien äußern, von denen einige solchen Arrhythmien ähneln können, für die das Arzneimittel therapeutisch angezeigt sein könnte. Z. B. ist besondere Vorsicht erforderlich bei Vorhoftachykardie mit wechselndem AV-Block, da der Rhythmus klinisch einem Vorhofflimmern entspricht.
Digitoxin kann ST-T Veränderungen im EKG verursachen, ohne dass gleichzeitig eine Myokardischämie vorliegt.
Für die Beurteilung, ob ein unerwünschtes Ereignis auf Digitoxin zurückzuführen ist, sollte der klinische Zustand des Patienten zusammen mit den Serum-Kalium-Spiegeln sowie der Nieren- und Schilddrüsenfunktion als wichtigste Faktoren herangezogen werden.
Bei Kaliummangel wird das Myokard für Digitoxin sensibilisiert, obwohl die Digitoxin-SerumKonzentration im therapeutischen Bereich liegen kann.
Ein Kaliummangel kann z. B. auftreten durch Dialyse, Absaugen von Magen-Darm-Sekret, Unterernährung, Durchfall, längeres Erbrechen sowie bei hohem Alter oder bei chronischer Herzinsuffizienz (z. B. infolge von Diuretikatherapie).
Im Allgemeinen sollten schnelle Änderungen der Serum-Kalium-Konzentration oder anderer Elektrolyte (z. B. Magnesium, Calcium) vermieden werden.
Eine Nierenfunktionsstörung ist einer der häufigsten Gründe für die Auslösung einer DigitalisIntoxikation.
Kontrollen der Serum-Elektrolyte sowie der Nierenfunktion sollten in regelmäßigen Abständen (in Abhängigkeit vom klinischen Zustand) erfolgen.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Digitoxin AWD 0,07 nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen können resultieren aus einer Beeinflussung der renalen Ausscheidung, der Bindung an Körpergewebe, der Plasmaproteinbindung, der Verteilung, der Resorptionskapazität des Darmes und der Empfindlichkeit gegenüber Digitoxin.
Als Vorsichtsmaßnahme sollte bei jeglicher zusätzlicher Therapie die Möglichkeit einer Interaktion berücksichtigt werden. Im Zweifelsfall sollten die Digitoxin-Serum-Spiegel überprüft werden.
Eine Übersicht von Wechselwirkungen gibt die nachstehende Tabelle.
Wirkungsverstärkung
|
Calcium (darf nicht i.v. injiziert werden) |
Verstärkung der Glykosidtoxizität |
|
Arzneimittel, die die Elektrolyt-Homöostase beeinflussen wie z. B. Diuretika (gerade im Hinblick auf Kaliuretika), Laxantien (Abusus), Benzylpenicillin, Amphotericin B, Carbenoxolon, Korticosteroide, ACTH, Salicylate, Lithiumsalze |
Verstärkung der Glykosidtoxizität durch medikamentös bedingte Hypokaliämie bzw. Hypomagnesiämie |
|
CYP3A-Inhibitoren, wie bestimmte Antibiotika (z.B. Makrolide), bestimmte Antimykotika (z.B. Itraconazol), Steroidhormone (z. B. Prednison, Danazol), bestimmte Antidepressiva (z. B. Fluoxetin), Proteaseinhibitoren (z. B. Indinavir, Ritonavir), Calciumantagonisten (z. B. Verapamil, Nifedipin, Diltiazem) oder betimmte Antiarrhythmika (z. B. Amiodaron). |
Erhöhung der Digitoxin-Serum-Konzentration |
|
ß-Blocker |
Verstärkung der bradykardisierenden Wirkung |
|
P-Glykoprotein-Inhibitoren, wie bestimmte Antibiotika (z. B. Makrolide, Tetrazykline) oder Chinidin. |
Erhöhung der Digitoxinserumkonzentration |
|
Antibiotika, die den Abbau von Digitoxin durch E. lentum hemmen (dies trifft nur für 10% der Bevölkerung zu), wie Makrolide, Carbapeneme und ß-Lactamantibiotika. |
Erhöhung der Digitoxinserumkonzentration |
|
Muskelrelaxantien (z. B. Suxamethoniumchlorid, Pancuronium) Reserpin, trizyklische Antidepressiva, Sympathomimetika, Phosphodiesterasehemmer (z. B. Theophyllin). Lithium (bei Patienten mit sinuatrialem Block) Wirkungsabschwächung |
Begünstigung von Herzrhythmusstörungen |
|
Kaliumspiegel-erhöhende Arzneimittel (z. B. Spironolacton, Kaliumcanrenoat, Amilorid, Triamteren, Kaliumsalze) |
Verminderung der positiv inotropen Wirkung von Digitoxin und Begünstigung von Herzrhythmusstörungen |
|
Aktivkohle, Colestyramin, Colestipol, KaolinPektin, einige Füll- oder Quell-Laxantien |
Verminderung der Glykosidresorption durch Bindung - daher Digitoxin AWD 0,07 Tabletten 2 Stunden vorher einnehmen - bzw. Beschleunigung der Elimination durch Unterbrechung des enterohepatischen Kreislaufs |
|
Arzneimittel, die CYP3A oder P-Glycoprotein induzieren, wie z. B. Phenylbutazon, Phenobarbital, Phenytoin, Rifampicin, Spironolacton, Barbiturate |
Erniedrigung der Digitoxin-Serum-Konzentration |
|
4.6 Schwangerschaft und Stillzeit |
Während der Schwangerschaft ist die Patientin besonders sorgfältig zu überwachen und auf eine individuelle, bedarfsgerechte Dosierung zu achten. Bisherige Erfahrungen mit Digitalis-Glykosiden in therapeutischen Dosierungen während der Schwangerschaft haben keine Hinweise auf eine Schädigung des Embryos oder Föten ergeben. Während der letzten Wochen der Schwangerschaft kann der Glykosidbedarf ansteigen.
Nach der Geburt ist dagegen häufig eine Dosisreduzierung angezeigt. Nach Digitalis-Vergiftungen der Mutter wurde auch beim Föten über Intoxikationserscheinungen berichtet.
Digitoxin wird in die Muttermilch abgegeben, daher sollte vorsichtshalber abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen wird nicht beeinträchtigt.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zu Grunde gelegt: sehr häufig (> 1/10)
|
häufig gelegentlich selten sehr selten nicht bekannt |
(> 1/100 bis < 1/10) (> 1/1000 bis < 1/100) (> 1/10 000 bis < 1/1000) (< 1/10 000) (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
Kardiale Nebenwirkungen werden am häufigsten beobachtet. Grundsätzlich ist jede Form von Herzrhythmusstörungen unter der Therapie mit Digitoxin AWD 0,07 möglich. Das Auftreten von Herzrhythmusstörungen wird durch das zusätzliche Vorliegen von Elektrolytstörungen (Kalium, Kalzium, Magnesium) begünstigt.
|
Systemorganklasse (MedDRA) |
Sehr häufig (>1/10) |
Häufig (>1/100, <1/10) |
Gelegentlich (>1/1000, <1/100) |
Selten (>1/10 000, <1/100) |
Sehr selten (<1/10.000) |
|
Herzerkrankungen |
Jede Form von Herzrhythmusstörungen, insbesondere Extraschläge, die von den Herzkammern ausgehen (Extrasystolen), Kammertachykardien (Bigeminie/Trigeminie = Doppel-/Dreifachschläge). Schnelle Schlagfolge der Vorhöfe (Vorhoftachykardien) (bei sehr hoher Dosierung). Erregungsleitungsstörungen zwischen Herzvorhof und Herzkammer (AVBlock I. - III. Grades), Störungen der Herzschlagfolge (z. B. Verlangsamung der Herzfrequenz [Bradykardie]). | ||||
|
Augenerkrankungen |
Veränderung des Farbsehens (Grün-/Gelb-Bereich) bereits im therapeutischen Bereich |
|
Erkrankungen des Gastrointe stinaltrakts |
Appetitlosigkeit, Übelkeit (das Auftreten von Übelkeit sollte als frühes Zeichen einer übermäßig hohen Dosierung angesehen werden), Erbrechen, Abdominelle Beschwerden (z. B. Bauchschmerzen), Durchfall |
Gefäßverschluss im Bauchraum (Mesenterialinfarkt) | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelschwäche | ||||
|
Endokrine Erkrankungen |
Vergrößerung der Brustdrüse beim Mann (Gynäkomastie) (bildet sich nach Absetzen von Digitoxin AWD 0,07 i. d. R. wieder zurück.) | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Kopfschmerzen, Müdigkeit, Schlaflosigkeit |
|
Erkrankungen des Immunsystems |
Allergische Reaktionen bilden sich nach Absetzen von Digitoxin AWD 0,07 in der Regel wieder zurück. Nesselsuchtartige oder scharlachartige Hautausschläge mit Veränderungen im Blutbild (ausgeprägter Eosinophilie), Hautrötung (Erythem); Verminderung der Blutplättchen (Thrombozytopenie) oder Schmetterlingserythem (Lupus erythematodes) | ||||
|
Psychiatrische Erkrankungen |
Psychische Veränderungen (z. B. Alpträume, Agitiertheit, Verwirrtheit) sowie Depressionen, Sinnestäuschungen (Halluzinationen) und Psychosen |
Sprachstörungen (Aphasien), Schwäche, Teilnahmslosigkeit (Apathie) und Unwohlsein |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
4.9 Überdosierung
Symptome einer Überdosierung
Bei Überdosierung können, individuell verschieden, die allgemein von Digitalis-Glykosiden bekannten kardialen, gastrointestinalen und zentralnervösen Nebenwirkungen auftreten. Eine typische Reihenfolge des Auftretens der Symptome gibt es nicht. Extrakardiale und kardiale Symptome können gleichzeitig oder nacheinander vorkommen, wobei die kardialen Zeichen einer Digitalis-Intoxikation weitaus ernster zu bewerten sind.
Glykosid-Intoxikationen mit letalem Ausgang sind in der Regel Folge von kardiotoxischen Wirkungen der Glykoside.
Bei digitalisierten Patienten ist das Auftreten einer Herzrhythmusstörung stets als digitalisbedingt aufzufassen, solange nicht durch einen Auslassversuch oder eine Serumspiegelbestimmung das Gegenteil erwiesen ist.
Bei einer akuten Überdosierung kann eine Hyperkaliämie auftreten, wogegen eine Hypokaliämie häufig mit chronischer Überdosierung assoziiert ist. Die toxischen Wirkungen können bis zu 12 Stunden nach einer akuten Überdosierung noch zunehmen.
Therapiemaßnahmen bei Überdosierung
Bei Überdosierung muss die Behandlung mit Digitoxin AWD 0,07 sofort abgebrochen werden. Die Reihenfolge und Art der therapeutischen Maßnahmen richten sich nach dem Schweregrad der Intoxikation:
Bei nur leichter Digitoxin-Intoxikation reichen Absetzen von Digitoxin AWD 0,07 und sorgfältige Überwachung des Patienten aus. Bedingungen, die zu einer Verminderung der Digitalis-Toleranz führen, sind zu vermeiden bzw. zu korrigieren (z. B. Störungen im Elektrolyt- und/oder Säure-BasenHaushalt).
Bedrohliche, digitalisinduzierte Herzrhythmusstörungen
Diese Patienten sollten unter EKG-Monitoring intensivmedizinisch betreut werden. Kalium- und Digitoxin-Serum-Konzentration sollten engmaschig kontrolliert werden.
In Abhängigkeit von der klinischen Situation können folgende Maßnahmen ergriffen werden bei:
- Hypokaliämie:
Anheben des Serum-Kalium-Spiegels auf hochnormale Werte (Kontraindikation: retrograde AV-Blockierungen bei nicht vorhandener Schrittmacher-Therapie)
- komplexen ventrikulären Arrhythmien:
Verabreichung von Phenytoin 250 mg i.v. über 10 min, dann Therapie per os fortsetzen oder Lidocain 100 mg i.v. als Bolus, dann Infusion von 2 mg/min
- bradvkarden Hcrzrhvthmusstörungcn:
Verabreichung von Parasympatholytika (z. B. Atropin, Ipratropiumbromid), ggf. ist eine passagcrc transvcnösc Schrittmachersonde angezeigt.
Ein eventuell vorhandenes Magnesiumdefizit ist auszugleichen.
Lebensbedrohliche Intoxikationen
Bei Einnahme extrem hoher Dosen erfolgen Maßnahmen der primären Giftelimination:
Magenspülung, wenn die Einnahme nicht lange zurückliegt, anschließend Aktivkohle, Colestyramin oder Colcstipol.
Therapie der Wahl einer schweren Digitoxin-Intoxikation ist die Behandlung mit spezifischem Digitalis-Antikörperfragment (Digitalis-Antidot), das freies Glykosid zu unwirksamen AntikörperGlykosid-Komplexen im Extrazellularraum bindet, die dann über die Nieren ausgcschicdcn werden.
Digitoxin-Serumspiegelmessungen können nach Antidotgabe - je nach Bestimmungsmethode -vorübergehend sehr hohe Werte anzeigen.
Im Rahmen schwerer Intoxikationen treten initial häufig bedrohliche Hyperkaliämien auf, zur Therapie dieser Hyperkaliämien ist die intravenöse Infusion hochprozentiger Glukose und Insulin indiziert.
Forcierte Diurese, Peritoneal- und Hämodialyse haben sich als unwirksam zur Digitoxin-Elimination erwiesen.
Vor allem durch die selektive Hämoperfusion mit trägergebundenen Digitoxin-Antikörpern, aber in geringem Umfang auch durch die Hämoperfusion mit beschichteter Aktivkohle oder Plasmapherese kann der Körperbestand von Digitoxin vermindert werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Digitalisglykosid ATC-Codc: C01AA04
Digitoxin ist ein langwirkendes Glykosid (Cardcnolid). Der kardiale Effekt des Digitoxins ist gekennzeichnet durch:
1. eine positiv inotrope Wirkung
(gesteigerte Kontraktionskraft und -geschwindigkeit bei verzögerter Relaxationszeit)
2. eine negativ chronotropc Wirkung (Abnahme der Schlagfrequenz)
3. eine negativ dromotropc Wirkung (Verzögerung der Erregungsleitung) und
4. eine positiv bathmotrope Wirkung
(gesteigerte Erregbarkeit, besonders im Bereich der Kammermuskulatur)
Die pharmakodynamischen Effekte von Digitoxin sind bis zu 21 Tagen beobachtbar.
Die primäre Digitoxin-Wirkung ist die spezifische Hemmung der Adenosintriphosphatase und damit des aktiven Transports von Natrium/Kalium-Ionen (Na+/K+). Die veränderte Ionenverteilung an der
Membran bewirkt einen vermehrten Einstrom von Calcium-Ionen und damit eine Zunahme an verfügbarem Calcium zum Zeitpunkt der elektromechanischen Kopplung. Die Wirksamkeit von Digitoxin kann daher verstärkt sein, wenn die extrazelluläre Kalium-Konzentration niedrig ist; demgegenüber hat eine Hyperkalziämie den umgekehrten Effekt.
Die Hemmung des Na+/K+-Austausches führt zu einer Reduktion der Impulsüberleitungsrate im Vorhof und dem AV-Knoten und einer Sensibilisierung der Karotissinusnerven. Indirekt resultieren Veränderungen der kardialen Kontraktilität auch aus der veränderten venösen Dehnbarkeit, die durch den veränderten vegetativen Tonus und die direkte venöse Wirkung hervorgerufen wird.
5.2 Pharmakokinetische Eigenschaften
Die Bioverfügbarkeit des Digitoxins nach oraler Applikation liegt bei 98-100 %.
Die Plasmaproteinbindung von Digitoxin liegt bei etwa 90-97 %. Der Anteil der freien DigitoxinFraktion im Plasma beträgt bei der Dauerbehandlung Nierengesunder etwa 0,8 ng/ml.
Das Verteilungsvolumen variiert interindividuell zwischen 0,4 und 1 l/kg.
Digitoxin unterliegt einem enterohepatischen Kreislauf.
Etwa 2 % des Gesamtdigitoxins werden in der Leber zu Digoxin hydroxyliert, der größte Teil wird zu Digitoxigenin nach schrittweiser Abspaltung der Digitoxosen epimerisiert und anschließend sulfatiert oder glukuronidiert.
Bei leber- und nierengesunden Patienten werden ca. 60 % über die Nieren, davon die Hälfte als konjugierte Metaboliten und ca. 40 % im Stuhl ausgeschieden. Die tägliche Abklingquote beträgt 7-10 %. Die Eliminationshalbwertszeit beträgt im Mittel 7-8 Tage.
Alleinige Störungen der Nierenfunktion haben kaum einen Einfluss auf die Elimination von Digitoxin, da die reduzierte renale Elimination durch vermehrte Metabolisierung und fäkale Elimination kompensiert wird.
Bei Leberinsuffizienz kann, bei gleichzeitiger Leber- und Niereninsuffizienz muss mit erhöhten Digitoxin-Plasmaspiegeln gerechnet werden.
Dialyse eliminiert Digitoxin nur geringfügig, da der größte Teil des Digitoxins an Plasmaproteine gebunden ist.
Bioverfügbarkeit
Eine im Jahr 1993 durchgeführte Bioverfügbarkeitsuntersuchung an 16 Probanden ergab im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration (css,max) ng/ml: |
18,7 ± 2,4 |
18,9 ± 2,7 |
|
Zeitpunkt der maximalen Plasmakonzentration (tss,max) h: |
1,6 ± 0,9 |
1,3 ± 1,2 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUCss,0-24h) ng • h/ml: |
334,0 ± 54,0 |
332,0 ± 34,3 |
Angabe der Werte als Mittelwert und Streubreite
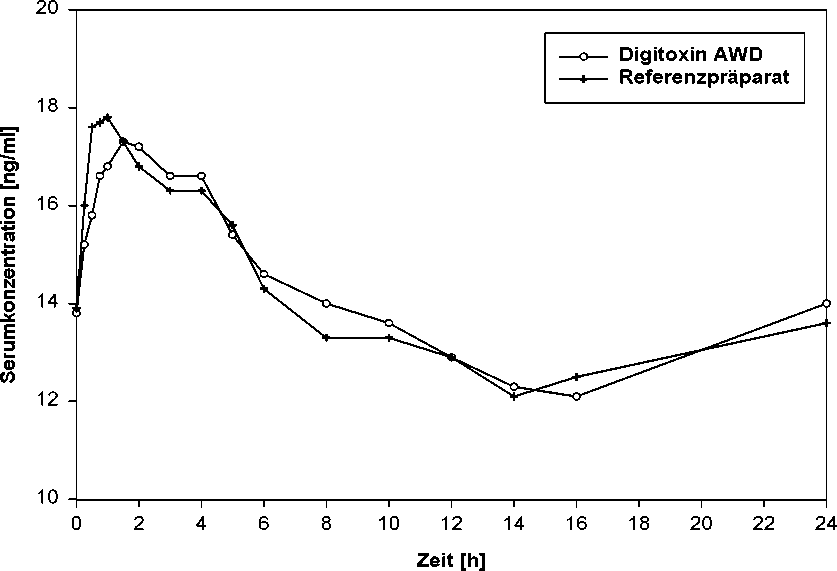
Mittlere Plasmaspiegelverläufe im steady state nach oraler Gabe von 0,07 mg Digitoxin im Vergleich zum Referenzpräparat
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Siehe Abschnitt 4.9- Notfallmaßnahmen, Symptome und Gegenmittel.
Chronische Toxizität
Auf Grund erheblicher Speziesunterschiede im pharmakokinetischen Verhalten (Gewebeverteilung, Metabolismus) ist eine Übertragbarkeit tierexperimenteller toxischer Daten auf den Menschen ohne Bedeutung. Bei chronischer Gabe treten dieselben kardialen und extrakardialen Nebenwirkungen wie beim Menschen auf (siehe Abschnitt 4.8 - Nebenwirkungen).
Mutagenes und tumorerzeugendes Potential
Untersuchungen auf ein mutagenes und tumorerzeugendes Potential liegen nicht vor. Reproduktionstoxizität
In Untersuchungen mit Metildigoxin an Ratten und Kaninchen zeigten sich keine Hinweise auf teratogene Eigenschaften. Es ist nicht bekannt, ob Digitoxin die Fertilität beeinflusst. Digitoxin passiert die Plazenta, zur Konzentration im Feten liegen keine Untersuchungen vor. Es gibt jedoch Anhaltspunkte für einen Anstieg der Plazentapassage von Digitalis-Glykosiden im Verlauf der Schwangerschaft.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat, Talkum, Magnesiumstearat (Ph.Eur.), mikrokristalline Cellulose, Mannitol, Povidon K 25, Crospovidon, hochdisperses Siliciumdioxid, Macrogol 20 000.
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
50 Tabletten 100 Tabletten
500 Tabletten als Klinikpackung (Bündelpackung 10 x 50 Tabletten)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
TEVA GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER
3000655.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
05.08.2003
10. STAND DER INFORMATION
Juni 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 15