Donepezil-Hcl Sandoz 5 Mg Schmelzfilm
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Donepezil-HCl Sandoz 5 mg Schmelzfilm Donepezil-HCl Sandoz 10 mg Schmelzfilm
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Donepezil-HCl Sandoz 5 mg Schmelzfilm
Jeder Schmelzfilm enthält 5 mg Donepezilhydrochlorid.
Sonstige Bestandteile:
Levomenthol (0,12 mg je Schmelzfilm)
Dieses Arzneimittel enthält geringe Mengen Ethanol (Alkohol), weniger als 100 mg pro Dosis.
Donepezil-HCl Sandoz 10 mg Schmelzfilm
Jeder Schmelzfilm enthält 10 mg Donepezilhydrochlorid.
Sonstige Bestandteile:
Levomenthol (0,24 mg je Schmelzfilm)
Dieses Arzneimittel enthält geringe Mengen Ethanol (Alkohol), weniger als 100 mg pro Dosis.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Schmelzfilm
Donepezil-HCl Sandoz 5 mg Schmelzfilm
Weißer bis leicht gelber, rechteckiger (3 cm2), biegsamer Schmelzfilm Donepezil-HCl Sandoz 10 mg Schmelzfilm
Weißer bis leicht gelber, rechteckiger (6 cm2), biegsamer Schmelzfilm
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Donepezil ist indiziert zur symptomatischen Behandlung der leichten bis mittelschweren Alzheimer-Demenz.
4.2 Dosierung, Art und Dauer der Anwendung
Erwachsene/ältere Patienten
Die Behandlung wird mit 5 mg/Tag (Einmaldosis pro Tag) begonnen. Der Schmelzfilm sollte am Abend kurz vor dem Schlafengehen eingenommen werden. Er sollte auf die Zunge gelegt werden, wo er sich schnell auflöst, sodass er mit oder ohne Wasser, je nach Wunsch des Patienten, leicht geschluckt werden kann (siehe weiter unten „Hinweise zur Handhabung“). Die 5-mg-Tagesdosis sollte für mindestens einen Monat aufrechterhalten werden, um eine Beurteilung des frühesten klinischen Ansprechens auf die Behandlung zu ermöglichen und damit Steady-State-Konzentrationen von Donepezil zu erreichen. Nach einer 1-monatigen klinischen Beurteilung der Behandlung mit 5 mg/Tag kann die Dosis auf 10 mg/Tag (Einmaldosis pro Tag) erhöht
werden. Die empfohlene Maximaldosis pro Tag beträgt 10 mg. Dosen, die 10 mg/Tag überschreiten, wurden in klinischen Studien nicht untersucht.
Die Behandlung sollte durch einen in der Diagnose und Therapie der AlzheimerDemenz erfahrenen Arzt begonnen und überwacht werden. Die Diagnose sollte gemäß anerkannten Richtlinien (z. B. DSM IV, ICD 10) gestellt werden. Die Therapie mit Donepezil sollte nur begonnen werden, wenn der Patient eine Bezugsperson hat, die die regelmäßige Arzneimitteleinnahme überwacht. Die Therapie kann fortgeführt werden, solange der Patient einen therapeutischen Nutzen davon hat. Der klinische Nutzen von Donepezil sollte daher regelmäßig beurteilt werden. Ein Abbruch der Behandlung sollte in Erwägung gezogen werden, wenn ein therapeutischer Effekt nicht länger nachweisbar ist. Ein Ansprechen auf die Behandlung mit Donepezil kann im Einzelfall nicht vorausgesagt werden.
Nach Absetzen der Behandlung wird ein langsames Abklingen der günstigen Wirkung von Donezepil beobachtet.
Funktionsstörungen von Nieren und Leber
Bei Patienten mit Funktionsstörungen der Nieren kann das gleiche Dosierungsschema angewendet werden, da die Clearance von Donepezilhydrochlorid hierdurch nicht beeinflusst wird.
Aufgrund der Möglichkeit erhöhter Wirkstoffspiegel bei leichten bis mittelschweren Funktionsstörungen der Leber (siehe Abschnitt 5.2) sollte eine Dosissteigerung entsprechend der individuellen Verträglichkeit erfolgen. Zu Patienten mit schwerer Leberfunktionseinschränkung liegen keine Daten vor.
Kinder und Jugendliche
Donezepil wird nicht für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren empfohlen.
Hinweise zur Handhabung der Schmelzfilme
Wichtig: Berühren Sie den Schmelzfilm nicht mit feuchten Händen!
a) Nehmen Sie den Beutel, suchen sie die Pfeilmarkierung auf einer der schmalen Seiten und halten Sie den Beutel mit dieser Seite nach oben. An dieser Stelle ist der Beutel nicht versiegelt.
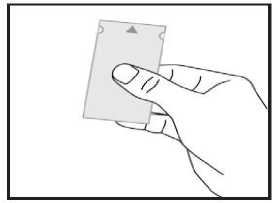
b) Trennen Sie vorsichtig beide Hälften des Beutels an der Pfeilmarkierung. Jetzt können Sie jede Hälfte mit Daumen und Zeigefinger einer Hand anfassen.
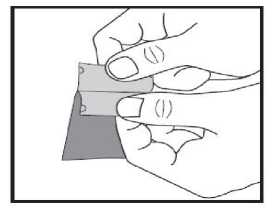
c) Ziehen Sie beide Hälften des Beutels vorsichtig in entgegengesetzte Richtungen auseinander, bis sie voneinander gelöst sind. Der Schmelzfilm ist jetzt zu sehen und befindet sich auf einer der getrennten Beutelhälften.
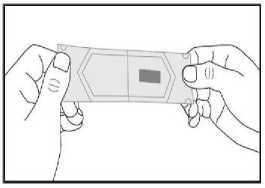
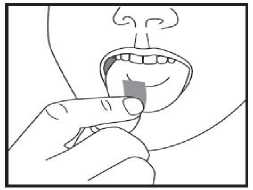
d) Nehmen Sie den Schmelzfilm mit trockenen Fingern heraus und legen Sie ihn in Ihrem Mund direkt auf die Zunge. Er wird sich schnell auflösen, so dass er leicht geschluckt werden kann. Falls gewünscht, kann der Schmelzfilm auch mit Wasser eingenommen werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen Donepezilhydrochlorid, Piperidinderivate, Levomenthol, Pfefferminz-Aroma oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Anwendung von Donepezil bei Patienten mit schwerer Alzheimer-Demenz, anderen Formen von Demenz oder anderen Gedächtnisstörungen (z. B. altersbedingter kognitiver Abbau) wurde nicht untersucht.
Anästhesie
Da es sich bei Donepezil um einen Cholinesterasehemmer handelt, ist es wahrscheinlich, dass während einer Anästhesie die Wirkung von Muskelrelaxantien des Succinylcholin-Typs durch das Arzneimittel verstärkt wird.
Kardiovaskuläre Erkrankungen
Aufgrund ihrer pharmakologischen Wirkungsweise können Cholinesterasehemmer vagotone Wirkungen auf die Herzfrequenz ausüben (z. B. Bradykardie). Die Möglichkeit dieser Wirkungen kann insbesondere bei Patienten mit Sinusknotensyndrom (Sick-Sinus-Syndrom) oder anderen supraventrikulären Störungen der Erregungsleitung des Herzens, wie sinoatrialem oder atrioventrikulärem Block, von Bedeutung sein.
Es liegen Berichte über Synkopen und Krampfanfälle vor. Bei der Untersuchung dieser Patienten sollte die Möglichkeit eines Herzblocks oder einer verlängerten Sinuspause berücksichtigt werden.
Gastrointestinale Erkrankungen
Bei Patienten mit einem erhöhten Risiko zur Bildung von Magen- und Darmulcera, z. B. Patienten mit Ulcera in der Anamnese oder gegenwärtig mit nicht-steroidalen Antirheumatika (NSAR) behandelte Patienten, sollte auf entsprechende Symptome geachtet werden. Mit Donepezil durchgeführte klinische Studien zeigten jedoch im Vergleich mit Placebo keine erhöhte Inzidenzrate peptischer Ulcera oder gastrointestinaler Blutungen.
Urogenitalsystem
Obwohl entsprechende Nebenwirkungen in klinischen Studien zu Donepezil nicht beobachtet wurden, können Cholinomimetika zu Blasenentleerungsstörungen führen.
Neurologische Störungen
• Krampfanfälle: Es wird angenommen, dass Cholinomimetika ein gewisses Potential besitzen, generalisierte Krampfanfälle auszulösen. Die Anfallsaktivität kann jedoch auch eine Manifestation der Alzheimer-Krankheit sein.
• Cholinomimetika können extrapyramidale Symptome verstärken oder auslösen.
• Malignes neuroleptisches Syndrom (MNS): Über MNS, einen potentiell lebensbedrohlichen Zustand, charakterisiert durch Hyperthermie, Muskelsteifigkeit, vegetative Instabilität, Veränderung des Bewusstseins und Erhöhung der Creatinkinase (CK), wurde sehr selten im Zusammenhang mit Donepezil berichtet, insbesondere bei Patienten, die gleichzeitig Antipsychotika einnahmen. Weitere Symptome können eine Myoglobinurie (Rhabdomyolyse) und akutes Nierenversagen sein. Wenn ein Patient Symptome einer MSN entwickelt und unklares, hohes Fieber hat ohne eine zusätzliche klinische Manifestation des MNS, muss die Behandlung abgebrochen werden.
Erkrankungen der Atemwege
Aufgrund ihrer cholinomimetischen Wirkungsweise sollten Cholinesterasehemmer Patienten mit Asthma oder obstruktiven Lungenerkrankungen in der Anamnese mit Vorsicht verschrieben werden.
Die Anwendung von Donepezil zusammen mit anderen Acetylcholinesterasehemmern sowie mit Agonisten oder Antagonisten des cholinergen Systems sollte vermieden werden.
Schwere Leberfunktionsstörung
Es liegen keine Daten zu Patienten mit schwerer Leberfunktionsstörung vor.
Mortalität in klinischen Studien zu vaskulärer Demenz
In drei 6-monatigen klinischen Studien wurden Patienten untersucht, die die NINDS-AIREN Kriterien für wahrscheinliche oder mögliche vaskuläre Demenz (VaD) erfüllten. Die NINDS-AIREN Kriterien wurden entwickelt zur Identifikation von Patienten, deren Demenz ausschließlich vaskulär bedingt ist und zum Ausschluss derer mit Alzheimer Erkrankung. In der ersten Studie lagen die Mortalitätsraten bei 2/198 (1,0 %) für Donepezilhydrochlorid 5 mg, bei 5/206 (2,4 %) für Donepezilhydrochlorid 10 mg und 7/199 (3,5 %) für Placebo. In der zweiten Studie lagen die Mortalitätsraten bei 4/208 (1,9 %) für Donepezilhydrochlorid 5 mg, bei 3/215 (1,4 %) für Donepezilhydrochlorid 10 mg und 1/193 (0,5 %) für Placebo. In der dritten Studie lagen die Mortalitätsraten bei 11/648 (1,7 %) für Donepezilhydrochlorid 5 mg und 0/326 (0 %) für Placebo. Die Mortalitätsrate der drei Studien zu vaskulärer Demenz zusammengefasst war prozentual höher in der Donepezilhydrochlorid-Gruppe (1,7 %) verglichen mit der
Placebogruppe (1,1 %). Dieser Unterschied ist jedoch statistisch nicht signifikant. Die Mehrheit der Todesfälle der Patienten, die entweder Donepezilhydrochlorid oder Placebo erhielten, scheint in verschiedenen vaskulär bedingten Ursachen begründet zu sein, was bei einer älteren Population mit vaskulärer Erkrankung zu erwarten ist. Eine Analyse aller schwerwiegenden nicht tödlichen und tödlichen vaskulären Ereignisse zeigte keinen Unterschied in der Häufigkeit des Auftretens in der Donepezil-Gruppe verglichen mit der Placebogruppe.
In gepoolten Studien zur Alzheimer Erkrankung (n=4.146), und wenn diese Studien zur Alzheimer Erkrankung gepoolt wurden mit anderen Demenz-Studien inklusive der Studien zur vaskulären Demenz (total n=6.888), war die Mortalitätsrate in der Placebogruppe prozentual höher als in der Donepezilhydrochlorid-Gruppe.
Donepezil-HCl Sandoz Schmelzfilme enthalten Alkohol (weniger als 100 mg pro Einzelgabe).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
• Donepezilhydrochlorid und/oder dessen Metaboliten hemmen beim Menschen nicht den Stoffwechsel von Theophyllin, Warfarin, Cimetidin oder Digoxin. Der Stoffwechsel von Donepezilhydrochlorid wird durch eine gleichzeitige Anwendung von Digoxin oder Cimetidin nicht beeinflusst.
• In-vitro-Untersuchungen haben gezeigt, dass die Cytochrom P450-Isoenzyme 3A4 und - in geringerem Maß - 2D6 am Metabolismus von Donepezil beteiligt sind. In-vitro-Studien zu Arzneimittelwechselwirkungen haben gezeigt, dass Ketoconazol und Chinidin, die Inhibitoren für CYP3A4 und 2D6 darstellen, den Metabolismus von Donepezil hemmen. Daher könnten diese und andere CYP3A4-Inhibitoren, wie Itraconazol und Erythromycin, sowie CYP2D6-Inhibitoren, wie Fluoxetin, den Metabolismus von Donepezil hemmen.
• In einer Studie mit gesunden Freiwilligen erhöhte Ketoconazol die mittleren Donepezil-Konzentrationen um etwa 30 %.
• Enzyminduktoren, wie Rifampicin, Phenytoin, Carbamazepin und Alkohol könnten die Plasmaspiegel von Donepezil erniedrigen. Da das Ausmaß der Hemmung oder Induktion unbekannt ist, sollten solche Arzneimittelkombinationen nur mit Vorsicht angewandt werden.
• Donepezilhydrochlorid verfügt über das Potential, die Wirkung anderer Arzneimittel mit anticholinerger Aktivität zu beeinflussen. Darüber hinaus besteht die Möglichkeit einer synergistischen Wirkung bei gleichzeitiger Behandlung mit Arzneimitteln wie Succinylcholin, anderen Arzneimitteln mit neuromuskulärer Blockwirkung oder cholinergen Agonisten sowie Betablockern, die eine Wirkung auf die kardiale Erregungsleitung haben.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
In Tierstudien wurden keine Auswirkungen auf die Fertilität beobachtet (siehe Abschnitt 5.3). Es liegen jedoch keine entsprechenden Daten hinsichtlich der Auswirkungen auf die Fertilität beim Menschen vor.
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Donepezil bei Schwangeren vor. Tierexperimentelle Studien haben keinen teratogenen Effekt gezeigt, jedoch eine peri- und postnatale Toxizität (siehe Abschnitt 5.3). Das mögliche Risiko für Menschen ist nicht bekannt. Wenn keine unbedingte Notwendigkeit besteht, sollte Donepezil nicht während der Schwangerschaft eingenommen werden.
Stillzeit
Donepezil geht in die Milch von Ratten über. Es ist nicht bekannt, ob Donepezilhydrochlorid beim Menschen in die Milch übergeht, und es wurden keine Studien an stillenden Frauen durchgeführt. Daher sollten Frauen, die Donepezil einnehmen, nicht stillen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Donepezil hat geringen oder mäßigen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Alzheimer-Demenz kann zu einer Beeinträchtigung der Verkehrstüchtigkeit und der Fähigkeit, Maschinen zu bedienen, führen. Außerdem kann Donepezil Müdigkeit, Schwindel und Muskelkrämpfe verursachen, am ehesten zu Beginn der Therapie oder bei Dosiserhöhung. Die Fähigkeit von mit Donepezil behandelten Alzheimer-Patienten, am Straßenverkehr teilzunehmen oder komplizierte Maschinen zu bedienen, sollte regelmäßig vom behandelnden Arzt überprüft werden.
4.8 Nebenwirkungen
Die häufigsten unerwünschten Ereignisse sind Diarrhö, Muskelkrämpfe, Müdigkeit, Übelkeit, Erbrechen, Kopfschmerzen und Schlaflosigkeit.
Nebenwirkungen, die häufiger als in Einzelfällen berichtet wurden, sind in nachfolgender Tabelle nach Systemorganklassen und Häufigkeit gelistet.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig Häufig Gelegentlich Selten Sehr selten Nicht bekannt
(> 1/10)
(> 1/100 bis < 1/10)
(> 1/1.000 bis < 1/100)
(> 1/10.000 bis < 1/1.000)
(< 1/10.000)
(Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklasse |
Sehr häufig |
Häufig |
Gelegentlich |
Selten |
Sehr selten |
|
Infektionen und parasitäre Erkrankungen |
- Erkältung | ||||
|
Stoffwechsel- und Ernährungsstörungen |
- Appetitlosigkeit | ||||
|
Psychiatrische Erkrankungen |
- Halluzinationen** Erregungszustände* * - Aggressives Verhalten** - ungewöhnliche Träume und Albträume** | ||||
|
Erkrankungen des Nervensystems |
- Synkope* - Schwindel - Schlaflosigkeit |
- Krampfanfälle* |
Extrapyramidal e Symptome |
- Malignes neuroleptisches Syndrom | |
|
Herzerkrankungen |
- Bradykardie |
- Sinuatrialer Block Atrioventrikulär er Block | |||
|
Erkrankungen des Gastrointestinaltrakts |
- Diarrhö - Übelkeit |
- Erbrechen - Abdominale Beschwerden |
- Gastrointestinale Blutung - Magen-und Duodenalulzera | ||
|
Leber- und Gallenerkrankungen |
- |
|
Leberfunktions störungen einschließlich Hepatitis*** | |||||
|
Erkankungen der Haut und des Unterhautzellgewebes |
- Ausschlag - Juckreiz | ||||
|
Sklelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
- Muskelkrämpfe | ||||
|
Erkrankungen der Nieren und Harnwege |
- Harninkontinenz | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Kopfschmerz en |
- Müdigkeit - Schmerz | |||
|
Untersuchungen |
- Geringfügiger Anstieg der MuskelKreatinkinase im Serum | ||||
|
Verletzung und Vergiftungen |
- Unfall |
* Bei der Untersuchung von Patienten mit Synkopen oder Krampfanfällen sollte die Möglichkeit eines Herzblocks oder einer verlängerten Sinuspause berücksichtigt werden (siehe Abschnitt 4.4).
** Halluzinationen, ungewöhnliche Träume und Albträume, Agitiertheit und aggressives Verhalten waren nach Dosisreduzierung oder Absetzen der Behandlung reversibel.
*** In Fällen nicht erklärbarer Leberdysfunktion sollte ein Absetzen von Donepezil erwogen werden.
Bei entsprechend sensibilisierten Patienten können durch Levomenthol bzw. Pfefferminz-Aroma Überempfindlichkeitsreaktionen (einschließlich Atemnot) ausgelöst werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Die geschätzte mittlere letale Dosis von Donepezilhydrochlorid nach Verabreichung einer einzelnen oralen Dosis an Mäuse und Ratten lag bei 45 bzw. 32 mg/kg oder etwa dem 225- bzw. 160-fachen der für den Menschen empfohlenen Maximaldosis von 10 mg/Tag.
Symptome
An Tieren wurden dosisbezogene Anzeichen einer cholinergen Stimulation beobachtet: dazu gehörten Herabsetzung der Spontanbewegungen, Bauchlage, schwankender Gang, Tränenabsonderung, klonische Konvulsionen, Atemdepression, Speichelfluss, Pupillenverengung, Faszikulationen und erniedrigte Oberflächentemperatur des Körpers.
Eine Überdosierung von Cholinesterasehemmern kann zu einer cholinergen Krise führen, die durch starke Übelkeit, Erbrechen, Speichelfluss, Schweißausbrüche, Bradykardie, Hypotonie, Atemdepression, Kollaps und Krampfanfälle gekennzeichnet ist. Zunehmende Muskelschwäche ist möglich, was bei Beteiligung der Atemmuskulatur zum Tode führen kann.
Behandlung
Wie bei allen anderen Überdosierungen sollten allgemeine Unterstützungsmaßnahmen zur Anwendung kommen. Tertiäre Anticholinergika wie z. B. Atropin können als Antidot bei einer Überdosis von Donepezil eingesetzt werden. Auf Wirkung titriertes intravenöses Atropinsulfat wird empfohlen: eine Initialdosis von 1,0-2,0 mg i.v. mit nachfolgenden Dosen auf der Basis des klinischen Ansprechens. Bei anderen Cholinomimetika wurden atypische Reaktionen des Blutdrucks und der Herzfrequenz beobachtet, wenn diese gleichzeitig mit quaternären Anticholinergika wie z. B. Glycopyrrolat angewendet wurden.
Es ist nicht bekannt, ob Donepezilhydrochlorid und/oder dessen Metaboliten durch Dialyse (Hämodialyse, Peritonealdialyse oder Hämofiltration) entfernt werden können.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antidementiva, Cholinesterasehemmer ATC-Code: N06DA02
Bei Donepezilhydrochlorid handelt es sich um einen spezifischen und reversiblen Inhibitor der Acetylcholinesterase, der im Gehirn überwiegenden Cholinesterase. Donepezilhydrochlorid ist als Hemmer dieses Enzyms in vitro 1.000-mal stärker wirksam als bei der Hemmung der Butyrylcholinesterase, eines Enzyms, das in erster Linie außerhalb des zentralen Nervensystems vorkommt.
Bei Patienten mit Alzheimer-Demenz führte die Gabe einer einmal täglichen Dosis von 5 mg bzw. 10 mg Donepezilhydrochlorid in klinischen Studien zu einer Steady-State-Inhibierung der Aktivität der Acetylcholinesterase (gemessen in Erythrozytenmembranen) von 63,6 % bzw. 77,3 % (Messung nach Dosisapplikation).
Es konnte gezeigt werden, dass die durch Donepezilhydrochlorid bewirkte Hemmung der Acetylcholinesterase (AChE) in den roten Blutkörperchen mit den Veränderungen in der ADAS-cog, einer empfindlichen Skala, die bestimmte Bereiche der Wahrnehmung untersucht, korreliert. Das Potential von Donepezilhydrochlorid, die neuropathologische Grunderkrankung in ihrem Verlauf zu beeinflussen, ist nicht untersucht worden. Daher kann nicht der Schluss gezogen werden, dass Donepezil eine Wirkung auf das Fortschreiten der Erkrankung hat.
Die Wirksamkeit der Behandlung mit Donepezil wurde in vier Placebo-kontrollierten Studien untersucht. Die Behandlungsdauer betrug in zwei dieser Studien 6 Monate und in zwei Studien 1 Jahr.
Nach der 6-monatigen Studie fand am Ende der Behandlung mit Donepezil eine Auswertung statt, in der eine Kombination von drei Wirksamkeitskriterien benutzt wurde: ADAS-cog (ein Maßstab für die kognitive Leistung), CIBIC-plus (Clinician Interview Based Impression of Change with Caregiver Input - ein Maßstab für die Globalfunktion) und ADL (Activities of Daily Living Subscale of the Clinical Dementia Rating Scale - ein Maßstab für die Fähigkeit, in der Gesellschaft, zu Hause, bei Hobbys und persönlicher Pflege zurechtzukommen).
Patienten, die die u. g. Kriterien erfüllten, galten als Responder.
Response =
- Verbesserung des ADAS-Cog um mindestens 4 Punkte
- Keine Verschlechterung des CIBIC
- Keine Verschlechterung der Aktivitäten des täglichen Lebens (ADL) anhand der Subskala der Clinical Dementia Rating Scale
|
% Response | ||
|
Intent to Treat- Population n=365 |
Auswertbare Population n=352 | |
|
Placebo-Gruppe |
10 % |
10 % |
|
Donepezilhydrochlorid 5-mg-Gruppe |
18 %* |
18 %* |
|
Donepezilhydrochlorid 10-mg-Gruppe |
21 %* |
22 %** |
p < 0,05
p < 0,01
Donepezil bewirkte einen dosisabhängigen statistisch signifikanten Anstieg des Anteils an Patienten, die als Responder definiert waren.
5.2 Pharmakokinetische Eigenschaften
Resorption
Maximale Plasmaspiegel werden etwa 3-4 Stunden nach oraler Anwendung erreicht. Die Plasmakonzentrationen und die Fläche unter der Kurve steigen proportional zur Dosis an. Die terminale Halbwertszeit liegt bei ca. 70 Stunden, so dass die Gabe von je einer Tagesdosis über mehrere Tage langsam zu einem Steady-State führt. Ein näherungsweiser Steady-State wird innerhalb von 3 Wochen nach Beginn der Therapie erreicht. Wenn der Steady-State einmal erreicht ist, zeigen die Donepezilhydrochlorid-Plasmakonzentrationen und die zugehörige pharmakodynamische Aktivität nur geringe Tagesschwankungen.
Die Resorption von Donepezilhydrochlorid wurde durch Nahrungsaufnahme nicht beeinflusst.
Verteilung
Donepezilhydrochlorid ist beim Menschen zu etwa 95 % an Plasmaproteine gebunden. Die Plasma-Protein-Bindung des aktiven Metaboliten 6-O-Desmethyl-Donepezil ist nicht bekannt. Die Verteilung von Donepezilhydrochlorid in den verschiedenen Geweben des Körpers ist nicht endgültig untersucht worden. In einer an gesunden männlichen Probanden vorgenommenen Studie zum Substanzgleichgewicht konnten jedoch 240 Stunden nach Gabe einer einmaligen Dosis von 5 mg 14C-markiertem Donepezilhydrochlorid etwa 28 % der markierten Substanz nicht wiedergewonnen werden. Dies legt den Schluss nahe, dass Donepezilhydrochlorid und/oder dessen Metaboliten möglicherweise für mehr als 10 Tage im Körper verbleiben.
Stoffwechsel/Ausscheidung
Donepezilhydrochlorid wird sowohl mit dem Urin in unveränderter Form ausgeschieden als auch durch das Cytochrom P450-System zu mehreren Metaboliten verstoffwechselt, von denen nicht alle identifiziert wurden. Nach Gabe einer einmaligen Dosis von 5 mg 14C-markiertem Donepezilhydrochlorid lag die Plasmaradioaktivität, ausgedrückt als Prozentsatz der applizierten Dosis, in erster Linie als unverändertes Donepezilhydrochlorid vor (30 %), 6-O-Desmethyl-Donepezil (11 % - einziger Metabolit, der eine dem Donepezilhydrochlorid ähnliche Aktivität zeigt), Donepezil-cis-N-oxid (9 %), 5-O-Desmethyl-Donepezil (7 %) und das Glucuronidkonjugat von 5-O-Desmethyl-Donepezil (3 %). Etwa 57 % der gesamten verabreichten Radioaktivität wurden aus dem Urin (17 % als unverändertes Donepezil) und 14,5 % aus den Fäzes wiedergewonnen.
Dies legt den Schluss nahe, dass Biotransformation und Ausscheidung über den Urin die primären Eliminationswege darstellen. Es bestehen keine Nachweise für die Annahme, dass eine enterohepatische Rezirkulation von Donepezilhydrochlorid und/oder irgendeines seiner Metaboliten stattfindet.
Der Abfall der Donepezil-Konzentrationen im Plasma erfolgt mit einer Halbwertszeit von etwa 70 Stunden. Geschlecht, Rasse und Rauchgewohnheiten haben keinen klinisch signifikanten Einfluss auf die Plasmakonzentrationen von Donepezilhydrochlorid. Die Pharmakokinetik von Donepezil wurde nicht bei älteren gesunden Menschen oder bei Alzheimer-Patienten oder Patienten mit vaskulärer Demenz untersucht. Jedoch stimmen die mittleren Plasmaspiegel bei Patienten weitgehend mit denen von jungen gesunden Freiwilligen überein.
Patienten mit leichter bis mittelschwerer Funktionsstörung der Leber wiesen im Steady-State höhere Konzentrationen von Donepezil auf: Erhöhung der mittleren AUC um 48 %, der mittleren Cmax um 39 % (siehe Abschnitt 4.2).
5.3 Präklinische Daten zur Sicherheit
Breit angelegte Tests an Versuchstieren zeigten, dass diese Substanz nur wenige Wirkungen ausübt, die von der beabsichtigten pharmakologischen Wirkung abweichen und die mit seiner Wirkung als cholinerges Stimulans in Zusammenhang stehen (siehe Abschnitt 4.9). Donepezil wirkt nicht mutagen in Bakterien oder Säuger-ZellMutationstests. Klastogene Effekte konnten vereinzelt in vitro bei Konzentrationen beobachtet werden, die bereits zelltoxisch wirken und mehr als 3.000-mal höher lagen als die Plasma-Konzentrationen im Steady-State. Im Mäuse-Mikronukleus-Modell in vivo wurden keine klastogenen oder andere genotoxische Effekte beobachtet. Langzeit-Kanzerogenitätsstudien an Ratten und Mäusen erbrachten keine Hinweise auf ein onkogenes Potential.
Donepezilhydrochlorid zeigte keine Auswirkungen auf die Fruchtbarkeit von Ratten und erwies sich bei Ratten oder Kaninchen als nicht teratogen, hatte jedoch eine leichte Auswirkung auf Totgeburten und frühes Überleben der Jungen, wenn es trächtigen Ratten in der 50-fachen Humandosis verabreicht wurde (siehe Abschnitt 4.6).
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
• Glycerol 85 %
• Hypromellose
• Levomenthol
• Maltodextrin
• Mikrokristalline Cellulose
• Pfefferminz-Aroma
• Sucralose
• Titandioxid (E 171)
• Ethanol 96 %
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
PET/ALU/PE-Beutel (84 x 47 mm)
Jeder Schmelzfilm ist separat in einen versiegelten Beutel eingepackt.
Packungsgrößen: 7, 10, 14, 28, 30, 50, 56, 60, 98 oder 100 Schmelzfilme
Einige Packungsgrößen enthalten auch eine PP-Schachtel zur vorübergehenden Lagerung einiger Beutel.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Donepezil-HCl Sandoz 5 mg Schmelzfilm 81226.00.00
Donepezil-HCl Sandoz 10 mg Schmelzfilm 81227.00.00
19.09.2011/--
Verschreibungspflichtig