Dopadura C 200/50 Mg Retard
- 1 -
August 2011
Fachinformation
dopadura® C 100/25 mg retard dopadura® C 200/50 mg retard
1. BEZEICHNUNG DER ARZNEIMITTEL
dopadura C 100/25 mg retard dopadura C 200/50 mg retard
Wirkstoffe: Levodopa und Carbidopa
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
dopadura C 100/25 mg retard
Jede Retardtablette enthält 100 mg Levodopa und 25 mg Carbidopa (als Carbidopa-Monohydrat).
dopadura C 200/50 mg retard
Jede Retardtablette enthält 200 mg Levodopa und 50 mg Carbidopa (als Carbidopa-Monohydrat).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Retardtablette
dopadura C 100/25 mg retard Ockerfarbene, runde, bikonkave Retardtablette
dopadura C 200/50 mg retard Ockerfarbene, runde, bikonvexe Retardtablette
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Idiopathische Parkinson-Krankheit, insbesondere zur Verkürzung der „OfF‘-Phase bei Patienten, die zuvor mit schnellfreisetzenden Levodopa/Decarboxylasehemmern oder nur mit Levodopa behandelt wurden und motorische Fluktationen aufwiesen.
Die Erfahrungen mit Levodopa/Carbidopa Retardtabletten bei zuvor nicht mit Levodopa behandelten Patienten sind begrenzt.
4.2 Dosierung, Art und Dauer der Anwendung
Die Tagesdosis von Levodopa/Carbidopa sollte sorgfältig ermittelt werden. Die Patienten sollten während der Dosisanpassung gut überwacht werden, insbesondere bezüglich des Auftretens oder einer Zunahme von Übelkeit und abnormen unwillkürlichen Bewegungen wie Dyskinesien, Chorea und Dystonie. Ein Blepharospasmus kann ein frühes Zeichen einer Überdosierung sein.
Die pharmakokinetischen Eigenschaften der Retardtabletten können sich verändern, wenn die Tabletten zerbrochen oder zerkaut werden. Daher müssen die Tabletten als Ganzes geschluckt werden.
Die Einnahme der meisten Mittel gegen die Parkinson-Krankheit - außer Levodopa - kann bei der Anwendung von dopadura C retard beibehalten werden, allerdings kann eine Dosisanpassung dieser Arzneimittel erforderlich werden.
Plötzliches Absetzen von Levodopa sollte unbedingt vermieden werden.
Da Carbidopa eine Wirkungsabschwächung von Levodopa durch Pyridoxin verhindert, kann dopadura C retard auch von Patienten eingenommen werden, die zusätzlich Pyridoxin (Vitamin B6) erhalten.
Anfangsdosis
Bisher nicht mit Levodopa behandelte Patienten
dopadura C 100/25 mg retard:
dopadura C 100/25 mg retard ist geeignet für Patienten, die bisher noch nie Levodopa eingenommen haben oder - falls erforderlich - zur Vereinfachung einer Dosisanpassung bei Patienten, die dopadura C 200/50 mg retard erhalten.
Die empfohlene Anfangsdosis beträgt 2-mal täglich 1 Retardtablette dopadura C 100/25 mg retard. Patienten, die mehr Levodopa benötigen, vertragen im Allgemeinen 3-4 Retardtabletten dopadura C 100/25 mg retard.
dopadura C 200/50 mg retard:
Die empfohlene Anfangsdosis beträgt 2-mal täglich 1 Retardtablette dopadura C 200/50 mg retard. Die Anfangsdosis sollte nicht höher als 600 mg Levodopa/Tag sein. Es sollten jeweils mindestens 6 Stunden zwischen den Einzelgaben liegen.
Dosisanpassungen sollten in Abständen von mindestens 2-4 Tagen vorgenommen werden.
Abhängig von der Schwere der Erkrankung, können bis zu 6 Monate erforderlich sein, um einen optimalen Behandlungserfolg zu erreichen.
Dosisempfehlung für Patienten, die bisher mit schnellfreisetzenden Levodopa+Decarboxylasehemmer-Präparaten behandelt werden
Die Umstellung auf dopadura C retard sollte zu Beginn in einer Dosierung erfolgen, die höchstens etwa 10 % mehr Levodopa/Tag ergänzt, wenn höhere Dosen erforderlich sind (über 900 mg täglich).
Es sollten mindestens 12 Stunden zwischen der letzten Einnahme von Levodopa plus Decarboxylasehemmer und der ersten Einnahme von dopadura C retard liegen.
Der zeitliche Abstand zwischen den Einzeldosen sollte um 30-50 % auf 4-12 Stunden erhöht werden. Wenn die Tagesdosis in ungleiche Einzeldosen aufgeteilt ist, wird empfohlen, die niedrigste Dosis am Ende des Tages anzuwenden.
Wie unter „Dosisanpassung“ beschrieben, sollte die Dosierung daran angepasst werden, wie der Patient auf die Behandlung anspricht.
Es ist möglich, dass Dosierungen erforderlich werden, die maximal 30 % über der bisherigen Levodopa-Dosis liegen.
Hinweise zur Umstellung von schnellfreisetzenden Levodopa/Carbidopa Tabletten auf Retardtabletten sind in den folgenden Tabletten angegeben:
Levodopa/Carbidopa Tabletten dopadura C100/25 mg retard
|
Tagesdosis Levodopa (mg) |
Tagesdosis Levodopa (mg) |
Retardtabletten/Tag |
|
100-200 |
200 |
2-mal täglich 1 Retardtablette |
|
300-400 |
400 |
4 Retardtabletten aufgeteilt in 3 oder mehr Dosen |
Für höhere Dosierungen steht dopadura C 200/50 mg retard zur Verfügung.
|
Levodopa/Carbidopa Tabletten |
dopadura C 200/50 mg retard | |
|
Tagesdosis Levodopa (mg) |
Tagesdosis Levodopa (mg) |
Retardtabletten/Tag |
|
300-400 |
400 |
2-mal täglich 1 Retardtablette |
|
500-600 |
600 |
3-mal täglich 1 Retardtablette |
|
700-800 |
800 |
4 Retardtabletten* |
|
900-1000 |
1000 |
5 Retardtabletten* |
|
1100-1200 |
1200 |
6 Retardtabletten* |
|
1300-1400 |
1400 |
7 Retardtabletten* |
|
1500-1600 |
1600 |
8 Retardtabletten* |
* aufgeteilt in 3 oder mehr Dosen
Patienten, die bisher nur mit Levodopa behandelt wurden
Es müssen mindestens 12 Stunden zwischen der letzten Einnahme von Levodopa und der ersten Einnahme von dopadura C retard liegen.
Bei Patienten mit leichter bis mäßiger Ausprägung der Krankheit beträgt die empfohlene Anfangsdosis 2-mal täglich 200 mg Levodopa/50 mg Carbidopa.
Dosisanpassung
Nachdem die Dosierung festgelegt ist, kann die Dosis oder die Dosierungshäufigkeit herauf- oder herabgesetzt werden, je nachdem, wie der Patient auf die Behandlung anspricht.
Für die meisten Patienten reicht eine Tagesdosis von 400 mg Levodopa/100 mg Carbidopa bis zu 1600 mg/400 mg Carbidopa aus. Die Retardtabletten sollten in aufgeteilten Dosen in Abständen von 4-12 Stunden während des Tages eingenommen werden.
Es wurden auch höhere Dosen (bis zu 2400 mg Levodopa/600 mg Carbidopa) in kürzeren Zeitabständen (weniger als 4 Stunden) angewendet, was aber im Allgemeinen nicht empfohlen wird.
Es sollte die niedrigste Dosis am Ende des Tages eingenommen werden, wenn die Zeitabstände zwischen den Einzelgaben weniger als 4 Stunden betragen oder wenn unterschiedlich hohe Einzeldosen angewendet werden.
Im Vergleich zu schnellfreisetzendem Levodopa/Carbidopa kann die gewohnte Wirkung der ersten am Morgen eingenommenen Dosis bei manchen Patienten um bis zu eine Stunde verzögert sein.
Dosisanpassungen sollten in Abständen von mindestens 3 Tagen vorgenommen werden.
Erhaltungsdosis
Regelmäßige Routineuntersuchungen werden empfohlen, da die Parkinson-Krankheit progressiv ist. Eine Anpassung der festgelegten Levodopa/Carbidopa-Dosis kann erforderlich werden.
Zusätzliche Anwendung anderer Anti-Parkinson-Mittel
Anticholinergika, Dopamin-Agonisten und Amantadin können zusammen mit dopadura C retard gegeben werden. Eine Dosisanpassung von dopadura C retard kann erforderlich werden, wenn diese Arzneimittel zusätzlich bei einer bereits begonnenen Therapie mit dopadura C retard gegeben werden.
Therapieunterbrechung
Falls die Dosis plötzlich vermindert wird oder wenn die Therapie mit dopadura C retard beendet werden muss, sollten die Patienten sorgfältig überwacht werden. Dies gilt insbesondere für Patienten, die Antipsychotika erhalten (siehe Abschnitt 4.4).
Wenn ein Narkosemittel erforderlich ist, kann dopadura C retard solange gegeben werden, wie der Patient Arzneimittel einnehmen darf. Wenn die Therapie vorübergehend unterbrochen wird, kann die gewohnte Dosis gegeben werden, sobald der Patient in der Lage ist, Arzneimittel einzunehmen.
Anwendung bei Kindern
Bisher ist die Sicherheit bei Patienten unter 18 Jahren nicht nachgewiesen.
Anwendung bei älteren Patienten
Für die Anwendung von Kombinationen von Levodopa und Carbidopa bei älteren Patienten liegt viel Erfahrung vor. Die oben angegebenen Empfehlungen spiegeln die klinischen Daten wider, die aus diesen Erkenntnissen gewonnen wurden.
Anwendung bei eingeschränkter Nieren- und Leberfunktion Es ist keine Dosisanpassung erforderlich.
4.3
4.4
Gegenanzeigen
dopadura C retard ist kontraindiziert bei Patienten mit
- Überempfindlichkeit gegen Levodopa, Carbidopa oder einen der sonstigen Bestandteile
- Engwinkelglaukom
- schwerer Herzinsuffizienz
- schweren Herzrhythmusstörungen
- akutem Schlaganfall.
Levodopa/Carbidopa retard darf nicht angewendet werden, wenn die Gabe eines Sympathomimetikums kontraindiziert ist.
Die gleichzeitige Anwendung von Levodopa/Carbidopa retard und nicht-selektiven Monoaminoxidase-(MAO-)Hemmern sowie selektiven MAO-A-Hemmern ist kontraindiziert. Die Anwendung dieser MAO-Hemmer sollte mindestens 2 Wochen vor Beginn einer Behandlung mit Levodopa/Carbidopa retard abgesetzt werden. Levodopa/Carbidopa retard kann gleichzeitig mit der empfohlenen Dosis eines selektiven MAO-B-Hemmers (z. B. Selegilin-HCl) eingesetzt werden (siehe Abschnitt 4.5).
Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wenn eine Behandlung mit dopadura C retard begonnen wird, sollten Patienten, die bisher nur mit Levodopa behandelt werden, 12 Stunden vorher die Behandlung beenden.
Dem pharmakokinetischen Profil von Retardtabletten mit Levodopa/Carbidopa entsprechend, kann die Wirkung bei Patienten, die an frühmorgendlichen Dyskinesien leiden, im Vergleich zu schnellfreisetzendem Levodopa/Carbidopa mit Verzögerung eintreten.
Die Inzidenz von Dyskinesien ist unter Behandlung mit Retardtabletten mit Levodopa/Carbidopa bei Patienten in einem fortgeschrittenen Stadium motorischer Fluktuationen höher als bei Anwendung schnellfreisetzender Tabletten mit Levodopa/Carbidopa (16,5 % versus 12,2 %).
Bei zuvor nur mit Levodopa behandelten Patienten kann es zu Dyskinesien kommen, da Carbidopa bewirkt, dass mehr Levodopa das Gehirn erreicht, so dass mehr Dopamin gebildet wird. Das Auftreten von Dyskinesien kann eine Dosisminderung erforderlich machen (siehe Abschnitt 4.8).
dopadura C retard kann, wie auch Levodopa allein, unwillkürliche Bewegungen und psychische Störungen verursachen.
Wenn dopadura C retard eingesetzt wird, sollten Patienten mit anamnestisch bekannten ausgeprägten unwillkürlichen Bewegungen und psychischen Störungen, die vorher nur mit Levodopa oder schnellfreisetzendem Levodopa/Carbidopa behandelt wurden, sorgfältig überwacht werden. Man nimmt an, dass diese Reaktionen durch das erhöhte Angebot von Dopamin im Gehirn ausgelöst werden. Die Anwendung von dopadura C retard kann ein Wiederauftreten bewirken und eine Dosisreduktion erforderlich machen.
Alle Patienten sollten wegen des Auftretens einer Depression mit begleitender Suizidtendenz sorgfältig überwacht werden. Die Behandlung von psychotischen Patienten und solchen mit anamnestisch bekannten Psychosen sollte mit Vorsicht erfolgen.
Wenn sich eine bestehende Psychose verschlechtert, sollte Levodopa/Carbidopa retard abgesetzt werden.
Levodopa wurde mit Schläfrigkeit und plötzlichem Einschlafen in Verbindung gebracht. Sehr selten wurde über plötzliches Einschlafen bei Alltagsaktivitäten berichtet, in einigen Fällen unbewusst ohne vorherige Warnzeichen. Die Patienten müssen hierüber informiert und darauf hingewiesen werden, vorsichtig zu sein, wenn sie während der Behandlung mit Levodopa ein Kraftfahrzeug führen oder Maschinen bedienen. Patienten, bei denen Schläfrigkeit und/oder plötzliches Einschlafen aufgetreten ist, dürfen kein Kraftfahrzeug führen oder Maschinen bedienen. Darüber hinaus sollte eine Dosisreduktion oder die Beendigung der Behandlung erwogen werden.
Bei Patienten mit schwerwiegenden kardiovaskulären oder Lungenerkrankungen, Bronchialasthma, einer Nieren-, Leber- oder endokrinen Störung sowie Ulkuserkrankungen, Hämatemesis und Krampfanfällen in der Anamnese ist dopadura C retard mit Vorsicht anzuwenden.
Bei Patienten mit frischem Myokardinfarkt, die noch Vorhof-, Knoten- oder Kammerarrhythmie aufweisen, soll Levodopa/Carbidopa mit Vorsicht angewendet werden. Bei diesen Patienten sollte die Herzfunktion zu Beginn der Behandlung und bei Dosisanpassungen besonders sorgfältig überwacht werden.
Patienten mit chronischem Weitwinkelglaukom können vorsichtig mit dopadura C retard behandelt werden, vorausgesetzt der Augeninnendruck ist gut eingestellt. Die Patienten sind während der Behandlung sorgfältig bezüglich Veränderungen des Augendrucks zu überwachen.
Bei plötzlicher Beendigung einer Behandlung der Parkinson-Krankheit mit Arzneimitteln wurde ein Symptomkomplex beschrieben, der dem malignen neuroleptischen Syndrom ähnelt, einhergehend mit Muskelsteifigkeit, erhöhter Körpertemperatur, psychischen Veränderungen und einem Anstieg der Phosphokreatininkinase im Serum. Die Patienten sollen daher sorgfältig überwacht werden, wenn die Dosis von Levodopa/Carbidopa Kombinationen plötzlich reduziert oder das Präparat abgesetzt wird, insbesondere wenn der Patient Antipsychotika erhält.
Von einer Anwendung von dopadura C retard zur Behandlung pharmakogener extrapyramidaler Reaktionen oder von Chorea Huntington wird abgeraten.
Während der Langzeitbehandlung wird empfohlen, die Leber- und Nierenfunktion sowie die Funktion blutbildender Organe und des Herz-Kreislauf-Systems regelmäßig zu überprüfen.
Bisher ist die Sicherheit und Wirksamkeit von dopadura C retard bei Säuglingen und Kindern nicht nachgewiesen. Von der Anwendung bei Patienten unter 18 Jahren wird abgeraten.
Bei Patienten mit Parkinson-Krankheit besteht möglicherweise ein erhöhtes Risiko eines Melanoms, jedoch konnte ein Zusammenhang mit der Levodopa-Therapie nicht nachgewiesen werden. Daher ist während der Behandlung Vorsicht angebracht.
Impulskontrollstörungen
Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten und / oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich dopadura C retard, behandelt werden, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen auftreten können, einschließlich pathologischer Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang . Die Überprüfung der Behandlung wird empfohlen, wenn solche Symptome auftreten.
Spielsucht/pathologisches Spielen, Libidosteigerung und Hypersexualität wurde bei Patienten, die Dopamin-Agonisten, einschließlich dopadura C retard zur Behandlung der Parkinson-Erkrankung angewendet haben, berichtet.
Laboruntersuchungen
Levodopa und Carbidopa haben Abweichungen in mehreren Labortests verursacht. Dies kann auch mit dopadura C retard auftreten. Dazu gehören erhöhte Werte bei Leberfunktionstests wie alkalische Phosphatase, SGOT (AST), SGPT (ALT), Laktatdehydrogenase, Bilirubin, Blutharnstoff, Kreatinin, Harnsäure sowie ein positiver Coombs-Test.
Verminderte Werte von Hämoglobin und Hämatokrit, erhöhte Blutzuckerspiegel sowie Leukozyten, Bakterien und Blut im Urin wurden mit dopadura C retard ebenfalls beobachtet.
Wenn Teststreifen zur Untersuchung auf Ketonurie verwendet werden, kann Levodopa/Carbidopa falsch-positive Ergebnisse für Ketonkörper im Urin verursachen. Diese Reaktion verändert sich durch Kochen der Urinprobe nicht. Es können auch falschnegative Ergebnisse bei der Untersuchung auf Glukosurie mit der Glukose-OxidaseMethode entstehen.
4.5
Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Vorsicht ist geboten bei gleichzeitiger Anwendung von dopadura C retard mit folgenden Arzneimitteln:
Antihypertonika
Wenn zu bestimmten Antihypertonika Levodopa mit einem Decarboxylasehemmer hinzugefügt wurde, kam es zu einer symptomatischen orthostatischen Dysregulation. Während der Einstellungsphase einer Behandlung mit dopadura C retard kann eine Dosisanpassung der Antihypertonika erforderlich sein.
Antidepressiva
Selten traten Nebenwirkungen, wie z. B. Hypertonie und Dyskinesie auf, wenn Levodopa/Carbidopa gleichzeitig mit trizyklischen Antidepressiva angewendet wurde (siehe Abschnitt 4.3 für Patienten, die MAO-Hemmer erhalten).
Anticholinergika
Anticholinergika können synergistisch mit Levodopa wirken, um einen Tremor zu bessern. Die gleichzeitige Anwendung kann jedoch unwillkürliche Bewegungsstörungen verschlimmern. Anticholinergika können durch Verzögerung der Resorption die Wirkung von Levodopa verschlechtern. Eine Dosisanpassung von Levodopa/Carbidopa kann erforderlich sein.
Sonstige Arzneimittel
Dopamin-D2-Rezeptor-Antagonisten (z. B. Phenothiazine, Butyrophenone, Risperidon), Benzodiazepine und Isoniazid können die therapeutische Wirkung von Levodopa herabsetzen.
Die positive Wirkung von Levodopa bei der Parkinson-Krankheit wird durch Phenytoin und Papaverin eingeschränkt. Patienten, die dieses Arzneimittel gleichzeitig mit dopadura C retard einnehmen, sollten wegen eines schlechteren therapeutischen Ansprechens sorgfältig überwacht werden.
Die gleichzeitige Anwendung von Selegilin und Levodopa/Carbidopa kann schwerwiegende orthostatische Dysregulation hervorrufen (siehe Abschnitt 4.3).
COMT-Hemmer (Tolcapon, Entacapon)
Die gleichzeitige Anwendung von COMT-(Catechol-O-Methyltransferase-)Hemmern und Levodopa/Carbidopa kann die Bioverfügbarkeit von Levodopa erhöhen. Die Dosierung von Levodopa/Carbidopa muss möglicherweise angepasst werden.
Amantadin wirkt synergistisch mit Levodopa und kann die Nebenwirkungen von Levodopa verstärken. Eine Dosisanpassung von Levodopa/Carbidopa kann erforderlich sein.
Metoclopramid beschleunigt die Magenentleerung und kann die Bioverfügbarkeit von dopadura C retard erhöhen.
Sympathomimetika können die kardiovaskulären Nebenwirkungen von Levodopa verstärken.
Die gleichzeitige Anwendung von Eisensulfat und Levodopa/Carbidopa kann zu einer Resorptionsminderung von Levodopa führen.
Da Levodopa mit bestimmten Aminosäuren konkurriert, kann die Resorption von Levodopa bei einigen Patienten, die eine proteinreiche Diät machen, gestört sein.
Die Wirkung einer Anwendung von Antazida und dopadura C retard auf die Bioverfügbarkeit von Levodopa wurde nicht untersucht.
4.6
4.7
4.8
Schwangerschaft und Stillzeit
Schwangerschaft
Zur Anwendung von Levodopa/Carbidopa bei schwangeren Frauen liegen keine ausreichenden Daten vor. Die Ergebnisse von Tierversuchen haben Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potentielle Risiko für den Embryo oder Fötus ist nicht bekannt.
dopadura C retard darf während der Schwangerschaft nicht angewendet werden. Frauen im gebärfähigen Alter müssen während der Einnahme von dopadura C retard sichere Methoden zur Empfängnisverhütung anwenden.
Stillzeit
Levodopa tritt in signifikanter Menge in die Muttermilch über. Frauen sollten während der Anwendung von dopadura C retard nicht stillen.
Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es liegen keine Daten zur Auswirkung dieses Arzneimittels auf die Verkehrstüchtigkeit vor. Nebenwirkungen wie Schläfrigkeit und Benommenheit können die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen beeinflussen.
Patienten, die mit Levodopa behandelt werden und über Schläfrigkeit und/oder plötzliches Einschlafen berichten, müssen vor dem Führen von Fahrzeugen gewarnt werden. Auch Aktivitäten, die die volle Aufmerksamkeit erfordern, sind zu unterlassen (z. B. das Bedienen von Fahrzeugen oder Maschinen), da sonst für sie selbst oder andere ein Verletzungs- oder Todesrisiko besteht. Das gilt, bis diese sich wiederholenden Episoden oder die Schläfrigkeit vorüber sind (siehe auch Abschnitt 4.4).
Nebenwirkungen
In kontrollierten klinischen Prüfungen an Patienten mit mäßigen bis schweren motorischen Fluktuationen traten unter Levodopa/Carbidopa Retardtabletten keine Nebenwirkungen auf, die durch die Darreichungsform mit verzögerter Wirkstofffreisetzung bedingt waren.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf der Grundlage der verfügbaren Daten nicht abschätzbar) Erkrankungen des Blutes und des Lymphsystems
Selten: Leukopenie, hämolytische und nicht-hämolytische Anämie, Thrombozytopenie Sehr selten: Agranulozytose
Stoffwechsel- und Ernährungsstörungen
Häufig: Anorexie
Gelegentlich: Gewichtsabnahme, Gewichtszunahme Psychiatrische Erkrankungen
Häufig: Halluzinationen, Verwirrtheit, Benommenheit, Albträume, Schläfrigkeit, Erschöpfung, Schlaflosigkeit, Depressionen, sehr selten mit Selbsttötungsversuchen, Euphorie, Demenz, psychotische Episoden, Antriebssteigerung
Selten: Agitation, Furcht, Denkstörungen, Desorientierung, Kopfschmerzen, gesteigerte Libido, Erstarrung und Krampfanfälle
Häufigkeit nicht bekannt: Es wurde berichtet, dass Patienten, die Dopamin-Agonisten einschließlich dopadura C retard, insbesondere in hohen Dosierungen, zur Behandlung des Morbus Parkinson angewendet haben, Zeichen von Spielsucht/pathologischem Spielen, Libidosteigerung und Hypersexualität zeigten, die allgemein bei Dosisreduktion oder mit Beendigung der Behandlung zurückgingen.
Impulskontrollstörungen
Pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich dopadura C retard, behandelt werden (siehe Abschnitt 4.4).
Erkrankungen des Nervensystems
Häufig: Dyskinesien (Bei der Anwendung von Levodopa/Carbidopa Retardtabletten wurden im Vergleich zu schnellfreisetzenden Levodopa/Carbidopa Darreichungsformen häufiger Dyskinesien gesehen.), Chorea, Dystonien, extrapyramidale und Bewegungsstörungen, „on-off‘ -Erscheinungen
Bradykinesie (,,on-off‘-Episoden) kann nach einigen Monaten bis Jahren nach Beginn einer Behandlung mit Levodopa auftreten und steht wahrscheinlich im Zusammenhang mit einem Fortschreiten der Erkrankung. Eine Anpassung des Dosierungsschemas und der Dosierungsintervalle kann erforderlich werden.
Gelegentlich: Ataxie, Verstärkung eines Tremors der Hände
Selten: Malignes neuroleptisches Syndrom, Parästhesien, Hinfallen, Gangstörungen,
Trismus.
Levodopa/Carbidopa wird mit Schläfrigkeit und bisher sehr selten mit extremer Tagesschläfrigkeit und plötzlichem Einschlafen in Verbindung gebracht.
Augenerkrankungen
Selten: verschwommenes Sehen, Blepharospasmus, Aktivierung eines latenten HornerSyndroms, Doppeltsehen, Pupillenerweiterung und Blickkrämpfe.
Ein Blepharospasmus kann ein frühes Anzeichen einer Überdosierung sein.
Herzerkrankungen
Häufig: Palpitationen, unregelmäßiger Herzschlag Gefäßerkrankungen
Häufig: orthostatische Dysregulation, Neigung zu Ohnmachtsanfällen, Synkope Gelegentlich: Hypertonie Selten: Phlebitis
Erkrankungen der Atemwege, des Brustraums und Mediastinums Gelegentlich: Heiserkeit, Brustschmerzen
Selten: Dyspnoe, gestörte Normalatmung Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, Erbrechen, Mundtrockenheit, bitterer Geschmack Gelegentlich: Verstopfung, Durchfall, Hypersalivation, Dysphagie, Blähungen Selten: Dyspepsie, Schmerzen im Magen-Darm-Bereich, Dunkelfärbung des Speichels, Bruxismus, Schluckauf, gastrointestinale Blutungen, Zungenbrennen, Duodenalulcera
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Ödeme
Selten: Angioödem, Urtikaria, Pruritus, Gesichtsröte, Haarausfall, Exanthem, vermehrtes Schwitzen, Dunkelfärbung des Schweißes und Purpura Schoenlein-Henoch
Skelettmuskulatur-. Bindegewebs- und Knochenerkrankungen Gelegentlich: Myospasmus
Erkrankungen der Nieren und Harnwege
Gelegentlich: Dunkelfärbung des Urins
Selten: Harnretention, Harninkontinenz, Priapismus
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Gelegentlich: Schwächegefühl, Unwohlsein, Hitzewallungen
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Die Behandlung einer akuten Überdosierung von dopadura C retard ist im Allgemeinen die gleiche wie bei einer akuten Überdosierung von Levodopa allein, jedoch ist Pyridoxin nicht geeignet zur Wirkungsabschwächung von dopadura C retard. Unter EKG-Kontrolle sollte der Patient sorgfältig wegen der Entwicklung kardialer Arrhythmien beobachtet werden. Wenn erforderlich, sollte eine angemessene antiarrhythmische Therapie erfolgen.
Die Möglichkeit, dass der Patient weitere Arzneimittel zusammen mit dopadura C retard eingenommen hat, sollte in Betracht gezogen werden.
Bisher liegen keine Dialyse-Erfahrungen vor, daher ist der Nutzen bei der Behandlung einer Überdosierung nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Levodopa: Dopaminergika; Carbidopa:
Dopadecarboxylase-Hemmer
ATC-Code: N04BA02
dopadura C retard ist eine Kombination aus Carbidopa, einem aromatischen Aminosäure-Decarboxylase-Hemmer, und Levodopa, dem Stoffwechselvorläufer von Dopamin, in Form einer Tablette mit verzögerter Wirkstofffreisetzung auf Polymerbasis für die Anwendung im Rahmen einer Behandlung der Parkinson-Krankheit.
dopadura C retard ist besonders geeignet für die Verkürzung der „Off“-Phase bei Patienten, die zuvor mit schnellfreisetzenden Levodopa/Decarboxylasehemmern behandelt wurden und bei denen Dyskinesien und motorische Fluktuationen aufgetreten sind.
Bei Patienten mit Parkinson-Krankheit, die mit Levodopa behandelt wurden, kann es zu motorischen Fluktuationen kommen, die durch Wirkungsverlust vor Einnahme der nächsten Dosis („wearing off“), Dyskinesie zur Zeit der maximalen Konzentration im Plasma und Akinesie gekennzeichnet sind. Die fortgeschrittene Form von motorischen Fluktuationen („On-off-Phänomen“) zeichnet sich durch nicht vorhersehbare Wechsel von Mobilität zu Immobilität aus. Obwohl die Ursachen motorischer Fluktuationen noch nicht vollständig geklärt sind, wurde nachgewiesen, dass sie durch Behandlungsschemata reduziert werden können, die gleichmäßige Levodopa-Konzentrationen im Plasma bewirken.
Levodopa wird im Gehirn zu Dopamin decarboxyliert und beeinflusst so die Symptome der Parkinson-Krankheit günstig. Carbidopa, das die Blut-Hirn-Schranke nicht passieren kann, hemmt nur die extrazerebrale Decarboxylierung von Levodopa, so dass mehr Levodopa für den Transport ins Gehirn und für die spätere Umwandlung in Dopamin zur Verfügung steht. Daher ist es normalerweise nicht erforderlich, hohe Dosen Levodopa in kurzen Zeitabständen zu geben. Gastrointestinale und kardiovaskuläre Nebenwirkungen, insbesondere solche, die auf die Dopaminbildung in extrazerebralen Geweben zurück zu führen sind, werden durch die niedrigere Dosis ganz oder teilweise vermieden.
In klinischen Prüfungen wurden bei Patienten mit motorischen Fluktuationen kürzere „Off“-Phasen mit Levodopa/Carbidopa in Retardform im Vergleich zu schnellfreisetzenden Levodopa/Carbidopa Tabletten beobachtet. Die Reduzierung der „Off‘-Zeit ist relativ gering (ca. 10 %), und die Häufigkeit von Dyskinesien war nach Anwendung von Levodopa/Carbidopa Retardtabletten im Vergleich zu einer Behandlung mit schnellfreisetzenden Levodopa/Carbidopa Tabletten leicht erhöht.
Bei Patienten ohne motorische Fluktuationen hatten Levodopa/Carbidopa Retardtabletten unter kontrollierten Bedingungen bei längeren Dosierungsintervallen dieselben therapeutischen Vorteile wie schnellfreisetzende Tabletten mit einer Kombination aus Levodopa und Carbidopa. Eine Besserung anderer Parkinson-Symptome fand insgesamt nicht statt.
5.2
Pharmakokinetische Eigenschaften
Resorption
Die Pharmakokinetik von Levodopa nach Anwendung von Levodopa/Carbidopa 200 mg/50 mg Retardtabletten wurde mit einer schnellfreisetzenden Form von Levodopa/Carbidopa 200 mg/50 mg an jungen gesunden Probanden untersucht. Nach Gabe von Levodopa/Carbidopa 200 mg/50 mg Retardtabletten dauerte es ca. 2 Stunden, bis die maximalen Levodopa-Spiegel im Plasma erreicht wurden im Vergleich zu 0,75 Stunden bei schnellfreisetzenden Tabletten.
Die mittleren maximalen Levodopa-Plasmaspiegel waren unter Anwendung von Levodopa/Carbidopa 200 mg/50 mg in Retardform um 60 % reduziert im Vergleich zu schnellfreisetzenden Tabletten.
Die Resorption von Levodopa nach Gabe von Levodopa/Carbidopa 200 mg/50 mg in Retardform verlief kontinuierlich über einen Zeitraum von 4-6 Stunden. In diesen Studien schwankten die Levodopa-Plasmakonzentrationen innerhalb engerer Grenzen als unter schnellfreisetzenden Tabletten, die Levodopa und Carbidopa enthielten.
Da die Bioverfügbarkeit von Levodopa aus Levodopa/Carbidopa 200 mg/50 mg in Retardform im Vergleich zu schnellfreisetzenden Tabletten, die Levodopa und Carbidopa enthalten, ungefähr 70 % beträgt, sollte die tägliche Levodopa-Dosis der Retardformen in der Regel höher sein als die der schnellfreisetzenden Darreichungsformen.
Die mittlere maximale Plasmakonzentration von Levodopa betrug 70 % nach Anwendung einer Einzeldosis von Levodopa/Carbidopa 100 mg/25 mg Retardtabletten im Vergleich zu der von Levodopa/Carbidopa 200 mg/50 mg Retardtabletten.
Die mittlere Zeit bis zum Erreichen der maximalen Konzentrationen im Plasma war mit Levodopa/Carbidopa 100 mg/25 mg Retardtabletten gegenüber Levodopa/Carbidopa 200 mg/50 mg Retardtabletten leicht reduziert.
Die Pharmakokinetik von Levodopa nach Gabe von Levodopa/Carbidopa retard wurde auch an Parkinson-Patienten untersucht. Die regelmäßige Gabe von 2-mal täglich Levodopa/Carbidopa 100 mg/25 mg in Retardform (Dosierungen von 200 mg Levodopa und 50 mg Carbidopa bis 600 mg Levodopa und 150 mg Carbidopa und 600 mg Levodopa) über 3 Monate zeigte keine Akkumulation von Levodopa im Plasma.
Die Nahrungsaufnahme hatte keinen Einfluss auf die Resorption von Levodopa. Aus der gleichzeitigen Nahrungsaufnahme resultierte eine 50%ige Reduzierung der AUC und eine 40%ige der Cmax für Carbidopa. Diese niedrigeren Plasmaspiegel von Carbidopa sind ohne klinische Bedeutung.
Verteilung
Levodopa wird weitgehend in die meisten Körpergewebe verteilt, aufgrund extensiver peripherer Metabolisierung aber nicht in das zentrale Nervensystem.
Levodopa wird nicht an Plasmaproteine gebunden. Es passiert die Blut-Hirnschranke über ein aktives, sättigbares Transportsystem für große neutrale Aminosäuren.
Carbidopa passiert die Blut-Hirnschranke nicht. Sowohl Levodopa als auch Carbidopa passieren die Plazenta und gehen in die Muttermilch über.
Metabolismus und Elimination
In Gegenwart von Carbidopa wird Levodopa hauptsächlich zu Aminosäuren metabolisiert und zu einem geringen Anteil zu Catecholaminderivaten. Alle Metaboliten werden renal eliminiert. Nach einer oralen Dosis werden ca. 50 % im Urin wiedergefunden.
5.3
6.
Präklinische Daten zur Sicherheit
Tierversuche zur pharmakologischen Sicherheit und Toxizität nach wiederholter Anwendung, Mutagenitätsstudien und Untersuchungen zur Karzinogenität ergaben kein besonderes Risiko für den Menschen.
In reproduktionstoxikologischen Studien traten bei Kaninchen sowohl nach Gabe von Levodopa als auch nach der Anwendung von Levodopa/Carbidopa viszerale und skelettale Missbildungen auf.
PHARMAZEUTISCHE ANGABEN
6.2
6.3
6.4
6.5
6.6 7.
Liste der sonstigen Bestandteile
Fumarsäure Hypromellose Macrogol 6000 Natriumstearylfumarat Hochdisperses Siliciumdioxid Chinolingelb (E 104)
Eisenoxidhydrat (E 172)
Eisen(III)-oxid (E 172)
Titandioxid (E 171)
Inkompatibilitäten
Nicht zutreffend
Dauer der Haltbarkeit
48 Monate
Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Art und Inhalt des Behältnisses
Blisterpackungen (Aluminium/Aluminium)
Packungsgrößen: 10, 30, 60, 100, 200 und 300 (10 x 30) Retardtabletten.
Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
8.
INHABER DER ZULASSUNG
Mylan dura GmbH Postfach 10 06 35 64206 Darmstadt
Tel. 06151 95 12-0 Telefax: 06151 95 12-471 Email: info@mylan-dura.de www.mylan-dura.de
24-Std.-Telefondienst für Notfälle: 06131-19240 (Giftnotrufzentrale Mainz)
ZULASSUNGSNUMMERN
dopadura C 100/25 mg retard: 52591.00.00
dopadura C 200/50 mg retard: 52591.01.00
STAND DER INFORMATION
10.
April 2015
VERKAUFSABGRENZUNG
Verschreibungspflichtig
Zusätzliche Angaben der Firma Merck dura GmbH zur Bioverfügbarkeit von dopadura ' C 100/25 mg bzw. 200/50 mg retard
Tabelle 3:
|
TagS (multiple dose, nach Nahrungsmittel aufnahme) |
dopadura® C 100/25 mg retard |
Referenzpräparat | ||
|
Levodopa |
Carbidopa |
Levodopa |
Carbidopa | |
|
maximale Plasmakonzentration (cmax) in ng/ml: |
465,7 ±172,4 |
25,4 ±10 |
399,3 ±126,0 |
23,4 ± 11,3 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h: |
2,6 ±1,2 |
3,7 ±1 |
2,6 ±1,2 |
3,6 ± 1.2 |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC0_T) in ng x h/ml: |
1169 ±322 |
91 ±46 |
1161 ± 355 |
89 ±55 |
dopadura® C 200/50 mg retard
Eine im Jahr 2000 durch geführte Bioverfügbarkeitsuntersuchung (1 x 1 Retardtablette an Tag 1. dann 2 x 1 Retardtablette an Tag 2-7 unter nüchternen Bedingungen sowie 1 x 1 Retardtablette an Tag 8 nach standardisierter Nahrungsmittelaufnahme) an 48 gesunden männlichen Probanden (20-34 Jahre) ergab im Vergleich zum Referenzpräparat:
Siehe Tabellen und Abbildungen 4-6.
Angabe der Werte als arithmetisches Mittel und Standardabweichung
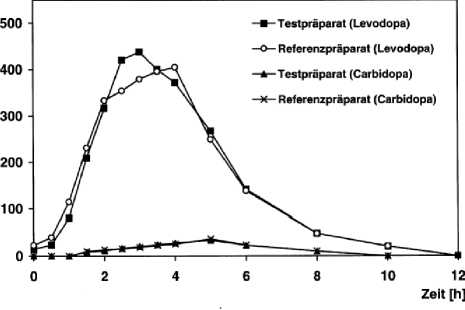
Abbildung 3: Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
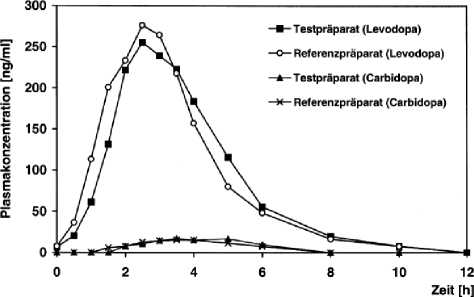
Tabelle 4:
|
Tag 1 (single dose, Nüchterngabe) |
dopadura® C 200/50 mg retard |
Referenzpräparat | ||
|
Levodopa |
Carbidopa |
Levodopa |
Carbidopa | |
|
maximale Plasmakonzentration 'Win ng/ml: |
518,9 ±132,0 |
67,0 ± 29,4 |
483,2 ±156,4 |
65,2 ±26,2 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h: |
2,0 ±0,7 |
3,7 ±1,0 |
2,0 ±1,0 |
4,0 ± 1.1 |
|
Fläche Linier der KonzentrationsZeit-Kurve (AUC0_T) in ng x h/ml: |
1686 ±383 |
319 ±158 |
1725 ±377 |
321 ±140 |
Angabe der Werte als arithmetisches Mittel und Standardabweichung
Abbildung 4: Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Ko nzent ratio ns-Zeit- Diag ra m m:
Zusätzliche Angaben der Firma Merck dura GmbH zur Bioverfügbarkeit von dopadura - C 100/25 mg bzw. 200/50 mg retard


Tabelle 5:
|
Tag 7 (multiple dose, Niichterngabe) |
dopadura® C 330/50 mg retard |
Referenzpräparat | ||
|
Levodopa |
Carbidopa |
Levodopa |
Carbidopa | |
|
maximale Plasmakonzentration (cmax) in ng/ml: |
611,2 ±155,5 |
66,1 ±23,0 |
576,0 ± 250,2 |
62,4 ±25,4 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h: |
1,5 ±0,7 |
3,8 ±1,2 |
1,5 ±0,6 |
4,1 ±1,3 |
|
Räche unter der KonzentrationsZeit-Kurve (AUC0_T) in ng xh/ml: |
2139 ±513 |
343 + 163 |
2137 +72:9 |
352 +165 |
Angabe der Werte als arithmetisches Mittel und Standardabweichung
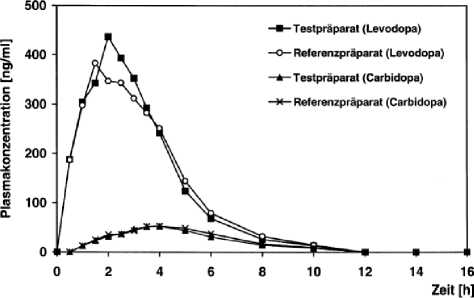
Abbildung 5: Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diag ramm:
0 2 4 6 8 10 12
Zeit [h]
Tabelle 6:
|
Tag 8 (multiple dose, nach Nahrungsmittelaufnahme) |
dopadura® C 230/50 mg retard |
Referenzpräparat | ||
|
Levodopa |
Carbidopa |
Levodopa |
Carbidopa | |
|
maximale Plasma konzentration (cmax) in ng/ml: |
671,7 ±203,2 |
42,0 ±17,4 |
600,8 ± 178,4 |
39,1 ±13,1 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) in h: |
3,2 ±1,2 |
4.1 ±1,2 |
3,0 ±1,3 |
4,1 ±1,3 |
|
Fläche unter der KonzentrationsZeit-Kurve (AUC0_T) in ng xh/ml: |
2064 ± 440 |
166 ±69 |
2161 ±471 |
161 ±57 |
Angabe der Werte als arithmetisches Mittel und Standardabweichung
Abbildung 6: Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diag ramm:
E
O)
c
o
ro
Q.