Dopegyt-Tabletten
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Dopegyt®-T abletten 250 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 282 mg Methyldopa 1,5 H2O (entsprechend 250 mg Methyldopa). Vollständige Auflistung der sonstigen Bestandteile siehe, Abschnitt 6.1.
3. DARREICHUNGSFORM
Tabletten
Runde, flache, kantige Tablette mit kreisförmiger Prägung „DOPEGYT" auf einer Tablettenseite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Schwangerschaftshypertonie
- Essentielle Hypertonie, [vorzugsweise] in Kombination mit anderen blutdrucksenkenden Mitteln, insbesondere Diuretika. Methyldopa sollte nur dann angewendet werden, wenn andere antihypertensiv wirkende Substanzen nicht ausreichend wirksam oder kontraindiziert sind.
4.2 Dosierung und Art der Anwendung Schwangerschaftshypertonie
250 - 2.000 mg Methyldopa täglich (entsprechend 1 bis 8 Tabletten); in mehreren Einzeldosen, initial einschleichend.
Essentielle Hypertonie, [vorzugsweise] in Kombination mit anderen blutdrucksenkenden Mitteln, insbesondere Diuretika
Erwachsene: Initiale Tagesdosis 250 mg Methyldopa (entsprechend 1 Tablette).
Die Dosierung kann innerhalb einiger Tage bis zur vollwirksamen Dosis gesteigert werden, die durchschnittliche Tagesdosis beträgt 500 - 750 mg Methyldopa, entsprechend 2 - 3 Tabletten.
Hinweis
Bei Niereninsuffizienz ist die Elimination vermindert.
Art und Dauer der Anwendung
Die Tabletten werden vor dem Essen - unzerkaut und mit reichlich Flüssigkeit -eingenommen.
Werden Dopegyt-Tabletten nach längerer Anwendung abgesetzt, soll die Behandlung nicht abrupt, sondern grundsätzlich langsam ausschleichend beendet werden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Akute und chronische Lebererkrankungen; schwere Nierenfunktionsstörungen; Phäochromozytom; Depressionen in der Anamnese. Schwere Herzinsuffizienz, hämolytische Anämien.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
- Bei plötzlichem Absetzen von Methyldopa kann es zu einem Rebound-Phänomen mit krisenhaftem Blutdruckanstieg kommen, daher muss die Dosis im Bedarfsfalle langsam stufenweise reduziert werden.
- Wegen möglicher Leberschädigungen sollte die Leberfunktion regelmäßig kontrolliert werden.
- Vorsicht ist bei älteren Patienten wegen der erhöhten Sensitivität gegenüber sedierenden und hypotensiven Effekten geboten.
- Vor Therapiebeginn und unter einer längerdauernden Behandlung sind Kontrollen des Coombs-Test und des Blutbildes empfehlenswert.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
- Zentraldämpfende Pharmaka und Alkohol verstärken die zentraldämpfende Wirkung.
- Die gleichzeitige Gabe von Methyldopa und Lithium kann die Lithiumtoxizität verstärken.
- Eisen führt zu einer verminderten Resorption von Methyldopa.
- Durch gleichzeitige Gabe von trizyklischen Antidepressiva, Barbituraten, Sympathomimetika und entzündungshemmenden Mitteln wie nichtsteroidalen Antirheumatika, insbesondere durch Indomethazin wird die Blutdrucksenkung abgeschwächt.
- Die gleichzeitige Gabe von Betablockern und Methyldopa kann zu schweren Bluthochdruckreaktionen führen.
- Bei der gleichzeitigen Gabe eines speziellen Arzneimittels zur Behandlung der Parkinsonkrankheit (L-Dopa) und Methyldopa ist sowohl eine schädigende Wirkung am zentralen Nervensystem (Hemmung der peripheren L-Dopa Decarboxylierung), als auch die Auslösung einer parkinson-ähnlichen Symptomatik (Mechanismus ungeklärt) möglich. Die blutdrucksenkende Wirkung wird erhöht.
- Blutdrucksenkende Arzneimittel, Diuretika, die Herzkraft schwächende Arzneimittel gegen Störungen der Herzschlagfolge (negativ inotrop wirkende Antiarrhythmika) und blutgefäßerweiternde Arzneimittel (Vasodilatatoren): Verstärkung der blutdrucksenkenden Wirkung.
- Methyldopa kann die blutzuckerspiegelsenkende (hypoglykämische) Wirkung von Tolbutamid verstärken.
- Methyldopa kann die Wirkung von Mitteln zur Herabsetzung der Blutgerinnungsfähigkeit (Antikoagulantien) auf die Prothrombinzeit erhöhen.
- Methyldopa kann die Wirkung von Ephedrin abschwächen.
- Bei gleichzeitiger Gabe von Monoaminooxidase-Hemmstoffen (MAO-Hemmer) kann Methyldopa Kopfschmerzen, Halluzinationen und erhöhten Blutdruck verursachen.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Grundsätzlich soll die Indikation zu einer medikamentösen Therapie vor allem im ersten Trimenon der Schwangerschaft streng gestellt werden. Unter Methyldopa kann sowohl die Häufigkeit schwerer Hypertonien in der Perinatalphase als auch die Abortrate gesenkt werden, und es gibt keine Hinweise auf kardiovaskuläre oder psychomotorische Schäden bei den Kindern.
Stillzeit
Methyldopa tritt in geringen Mengen in die Muttermilch über.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Die Behandlung des Bluthochdrucks mit diesem Arzneimittel bedarf der regelmäßigen ärztlichen Kontrolle. Durch individuell auftretende unterschiedliche Reaktionen kann das Reaktionsvermögen soweit verändert sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Als häufige Nebenwirkung tritt in den ersten Behandlungswochen bei 1-3 % der Patienten Fieber auf, das mit Schüttelfrost verlaufen kann.
Anfänglich auftretende Müdigkeit (Sedierung), Störung der Blutdruckregulation beim Aufrichten vom Liegen zum Stehen (orthostatische Dysregulation) sind ebenfalls häufige Nebenwirkungen.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich:
- Hämolytische Anämie Selten:
- Blut- und Blutbildungsstörungen (Agranulozytose, Thrombozytopenie, Leukozytopenie)
Erkrankungen des Immunsystems
Selten:
- LE-Syndrom Sehr selten:
- Überempfindlichkeitsreaktionen
- Toxische Nebenwirkungen im Sinne einer Autoimmunerkrankung
Psychiatrische Erkrankungen
Häufig:
- Depressive Verstimmungen
- Halluzinationen
Erkrankungen des Nervensystems Sehr häufig:
- Kopfschmerzen Gelegentlich:
- Schlafstörungen Selten:
- Parkinsonähnliche Symptome
Herzerkrankungen
Häufig:
- Bradykardie Selten:
- Myokarditis Sehr selten:
- Verstärkung von Angina-pectoris-Zeichen
- Perikarditis
Erkrankungen der Atemwege, des Brustraums und Mediastinums
Häufig:
- Trockenheit der Nasenschleimhaut
Erkrankungen des Gastrointestinaltrakts
Häufig:
- Magen-Darm-Störungen
- Trockenheit der Mundschleimhaut Selten:
- Pankreatitis
Leber- und Gallenerkrankungen
Selten:
- Pathologische Leberfunktionswerte
- Akute toxische Lebernekrose (auch während der Schwangerschaft)
- Schwere granulomatöse Hepatitis
Erkrankungen der Haut und des Unterhautzellgewebes
Gelegentlich:
- Ödeme Selten:
- Exantheme
- Lupus erythematodes-ähnliches Syndrom
- Hautreaktionen
Erkrankungen der Nieren und Harnwege
Selten:
- Retroperitoneale Fibrose Gelegentlich:
- Dunkelfärbung des Urins bei Luftkontakt
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Gelegentlich:
- Verstärkung von Potenzstörungen
- Verminderung der Libido Sehr selten:
- Gynäkomastie
- Galaktorrhoe
Nach 6-12-monatiger Behandlung mit Methyldopa findet man bei 10-20 % der Patienten einen positiven Coombs-Test, der in der Regel ohne klinische Relevanz ist (Inzidenz einer hämolytischen Anämie absolut ca. 1 %). Die Behandlung kann in der Regel unter Kontrollen des Blutbildes fortgesetzt werden.
Die antihypertensive Behandlung mit Methyldopa während der Schwangerschaft kann beim Neugeborenen zu Zittern (neonataler Tremor) führen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome
Das klinische Bild zeigt abhängig vom Ausmaß der Intoxikation im Wesentlichen kardiovaskuläre und zentralnervöse Symptome:
Mundtrockenheit, starke Müdigkeit bis zu starker Schläfrigkeit (Sedation bis zur Somnolenz), schwere Untertemperatur (Hypothermie), erniedrigter Blutdruck (Hypotonie), Störung der Blutdruckregulation beim Aufrichten vom Liegen zum Stehen (orthostatische Dysregulation), verlangsamter Herzschlag (Bradykardie), Herzrhythmusstörungen (AV-Blockierungen), schwere extrapyramidale Symptome, Koma.
Therapiemaßnahmen
Neben allgemeinen Maßnahmen (primäre Giftentfernung) müssen unter intensivmedizinischen Bedingungen die vitalen Parameter überwacht und ggf. korrigiert werden: ggf. künstliche Beatmung, externer Schrittmacher, i.v.-Gabe von Sympathomimetika und/oder Plasmaexpander. Bei Bradykardie subcutan oder i.v.-Gabe von Atropin unter EKG-Kontrolle.
Methyldopa ist hämolysierbar, dabei ist jedoch die kurze Eliminationshalbwertszeit zu berücksichtigen.
Tolazolin und Noradrenalin können als mögliche Antidote angewendet werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kardiovaskuläres System, Antihypertonika, Antiadrenerge Mittel, Zentralwirkend, Methyldopa, Methyldopa (linksdrehend)
ATC-Code: C02AB01
Das Antisympathotonikum Methyldopa ist ein a2-selektiver Agonist, dessen Wirkung im Wesentlichen auf das nach Passage der Blut-Hirn-Schranke im Zentralnervensystem gebildete a-Methylnoradrenalin zurückgeführt wird. Die Grundlage für eine ausgeprägte blutdrucksenkende Wirkung des a-Methylnoradrenalins ist seine stimulierende Wirkung auf zentral hemmende a2-adrenerge Rezeptoren, was zu einer Abnahme des peripheren Gefäßwiderstandes und zu Blutdrucksenkung führt. Wegen der Notwendigkeit der Metabolisierung treten diese Wirkungen erst nach einigen Stunden ein.
Dieser Wirkungsmechanismus beruht auf der T atsache, dass Methyldopa gut in das ZNS penetriert und dort größtenteils zum a-Methyldopamin decarboxyliert wird. Dadurch werden die Bildung von Dopamin aus Dopa sowie die analoge Bildung von Serotonin durch Decarboxylierung von 5-Hydroxytryptophan gestört. a-Methyldopamin wird dann durch die Dopamin-a-Hydroxylase zum a-Methylnoradrenalin hydroxyliert, das dann als „falscher Transmitter" fungiert. Dadurch wird der Sympathikotonus herabgesetzt.
Methyldopa kann die Retention von Natrium und Flüssigkeit verursachen. Die Entwicklung von Toleranzerscheinungen ist möglich.
5.2 Pharmakokinetische Eigenschaften
Die Resorption von oral verabreichtem Methyldopa ist variabel und unvollständig. Die Bioverfügbarkeit beträgt etwa 25 %. Maximale Plasmakonzentrationen werden nach 2 bis 3 Stunden erreicht, die Plasmahalbwertszeit beträgt etwa 2 Stunden. Die Ausscheidung erfolgt relativ rasch, so dass innerhalb von 48 Stunden etwa 90 % eliminiert sind. Im Urin findet sich überwiegend unverändertes Methyldopa und dessen Konjugat mit Schwefelsäure, weiterhin eine Reihe von Metaboliten und deren Schwefelsäurekonjugate. Die Eiweißbindung von Methyldopa beträgt 10-15 %. Methyldopa durchdringt die Plazentaschranke und ist im Nabelschnurblut und in der Muttermilch nachzuweisen.
Eine in den Jahren 1994-1995 durchgeführte Bioverfügbarkeitsuntersuchung an 24 Probanden ergab im Vergleich zu einem Referenzpräparat und einer 250 mg oralen Lösung:
|
Testpräparat (Dopegyt-Tabletten) |
Referenzpräparat (Methyldopa 250 mg Filmtabletten) |
Methyldopa 250 mg (orale Lösung) | |
|
maximale Plasmakonzentration (Cmax) (ng/ml) |
1527,2 ± 713,6 |
1477,4 ± 720,6 |
1336,5 ± 628,6 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax) (h) |
3,15 ± 1,17 |
2,80 ± 0,97 |
2,38 ± 1,03 |
|
Fläche unter der Konzentrations- |
6358,7 ± 2517,2 |
6080,6 ± 2503,0 |
5270,4 ± 2116,5 |
|
Zeit-Kurve (AUC0-O (ng h/ml) |
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat und einer 250 mg oralen Lösung in einem Konzentrations-Zeit-Diagramm:
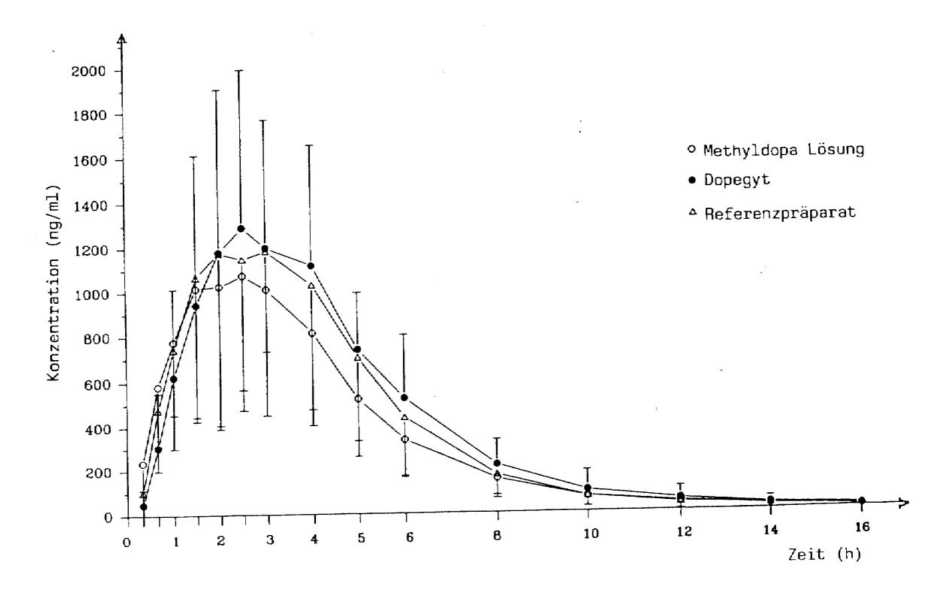
5.3 Präklinische Daten zur Sicherheit Akute Toxikologie
Die LD50 Werte schwanken nach oraler Anwendung von Methyldopa in Abhängigkeit von der Tierspezies beträchtlich. Während an der Maus und Ratte ähnliche Werte vorliegen (Maus: 5.300 mg/kg KG, 5.000 mg/kg KG Ratte) wird die LD50 beim Kaninchen bereits bei 713 mg/kg erreicht. Methyldopa ist somit in die Gruppe der mäßig toxischen Arzneimittel einzuordnen.
Subchronische Toxikologie
Subakute Toxizitätsuntersuchungen an Mäusen und Ratten über einen Zeitraum von 14 Tagen ergaben, dass die Verabreichung von Methyldopa mit dem Futter in einer Dosis, die das Fünf- bis Zehnfache der empfohlenen humantherapeutischen Dosis beträgt, keine toxikologisch relevanten Veränderungen verursachten.
Chronische Toxikologie
Chronische Studien von bis zu einem Jahr Dauer bei oraler Gabe von Methyldopa bis zu 1.800 mg/kg/Tag (Ratten), 1.350 mg/kg/Tag (Hunde) und 1.000 mg/kg/Tag (Affen) führten zu keinen relevanten histopathologischen, hämatologischen oder biochemischen Veränderungen.
Ratten und Mäusen, die Futter mit Methyldopa im Konzentrationsbereich von 3,1 g/kg Futter bis 12,5 g/kg Futter über einen Zeitraum von 2 Jahren erhielten, wiesen Veränderungen im
Körpergewicht (5-22% weniger im Vergleich zu Kontrollen) und im Verhalten auf. Bei hoher Dosierung wurden Veränderungen im Vormagen und Anzeichen von Nierenschädigung nachgewiesen.
Bei Dosierungen von Methyldopa, die das Fünf- oder Zehnfache der therapeutischen Dosis betrugen, berechnet auf Körpergewichtsbasis, wurden keine pathologisch relevanten Veränderungen nachgewiesen.
Reproduktionstoxikologische Untersuchungen
Reproduktionstoxikologische Untersuchungen wurden an drei aufeinanderfolgenden Mäusegenerationen mit Dosen bis 1.000 mg/kg KG/Tag per os im Futter, an zwei aufeinanderfolgenden Rattenwürfen mit Dosen von 100 mg/kg KG/Tag per os im Futter sowie an Kaninchen bei Gabe von Dosen bis 200 mg/kg KG/Tag per os vom 8. bis 16. Trächtigkeitstag durchgeführt.
Bei keiner Spezies ergaben sich Anhaltspunkte für eine teratogene Wirkung; die diaplazentare Passage - mit radioaktiver Substanz an der Maus untersucht - erfolgte rasch und praktisch ungehindert.
Mutagenität und Kanzerogenität
Bisherige in vitro- und in vivo-Untersuchungen zeigten in vitro teilweise schwach positive Effekte, ergaben aber keine relevanten Hinweise für ein genotoxisches Potential unter den Bedingungen der klinischen Anwendung.
Langzeitstudien zur kanzerogenen Wirkung an Ratten und Mäusen über einen Zeitraum von 2 Jahren ergaben keine eindeutigen Hinweise auf ein kanzerogenes Potential. Die Inzidenz einiger Tumorarten war unter Methyldopa herabgesetzt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Magnesiumstearat (Ph.Eur.)
Stearinsäure (Ph.Eur.)
Talkum
Ethylcellulose
Maisstärke
Carboxymethylstärke, Natriumsalz
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses Braune Glasflaschen
Packungen mit 50, 100 bzw. 200 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
CHEPLAPHARM Arzneimittel GmbH
Bahnhofstr. 1a
17498 Mesekenhagen
Telefon: 03834/8539-0
Telefax: 03834/8539-398
E-Mail: info@cheplapharm.com
8. ZULASSUNGSNUMMER
3001951.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG / VERLÄNGERUNG DER ZULASSUNG
28.05.2004
10. STAND DER INFORMATION
Januar 2015
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 9 von 9