Dorzolamid - 1A Pharma 20Mg/Ml Augentropfen
Fachinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Dorzolamid - 1 A Pharma® 20 mg/ml Augentropfen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml enthält 20 mg Dorzolamid, entsprechend 22,3 mg Dorzolamidhydrochlorid. Sonstige Bestandteil mit bekannter Wirkung: 0,08 mg Benzalkoniumchlorid Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Augentropfen
Isotonische, gepufferte, leicht visköse wässrige Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Dorzolamid ist indiziert
• als Zusatztherapie zu Betablockern
• als Monotherapie bei Patienten, die auf Betablocker nicht ansprechen oder bei denen Betablocker kontraindiziert sind
• zur Behandlung des erhöhten Augeninnendrucks bei
- okulärer Hypertension
- Offenwinkelglaukom
- Pseudoexfoliationsglaukom
4.2 Dosierung und Art der Anwendung
Dosierung
Bei Anwendung als Monotherapie beträgt die Dosierung 3-mal täglich 1 Tropfen Dorzolamid in den Bindehautsack jedes erkrankten Auges.
Bei Anwendung als Zusatztherapie mit einem topischen Betablocker beträgt die Dosierung 2-mal täglich 1 Tropfen Dorzolamid in den Bindehautsack jedes erkrankten Auges.
Wenn von einem anderen Antiglaukomatosum auf Dorzolamid umgestellt wird, sollte dieses Arzneimittel noch einen Tag lang in der adäquaten Dosierung angewendet, dann abgesetzt und am nächsten Tag die Behandlung mit Dorzolamid begonnen werden.
Art der Anwendung
Werden mehr als ein Arzneimittel zur topischen Anwendung am Auge angewendet, sollten die Arzneimittel in einem Abstand von mindestens 10 Minuten appliziert werden.
Die Patienten sollten darauf hingewiesen werden, dass die Spitze des Tropfers nicht mit den Augen und den Geweben um die Augen in Berührung kommen darf.
Die Patienten sollten auch darauf hingewiesen werden, dass Augentropfen bei nicht ordnungsgemäßer Handhabung durch Bakterien kontaminiert werden können, was zu Augeninfektionen führen kann. Schwere Schädigungen des Auges und ein daraus resultierender Verlust des Sehvermögens können die Folge der Anwendung kontaminierter Lösungen sein.
Die Patienten sollten über die korrekte Handhabung der Dorzolamid - 1 A Pharma 20 mg/ml Augentropfen informiert werden.
Hinweise für die Anwendung
Bitte befolgen Sie diese Anweisungen sorgfältig bei der Anwendung von Dorzolamid -1 A Pharma 20 mg/ml. Es wird empfohlen, vor dem Einbringen von Augentropfen die Hände zu waschen.
1. Sie dürfen die Flasche nicht verwenden, wenn der Originalitätsverschluss am Flaschenhals vor der ersten Anwendung aufgebrochen ist.
2. Zum Öffnen der Flasche schrauben Sie die Kappe durch Drehen auf, bis der Originalitätsverschluss aufbricht.
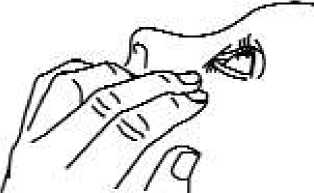
3. Beugen Sie den Kopf nach hinten und ziehen Sie das Unterlid leicht herab, damit sich zwischen Ihrem Augenlid und Ihrem Auge eine Tasche bildet (Abb. 1).
Abb. 1
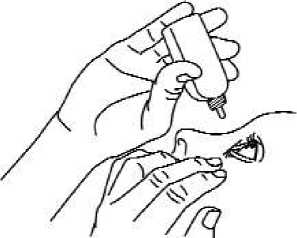
4. Kippen Sie die Flasche und drücken Sie leicht wie gezeigt (Abb. 2), bis ein einzelner Tropfen in das Auge gelangt, wie von Ihrem Arzt verordnet. BERÜHREN SIE MIT DER TROPFERSPITZE NICHT IHR AUGE ODER AUGENLID.
Abb. 2
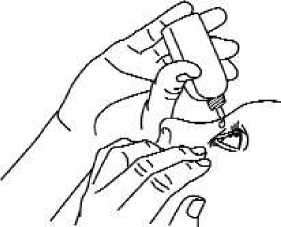
5. Falls von Ihrem Arzt angeordnet, wiederholen Sie die Schritte 3 und 4 am anderen Auge.
6. Verschließen Sie die Flasche durch festes Drehen der Kappe direkt nach der Anwendung und legen Sie die Flasche wieder in den Originalkarton zurück.
7. Die Tropferspitze ist so konzipiert, dass sie einen genau abgemessenen Tropfen abgibt. Vergrößern Sie deshalb nicht die Öffnung der Tropferspitze.
Anwendung bei Kindern
Die Erfahrungen bei Kindern sind begrenzt. Über die 3-mal tägliche Anwendung von Dorzolamid bei pädiatrischen Patienten sind begrenzte klinische Daten verfügbar (Informationen über Dosierung bei pädiatrischen Patienten siehe Abschnitt 5.1).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile in Abschnitt 6.1 oder gegen Sulfonamide.
Dorzolamid wurde bei Patienten mit schweren Nierenfunktionsstörungen (Kreatinin-Clearance < 30 ml/min) oder mit hyperchlorämischer Azidose nicht geprüft. Da die Ausscheidung von Dorzolamid und seinen Metaboliten überwiegend über die Nieren erfolgt, ist Dorzolamid daher bei diesen Patienten kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Dorzolamid wurde bei Patienten mit Leberfunktionsstörungen nicht geprüft und sollte daher bei solchen Patienten mit Vorsicht angewendet werden.
Die Therapie von Patienten mit akutem Winkelblockglaukom erfordert zu den topischen drucksenkenden Mitteln zusätzliche therapeutische Maßnahmen. Dorzolamid wurde bei Patienten mit akutem Winkelblockglaukom nicht geprüft.
Dorzolamid ist ein Sulfonamid, das, obwohl topisch appliziert, systemisch resorbiert wird. Daher können bei topischer Anwendung dieselben Nebenwirkungen wie bei Sulfonamiden auftreten, auch schwerwiegende Reaktionen wie Stevens-JohnsonSyndrom oder toxische epidermale Nekrolyse. Wenn Anzeichen schwerwiegender Überempfindlichkeitsreaktionen auftreten, ist das Arzneimittel abzusetzen.
Die Therapie mit oralen Carboanhydrasehemmern wurde mit Urolithiasis als Folge von Störungen des Säure-Basen-Haushaltes, insbesondere bei Patienten mit anamnestisch bekannten Nierensteinen, in Zusammenhang gebracht. Obwohl keine Störungen des Säure-Basen-Haushaltes unter Dorzolamid beobachtet wurden, wurde selten über Urolithiasis berichtet. Da Dorzolamid ein topischer
Carboanhydrasehemmer ist, der systemisch resorbiert wird, kann bei Patienten mit anamnestisch bekannten Nierensteinen ein erhöhtes Risiko für eine Urolithiasis während der Anwendung von Dorzolamid bestehen.
Wenn allergische Reaktionen (z. B. Konjunktivitis und Augenlidreaktionen) beobachtet werden, sollte ein Abbruch der Behandlung erwogen werden.
Eine additive Wirkung der bekannten systemischen Wirkungen der Carboanhydrasehemmung ist bei Patienten, die einen Carboanhydrasehemmer zum Einnehmen und Dorzolamid erhalten, möglich. Die gleichzeitige Gabe von Dorzolamid und oralen Carboanhydrasehemmern wird nicht empfohlen.
Bei Patienten mit vorbestehenden chronischen Hornhautdefekten und/oder intraokularer Operation in der Anamnese wurde über Hornhautödeme und irreversible Hornhautdekompensationen während der Anwendung von Dorzolamid berichtet. Topisches Dorzolamid sollte bei solchen Patienten mit Vorsicht angewendet werden.
Nach fistulierenden Operationen wurde bei der Gabe von Arzneimitteln, die die Kammerwasserproduktion hemmen, über Aderhautabhebung in Verbindung mit okulärer Hypotonie berichtet.
Dorzolamid enthält den Konservierungsstoff Benzalkoniumchlorid, der Irritationen am Auge hervorrufen kann. Kontaktlinsen sind vor der Anwendung zu entfernen und frühestens 15 Minuten nach Anwendung wieder einzusetzen.
Benzalkoniumchlorid kann zu Verfärbungen weicher Kontaktlinsen führen.
Pädiatrische Patienten
Dorzolamid wurde bei Frühgeborenen, die vor der 36. Schwangerschaftswoche geboren wurden und bei Neugeborenen unter 1 Woche Lebensalter nicht geprüft. Patienten mit ausgeprägter Unreife der Nierentubuli sollten aufgrund des möglichen Risikos einer metabolischen Azidose Dorzolamid nur nach gründlicher Abwägung des Nutzen -Risiko -Verhältnisses erhalten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Gezielte Studien hinsichtlich Wechselwirkungen wurden mit Dorzolamid nicht durchgeführt.
In klinischen Studien wurde Dorzolamid gleichzeitig mit den folgenden Medikationen ohne Auftreten von Wechselwirkungen angewendet: Timolol-Augentropfen, Betaxolol-Augentropfen und systemische Arzneimittel einschließlich ACE-Hemmern, Kalziumkanalblockern, Diuretika, nichtsteroidaler Antiphlogistika einschließlich Acetylsalicylsäure sowie Hormonen (z. B. Östrogen, Insulin, Thyroxin).
Das Zusammenwirken von Dorzolamid und Miotika sowie adrenergen Agonisten während der Glaukomtherapie wurde nicht abschließend ausgewertet.
Dorzolamid ist ein Carboanhydrasehemmer, der, obwohl topisch angewendet, auch in den systemischen Kreislauf resorbiert wird. In klinischen Studien wurden keine Störungen des Säure-Basen-Haushaltes unter Dorzolamid beobachtet. Jedoch wurden diese Wirkungen bei Gabe von oralen Carboanhydrasehemmern beschrieben und führten in einigen Fällen zu Arzneimmittelwechselwirkungen (z. B. toxische Reaktionen bei Patienten unter hochdosierter Therapie mit Salicylaten). Daher sollte die potentielle
Möglichkeit solcher Wechselwirkungen bei Patienten, die Dorzolamid erhalten, berücksichtigt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Über die Anwendung von Dorzolamid bei Schwangeren liegen keine ausreichenden Daten vor. In Studien an Kaninchen wurden bei maternotoxischen Dosen teratogene Wirkungen beobachtet (siehe Abschnitt 5.3).
Dorzolamid soll während der Schwangerschaft nicht angewendet werden.
Stillzeit
Es ist nicht bekannt, ob das Arzneimittel in die Muttermilch übertritt. Bei säugenden Ratten wurde bei den Nachkommen eine Verringerung der Körpergewichtszunahme beobachtet. Wenn eine Behandlung mit Dorzolamid erforderlich ist, wird Stillen nicht empfohlen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Studien zu Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen wurden nicht durchgeführt.
Mögliche Nebenwirkungen, wie Schwindel und Sehstörungen, können die Fahrtüchtigkeit und das Bedienen von Maschinen beeinträchtigen (siehe auch Abschnitt 4.8).
4.8 Nebenwirkungen
Dorzolamidhaltige Augentropfen wurden an mehr als 1.400 Personen in kontrollierten und nicht kontrollierten klinischen Studien untersucht. In Langzeitstudien wurden 1.108 Patienten mit dorzolamidhaltigen Augentropfen als Monotherapie oder als Zusatztherapie zu einem topischen Betablocker behandelt. Die häufigsten Gründe für einen Abbruch der Behandlung mit dorzolamidhaltigen Augentropfen (bei ca. 3 % der Patienten) waren dabei arzneimittelbedingte Nebenwirkungen am Auge, insbesondere Konjunktivitis und Lidreaktionen.
Folgende Nebenwirkungen wurden entweder während klinischer Studien oder nach Markteinführung berichtet.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100, < 1/10)
Gelegentlich (> 1/1.000, < 1/100)
Selten (> 1/10.000, < 1/1.000)
Sehr selten (< 1/10.000)
Erkrankungen des Nervensystems und psychiatrische Erkrankungen Häufig: Kopfschmerzen Selten: Schwindel, Parästhesien
Augenerkrankungen
Sehr häufig: Brennen und Stechen
Häufig: Keratitis superficialis punctata, Tränen, Konjunktivitis, Lidentzündung, Jucken der Augen, Lidreizung, Verschwommensehen Gelegentlich: Iridozyklitis
Selten: Reizungen einschließlich Rötung, Schmerzen, Krustenbildung an den Augenlidern, vorübergehende Myopie (die sich nach Absetzen der Therapie zurückbildete), Hornhautödem, okuläre Hypotonie, Aderhautabhebung nach fistulierenden (den Kammerwasserabluss regulierenden) Operationen
Erkrankungen der Atemwege, des Brustraums und Mediastinums Selten: Epistaxis
Erkrankungen des Gastrointestinaltrakts
Häufig: Übelkeit, bitterer Geschmack
Selten: Reizung im Rachenbereich, trockener Mund
Erkrankungen der Haut und des Unterhautzellgewebes
Selten: Kontaktdermatitis, Urtikaria, Pruritus, Ausschlag, Stevens-Johnson-Syndrom, toxische epidermale Nekrolyse
Erkrankungen der Nieren Selten: Urolithiasis
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: Asthenie/Müdigkeit
Selten: Überempfindlichkeit: Anzeichen und Symptome lokaler Reaktionen (palpebrale Reaktionen) und systemische allergische Reaktionen einschließlich Angioödem, Kurzatmigkeit, selten Bronchospasmen
Laborbefunde
Dorzolamid wurde nicht mit klinisch relevanten Elektrolytstörungen in Verbindung gebracht.
Pädiatrische Patienten Siehe Abschnitt 5.1.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Es liegen nur begrenzte Informationen hinsichtlich der Überdosierung beim Menschen bei versehentlicher oder absichtlicher Einnahme von Dorzolamidhydrochlorid vor. Folgendes wurde bei Einnahme berichtet:
• orale Einnahme: Somnolenz
• topischer Applikation: Übelkeit, Schwindel, Kopfschmerzen, Müdigkeit, verändertes Träumen und Dysphagie.
Die Behandlung sollte symptomatisch und unterstützend sein. Es können Elektrolytverschiebungen, Entwicklung einer Azidose und möglicherweise Auswirkungen auf das ZNS auftreten. Serumelektrolytspiegel (insbesondere Kalium) und der pH-Wert des Blutes sollten überwacht werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiglaukomatosum und Miotikum,
Carboanhydrasehemmer
ATC-Code: S01E C03
Wirkmechanismus
Die Carboanhydrase (CA) ist ein Enzym, das in vielen Körpergeweben einschließlich des Auges vorkommt. Beim Menschen sind mehrere Isoenzyme der Carboanhydrase vorhanden. Das aktivste Isoenzym ist die Carboanhydrase II (CA II), die in erster Linie in den roten Blutkörperchen, aber auch in anderen Geweben vorkommt. Die Hemmung der Carboanhydrase im Ziliarkörper des Auges verringert die Kammerwasserproduktion. Daraus resultiert eine Augeninnendrucksenkung.
Dorzolamid - 1 A Pharma 20 mg/ml enthält Dorzolamidhydrochlorid, einen potenten Inhibitor der humanen Carboanhydrase II. Nach topischer Applikation am Auge senkt Dorzolamid den erhöhten Augeninnendruck, unabhängig davon, ob ein Glaukom besteht oder nicht. Der erhöhte Augeninnendruck ist ein Hauptrisikofaktor bei der Entstehung von Sehnervenschäden und Gesichtsfeldverlust. Dorzolamid erzeugt keine Pupillenverengung und senkt den intraokularen Druck ohne Nebenwirkungen wie Nachtblindheit und Akkommodationsspasmus. Dorzolamid hat nur eine sehr geringe bzw. keine Auswirkung auf die Pulsfrequenz oder den Blutdruck.
Topisch angewendete Betablocker senken ebenfalls den Augeninnendruck durch Verringerung der Kammerwasserproduktion, jedoch über einen anderen Wirkmechanismus. Studien haben gezeigt, dass durch die Gabe von Dorzolamid zu einem topischen Betablocker eine zusätzliche Augeninnendrucksenkung erreicht wird. Dieser Befund stimmt mit den berichteten additiven Wirkungen von Betablockern und oralen Carboanhydrasehemmern überein.
Pharmakodynamische Wirkungen Klinische Wirksamkeit und Sicherheit Erwachsene Patienten:
In umfangreichen klinischen Studien mit bis zu 1-jähriger Dauer bei Patienten mit Glaukom oder okulärer Hypertension zeigte sich die Wirksamkeit von Dorzolamid als Monotherapie bei 3-mal täglicher Gabe (Augeninnendruck-Ausgangswert > 23 mmHg) oder als Zusatztherapie zu topischen Betablockern (Augeninnendruck-Ausgangswert > 22 mmHg) bei 2-mal täglicher Gabe. Die augeninnendrucksenkende Wirkung von Dorzolamid als Monotherapie und als Zusatztherapie hielt während des ganzen Tages an und konnte auch in der Langzeitanwendung aufrechterhalten werden. Die Wirksamkeit bei langfristiger Monotherapie war vergleichbar mit der von Betaxolol und etwas geringer als bei Timolol. Bei Anwendung als Zusatztherapie zu topischen Betablockern war die zusätzliche Augeninnendrucksenkung von Dorzolamid vergleichbar mit Pilocarpin 2 % 4-mal täglich.
Kinder und Jugendliche:
Eine 3-monatige, doppelblinde, aktiv-kontrollierte, multizentrische Studie wurde bei 184 (122 unter Dorzolamid) pädiatrischen Patienten im Alter von 1 Woche bis 6 Jahren mit Glaukom oder erhöhtem Augeninnendruck (Ausgangswert Augeninnendruck > 22 mmHg) durchgeführt, um die Verträglichkeit einer 3-mal täglichen topischen Verabreichung von Dorzolamid zu beurteilen. Bei ungefähr der Hälfte der Patienten in beiden Behandlungsgruppen wurde ein kongenitales Glaukom diagnostiziert; andere häufige Ätiologien waren Sturge-Weber-Syndrom, iridocorneale mesenchymale Dysgenesie, sowie Aphakie. Die Verteilung nach Alter und Behandlungen in der Monotherapie-Phase war wie folgt:
|
Dorzolamid 2 % |
Timolol | |
|
Alterskohorte < 2 Jahre |
n = 56 Altersbereich: 1-23 Monate |
Timolol* 0,25 % n = 27 Altersbereich: 0,25-22 Monate |
|
Alterskohorte > 2 - < 6 Jahre |
n = 66 Altersbereich: 2-6 Jahre |
Timolol 0,5 % n = 35 Altersbereich: 2-6 Jahre |
* gelbildende Lösung
In beiden Alterskohorten zusammen wurden rund 70 Patienten mindestens 61 Tage und rund 50 Patienten 81-100 Tage behandelt.
Wenn der Augeninnendruck durch Monotherapie mit Dorzolamid- oder Timolol-gelbildenden Augentropfen unzureichend kontrolliert war, wurde die Untersuchung als offene Studie wie folgt weitergeführt: 30 Patienten < 2 Jahren wechselten zu einer Kombinationstherapie mit gelbildenden Timolol-Augentropfen 0,25 % 1-mal/Tag und Dorzolamid 2 % 3-mal/Tag; 30 Patienten > 2 Jahren wechselten zu einer Fixkombination 2 % Dorzolamid/0,5 % Timolol 2-mal/Tag.
Insgesamt ergaben sich in dieser Studie keine zusätzlichen Sicherheitsbedenken bei pädiatrischen Patienten.
In einer klinischen Studie wurden bei ungefähr 20 % der Patienten unter Dorzolamid-Monotherapie arzneimittelbedingte Nebenwirkungen beobachtet. Die meisten davon waren lokale, nicht schwerwiegende Wirkungen auf die Augen wie Augenbrennen und -stechen, Injektion und Augenschmerzen. Bei einem kleinen Prozentsatz < 4 % wurden Hornhautödeme oder Trübungen beobachtet. Lokale Reaktionen kamen bei der Vergleichssubstanz ähnlich häufig vor. In den Daten nach Markteinführung wurde über metabolische Azidose insbesondere bei sehr jungen Patienten mit Unreife/Beeinträchtigung der Nieren berichtet.
Wirksamkeitsstudien bei pädiatrischen Patienten deuten darauf hin, dass die mittlere Abnahme des Augeninnendrucks in der Dorzolamidgruppe der mittleren Abnahme des Augeninnendrucks der Timololgruppe entsprach, selbst wenn zahlenmäßig ein kleiner Vorteil unter Timolol zu beobachten war.
Wirksamkeitsstudien über einen längeren Zeitraum (> 12 Wochen) sind nicht verfügbar.
5.2 Pharmakokinetische Eigenschaften
Im Gegensatz zur oralen Gabe von Carboanhydrasehemmern ermöglicht die topische Anwendung von Dorzolamidhydrochlorid eine direkte Wirkung am Auge bei wesentlich niedrigeren Dosen und daher geringerer systemischer Belastung. In klinischen Studien führte dies zu einer Augeninnendrucksenkung ohne Störungen des Säure-BasenHaushaltes oder Elektrolytverschiebungen, die charakteristisch für oral angewendete Carboanhydrasehemmer sind.
Nach topischer Anwendung gelangt Dorzolamid in den systemischen Kreislauf. Zur Erfassung einer möglichen systemischen Carboanhydrasehemmung nach topischer Anwendung wurden Wirksubstanz- und Metabolitenkonzentrationen in den roten Blutkörperchen und im Plasma sowie die Carboanhydrasehemmung in den roten Blutkörperchen gemessen.
Unter Dauertherapie reichert sich Dorzolamid in den roten Blutkörperchen als Folge der selektiven Bindung an die Carboanhydrase II (CA-II) an, während im Plasma extrem niedrige Konzentrationen der freien Wirksubstanz verbleiben. Die Muttersubstanz bildet einen einzigen N-Desethyl-Metaboliten, der die CA-II zwar weniger stark als die Muttersubstanz, zusätzlich aber noch ein weniger aktives Isoenzym (CA-I) hemmt. Der Metabolit reichert sich auch in den roten Blutkörperchen an, wo er in erster Linie an CA-I bindet. Dorzolamid weist eine mäßige Plasmaproteinbindung (ca. 33 %) auf und wird größtenteils unverändert im Urin ausgeschieden. Der Metabolit wird ebenfalls im Urin ausgeschieden. Nach Beendigung der Anwendung wird Dorzolamid nicht linear aus den roten Blutkörperchen ausgewaschen, was anfangs zu einem raschen Konzentrationsabfall führt, gefolgt von einer langsameren Eliminationsphase mit einer Halbwertszeit von ca. 4 Monaten.
Nach oraler Gabe von Dorzolamid zur Stimulation der maximalen systemischen Belastung nach Langzeitanwendung der topischen Form am Auge wurde innerhalb von 13 Wochen ein Gleichgewicht (steady state) erreicht. Im steady state waren praktisch weder freie Wirksubstanz noch Metabolit im Plasma nachweisbar. Die Carboanhydrasehemmung in den roten Blutkörperchen war geringer als sie für eine pharmakologische Wirkung auf Nierenfunktion oder Atmung für notwendig erachtet wird. Vergleichbare pharmakokinetische Ergebnisse wurden nach topischer Dauertherapie mit Dorzolamid beobachtet.
Einige ältere Patienten mit Nierenfunktionsstörungen (geschätzte Kreatinin-Clearance 30-60 ml/min) wiesen jedoch höhere Metabolitenkonzentrationen in den roten Blutkörperchen auf. Daraus ergaben sich jedoch keine wesentlichen Unterschiede bezüglich der Carboanhydrasehemmung und keine klinisch signifikanten systemischen Nebenwirkungen.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In klinischen Studien entwickelten Patienten keine Anzeichen einer metabolischen Azidose oder Serum-Elektrolytverschiebungen, die auf eine systemische Carboanhydrasehemmung hinweisen. Daher ist nicht zu erwarten, dass die in Tierstudien erfassten Wirkungen bei Patienten unter therapeutischen Dosen von Dorzolamid beobachtet werden können.
Bei Kaninchen wurden bei Gabe von Dorzolamid in maternotoxischen Dosen in Verbindung mit einer metabolischen Azidose Missbildungen der Wirbelkörper beobachtet.
6.1 Liste der sonstigen Bestandteile
Benzalkoniumchlorid Hyetellose Mannitol (Ph.Eur.)
Natriumcitrat 2 H2O
Natriumhydroxid/Salzsäure (zur pH-Einstellung) Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
Haltbarkeit nach Anbruch: 4 Wochen
Aus mikrobiologischer Sicht kann das Produkt für maximal 28 Tage aufbewahrt werden. Für andere Lagerungszeiten ist der Anwender verantwortlich.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
LDPE-Flasche mit LDPE-Tropfer und HDPE-Schraubkappe
Packungsgrößen
1x5 ml3x5 ml und 6x5 ml
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
Siehe Abschnitt 4.2 zu Anweisungen für den Patienten.
7. INHABER DER ZULASSUNG
1 A Pharma GmbH Keltenring 1 + 3 82041 Oberhaching Tel.: 089/6138825-0
Fax: 089/6138825-65
E-Mail: medwiss@1apharma.com
8. ZULASSUNGSNUMMER
66681.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 06. März 2008
Datum der letzten Verlängerung der Zulassung: 16. Oktober 2012
10. STAND DER INFORMATION
Oktober 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig