Duodopa, 20 Mg/Ml + 5 Mg/Ml, Gel Zur Intestinalen Anwendung
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
Duodopa, 20 mg/ml + 5 mg/ml, Gel zur intestinalen Anwendung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Gel enthält 20 mg Levodopa und 5 mg Carbidopa-Monohydrat
100 ml Gel enthalten 2000 mg Levodopa und 500 mg Carbidopa-Monohydrat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Gel zur intestinalen Anwendung Cremefarbenes bis leicht gelbes Gel.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Behandlung der fortgeschrittenen, auf Levodopa-reaktiven Parkinson-Krankheit mit schweren motorischen Fluktuationen und Hyper-/Dyskinesie, wenn verfügbare Kombinationen von Antiparkinsonmitteln nicht zu zufrieden stellenden Ergebnissen geführt haben.
4.2 Dosierung und Art der Anwendung
Duodopa ist ein Gel zur kontinuierlichen intestinalen Anwendung. Bei einer Langzeitanwendung sollte das Gel mit einer tragbaren Pumpe direkt in das Duodenum oder obere Jejunum über eine Dauersonde verabreicht werden, die mittels einer perkutanen endoskopischen Gastrostomie, mit einer äußeren Transabdominalsonde und einer inneren Intestinalsonde gelegt wird. Alternativ kann eine radiologische Gastrojejunostomie in Erwägung gezogen werden, wenn die perkutane endoskopische Gastrostomie aus irgendeinem Grund nicht angebracht ist. Das Festlegen der transabdominalen Öffnung und der Dosiseinstellungen sollte in Zusammenarbeit mit einer neurologischen Klinik erfolgen.
Eine temporäre Nasoduodenalsonde/Nasojejunalsonde kann verwendet werden, um zu bestimmen, ob der Patient auf diese Art der Behandlung positiv reagiert, bevor eine permanente perkutane endoskopische Gastrostomie mit jejunaler Sonde (PEG-J) gelegt wird. Bei Fällen, bei denen der Arzt diese Prüfung für nicht notwendig erachtet, kann auf die nasojejunale Testphase verzichtet werden und die Behandlung direkt mit Legung der PEG-J begonnen werden.
Die Dosis sollte für eine optimale klinische Reaktion jedes einzelnen Patienten angepasst werden, das bedeutet, Maximierung der funktionalen ON-Phase während des Tages durch Minimierung der Anzahl und Dauer der OFF-Episoden (Bradykinesie) und Minimierung der ON-Phase mit behindernder Dyskinesie.
Siehe Empfehlungen unter Dosierung.
Duodopa sollte zu Beginn als Monotherapie angewendet werden. Wenn es erforderlich ist, können andere Arzneimittel für die Behandlung der Parkinson-Krankheit zusammen mit Duodopa angewendet werden. Für die Verabreichung von Duodopa sollte nur die CADD-Legacy-1400-Pumpe (CE 0473) verwendet werden. Ein Handbuch mit Anweisungen für die Handhabung der tragbaren Pumpe wird zusammen mit der Pumpe geliefert.
Die Behandlung mit Duodopa® mit einer Dauersonde kann jederzeit beendet werden; hierfür wird die Sonde entfernt, und die Wunde kann verheilen. Die Behandlung sollte dann mit oralen Arzneimitteln fortgeführt werden, einschließlich Levodopa/Carbidopa.
Dosierung:
Die gesamte Tagesdosis von Duodopa besteht aus drei individuell eingestellten Dosen: Der morgendlichen Bolusdosis, der kontinuierlichen Erhaltungsdosis und den Extra-Bolusdosen, die über ca. 16 Stunden verabreicht werden.
Die Kassetten mit Arzneimittel sind nur zum einmaligen Gebrauch und sollten nicht länger als 16 Stunden verwendet werden, auch wenn etwas Arzneimittel übrig bleibt. Geöffnete Kassetten sind nicht wieder zu verwenden.
Am Ende der Lagerzeit kann sich das Gel leicht gelb verfärben. Dieses hat keinen Einfluss auf die Konzentration des Arzneimittels oder die Behandlung.
Morgendosis: Die morgendliche Bolusdosis wird mittels der Pumpe verabreicht, um schnell die therapeutische Dosishöhe zu erreichen (innerhalb von 10 - 30 Minuten). Die Dosis sollte auf der Grundlage der vorhergehenden morgendlichen Levodopa-Dosis des Patienten + des Volumens zum Befüllen der Sonde festgelegt werden. Die gesamte Morgendosis beträgt gewöhnlich 5-10 ml, was 100-200 mg Levodopa entspricht. Die gesamte Morgendosis sollte 15 ml (300 mg Levodopa) nicht übersteigen.
Kontinuierliche Erhaltungsdosis: Die Erhaltungsdosis kann in Schritten von 2 mg/Stunde (0,1 ml/Stunde) angepasst werden. Die Dosis sollte entsprechend der vorhergehenden täglichen Einnahme von Levodopa berechnet werden. Wenn zusätzliche Arzneimittel abgesetzt werden, muss die Duodopa-Dosis angepasst werden. Die kontinuierliche Erhaltungsdosis wird individuell eingestellt. Sie sollte innerhalb eines Bereichs von 1-10 ml/Stunde (20-200 mg Levodopa/Stunde) liegen und beträgt gewöhnlich 2-6 ml/Stunde (40-120 mg Levodopa/Stunde). Die maximale empfohlene Tagesdosis sind 200 ml (siehe auch Abschnitt 4.4). In Ausnahmefällen ist möglicherweise eine höhere Dosis erforderlich.
Beispiel:
Tägliche Dosis von Levodopa in Form von Duodopa: 1640 mg/Tag Morgendliche Bolusdosis: 140 mg = 7 ml (ohne das Volumen zum Befüllen der Intestinalsonde)
Kontinuierliche Erhaltungsdosis: 1500 mg/Tag 1500 mg/Tag: 20 mg/ml = 75 ml Duodopa pro Tag
Die Einnahme wird über 16 Stunden berechnet. 75 ml/16 Stunden = 4,7 ml/h.
Extra-Bolusdosen: Falls erforderlich zu verabreichen, wenn der Patient im Verlaufe des Tages hypokinetisch wird. Die Extradosis sollte individuell eingestellt werden, sie liegt normalerweise zwischen 0,5 - 2,0 ml. In seltenen Fällen ist möglicherweise eine höhere Dosis erforderlich. Wenn es notwendig ist, mehr als 5 Mal täglich eine Extra-Bolusdosis zu verabreichen, dann sollte die Erhaltungsdosis erhöht werden.
Nach Einstellen der Anfangsdosis sollten in den nächsten Wochen Feinanpassungen der morgendlichen Bolusdosis, der Erhaltungsdosis und der Extra-Bolusdosen durchgeführt werden.
Wenn es medizinisch gerechtfertigt ist, kann Duodopa während der Nacht verabreicht werden.
Überwachung der Behandlung: Eine plötzliche Verschlechterung der Behandlungsreaktion mit wieder auftretenden motorischen Fluktuationen sollte zu der Annahme führen, dass der distale Teil der Sonde sich vom Duodenum/Jejunum in den Magen verschoben hat. Die Lage der Sonde sollte mittels einer Röntgenaufnahme festgestellt und das Ende der Sonde wieder im Duodenum/Jejunum positioniert werden.
Besondere Bevölkerungsgruppen Pädiatrische Bevölkerung
Es gibt keine relevante Anwendung von Duodopa in der pädiatrischen Bevölkerung für die Indikation fortgeschrittener, auf Levodopa-reaktiver Parkinson-Krankheit mit schweren motorischen Fluktuationen und Hyper-/Dyskinesie.
Ältere Bevölkerung
Es gibt ein beträchtliches Erfahrungsspektrum über die Anwendung von Levodopa/Carbidopa bei älteren Patienten. Die Dosierung für alle Patienten, einschließlich der geriatrischen Bevölkerung, wird individuell durch Titrieren eingestellt.
Beeinträchtigung der Nieren-/Leberfunktion
Es gibt keine Studien zur Pharmakokinetik von Carbidopa und Levodopa bei Patienten mit Beeinträchtigung der Leber- oder Nierenfunktion. Die Dosierung mit Duodopa erfolgt individuell durch Titrieren auf die optimale Wirkung (diese entspricht individuell optimierten Levodopa und Carbidopa-Plasma-Expositionen); daher werden mögliche Effekte auf die Beeinträchtigung der Leber- oder Nierenfunktion durch die Levodopa- und Carbidopa-Exposition indirekt für die Dosiseinstellung berechnet. Die Dosiseinstellung sollte bei Patienten mit schwerer Beeinträchtigung der Nieren- bzw. Leberfunktion mit Vorsicht erfolgen (siehe Abschnitt 4.4). .
Unterbrechung der Behandlung
Patienten sollten im Falle einer plötzlich erforderlichen Reduzierung der Dosis oder wenn es notwendig wird, die Behandlung mit Duodopa abzubrechen, sorgfältig überwacht werden; dies ist insbesondere bei Patienten erforderlich, die Antipsychotika erhalten (siehe Abschnitt 4.4).
Im Falle einer vermuteten oder diagnostizierten Demenz mit einer verminderten Desorientierungsschwelle, sollte die Pumpe nur vom Pflegepersonal oder Betreuer gehandhabt werden.
Wenn eine Kassette verwendet werden soll, wird sie zur Verabreichung an der tragbaren Pumpe befestigt, und das System wird mit der Nasoduodenalsonde oder der Duodenal-/Jejunalsonde gemäß den entsprechenden Anweisungen verbunden.
4.3 Gegenanzeigen
Duodopa ist kontraindiziert bei Patienten mit:
• Überempfindlichkeit gegen Levodopa, Carbidopa oder einen der sonstigen Bestandteile, aufgelistet in Abschnitt 6.1
• Engwinkel-Glaukom
• schwerer Herzinsuffizienz
• schwerer Herzarrhythmie
• akutem Schlaganfall
• Nicht-selektive MAO-Hemmer und selektive MAO-Hemmer des Typs A dürfen nicht gleichzeitig mit Duodopa angewendet werden. Diese Inhibitoren müssen mindestens zwei Wochen vor Therapiebeginn mit Duodopa abgesetzt werden. Duodopa kann gleichzeitig in der vom Hersteller empfohlenen Dosis eines MAO-Inhibitors mit Selektivität für MAO Typ B (z. B. Selegilin-HCl) verabreicht werden (siehe Abschnitt 4.5).
• Erkrankungen, bei denen Adrenergika kontraindiziert sind, z. B. Phäochromozytom, Schilddrüsenüberfunktion und Cushing-Syndrom.
Da Levodopa maligne Melanome aktivieren kann, darf Duodopa nicht bei Patienten mit
verdächtigen, nicht diagnostizierten Hautveränderungen oder Melanom in der Anamnese
verwendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Einige Warnhinweise und Vorsichtsmaßnahmen gelten generell für Levodopa und gelten
daher auch für Duodopa.
• Duodopa wird für die Behandlung von durch Arzneimittel verursachten extrapyramidalen Reaktionen nicht empfohlen.
• Die Duodopa-Therapie sollte bei Patienten mit schweren Herz-Kreislauf- oder Lungenerkrankungen, Bronchialasthma, einer Nieren-, Leber- oder endokrinen Erkrankung sowie bei Patienten mit peptischen Ulzera oder Krampfanfällen in der Anamnese mit Vorsicht erfolgen.
• Bei Patienten mit anamnestisch bekanntem Myokardinfarkt und residualer Vorhof-, AV-Knoten- oder Kammerarrhythmie sollte die Herzfunktion während des Zeitraums der anfänglichen Dosisanpassungen mit besonderer Sorgfalt überwacht werden.
• Alle Patienten, die mit Duodopa behandelt werden, sollten sorgfältig im Hinblick auf die Entwicklung von psychischen Veränderungen, Depression mit Suizidneigung und andere schwerwiegende psychische Veränderungen beobachtet werden. Patienten, die an einer Psychose leiden oder gelitten haben, müssen mit Vorsicht behandelt werden.
• Die gleichzeitige Anwendung von Antipsychotika mit Dopamin-Rezeptor-blockierenden Eigenschaften, insbesondere D2-Rezeptor-Antagonisten, sollte mit Vorsicht erfolgen, und der Patient sollte engmaschig auf einen Verlust der Anti-Parkinson-Wirkung oder eine Verschlechterung der Parkinson-Symptome beobachtet werden, siehe Abschnitt 4.5.
• Patienten mit einem chronischen Weitwinkel-Glaukom können mit Vorsicht mit Duodopa behandelt werden, vorausgesetzt, dass der Augeninnendruck gut kontrolliert und der Patient kontinuierlich auf Veränderungen des Augeninnendrucks überwacht wird.
• Duodopa kann eine orthostatische Hypotonie verursachen. Deshalb sollte Duodopa bei Patienten, die andere Arzneimittel einnehmen, die eine orthostatische Hypotonie verursachen können, mit Vorsicht angewendet werden, siehe Abschnitt 4.5.
• Levodopa ist bei Parkinson-Patienten mit Somnolenz und mit Episoden plötzlich eintretender Schlafanfälle in Verbindung gebracht worden, daher ist beim Führen von Fahrzeugen oder Bedienen von Maschinen Vorsicht geboten (siehe Abschnitt 4.7).
• Ein Symptomenkomplex, der dem malignen neuroleptischen Syndrom (MNS) ähnelt, einschließlich Muskelsteifigkeit, erhöhter Körpertemperatur, psychischer Veränderungen (z. B. Agitiertheit, Verwirrtheit, Koma) und eines erhöhten Spiegels der Serum-Kreatinphosphokinase, wurde bei Patienten beobachtet, bei denen Anti-Parkinson-Mittel abrupt abgesetzt wurden. In seltenen Fällen wurden bei Parkinson-Patienten eine sekundäre Rhabdomyolyse als Folge des malignen neuroleptischen Syndroms oder schwere Dyskinesien beobachtet. Deshalb sollten Patienten sorgfältig überwacht werden, wenn die Dosis der Levodopa/Carbidopa-Kombinationen abrupt reduziert oder abgesetzt wird, insbesondere bei den Patienten, die Antipsychotika erhalten. Im Zusammenhang mit Duodopa ist weder über MNS noch über Rhabdomyolyse berichtet worden.
• Die Patienten sollten im Hinblick auf eine Entwicklung von Störungen der Impulskontrolle regelmäßig überwacht werden. Es sollte sowohl Patienten als auch Pflegenden bewusst gemacht werden, dass sich im Verhalten von Patienten, die mit Dopamin-Agonisten und/oder anderen Levodopa enthaltenden dopaminergen Arzneimitteln, einschließlich Duodopa, behandelt werden, Symptome einer Störung der Impulskontrolle, einschließlich
Spielsucht/pathologischem Spielen, Libidosteigerung und Hypersexualität, zwanghaftem Geldausgeben oder Kaufverhalten, Fressattacken/Binge Eating und zwanghaftem Essen, zeigen können. Es wird empfohlen, die Therapie zu überprüfen, sollten sich solche Symptome entwickeln.
• Epidemiologische Studien haben gezeigt, dass Parkinson-Patienten ein höheres Risiko zur Melanomentwicklung als die allgemeine Bevölkerung tragen. Es ist unklar, ob das erhöhte Risiko durch Morbus Parkinson oder andere Faktoren, wie Medikamente zur Behandlung des Morbus Parkinson, bedingt ist. Daher wird Patienten und Versorgern geraten, bei Anwendung von Duodopa, unabhängig von der Indikation, regelmäßig im Hinblick auf Melanome zu beobachten. Idealerweise sollten regelmäßige Hautuntersuchungen durch kompetente Fachleute durchgeführt werden (z. B. Dermatologen).
• Wenn eine Vollnarkose erforderlich ist, kann die Behandlung mit Duodopa so lange fortgesetzt werden, wie es dem Patienten erlaubt wird, Flüssigkeiten und Arzneimittel oral aufzunehmen. Wenn die Therapie vorübergehend abgesetzt werden muss, kann die Behandlung mit Duodopa, sobald die orale Flüssigkeitsaufnahme erlaubt ist, mit der gleichen Dosis wieder aufgenommen werden, die vorher gegeben wurde.
• Es kann erforderlich sein, die Duodopa-Dosis nach unten anzupassen, um eine Levodopainduzierte Dyskinesie zu vermeiden.
• Die regelmäßige Kontrolle der Leber-, hämatopoetischen, Herz-Kreislauf- und Nierenfunktion wird bei einer längeren Duodopa-Therapie empfohlen.
• Duodopa enthält Hydrazin, ein Abbauprodukt von Carbidopa, welches genotoxisch und möglicherweise karzinogen sein kann. Die durchschnittlich empfohlene Tagesdosis von Duodopa beträgt 100 ml und enthält 2 g Levodopa und 0,5 g Carbidopa. Die maximale empfohlene Tagesdosis sind 200 ml. Dies bedeutet eine durchschnittliche Hydrazinaufnahme von 4 mg/Tag mit einer Maximalaufnahme von 8 mg/Tag. Die klinische Relevanz dieser Hydrazinaufnahme ist unbekannt.
• Ein früherer chirurgischer Eingriff im oberen Teil des Abdomens kann zu Schwierigkeiten bei der Durchführung der Gastrostomie / Jejunostomie führen.
Berichte über Komplikationen in klinischen Studien schließen Bezoar, Ileus, Erosion/Geschwür an der Implantationsstelle, intestinale Hämorrhagie, intestinale Ischämie, intestinale Obstruktion, intestinale Perforation, Pankreatitis, Peritonitis, Pneumoperitoneum und post-operative Wundinfektion ein.
Bezoare sind zurückbehaltene Verdichtungen unverdauter Lebensmittelreste im Verdauungstrakt. Die meisten Bezoare befinden sich im Magen, können aber auch an anderen Stellen im Verdauungstrakt auftreten. Abdominalschmerzen können ein Anzeichen der oben aufgezählten Komplikationen sein. Einige Ereignisse können zu schwerwiegenden Folgen führen, wie z. B. Operation und/oder Tod. Patienten sollte geraten werden, ihren Arzt in Kenntnis zu setzen, wenn irgendwelche Symptome auftreten, die mit obigen Ereignissen zusammenhängen.
• Eine eingeschränkte Fähigkeit, das System zu bedienen (Pumpe, Sondenanschlüsse) kann zu Komplikationen führen. Bei solchen Patienten sollte ein Pflegender (z. B. Schwester, Hilfsschwester oder ein naher Verwandter) den Patienten unterstützen.
• Eine plötzliche oder allmähliche Verschlechterung der Bradykinesie kann auf eine Verstopfung der Vorrichtung, aus welchem Grund auch immer, hinweisen und muss untersucht werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Wechselwirkungsstudien mit Duodopa durchgeführt. Die folgenden Wechselwirkungen sind aus der generischen Kombination von Levodopa/Carbidopa bekannt.
Vorsicht ist bei gleichzeitiger Anwendung von Duodopa mit den folgenden Arzneimitteln geboten:
Antihypertensiva
Eine symptomatische orthostatische Hypotonie trat auf, als eine Kombination von Levodopa und einem Decarboxylase-Hemmer der Behandlung von Patienten hinzugefügt wurde, die bereits Antihypertensiva erhielten. Eine Dosisanpassung des Antihypertensivums kann erforderlich sein.
Antidepressiva
Selten wurde über unerwünschte Reaktionen, einschließlich Hypertonie und Dyskinesie, berichtet, die bei der gleichzeitigen Anwendung von trizyklischen Antidepressiva und Carbidopa/Levodopa-Präparaten auftraten.
Anticholinergika
Anticholinergika können eine synergistische Wirkung mit Levodopa haben und den Tremor verringern. Eine kombinierte Anwendung kann jedoch abnorme unwillkürliche Bewegungen verstärken. Anticholinergika können die Wirkung von Levodopa verringern, indem sie seine Resorption verzögern. Möglicherweise ist eine Anpassung der Duodopa-Dosis erforderlich.
COMT-Hemmer (Tolcapon, Entacapon)
Die gleichzeitige Anwendung von COMT (Catechol-O-Methyltransferase) - Hemmern und Duodopa kann die Bioverfügbarkeit von Levodopa erhöhen. Die Duodopa-Dosis muss möglicherweise angepasst werden.
Andere Arzneimittel
Dopaminrezeptor-Antagonisten (einige Antipsychotika, z. B. Phenothiazine, Butyrophenone und Risperidon sowie Antiemetika, z. B. Metoclopramid), Benzodiazepine, Isoniazid, Phenytoin und Papaverin können die therapeutische Wirkung von Levodopa verringern. Patienten, die diese Arzneimittel zusammen mit Duodopa einnehmen, sollten engmaschig in Bezug auf einen Verlust des therapeutischen Ansprechens überwacht werden.
Duodopa kann zusammen mit der empfohlenen Dosis eines MAO-Hemmers, der selektiv für MAO Typ B ist (z. B. Selegilin-HCl) angewendet werden. Die Levodopa-Dosis muss möglicherweise verringert werden, wenn ein MAO-Inhibitor mit Selektivität für MAO Typ B hinzugefügt wird.
Die gleichzeitige Anwendung von Selegilin und Levodopa/Carbidopa ist mit schwerer orthostatischer Hypotonie in Verbindung gebracht worden.
Amantadin hat eine synergistische Wirkung mit Levodopa und kann die mit Levodopa verbundenen unerwünschten Wirkungen verstärken. Eine Anpassung der Duodopa-Dosis kann erforderlich sein.
Sympathomimetika können die kardiovaskulären unerwünschten Wirkungen verstärken, die mit Levodopa im Zusammenhang stehen.
Levodopa bildet im Magen-Darm-Trakt ein Chelat mit Eisen, was zur verringerten Resorption von Levodopa führt.
Da Levodopa sich kompetitiv zu gewissen Aminosäuren verhält, kann die Resorption von Levodopa bei Patienten, die eine proteinreiche Ernährung erhalten, gestört sein.
Die Auswirkung der Anwendung von Antazida und Duodopa auf die Bioverfügbarkeit von Levodopa ist nicht untersucht worden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine oder begrenzte Daten über die Anwendung von Levodopa/Carbidopa bei schwangeren Frauen vor. Tierversuche haben eine Reproduktionstoxizität gezeigt, siehe Abschnitt 5.3. Duodopa wird während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine Kontrazeption anwenden, nicht empfohlen, es sei denn, der Nutzen für die Mutter überwiegt die möglichen Risiken für den Fötus.
Stillzeit
Levodopa und mögliche Levodopa-Metaboliten gehen in die Muttermilch über. Es gibt Anzeichen, dass die Milchbildung während der Behandlung mit Levodopa unterdrückt wird.
Es ist nicht bekannt, ob Carbidopa oder seine Metaboliten in die menschliche Muttermilch übergehen. Tierexperimentelle Daten zeigen einen Übergang von Carbidopa in die Milch.
Über die Sicherheit von Levodopa/Carbidopa oder ihrer Metaboliten beim Neugeborenen/Säugling liegen nur unzureichende Informationen vor. Frauen sollten während der Anwendung von Duodopa nicht stillen.
Fertilität
In präklinischen Studien mit Carbidopa oder Levodopa allein wurden keine unerwünschten Reaktionen auf die Fertilität beobachtet. Fertilitätsstudien an Tieren wurden in der Kombination von Levodopa und Carbidopa nicht durchgeführt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Duodopa hat einen bedeutenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit, Maschinen zu bedienen. Levodopa und Carbidopa können Benommenheit und orthostatische Hypotonie hervorrufen. Daher ist beim Führen von Fahrzeugen und beim Bedienen von Maschinen Vorsicht geboten. Patienten, die mit Duodopa behandelt werden und bei denen Somnolenz und/oder Episoden plötzlich eintretender Schlafanfälle auftreten, müssen darauf hingewiesen werden, dass sie kein Fahrzeug führen oder keinen Tätigkeiten nachgehen dürfen, bei denen sie sich selbst oder andere aufgrund verminderter Aufmerksamkeit dem Risiko schwerer Verletzungen oder des Todes aussetzen (z. B. beim Bedienen von Maschinen), bis solche wiederkehrenden Episoden und Somnolenz nicht mehr auftreten, siehe auch Abschnitt 4.4.
4.8 Nebenwirkungen
Arzneimittel-bezogene Nebenwirkungen, die häufig mit dem Duodopa-System auftreten, schließen Nausea und Dyskinesie mit ein.
Auf das technische System und den Eingriff bezogene Nebenwirkungen, die häufig mit dem Duodopa-System auftreten, umfassen Abdominalschmerzen, Komplikationen beim Einsetzen des technischen Systems, zu viel Granulationsgewebe, Erytheme an der Einschnittstelle, postoperative Wundinfektion, Auslaufen nach dem Eingriff, durch den Eingriff bedingter Schmerz und durch den Eingriff bedingte lokale Reaktion.
Die meisten dieser Nebenwirkungen wurden bald nach Studienbeginn im Anschluss an das perkutane endoskopische Gastrostomieverfahren berichtet und traten während der ersten 28 Tage auf.
Nebenwirkungen, die mit Duodopa berichtet wurden
Die Sicherheit von Duodopa wurde mit der oralen Standardformulierung von Levodopa/Carbidopa (100 mg/25 mg) an insgesamt 71 Patienten mit fortgeschrittenem Morbus Parkinson verglichen, die an einer randomisierten, doppelblinden, Doppel-Dummy aktiven Kontrollstudie mit einer Dauer von 12 Wochen teilnahmen. Zusätzliche Sicherheitsinformation wurde an 354 Patienten mit fortgeschrittener Parkinson-Krankheit in einer offenen Fortsetzungsstudie (Dauer 12 Monate) sowie offenen Fortsetzungsstudien gesammelt.
Eine Analyse wurde für Patienten, die Duodopa in allen Studien erhielten, unabhängig vom Studiendesign (doppelblind oder offen) durchgeführt, um eine Zusammenfassung der arzneimittelbezogenen Nebenwirkungen zu ermöglichen. Eine andere Analyse wurde für Patienten durchgeführt, die Duodopa oder Placebo-Gel über eine PEG-J erhielten, um eine Zusammenfassung der Nebenwirkungen (bedingt durch das Verfahren (Eingriff) bzw. durch das technische System) in allen Studien zu ermöglichen, unabhängig vom Studiendesign (doppelblind oder offen).
Nebenwirkungen (zu Arzneimittel, Verfahren und technischem Gerät) basierten, unabhängig von der zugewiesenen Kausalität, auf Häufigkeitsangaben bei der Behandlung und zusätzlich auf Nebenwirkungen, die aus der Anwendung nach der Markteinführung von Duodopa identifiziert wurden. Diese sind in Tabelle 1 dargestellt.
Tabelle 1 Daten zu Nebenwirkungen aus klinischen Studien und aus Erfahrung nach der Markteinführung
|
MedDRA- System Organklasse |
Sehr häufiga (> 1/10) |
Häufiga (> 1/100 bis < 1/10) |
Gelegentlich0 (> 1/1000 bis < 1/100) |
Selten0 (> 1/10000 bis < 1/1000) |
Häufigkeit unbekannt nach Marktein führung |
|
Arzneimittelbezogene Nebenwirkungen | |||||
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie |
Leukopenie, Thrombo zytopenie | |||
|
Erkrankungen des Immunsystems |
anaphylak tische Reaktion | ||||
|
Stoffwechsel- und Ernährungs störungen |
Gewichts abnahme |
Gewichtszunahme, erhöhter Spiegel an Aminosäure (erhöhte Methyl-malonsäure), erhöhtes Homocystein im Blut, verminderter | |||
|
Appetit, Vitamin-B6- Mangel, Vitamin-B12- Mangel | |||||
|
Psychiatrische Erkrankungen |
Ängstlich keit, Depression, Schlaflosig keit |
Ungewöhnliche Träume, Agitiertheit, Verwirrtheitszustand, Halluzinationen, impulsives Verhaltenc, psychotische Störung, Schlafattacken, Schlafstörung |
vollendeter Suizid, Demenz, Desorien tierung, euphorische Stimmung, Furcht, Libido zunahme (siehe Abschnitt 4.4), Albträume, Suizidversuch |
Unge- wöhn- liches Denken | |
|
Erkrankungen des Nervensystems |
Dyskinesien, Verschlimmerung der keine Verbesserung der Parkinson Erkrankung |
Schwindel, Dystonie, Kopf schmerzen, Hypästhesie, On-off- Phänomen, Parästhesie, Poly neuropathie, Somnolenz, Synkope, Tremor |
Ataxie, Krämpfe, Gangstörung | ||
|
Augen erkrankungen |
Blepharospasmus, Diplopie, optische ischämische Neuropathie, verschwommenes Sehen | ||||
|
Herz erkrankungen |
Unregel mäßiger Herzschlag |
Palpitationen | |||
|
Gefäß erkrankungen |
Ortho statische Hypotonie |
Hypertonie, Hypotonie, |
Phlebitis | ||
|
Erkrankungen der Atemwege, des Brustraumes und Mediastinums |
Dyspnoe, Oropharynx- schmerz, Aspirations pneumonie |
Brustschmerz, Dysphonie |
anomale Atmung | ||
|
Erkrankungen des Gastrointestinal- |
Nausea (Übelkeit), Obstipation |
Spannungsge fühl im Abdomen, |
vermehrte Speichel drüsen- |
Zähne knirschen, Speichel- |
|
traktes |
Diarrhö, Mund trockenheit, Dysgeusie, Dyspepsie, Dysphagie, Blähungen, Erbrechen |
sekretion |
ver färbung, Glosso- dynie, Schluck auf | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Kontakt- dermatitis, Hyper- hidrosis, periphere Ödeme, Pruritus, Haut ausschlag |
Alopezie, Erytheme, Urtikaria |
Ver färbung von Schweiß, malignes Melanom (siehe Abschnitt 4.4) | ||
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Muskel krämpfe, Nacken schmerzen | ||||
|
Erkrankungen der Nieren und Harnwege |
Harn inkontinenz, Harn verhaltung |
Verfärbung des Urins |
Priapismu s | ||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Müdigkeit, Schmerzen, Asthenie |
Unwohlsein | |||
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Stürze | ||||
|
Nebenwirkungen im Zusammenhang mit dem technischen Gerät und dem Eingriff | |||||
|
Infektionen und parasitäre Erkrankungen |
post operative Wund infektion |
Zellgewebsentzündung an der Einschnittstelle, Infektion nach dem Eingriff |
postoperativer Abszess | ||
|
Erkrankungen des Gastrointestinaltraktes |
abdominaler Schmerz |
abdominale Be schwerden, Oberbauch schmerz, |
Bezoar (siehe Abschnitt 4.4), ischämische Colitis, gastro- |
Magen durchbruch, gastro intestinale Perforation, | |
|
Peritonitis, Pneumo peritoneum |
intestinale Ischämie, Magendarm verschluss erkrankungen, Pankreatitis, Dünndarm blutungen, Dünndarm geschwür, Dickdarm perforation |
Dünndarm ischämie, Dünndarm perforation | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
übermäßiges Granu lations gewebe | ||||
|
Allgemeine Erkrankungen und Beschwerden am Verabreichung sort |
Kompli kationen beim Einsetzens des technischen Gerätesd |
Verlagerung des technischen Gerätes, Verschluss des technischen Gerätes | |||
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Erythem an der Einschnittstelle, Auslaufen nach dem Eingriff, durch den Eingriff bedingte Schmerzen, durch den Eingriff bedingte lokale Reaktion |
Gastrointestinale Stomakomplikation, Schmerz an der Einschnitt stelle, post operativer Ileus, Komplikation nach dem Eingriff, Beschwerden nach dem Eingriff, Hämorrhagie nach dem Eingriff |
a Nebenwirkungen aus klinischen Studien. Zugewiesene Häufigkeiten spiegeln Nebenwirkungshäufigkeiten wider und sind ohne Bezug zur Kausalität, die vom Prüfer zugewiesen wurde.
b Nebenwirkungen, die mit Duodopa beobachtet wurden, aber für die Schätzungen der Häufigkeit nicht verfügbar sind. Festgesetzte Häufigkeiten basieren auf historischen Daten für orales Levodopa/Carbidopa.
c Störungen der Impulskontrolle: Bei Patienten, die mit Dopamin-Agonisten und/oder anderen Levodopa enthaltenden dopaminergen Arzneimitteln, einschließlich Duodopa, behandelt werden, können Spielsucht/pathologisches Spielen, Libidosteigerung und Hypersexualität,
zwanghaftes Geldausgeben oder Kaufverhalten, Fressattacken/Binge Eating und zwanghaftes Essen auftreten (siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
d Komplikationen bei der Einsetzung des technischen Gerätes waren eine häufig berichtete Nebenwirkung sowohl für die nasojejunale Sonde wie für die PEG-J. Diese Nebenwirkung wurde zusammen mit einer oder mehreren der folgenden Nebenwirkungen für die nasojejunale Sonde berichtet: oropharyngealer Schmerz, Spannungsgefühl im Bauch, Abdominalschmerz, abdominale Beschwerden, Schmerz, Hustenreiz, Magen-DarmtraktVerletzungen, ösophagale Blutungen, Ängstlichkeit, Dysphagie und Erbrechen. Für die PEG-J wurde diese Nebenwirkung zusammen mit einer oder mehreren der folgenden Nebenwirkungen berichtet: Abdominalschmerz, abdominale Beschwerden, Spannungsgefühl im Bauch, Flatulenz oder Pneumoperitoneum. Andere nicht schwerwiegende Nebenwirkungen, die zusammen mit einer Komplikation beim Einsetzens des technischen Gerätes berichtet wurden, schlossen abdominale Beschwerden, abdominalen Schmerz, oberes Duodenalgeschwür, blutende Duodenalgeschwüre, erosive Zwölffingerdarmentzündung, erosive Gastritis, Magendarmblutung, Peritonitis, Pneumoperitoneum, Dünndarmgeschwür ein.
Lageveränderung der intestinalen Sonde zurück in den Magen oder Blockierung im technischen Gerät führen zum Wiederauftreten der motorischen Fluktuationen.
Die folgenden zusätzlichen Nebenwirkungen (bevorzugt in MedDRA-Terminologie) wurden mit oralem Levodopa/Carbidopa beobachtet und könnten mit Duodopa auftreten:
Tabelle 2 mit oralem Levodopa/Carbidopa beobachtete Nebenwirkung
|
MedDRA-System Organklasse |
Selten0 (> 1/10000 bis < 1/1000) |
Sehr selten (> 1/100000 bis < 1/10000) |
|
Erkrankungen des Blutes und des Lymphsystems |
Hämolytische Anämie |
Agranulozytose |
|
Erkrankungen des Nervensystems |
Trismus, Neuroleptisches malignes Syndrom (siehe Abschnitt 4.4) | |
|
Augenerkrankungen |
Horner’s Syndrom Mydriasis okulogyrische Krise | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Angioödem Henoch-Schönlein Purpura |
Laborwerte: Über die folgenden Abnormitäten der Laborwerte ist bei der Behandlung mit Levodopa/Carbidopa berichtet worden, sie sollten bei der Behandlung von Patienten mit Duodopa beachtet werden: Erhöhte Werte von Harnstickstoff, alkalischen Phosphatasen, S-ASAT, S-ALAT, LDH, Bilirubin, Blutzucker, Kreatinin, Harnsäure und positiver Coomb-Test sowie verminderte Hämoglobin- und Hämatokritwerte. Über Leukozyten, Bakterien und Blut im Urin wurde berichtet. Levodopa/Carbidopa, und somit Duodopa, können eine falsche positive Reaktion hervorrufen, wenn Teststreifen für die Prüfung auf Ketone im Urin verwendet werden; diese Reaktion wird durch Kochen der Urinprobe nicht verändert. Bei Einsatz von Glucose-Oxidase-Verfahren besteht die Möglichkeit falsch negativer Ergebnisse hinsichtlich Glucosurie.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen.
Deutschland
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de Österreich
Bundesamt für Sicherheit im Gesundheitswesen
Traisengasse 5
1200 WIEN
ÖSTERREICH
Fax: + 43 (0) 50 555 36207
Website: http://www.basg.gv.at/
4.9 Überdosierung
Die bedeutendsten klinischen Symptome einer Überdosierung mit Levodopa/Carbidopa sind Dystonie und Dyskinesie. Ein Blepharospasmus kann ein Frühzeichen einer Überdosierung sein. Die Behandlung einer akuten Überdosierung von Duodopa ist im Allgemeinen die gleiche wie bei einer akuten Überdosierung von Levodopa: Pyridoxin ist jedoch zur Umkehrung der Wirkung von Duodopa nicht wirksam. Eine EKG-Überwachung sollte durchgeführt und der Patient sorgfältig auf eine mögliche Entwicklung von Herzarrhythmien hin überwacht werden. Falls erforderlich, sollte eine geeignete antiarrhythmische Behandlung eingeleitet werden. Die Möglichkeit, dass der Patient andere Arzneimittel zusammen mit Duodopa eingenommen hat, sollte in Erwägung gezogen werden. Derzeit sind noch keine Erfahrungen mit Dialyse berichtet worden, daher ist ihr Nutzen bei der Behandlung einer Überdosierung nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiparkinsonmittel, Levodopa und Decarboxylasehemmer ATC-Code: N04BA02
Wirkmechanismus:
Duodopa ist eine Kombination aus Levodopa und Carbidopa (Verhältnis 4:1) in einem Gel, und für die kontinuierliche intestinale Infusion bei der fortgeschrittenen Parkinson-Krankheit bestimmt, bei der es zu schweren motorischen Fluktuationen und Hyper-/Dyskinesie kommt. Levodopa ist eine metabolische Vorstufe von Dopamin, das nach Decarboxylierung zu Dopamin im Gehirn die Symptome der Parkinson-Krankheit reduziert. Carbidopa, das die Blut-Hirn-Schranke nicht überschreitet, hemmt die extrazerebrale Decarboxylierung von Levodopa, was bedeutet, dass eine größere Menge Levodopa für den Transport in das Gehirn und die Umformung in Dopamin zur Verfügung steht. Ohne die gleichzeitige Gabe von Carbidopa würden sehr viel größere Mengen Levodopa erforderlich sein, um den gewünschten Effekt zu erzielen. Die intestinale Infusion individueller Duodopa-Dosen hält die Levodopa-Plasmakonzentrationen innerhalb des individuellen therapeutischen Fensters auf einem stabilen Spiegel.
Pharmakodynamische Effekte:
Durch die intestinale Infusionstherapie mit Duodopa werden die motorischen Fluktuationen reduziert und die „OFF“-Phase der Patienten mit fortgeschrittener Parkinson-Krankheit, die vorher jahrelang eine Tablettenbehandlung mit Levodopa/Decarboxylase-Hemmer erhalten haben, wird verringert. Die motorischen Fluktuationen und Hyper-/Dyskinesien werden aufgrund von im Vergleich zu oralem Carbidopa/Levodopa weniger schwankenden Plasmakonzentrationen reduziert, was die Behandlung in einem engen therapeutischen Fenster erlaubt. Der therapeutische Effekt auf motorische Fluktuationen und Hyper-/Dyskinesien wird häufig am ersten Behandlungstag erzielt.
Klinische Wirksamkeit und Sicherheit:
Die Wirksamkeit von Duodopa wurde in zwei identisch konzipierten Phase-3-Studien bestätigt (12 Wochen, randomisiert, doppel-blind, doppel-Dummy, aktiv kontrolliert, Parallelgruppen-Studien, multizentrisch), um die Wirksamkeit, Sicherheit und Verträglichkeit von Duodopa gegenüber Tabletten mit Levodopa/Carbidopa 100/25 mg zu evaluieren. Die Studien wurden mit Patienten mit fortgeschrittener Parkinson-Krankheit durchgeführt, die auf Levodopa ansprachen und trotz optimierter Therapie mit oralem Levodopa/Carbidopa und anderen verfügbaren Arzneimitteln zur Behandlung der Parkinson-Krankheit anhaltende motorische Fluktuationen hatten. Es waren insgesamt 71 Patienten eingeschlossen. Die Ergebnisse der zwei Studien wurden kombiniert und eine Einzelanalyse wurde durchgeführt.
Der primäre Endpunkt für die Wirksamkeit, Veränderung in der normalisierten „OFF“-Phase (zu Beginn bis zum Endpunkt) auf Basis der Daten des Parkinson's Disease Diary© unter Verwendung der letzten übertragenen Beobachtung zeigte eine statistisch signifikante mittlere Least-Square (LS)-Differenz zugunsten der Duodopa-Behandlungsgruppe (Tabelle 3).
Die primären Endpunktergebnisse wurden durch Mixed Model Repeated Measures (MMRM)-Analyse unterstützt, die die Veränderung seit Studienbeginn zu jeder Studienvisite nach Studienbeginn untersuchte. Diese Analyse der „OFF“-Phase zeigte in Woche 4 eine statistisch signifikante größere Verbesserung der Duodopa-Gruppe über die LC-orale Gruppe, und es wurde gezeigt, dass die Verbesserung in Woche 8, 10 und 12 statistisch signifikant ist.
Auf Basis der Daten des Parkinson's Disease Diary© stand diese Veränderung in der „OFF”-Phase zwischen der Duodopa-Behandlungsgruppe und der aktiven Kontrollgruppe in Zusammenhang mit einer statistisch signifikanten LS-Durchschnittsdifferenz von Studienbeginn in der durchschnittlichen täglichen normalisierten „ON“-Phase ohne beschwerliche Dyskinesie. Die Werte zu Studienbeginn wurden drei Tage vor der Randomisierung und nach 28 Tagen standardisierter oraler Therapie gesammelt.
Tabelle 3 Veränderung von Studienbeginn bis zum Endpunkt in der „Off“-Phase und in der „On"-Phase ohne beschwerliche Dyskinesie
|
Behandlungsgrup |
n |
Studienbegin |
Endpunkt |
LS |
LS |
p Wert |
|
pe |
n (Mittelwert |
(SD) |
Mittelwert |
Mittelwer | ||
|
(SD) |
(Stunden) |
(SE) der |
t (SE) der | |||
|
(Stunden) |
Veränderun |
Differenz | ||||
|
g(Stunden) |
(Stunden) |
Primäre Messung
|
„Off“-Phase | ||||||
|
Aktive Kontrollea |
31 |
6,90 (2,06) |
4,95 (2,04) |
-2,14 (0,66) | ||
|
Duodopa |
35 |
6,32 (1,72) |
3,05 (2,52) |
-4,04 (0,65) |
-1,91 (0,57)_ |
0,0015 |
|
Sekundäre Messung | ||||||
|
„On“-Phase ohne beschwerliche Dyskinesie | ||||||
|
Aktive Kontrolle |
31 |
8,04 (2,09) |
9,92 (2,62) |
2,24 (0,76) | ||
|
Duodopa |
35 |
8,70 (2,01) |
11,95 (2,67)_ |
4,11 (0,75) |
1,86 (0,65) |
0,0059 |
SD = Standardabweichung; SE = Standard-Error a Aktive Kontrolle, orale Tabletten Levodopa/Carbidopa 100/25 mg
Die Analysen anderer sekundärer Endpunkte zur Wirksamkeit, in der Reihenfolge des hierarchischen Testverfahrens, zeigte für Duodopa im Vergleich zu oralem Levodopa/Carbidopa statistisch signifikante Ergebnisse für den Parkinson ’s Disease Questionnaire (PDQ-39) Summary Index, Clinical Global Impression (CGI-I) Score und Unified Parkinson’s Disease Rating Scale (UPDRS) Teil-II-Score (Aktivitäten im täglichen Leben). Der PDQ-39 Summary Index zeigte in Woche 12 eine Abnahme gegenüber Studienbeginn von 10,9 Punkten. Andere sekundäre Endpunkte, UPDRS Teil III Score, EQ-5D-Summary-Index und ZßI-Gesamt-Score, erreichten auf Basis des hierarchischen Testverfahrens keine statistische Signifikanz.
Eine offene, einarmige, multizentrische Phase-3-Studie wurde ausgeführt, um über 12 Monate die Langzeitsicherheit und -verträglichkeit von Duodopa an 354 Patienten zu prüfen. Die Zielpopulation waren auf Levodopa ansprechende Patienten mit fortgeschrittener ParkinsonKrankheit und, trotz optimierter Behandlung mit gegen die Parkinson-Krankheit verfügbaren Arzneimitteln, schweren motorischen Fluktuationen. Die durchschnittliche tägliche normalisierte „Off‘-Phase änderte sich um - 4,44 Stunden von Studienbeginn bis zum Endpunkt (6,77 Stunden zu Studienbeginn und 2,32 Stunden bis zum Endpunkt) mit einer entsprechenden Zunahme von 4,8 Stunden in der „On“-Phase ohne Dyskinesie.
Pädiatrische Population
Die Sicherheit von Duodopa bei Patienten unter 18 Jahren wurde nicht nachgewiesen, und seine Anwendung bei Patienten unter 18 Jahren wird nicht empfohlen.
5.2 Pharmakokinetische Eigenschaften Resorption
Duodopa wird über eine eingesetzte Sonde direkt in das Duodenum oder Jejunum verabreicht. Levodopa wird schnell und wirksam über ein Hochleistungs-Transportsystem für Aminosäuren aus dem Dünndarm resorbiert. Die absolute Bioverfügbarkeit von Levodopa aus oralen Tabletten mit sofortiger Freisetzung, die Levodopa/Carbidopa enthalten, wird mit 84 -99 % beschrieben. Nach einer Analyse zur Pharmakokinetik in der Population einer Kreuzstudie liegt es nahe, dass die Bioverfügbarkeit von Duodopa mit oralen Tabletten mit Levodopa/Carbidopa (100/25 mg) vergleichbar ist.
In einer Phase-1-Studie wurden bei intrajejunaler Verabreichung von Duodopa schnell therapeutische Levodopa-Plasmaspiegel erreicht und über den Infusionsverlauf konsistente Levodopaspiegel aufrechterhalten. Nach Beendigung der Infusion nahmen die
Levodopaspiegel schnell ab (Abbildung 1). Die Intra-Patienten-Variabilität der LevodopaPlasma-Konzentrationen war im Betrachtungszeitraum von Stunde 2 bis Stunde 16 nach Infusionsbeginn niedrig (13 %).
Abbildung 1 Plasma-Konzentrationen (Mittelwert ± Standardabweichung) gegenüber Zeitprofil von Levodopa bei Duodopa-Infusion über 16 Stunden
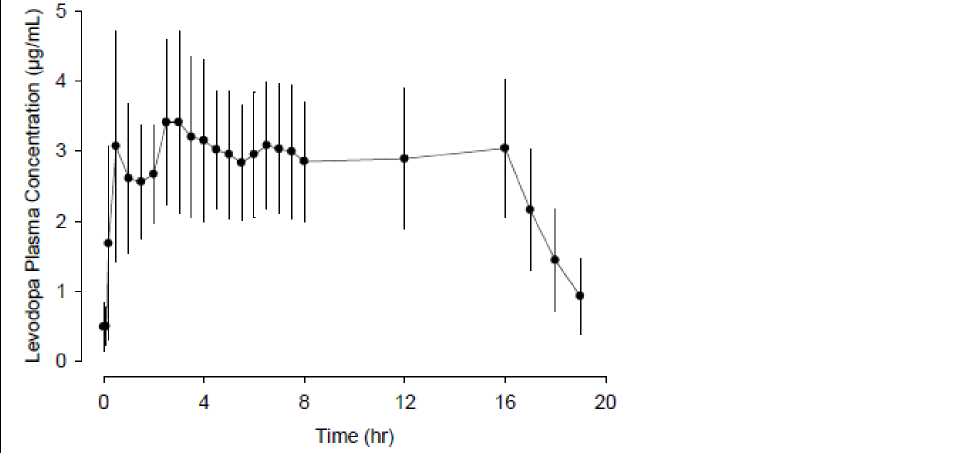
In einer Duodopa-Phase-3-Studie (doppelblind, aktiv kontrolliert) war die Intra-PatientenVariabilität in den Levodopa-Plasmakonzentrationen für Patienten, die mit Duodopa behandelt wurden, niedriger (21 %) als bei Patienten, die mit oralen verkapselten Levodopa/Carbidopa-Tabletten (100/25 mg) behandelt wurden (67 %).
Verteilung
Levodopa wird zusammen mit Carbidopa, einem Decarboxylase-Hemmer, angewendet, der die Bioverfügbarkeit von Levodopa erhöht und die Clearance senkt. Die Clearance und das Verteilungsvolumen für Levodopa beträgt 0,3 l/Stunde/kg bzw. 0,9-1,6 l/kg, wenn es zusammen mit einem Decarboxylase-Hemmer angewendet wird. Das Verteilungsverhältnis für Levodopa zwischen Erythrozyten und Plasma ist annähernd 1. Die Proteinbindung von Levodopa im Plasma ist vernachlässigbar (ungefähr 10 % - 30 %). Levodopa wird durch einen Trägermechanismus für große neutrale Aminosäuren ins Gehirn transportiert.
Carbidopa wird annähernd zu 36 % an Plasmaprotein gebunden. Carbidopa überwindet die Blut-Hirnschranke nicht.
Biotransformation und Ausscheidung
Bei Verabreichung mit Carbidopa beträgt die Eliminations-Halbwertzeit für Levodopa ca. 1,5 Stunden. Levodopa wird vollständig durch Metabolisierung eliminiert, und die gebildeten Metaboliten werden hauptsächlich über den Urin ausgeschieden. Es sind vier Stoffwechselwege bekannt, aber Levodopa wird hauptsächlich durch Metabolisierung durch zwei Enzyme, die aromatische Aminosäuredecarboxylase (AAAD) und die Catechol-O-Methyl-Transferase (COMT), eliminiert. Andere Metabolismuswege sind Transaminierung und Oxidation. Die Decarboxylierung von Levodopa zu Dopamin durch AAAD ist der enzymatische Hauptweg, wenn kein Enzyminhibitor mit verabreicht wird.. Wenn Levodopa zusammen mit Carbidopa angewendet wird, wird die Decarboxylase gehemmt, so dass die
Metabolisierung über die Catechol-O-Methyl-Transferase (COMT) der vorherrschende Stoffwechselweg wird. O-Methylierung von Levodopa durch COMT bildet 3-O-Methyldopa.
Carbidopa wird zu zwei Hauptmetaboliten (a-Methyl-3-Methoxy-4-
Hydroxyphenylpropionsäure und a-Methyl-3,4-Dihydroxphenylpropionsäure) metabolisiert. Diese zwei Metaboliten werden primär unverändert oder als Glukuronidkonjugate in den Urin eliminiert. Unverändertes Carbidopa macht 30 % der gesamten Urinausscheidung aus. Die Eliminationshalbwertszeit von Carbidopa beträgt ungefähr 2 Stunden.
Pharmakokinetische-Pharmakodynamische Beziehung
Die reduzierten Schwankungen in der Plasmakonzentration von Levodopa verringern die Schwankungen im Ansprechen auf die Behandlung. Die benötigte Levodopa-Dosis ist bei fortgeschrittener Parkinson-Krankheit sehr unterschiedlich, und es ist wichtig, dass die Dosis basierend auf dem klinischen Ansprechen individuell eingestellt wird. Man hat bei Duodopa keine Toleranzentwicklung im Laufe der Zeit festgestellt.
5.3 Präklinische Daten zur Sicherheit
Nicht-klinische Daten zeigen keine spezielle Gefährdung des Menschen basierend auf konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und zum karzinogenen Potential. In Studien zur Reproduktionstoxizität haben sowohl Levodopa als auch die Kombination Carbidopa/Levodopa viszerale und skeletale Missbildungen bei Kaninchen verursacht.
Hydrazin ist ein Abbauprodukt von Carbidopa. In Tierstudien zeigte Hydrazin deutliche systemische Toxizität, v. a. bei Exposition über die Atemwege. Diese Studien zeigten, dass Hydrazin hepatotoxisch ist, ZNS-Toxizität aufweist (allerdings nicht nach oraler Aufnahme beschrieben) und sowohl genotoxisch als auch karzinogen ist (siehe auch Abschnitt 4.4).
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Carmellose-Natrium Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Ungeöffnet: 15 Wochen
Nach Anbruch: Sofort verbrauchen. Nach Entnahme aus dem Kühlschrank kann das Arzneimittel bis zu 16 Stunden lang verwendet werden. Nicht aufgebrauchte Restmengen verwerfen.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C).
Die Kassette im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Aufbewahrungsbedingungen nach Anbruch des Arzneimittels siehe Abschnitt 6.3.
6.5 Art und Inhalt des Behältnisses
Gesamtmenge von 100 ml im PVC-Beutel in einer Schutzkassette aus Hartplastik.
Karton mit 7 Kassetten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Die Kassetten sind nur für den Einmalgebrauch gedacht.
Eine geöffnete Kassette darf nicht wieder verwendet werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial sind gemäß den nationalen Anforderungen zu entsorgen.
Leere/gebrauchte Kassetten sollten an die Apotheke zur Entsorgung zurückgegeben werden.
7. INHABER DER ZULASSUNG
Zulassungsinhaber in Deutschland:
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Deutschland
Hotline: 0800 222843 0 (gebührenfrei aus dem deutschen Festnetz) Tel.: +49 (0) 611-1720-0
Zulassungsinhaber in Österreich: AbbVie GmbH Perfektastraße 84A 1230 Wien
Tel. +49 511-8573737
8. ZULASSUNGSNUMMER
DE: Zul.-Nr.: 59725.00.00 AT und LI: Z.Nr.: 1-25624
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLANGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:
DE: 21 Oktober 2004 AT: 24. November 2004
Datum der Erteilung der letzten Verlängerung der Zulassung:
DE: 04. November 2009 AT: 21. Jänner 2009
10. STAND DER INFORMATION
14. Mai 2014
11. VERSCHREIBUNGSPFLICHT/APOTHEKENPFLICHT
DE: Verschreibungspflichtig AT: Rezept- und apothekenpflichtig
19