Eligard 45 Mg
GEBRAUCHSINFORMATION: INFORMATION FÜR DEN ANWENDER
ELIGARD 45 mg
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Zur Anwendung bei Erwachsenen Leuprorelinacetat
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt
4.
Was in dieser Packungsbeilage steht
1. Was ist ELIGARD und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von ELIGARD beachten?
3. Wie ist ELIGARD anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist ELIGARD aufzubewahren?
6. Inhalt der Packung und weitere Informationen
7. Informationen für das medizinische Fachpersonal
1. WAS IST ELIGARD UND WOFÜR WIRD ES ANGEWENDET?
Der Wirkstoff von ELIGARD gehört zur Gruppe der sogenannten Gonadotropin-Releasing-Hormone. Diese Arzneimittel werden verwendet, um die Produktion bestimmter Geschlechtshormone (Testosteron) zu vermindern.
ELIGARD wird zur Behandlung von hormonabhängigem, metastasiertem Prostatakrebs bei erwachsenen Männern und in Kombination mit Strahlentherapie zur Behandlung von nicht-metastasiertem hormonabhängigem Hochrisiko- Prostatakrebs eingesetzt.
2. WAS SOLLTEN SIE VOR DER ANWENDUNG VON ELIGARD BEACHTEN? ELIGARD darf nicht angewendet werden,
- bei Frauen und Kindern;
- wenn Sie überempfindlich (allergisch) gegen den Wirkstoff Leuprorelinacetat, gegen Produkte mit einer ähnlichen Wirkung wie das natürlich vorkommende Hormon Gonadotropin oder einen der in Abschnitt 6. genannten sonstigen Bestandteile von ELIGARD sind;
- bei Patienten nach chirurgischer Entfernung der Hoden, weil ELIGARD in solchen Fällen keine weitere Herabsetzung des Testosteronspiegels im Serum bewirkt;
- als alleinige Behandlung, wenn Sie an Symptomen leiden, die mit einem Druck auf das Rückenmark oder einem Tumor in der Wirbelsäule zusammenhängen. In solchen Fällen darf ELIGARD nur in Kombination mit anderen Arzneimitteln gegen Prostatakrebs eingesetzt werden.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie ELIGARD anwenden,
- wenn eine der folgenden Situationen auf Sie zutrifft: Eine Herz- oder Gefäßerkrankung, einschließlich Herzrhythmusstörungen (Arrhythmie), oder eine Behandlung mit einem Arzneimittel für diese Erkrankungen. Das Risiko für Herzrhythmusstörungen kann unter Anwendung von ELIGARD erhöht sein.
- wenn Sie beim Wasserlassen Beschwerden haben. In diesem Fall müssen Sie von Ihrem Arzt in den ersten Behandlungswochen sorgfältig überwacht werden.
- wenn bei Ihnen ein Druck auf das Rückenmark entsteht oder wenn Sie an Beschwerden beim Wasserlassen leiden: Im Zusammenhang mit Arzneimitteln, die einen ähnlichen Wirkungsmechanismus haben wie ELIGARD, wird berichtet, dass ein stark ausgeprägter Druck auf das Rückenmark und eine Verengung der Verbindung zwischen Nieren und Harnblase zur Entstehung lähmungsartiger Erscheinungen beitragen können. Bei solchen Komplikationen sind die üblichen Behandlungsmaßnahmen einzuleiten.
- wenn Sie in den ersten beiden Behandlungswochen an plötzlichen Kopfschmerzen, Erbrechen, verändertem Geisteszustand oder Kreislaufzusammenbruch leiden, müssen Sie Ihren Arzt oder das medizinische Fachpersonal verständigen. Hierbei handelt es sich um seltene Fälle einer sogenannten Hypophysenapoplexie, die bei ANDEREN ARZNEIMITTELN mit ähnlichem Wirkungsmechanismus wie ELIGARD beobachtet wurden.
- wenn Sie an Diabetes mellitus (einem erhöhten Blutzuckerspiegel) leiden, müssen Sie während der Behandlung regelmäßig überwacht werden.
- Eine Behandlung mit ELIGARD kann das Risiko von Knochenbrüchen infolge von Osteoporose (verminderte Knochendichte) erhöhen.
- Das Auftreten von Depressionen wurde bei Patienten, die mit Eligard behandelt wurden, beobachtet. Wenn Sie mit Eligard behandelt werden und eine depressive Gemütslage entwickeln, informieren Sie Ihren Arzt.
- Bei Patienten, die mit Medikamenten behandelt wurden, die Eligard ähneln, wurden kardiovaskuläre Ereignisse beobachtet. Es ist unklar, ob die kardiovaskulären Ereignisse mit diesen Medikamenten in Zusammenhang stehen. Wenn Sie mit Eligard behandelt werden und kardiovaskuläre Anzeichen oder Symptome entwickeln, informieren Sie Ihren Arzt.
Komplikationen zu Beginn der Behandlung
In der ersten Behandlungswoche kommt es gewöhnlich zu einem kurzfristigen Anstieg des männlichen Geschlechtshormons Testosteron im Blut. Dies kann zu einer vorübergehenden Verschlechterung krankheitsbedingter Symptome und zum Auftreten neuer, bislang nicht bekannter Beschwerden führen. Hierzu zählen insbesondere Knochenschmerzen, erschwertes Wasserlassen, Druck auf das Rückenmark oder Ausscheidung von Blut im Urin. Diese Beschwerden klingen bei Fortsetzung der Behandlung gewöhnlich wieder ab. Andernfalls sollten Sie sich an Ihren Arzt wenden.
Wenn ELIGARD nicht wirkt
Bei manchen Patienten spricht der Tumor auf die Herabsetzung des Testosteronspiegels im Serum nicht an. Sprechen Sie bitte mit Ihrem Arzt, wenn Sie den Eindruck haben, dass ELIGARD nicht stark genug wirkt.
Anwendung von ELIGARD zusammen mit anderen Arzneimitteln
ELIGARD kann die Wirkung anderer Arzneimittel, die zur Behandlung von Herzrhythmusstörungen angewendet werden (z. B. Chinidin, Procainamid, Amiodaron und Sotalol), beeinträchtigen oder bei gleichzeitiger Anwendung mit anderen Arzneimitteln (z. B. Methadon (angewendet zur Schmerzlinderung und als Teil des Entzugs bei Rauschgiftsucht), Moxifloxacin (ein Antibiotikum), Antipsychotika, die bei ernsthaften psychischen Erkrankungen angewendet werden) das Risiko für Herzrhythmusstörungen erhöhen.
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel einnehmen/anwenden bzw. vor kurzem eingenommen/angewendet haben, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Schwangerschaft und Stillzeit
ELIGARD ist nicht für die Behandlung von Frauen bestimmt.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Müdigkeit, Schwindel und Sehstörungen sind mögliche Nebenwirkungen einer Behandlung mit ELIGARD, können aber auch auf Ihre Krankheit zurückzuführen sein. Wenn solche Nebenwirkungen bei Ihnen auftreten, ist im Straßenverkehr und beim Bedienen von Maschinen Vorsicht geboten.
3. WIE IST ELIGARD ANZUWENDEN?
Dosierung
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Falls vom Arzt nicht anders verordnet, wird ELIGARD 45 mg alle 6 Monate einmal verabreicht.
Die Injektionslösung bildet im Körper ein Wirkstoffdepot, aus dem der Wirkstoff Leuprorelinacetat 6 Monate lang kontinuierlich freigesetzt wird.
Zusätzliche Untersuchungen
Die Wirkung der Behandlung mit ELIGARD sollte vom Arzt durch Bestimmung bestimmter klinischer Werte und Messung des Blutspiegels des sogenannten prostataspezifischen Antigens (PSA) geprüft werden.
Art der Anwendung
ELIGARD darf nur vom Arzt oder vom medizinischen Fachpersonal verabreicht werden. Der Arzt oder das medizinische Fachpersonal übernimmt auch die Zubereitung der gebrauchsfertigen Lösung (nach den Anweisungen in Abschnitt 7 ,,Informationen für das medizinische Fachpersonar" am Ende dieser Gebrauchsinformation).
Nach der Herstellung wird die Lösung als subkutane Injektion (Injektion in das Gewebe unter der Haut) verabreicht. Eine intraarterielle Injektion (Injektion in eine Arterie) oder intravenöse Injektion (Injektion in eine Vene) ist unbedingt zu vermeiden. Wie bei anderen subkutan injizierten Wirksubstanzen ist die Injektionsstelle regelmäßig zu wechseln.
Wenn Sie eine größere Menge von ELIGARD angewendet haben, als Sie sollten
Da die Injektion gewöhnlich vom Arzt oder von geschultem Fachpersonal vorgenommen wird, ist nicht mit einer Überdosierung zu rechnen.
Wird dennoch eine größere als die vorgesehene Menge injiziert, werden Sie vom Arzt sorgfältig überwacht und erhalten erforderlichenfalls eine zusätzliche Behandlung.
Wenn Sie die Anwendung von ELIGARD vergessen haben
Wenden Sie sich bitte an Ihren Arzt, wenn Sie glauben, dass Ihre alle 6 Monate vorzunehmende ELIGARD-Injektion vergessen wurde.
Wenn Sie die Anwendung von ELIGARD abbrechen
Da die Therapie von Prostatakrebs in der Regel eine Langzeitbehandlung mit ELIGARD erforderlich macht, sollte die Behandlung auch dann nicht abgebrochen werden, wenn eine Besserung eintritt oder die Beschwerden zum Verschwinden kommen.
Ein vorzeitiger Abbruch der Behandlung mit ELIGARD kann zur Verschlechterung krankheitsbedingter Symptome führen.
Die Behandlung sollte ohne vorherige Rücksprache mit dem Arzt nicht vorzeitig abgebrochen werden.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann ELIGARD Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die während einer Behandlung mit ELIGARD beobachteten Nebenwirkungen sind hauptsächlich auf den spezifischen Effekt des Wirkstoffs Leuprorelinacetat (Erhöhung bzw. Herabsetzung gewisser Hormonkonzentrationen) zurückzuführen. Bei den am häufigsten beschriebenen Nebenwirkungen handelt es sich um Hitzewallungen (ca. 58 % der Patienten), Übelkeit, Unwohlsein und Müdigkeit sowie um eine vorübergehende Reizung an der Injektionsstelle.
Nebenwirkungen zu Beginn der Behandlung
In den ersten Wochen der Behandlung mit ELIGARD kann es zu einer Verschlechterung krankheitsbedingter Beschwerden kommen, weil der Blutspiegel des männlichen Geschlechtshormons Testosteron gewöhnlich zunächst kurze Zeit angehoben wird. Daher kann der Arzt in der Anfangsphase der Therapie ein geeignetes Antiandrogen (den Effekt von Testosteron hemmende Substanz) verabreichen, um eventuelle Nebenwirkungen abzuschwächen (siehe auch Abschnitt 2 „Was müssen Sie vor der Anwendung von ELIGARD beachten? Komplikationen zu Beginn der Behandlung“).
Nebenwirkungen an der Injektionsstelle
Diese nach der Injektion von ELIGARD beschriebenen Nebenwirkungen entsprechen gewöhnlich den bei ähnlichen subkutan (in das Gewebe unter der Haut) injizierten Präparaten häufig beobachteten Begleiteffekten. Sehr häufig kommt es unmittelbar nach der Injektion zu einem leichten Brennen. Stechen und Schmerzen nach der Injektion treten sehr häufig auf, ebenso ein Bluterguss an der Injektionsstelle. Über eine Rötung der Haut an der Injektionsstelle wird häufig berichtet. Gelegentlich kommt es zu einer Verhärtung des Gewebes und zur Ulzeration.
Die Nebenwirkungen an der subkutanen Injektionsstelle sind von geringem Schweregrad und werden als kurzzeitig beschrieben. Sie treten in der Zeit zwischen den einzelnen Injektionen nicht erneut auf.
Sehr häufige Nebenwirkungen (mehr als 1 Behandelter von 10)
• Hitzewallungen
• spontane Haut- oder Schleimhautblutungen, Hautrötung
• Müdigkeit, injektionsbedingte Nebenwirkungen (siehe auch „Nebenwirkungen an der Injektionsstelle“)
Häufige Nebenwirkungen (1 bis 10 Behandelte von 100)
• Nasopharyngitis (Erkältungserscheinungen)
• Übelkeit, Unwohlsein, Durchfall
• Juckreiz, Nachtschweiß
• Gelenkschmerzen
• unregelmäßiges Wasserlassen (auch nachts), Schwierigkeiten beim Beginn des Wasserlassens, Schmerzen beim Wasserlassen, verringertes Harnvolumen
• Druckempfindlichkeit der Brust, Anschwellen der Brust, Rückbildung der Hoden, Hodenschmerzen, Unfruchtbarkeit
• Rigor (Episoden von Schüttelfrost mit hohem Fieber), Schwäche
• verlängerte Blutungszeit, Veränderung der Blutwerte
Gelegentliche Nebenwirkungen (1 bis 10 Behandelte von 1.000)
• Harnwegsinfektion, lokale Infekte der Haut
• Verschlechterung des Diabetes mellitus
• abnorme Träume, Depression, verminderte Libido
• Schwindel, Kopfschmerzen, Veränderung der Hautsensibilität, Schlaflosigkeit, Geschmacks- und Geruchsstörungen
• Hypertonie (erhöhter Blutdruck), Hypotonie (verminderter Blutdruck)
• Kurzatmigkeit
• Verstopfung, Mundtrockenheit, Dyspepsie (Verdauungsstörung mit Beschwerden wie voller Magen, Magenschmerzen, Aufstoßen, Übelkeit, Erbrechen, brennendes Gefühl im Magen), Erbrechen
• feuchtkalte Haut, vermehrtes Schwitzen
• Rückenschmerzen, Muskelkrämpfe
• Hämaturie (Blut im Urin)
• Blasenkrämpfe, ungewöhnlich häufiges Wasserlassen, Unfähigkeit zum Wasserlassen
• Vergrößerung des männlichen Brustgewebes, Impotenz
• Lethargie (Schläfrigkeit), Schmerzen, Fieber
• Gewichtszunahme
Seltene Nebenwirkungen (1 bis 10 Behandelte von 10.000)
• abnorme unwillkürliche Bewegungen
• plötzlicher Bewusstseinsverlust, Ohnmacht
• Flatulenz, Aufstoßen
• Haarausfall, Hautausschlag (Pusteln auf der Haut)
• Brustschmerzen
• Ulzeration an der Injektionsstelle
Sehr seltene Nebenwirkungen (weniger als 1 Behandelter von 10.000)
• Nekrose an der Injektionsstelle
Nicht bekannt (Häufigkeit auf Grund der verfügbaren Daten nicht abschätzbar)
• Veränderungen im EKG (QT-Verlängerung)
Sonstige Nebenwirkungen
Zu den sonstigen Nebenwirkungen, die in der Fachliteratur im Zusammenhang mit einer Behandlung mit Leuprorelin (Wirkstoff von ELIGARD) beschrieben wurden, gehören: Ödeme (Wasseransammlung im Gewebe, tritt als Schwellung an Händen und Füßen in Erscheinung), Lungenembolie (führt zu Symptomen wie Atemlosigkeit, Atemnot und Schmerzen im Brustbereich), Herzklopfen (Wahrnehmung der eigenen Herztätigkeit), Muskelschwäche, Schüttelfrost, Hautausschlag, Gedächtnisstörungen und beeinträchtigtes Sehvermögen. Nach einer Langzeittherapie mit ELIGARD ist mit zunehmenden Anzeichen einer Verminderung des Knochengewebes (Osteoporose) zu rechnen. Durch Osteoporose erhöht sich das Risiko von Knochenbrüchen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST ELIGARD AUFZUBEWAHREN?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen das Arzneimittel nach dem auf dem Umkarton angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Hinweise zur Aufbewahrung
Im Kühlschrank lagern (2 °C - 8 °C).
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
Dieses Produkt muss vor der Injektion auf Raumtemperatur gebracht werden. Ungefähr 30 Minuten vor der Anwendung aus dem Kühlschrank nehmen. Nach erstmaliger Entnahme aus dem Kühlschrank kann dieses Produkt in der Originalverpackung bei Raumtemperatur (unter 25 °C) bis zu vier Wochen gelagert werden.
Nach erstmaligem Öffnen der Schalenverpackung muss die Lösung sofort zubereitet und verwendet werden. Nur zum einmaligen Gebrauch.
Hinweise für die Entsorgung von ELIGARD-Packungen, die nicht aufgebraucht wurden oder deren Verfallzeit abgelaufen ist
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr benötigen. Diese Maßnahme hilft, die Umwelt zu schützen.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN Was ELIGARD enthält
Der Wirkstoff ist Leuprorelinacetat.
Eine vorgefüllte Spritze (Spritze B) enthält 45 mg Leuprorelinacetat.
Die sonstigen Bestandteile sind Poly(glycolsäure-co-milchsäure) (15:85) und N-Methylpyrrolidon (Ph.Eur.) in der vorgefüllten Spritze mit der Injektionslösung (Spritze A).
Wie ELIGARD aussieht und Inhalt der Packung
ELIGARD ist ein Pulver und ein Lösungsmittel zur Herstellung einer Injektionslösung.
ELIGARD 45 mg ist in folgenden Packungen erhältlich:
• Thermoplastisch geformte Schalenverpackung, bestehend aus 2 thermoplastisch geformten Schalen in einem Umkarton. Eine Schale enthält eine vorgefüllte Spritze A, einen großen Kolben für Spritze B und einen Beutel mit einem Trockenmittel. Die andere Schale enthält eine vorgefüllte Spritze B, eine sterile 18G-Nadel und einen Beutel mit einem Trockenmittel.
• Bündelpackung mit 2 x 2 vorgefüllten Spritzen (1 x Spritze A und 1 x Spritze B).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller
Astellas Pharma Europe B.V.
Sylviusweg 62 2333 BE Leiden Niederlande
Mitvertreiber
Astellas Pharma GmbH Postfach 50 01 66 80971 München Tel.: (089) 45 44 01 Fax: (089) 45 44 13 29
Falls weitere Informationen über das Arzneimittel gewünscht werden, setzen Sie sich bitte mit dem Mitvertreiber in Verbindung.
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Belgien
Bulgarien
Dänemark
Deutschland
Estland
Finnland
Frankreich
Irland
Island
Italien
Lettland
Litauen
Luxemburg
Niederlande
Norwegen
Österreich
Polen
Portugal
Rumänien
Schweden
Slowakei
Slowenien
Spanien
Tschechische Republik
Ungarn
Zypern
Depo-Eligard 45 mg
Eligard 45 mg
Eligard
Eligard 45 mg
Eligard
Eligard
Eligard 45 mg
Eligard 45 mg
Eligard
Eligard
Eligard 45 mg
Eligard 45 mg
Depo-Eligard 45 mg
Eligard 45 mg
Eligard
Eligard Depot 45 mg Eligard 45 mg Eligard 45 mg Eligard 45 mg Eligard Eligard 45 mg Eligard 45 mg Eligard mensual 45 mg Eligard 45 mg Eligard 45 mg Eligard
Diese Packungsbeilage wurde zuletzt überarbeitet im 04/2015.
7. INFORMATIONEN FÜR DAS MEDIZINISCHE FACHPERSONAL
Das Produkt auf Raumtemperatur anwärmen lassen indem Sie es ungefähr 30 Minuten vor der Anwendung aus dem Kühlschrank nehmen.
Zuerst ist der Patient für die Injektion vorzubereiten. Danach ist die Injektionslösung wie unten beschrieben herzustellen. Falls bei der Zubereitung des Produktes nicht korrekt vorgegangen wurde, darf es nicht verabreicht werden, da mangelnde klinische Wirksamkeit aufgrund fehlerhafter Rekonstitution des Produktes auftreten kann.
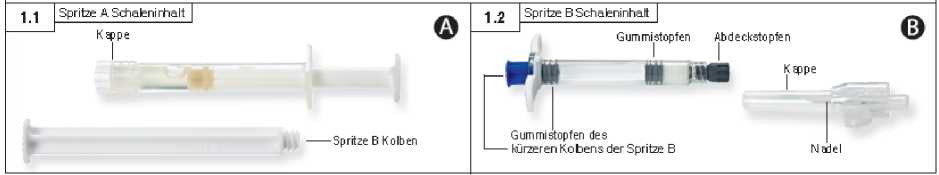
1. Schritt: Beide Schalenverpackungen durch Abreißen der Folie an der durch eine kleine Blase gekennzeichneten Ecke öffnen und den Inhalt (2 Schalen mit Spritze A [Abb. 1.1] bzw. Spritze B [Abb. 1.2]) auf einer sauberen Arbeitsfläche auslegen. Beutel mit dem Trockenmittel entsorgen.
2. Schritt:
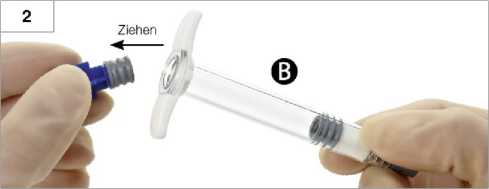
Blau gefärbten, kurzen Kolben zusammen mit angehängtem grauen Stopfen von Spritze B abziehen (nicht abschrauben) und entsorgen (Abb. 2). Das Produkt kann nicht gemischt werden, wenn sich 2 graue Stopfen in Spritze B befinden.
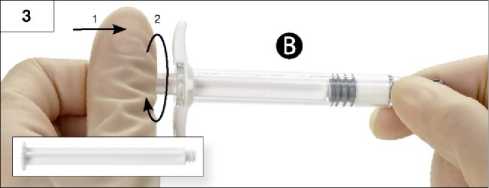
3. Schritt: Weißes Kolbenstück der Spritze B vorsichtig auf den verbliebenen grauen Stopfen in Spritze B schrauben (Abb. 3).
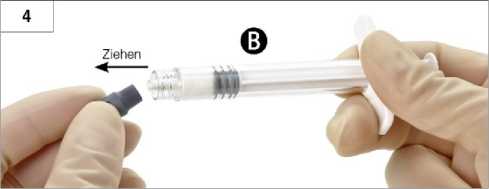
4. Schritt: Graue Gummikappe von Spritze B entfernen und Spritze ablegen (Abb. 4).
5. Schritt: Spritze A senkrecht halten, um ein Auslaufen der Flüssigkeit zu vermeiden, und die helle Verschlusskappe dieser Spritze abschrauben (Abb. 5).

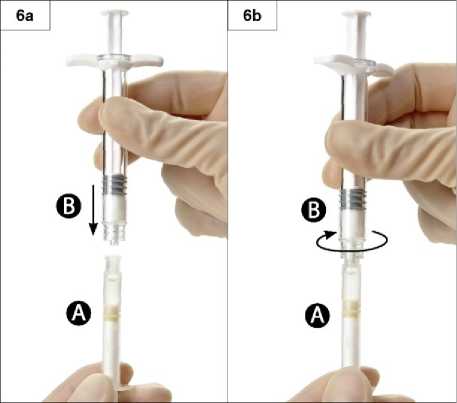
6. Schritt: Die beiden Spritzen ineinanderschieben und Spritze B auf Spritze A bis zum Anschlag aufschrauben (Abb. 6 a und b). Nicht überdrehen.
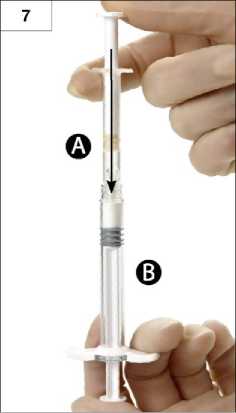
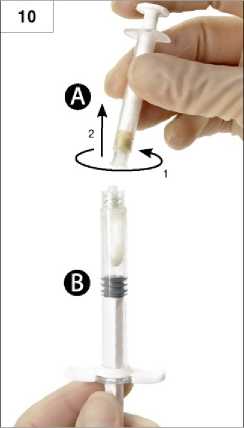
7. Schritt: Die zusammengeschraubte Einheit umdrehen und die Spritzen weiterhin senkrecht halten (Spritze B unten) und die in der Spritze A enthaltene Flüssigkeit in die Spritze B mit dem darin enthaltenen Pulver (Leuprorelinacetat) hineindrücken (Abb. 7).
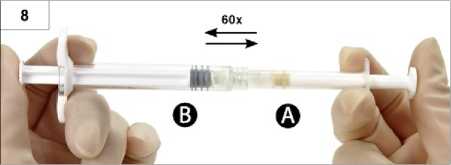
8. Schritt: Mischen Sie das Produkt sorgfältig, indem Sie die Spritzen waagerecht halten und den Spritzeninhalt beider Spritzen sanft zwischen den Spritzen hin- und her-bewegen (insgesamt ca. 60-mal, dauert ungefähr 60 Sekunden). So erhalten Sie eine homogene, viskose Lösung (Abb. 8). Die zusammengeschraubten Spritzen nicht verbiegen, da die Spritzen dadurch eventuell leicht auseinandergeschraubt werden, was zum Auslaufen von Flüssigkeit führen kann.
Nach sorgfältigem Vermischen entsteht eine viskose, farblose bis weiße oder blassgelbe Lösung (weiße bis blassgelbe Farbtöne sind möglich).
Wichtig: Nach Mischen sofort mit nächstem Schritt fortfahren, da die Viskosität der Lösung, wenn sie einmal hergestellt ist, mit der Zeit zunimmt. Hergestelltes Produkt nicht weiter kühlen.
Anmerkung: Das Präparat muss nach diesem Verfahren gemischt werden. Durch Schütteln lässt sich KEINE verwendbare Mischung herstellen.
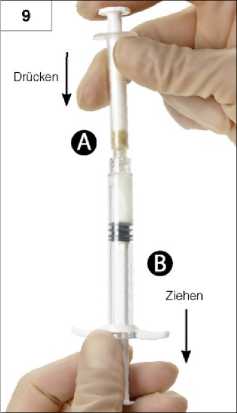
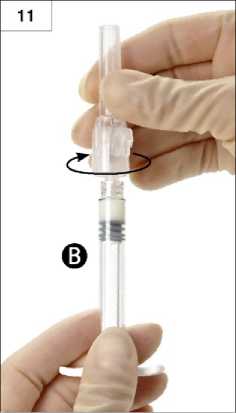
9. Schritt: Spritzen senkrecht halten (Spritze B unten). Die Spritzen müssen fest aneinandergeschraubt sein. Gesamtes Gemisch durch Druck auf den Kolben der Spritze A und leichtes Zurückziehen des Kolbens der Spritze B in die breitere Spritze B drücken (Abb. 9).
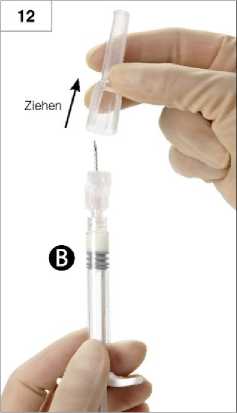
10. Schritt: Spritze A abschrauben, während der Kolben der Spritze A weiterhin nach unten gedrückt wird (Abb. 10). Es darf keine Flüssigkeit auslaufen, weil die Sicherheitsnadel sonst nicht richtig aufgeschraubt werden kann.
Anmerkung: Eine große oder mehrere kleine Luftblasen können im Präparat verbleiben und stellen kein Problem dar.
Bitte in dieser Phase keine Luftblasen aus Spritze B ausdrücken, da es zu einem Produktverlust kommen kann.
11. Schritt: Spritze B senkrecht halten. Öffnen Sie die Verpackung der Sicherheitsnadel durch Aufreißen an der Lasche der Papierfolie und entnehmen Sie die Sicherheitsnadel. Anschließend die Sicherheitsnadel an Spritze B durch Halten der Nadel und Drehen der Spritze im Uhrzeigersinn anbringen, damit die Nadel vollständig an der Spritze sitzt (Abb. 11). Nicht überdrehen.
12. Schritt: Vor Injektion Schutzkappe der Nadel entfernen (Abb. 12).
Wichtig: Vor Injektion sicherstellen, dass die Schutzvorrichtung der Sicherheitsnadel nicht betätigt wird.
13. Schritt: Vor der Anwendung große Luftblasen aus der Spritze B entfernen. Applizieren Sie das Produkt subkutan. Stellen Sie sicher, dass der komplette Inhalt aus Spritze B injiziert wird.
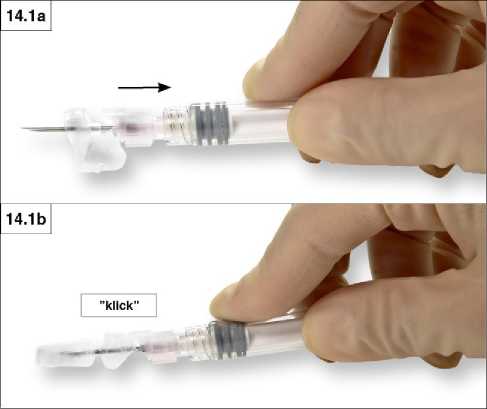
14. Schritt: Schließen Sie die Schutzvorrichtung nach der Applikation auf eine der folgenden Weisen. 1. Verschließen auf flacher Oberfläche
Drücken Sie die Schutzvorrichtung mit dem Hebel nach unten auf eine glatte Oberfläche (Abb. 14.1 a und b), um die Nadel zu bedecken, und schließen Sie die Schutzvorrichtung.
Ein hör- und fühlbares „Klick“ zeigt an, dass die Schutzvorrichtung richtig geschlossen wurde. Eine geschlossene Schutzvorrichtung umschließt die Nadel vollständig (Abb. 14.1 b).
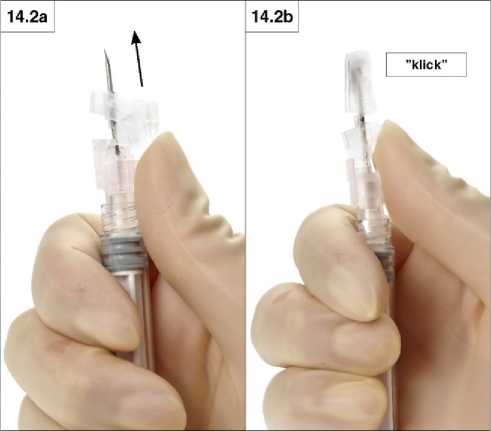
2. Verschließen mit Daumen
Schieben Sie mit dem Daumen die Schutzvorrichtung Richtung Nadelspitze (Abb. 14.2 a und b), um die Nadel zu bedecken, und schließen Sie die Schutzvorrichtung.
Ein hör- und fühlbares „Klick“ zeigt an, dass die Schutzvorrichtung richtig geschlossen wurde. Eine geschlossene Schutzvorrichtung umschließt die Nadel vollständig (Abb. 14.2 b).
15. Schritt: Sobald die Schutzvorrichtung verschlossen ist, sofort Nadel und Spritze in einem passenden Spritzenbehälter entsorgen.