Emerade 500 Mikrogramm Injektionslösung In Einem Fertigpen
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Emerade 150 Mikrogramm Injektionslösung in einem Fertigpen Emerade 300 Mikrogramm Injektionslösung in einem Fertigpen Emerade 500 Mikrogramm Injektionslösung in einem Fertigpen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Der Fertigpen enthält 0.5 ml Epinephrin Lösung 1 mg/ml.
Emerade 150 Mikrogramm gibt eine Einzeldosis von 0.15 ml mit 150 Mikrogramm Epinephrin (als Tartrat) ab.
Emerade 300 Mikrogramm gibt eine Einzeldosis von 0.3 ml mit 300 Mikrogramm Epinephrin (als Tartrat) ab.
Emerade 500 Mikrogramm gibt eine Einzeldosis von 0.5 ml mit 500 Mikrogramm Epinephrin (als Tartrat) ab.
Jede 0.15 ml (150 Mikrogramm) Dosis enthält 0.075 mg Natriummetabisulfit (E 223).
Jede 0.3 ml (300 Mikrogramm) Dosis enthält 0.15 mg Natriummetabisulfit (E 223).
Jede 0.5 ml (500 Mikrogramm) Dosis enthält 0.25 mg Natriummetabisulfit (E 223).
Vollständige Auflistung der sonstigen Bestandteile siehe, Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung in einem Fertigpen (Auto-Injektor). Klare und farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Emerade wird angewendet zur Notfallbehandlung von schweren akuten allergischen Reaktionen (Anaphylaxie), verursacht durch Allergene in Nahrungsmitteln, Arzneimitteln, Insektenstiche oder -bisse und andere Allergene sowie bei anstrengungsbedingter oder idiopathischer Anaphylaxie.
4.2 Dosierung und Art der Anwendung
Dosierung
Die wirksame Dosis liegt normalerweise in einem Bereich von 5 -10 Mikrogramm pro kg Körpergewicht, es können aber in einigen Fällen auch höhere Dosierungen notwendig sein.
Kinder und Jugendliche
Anwendung bei Kindern: Emerade 500 Mikrogramm wird nicht zur Anwendung bei Kindern empfohlen.
Kinder mit einem Körpergewicht unter 15 kg
Bei Kindern, die weniger als 15 kg wiegen, kann eine Dosierung unter 150 Mikrogramm nicht mit ausreichender Genauigkeit gegeben werden. Daher wird die Anwendung nur empfohlen, wenn es sich um eine lebensbedrohliche Situation handelt und die Anwendung unter medizinischer Aufsicht erfolgt.
Kinder mit einem Körpergewicht zwischen 15kg und 30 kg Die übliche Dosierung ist 150 Mikrogramm.
Kinder mit einem Körpergewicht über 30 kg Die übliche Dosierung ist 300 Mikrogramm.
Jugendliche Patienten mit einem Körpergewicht über 30 kg Die Dosisempfehlungen für Erwachsene sind zu befolgen.
Anwendung bei Erwachsenen
Die empfohlene Dosierung für Personen mit weniger als 60 kg Körpergewicht beträgt 300 Mikrogramm. Die empfohlene Dosierung für Personen mit mehr als 60 kg Körpergewicht beträgt 300 bis 500 Mikrogramm und ist abhängig von einer klinischer Beurteilung.
Eine erste Injektion sollte unverzüglich nach dem Auftreten von Symptomen einer Anaphylaxie gegeben werden. Bei einer fehlenden klinischen Verbesserung oder falls eine Verschlechterung eintritt, kann eine zweite Injektion mit einem zusätzlichen Emerade Fertigpen 5 bis 15 Minuten nach der ersten Injektion angewendet werden. Es wird empfohlen, dass den Patienten zwei Emerade Fertigpens verschrieben werden, die sie zu jeder Zeit bei sich tragen sollten.
Art der Anwendung
Nur zur intramuskulären Injektion.
Zum einmaligen Gebrauch.
Emerade wird unverzüglich bei den ersten Anzeichen eines anaphylaktischen Schocks
intramuskulär angewendet. Ein schlechtes Ansprechen einer Anaphylaxie ist mit einer späten
Anwendung von Epinephrin verbunden.
Emerade muss in die Außenseite des Oberschenkels injiziert werden.
Eine Massage um den Bereich der Applikationsstelle verbessert die Aufnahme des Epinephrins.
Es kann durch die Kleidung hindurch injiziert werden.
Der Patient/die Betreuungsperson muss darauf hingewiesen werden, dass nach jeder
Anwendung von Emerade:
- sofort der medizinische Notruf gewählt werden muss und unter Nennung des Begriffes „Anaphylaxie“ um einen Krankenwagen gebeten werden soll, auch wenn die Symptome sich zu bessern scheinen (siehe Abschnitt 4.4).
- Patienten, die bei Bewusstsein sind, sollen sich vorzugsweise flach hinlegen und die Füße hoch lagern. Bei erschwerter Atmung sollen Sie sich jedoch aufrecht hinsetzen.
Bewusstlose Patienten müssen in die stabile Seitenlage gebracht werden.
- Wenn möglich, soll eine weitere Person bei dem Patienten bleiben, bis medizinische Hilfe eintrifft.
Ausführliche Hinweise zur Handhabung siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Es gibt keine absoluten Gegenanzeigen für die Anwendung von Emerade in einem allergiebedingten Notfall.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Ziehen Sie die Schutzkappe der Nadel erst unmittelbar vor dem Gebrauch von Emerade ab. Emerade darf nur in die Außenseite des Oberschenkels verabreicht werden.
Die Injektion wird sofort ausgelöst, wenn der Fertigpen fest gegen die Haut gepresst wird. Patienten sollten darauf hingewiesen werden, Emerade aufgrund des Risikos einer versehentlichen intravenösen Injektion nicht in den großen Gesäßmuskel zu injizieren.
Emerade sollte in Notfallsituationen als lebenserhaltende Behandlung angewendet werden.
Der Patient muss nach der ersten Anwendung von Emerade unverzüglich ärztliche Hilfe aufsuchen um weiterbehandelt zu werden.
Alle Patienten, die einen Emerade verschrieben bekommen, sollten eine detaillierte Anweisung für den Gebrauch erhalten, damit sie die Einsatzmöglichkeiten und die korrekte Anwendung verstehen (siehe Abschnitt 6.6). Es wird auch dringend geraten, den Patienten nahestehende Personen (z.B. Eltern, Pflegepersonal, Lehrer) über den korrekten Gebrauch von Emerade aufzuklären, falls in einer Notfallsituation eine Unterstützung durch diese Personen notwendig wird.
Der Patient/die Betreuungsperson muss über die Möglichkeit einer zweiphasigen Anaphylaxie aufgeklärt werden, die durch eine anfängliche Erleichterung, gefolgt von einem Wiederauftreten der Symptome einige Stunden später, gekennzeichnet ist. Das Risiko einer schweren anaphylaktischen Reaktion kann bei Patienten mit asthmatischer Vorerkrankung erhöht sein.
Bei Patienten mit Herzkrankheiten einschließlich Anginapectoris, Herzrhythmusstörungen, Cor pulmonale, obstruktiver Kadiomyopathie und Artheriosklerose ist Vorsicht geboten. Es besteht ebenfalls ein Risiko von Nebenwirkungen nach einer Epinephrin-Gabe bei Patienten mit Hyperthyreose, Hypertonie, Phäochromozytom, Glaukom, schwerer Nierenfunktionsstörung, Prostataadenom, Hyperkalzämie, Hypokaliämie, Diabetes mellitus, sowie bei älteren Patienten und Schwangeren.
Emerade enthält Natriummetabisulfit, das bei empfindlichen Patienten zu schweren Überempfindlichkeitsreaktionen, einschließlich anaphylaktischen Reaktionen und Bronchospasmus, führen kann, insbesondere bei Patienten mit einer asthmatischen Vorerkrankung. Diese Patienten müssen sorgfältig aufgeklärt werden, in welchen Situationen Emerade angewendet werden muss.
Eine versehentliche Injektion in Hände oder Füße kann zu einer peripheren Ischämie führen, die eine Behandlung erfordert.
Der Patient muss auf verwandte Allergene hingewiesen werden und soweit möglich eingehend untersucht werden, um seine spezifischen Allergene zu bestimmen.
Emerade ist nahezu „natriumfrei“ (enthält weniger als 1 mmol Natrium (23mg) pro Dosis).
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bestimmte Arzneimittel können die Wirkung von Epinephrin verstärken:
Trizyklische Antidepressiva, Monoaminooxidase-Hemmer (MAO-Hemmer) und Catechol-O-Methyltransferase (COMT)-Inhibitoren. Epinephrin muss bei Patienten mit Vorsicht angewendet werden, die halogenierte Kohlenwasserstoffe und verwandte Arzneimittel und Wirkstoffe erhalten, die proarrythmisch wirken wie z.B. Digitalis, Chinidin und halogenierte Anästhetika.
Die Gabe von schnellwirksamen Vasodilatatoren oder Alpha-Rezeptorenblocker können der Wirkung von Adrenalin auf den Blutdruck entgegensteuern. Betablocker können die stimulierende Wirkung von Epinephrin hemmen.
Die hyperglykämische Wirkung von Epinephrin kann dazu führen, dass Diabetiker, die Epinephrin erhalten, ihre Insulindosis oder die Dosis von oralen Antidiabetika erhöhen müssen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es liegen keine hinreichenden oder gut kontrollierten Studien über die Anwendung von Epinephrin bei schwangeren Frauen vor. Epinephrin sollte in der Schwangerschaft nur angewendet werden, wenn der potenzielle Nutzen für die Mutter das potenzielle Risiko für das ungeborene Kind überwiegt.
Aufgrund der schlechten oralen Bioverfügbarkeit und kurzen Halbwertszeit ist es unwahrscheinlich, dass das in der Muttermilch vorhandene Epinephrin Auswirkungen auf den gestillten Säugling hat.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Emerade hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Trotzdem wird den Patienten empfohlen, nach der Anwendung von Epinephrin kein Fahrzeug zu führen und keine Maschine zu bedienen, da sie durch die anaphylaktische Reaktion beeinträchtigt sind.
4.8 Nebenwirkungen
Nebenwirkungen von Epinephrin sind im Allgemeinen durch die Alpha- und BetaRezeptoraktivität von Epinephrin bedingt.
Die nachfolgende Tabelle basiert auf Erfahrungen mit der Anwendung von Epinephrin. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100, <1/10)
Gelegentlich (>1/1.000, <1/100)
Selten (>1/10.000, <1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklassen |
Häufigkeit |
Nebenwirkung |
|
Stoffwechsel- und Ernährungsstörungen |
Nicht bekannt |
Hyperglykämie, Hypokaliämie, metabolische Azidose |
|
Psychiatrische Erkrankungen |
Nicht bekannt |
Angst, Halluzinationen |
|
Erkrankungen des Nervensystems |
Nicht bekannt |
Kopfschmerzen, Schwindel, Tremor, Synkope |
|
Herzerkrankungen |
Nicht bekannt |
Tachykardie, Arrhythmie, Herzklopfen, Angina pectoris, StressKardiomyopathie |
|
Gefäßerkrankungen |
Nicht bekannt |
Hypertonie, Vasokonstriktion, periphere Ischämie |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Nicht bekannt |
Bronchospasmus |
|
Erkrankungen des Gastrointe stinaltrakts |
Nicht bekannt |
Übelkeit, Erbrechen |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Nicht bekannt |
Hyperhidrose, Asthenie |
Emerade enthält Natriummetabisulfit, das in seltenen Fällen zu schweren Überempfindlichkeitsreaktionen führen kann (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine Überdosierung oder versehentliche intravaskuläre Injektion von Epinephrin kann zu einem plötzlichen Blutdruckanstieg führen, der Hirnblutungen verursachen kann. Durch periphere Gefäßverengung bei gleichzeitiger kardialer Stimulation kann es zu einem akuten Lungenödem kommen, das zum Tod führen kann. Ein akutes Lungenödem mit erschwerter Atmung kann durch die Gabe eines schnell wirksamen Alpha-Rezeptorblockers behandelt werden. Lebensbedrohliche Herzrhythmusstörungen können mit einem Betablocker behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kardiostimulanzien exkl. Herzglykoside, adrenerge und dopaminerge Mittel - Epinephrin, ATC-Code: C01CA24
Epinephrin ist ein natürlich vorkommendes Sympathomimetikum aus dem Nebennierenmark. Es stimuliert sowohl Alpha- als auch Betarezeptoren. Es ist das Arzneimittel der Wahl zur Notfallbehandlung schwerer allergischer Reaktionen oder idiopathischer bzw. durch Belastung ausgelöster Anaphylaxien.
Epinephrin hat über die Stimulation der Alpha-Rezeptoren eine stark gefäßverengende Wirkung. Dies wirkt der Vasodilatation und der erhöhten Gefäßpermeabilität, die zu einem Verlust an intravaskulärer Flüssigkeit und anschließender Hypotonie führen kann - den wichtigsten pharmakotoxikologischen Merkmalen eines anaphylaktischen Schocks - entgegen.
Durch seine Stimulation der bronchialen Beta-Rezeptoren übt Epinephrin eine starke bronchodilatatorische Wirkung aus, welche Keuchen und Atembeschwerden lindert. Epinephrin lindert auch Juckreiz, Urtikaria und Angioödem, die in Verbindung mit Anaphylaxie auftreten.
5.2 Pharmakokinetische Eigenschaften
Epinephrin wird in der Leber und anderem Gewebe durch die Enzyme COMT und MAO metabolisiert. Inaktive Metaboliten werden über den Urin ausgeschieden.
Die Plasma-Halbwertszeit von Epinephrin beträgt etwa 2-3 Minuten. Bei subkutaner oder intramuskulärer Injektion kann jedoch die lokale Vasokonstriktion die Resorption verzögern, so dass die Wirkungen länger anhalten können, als nach der Halbwertszeit anzunehmen wäre. Eine Massage um den Bereich der Applikationsstelle wird nach der Injektion empfohlen, um die Absorption des Epinephrins zu verbessern.
5.3 Präklinische Daten zur Sicherheit
Epinephrin wird seit vielen Jahren extensiv bei der Notfall-Behandlung von schweren allergischen Reaktionen eingesetzt. Außer den bereits in dieser Fachinformation aufgeführten Informationen liegen keine weiteren präklinischen Daten vor, die für den Verordner relevant sind.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid Natriummetabisulfit (E223) Natriumedetat
Salzsäure (zur pH-Einstellung) Wasser für Injektionszwecke
Inkompatibilitäten
6.2
Da keine Kompatibilitätsstudien durchgeführt wurden, darf dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
30 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren. Diese ist ein besonders konstruiertes Etui zum Schutz des Fertigpens und des Etiketts.
Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
Emerade besteht aus einer Fertigspritze aus Glas mit einem Polyisopren Gummikolben mit Nadel in einem Auto-Injektor (Fertigpen).
Emerade ist Latex-frei
Freiliegende Nadellänge
Emerade 150 Mikrogramm: 16 mm
Emerade 300 Mikrogramm und Emerade 500 mg: 23 mm
Packungsgröße
Emerade hat ein Behältnis aus Kunststoff, in dem der Auto-Injektor aufbewahrt wird. Packungsgrößen: 1 oder 2 Fertigpens
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Es ist sehr wichtig, dass der Patient genaue Informationen zur Anwendung von Emerade erhält. Nur zur einmaligen Anwendung.
Das Verfalldatum ist auf dem Etikett angegeben. Emerade darf nach Ablauf dieses Datums nicht mehr angewendet werden.
Nach Ablauf des Verfalldatums ist der Auto-Injektor zu entsorgen und zu ersetzen.
Die Lösung kann jederzeit durch das Sichtfenster auf dem Fertigpen geprüft werden, indem das Etikett angehoben wird. Wenn sich die Lösung verfärbt hat oder Partikel enthält, muss Emerade entsorgt und ersetzt werden.
Patienten, bei denen das Risiko einer Anaphylaxie besteht, sollten Emerade immer bei sich tragen.
Emerade wurde für die einfache Anwendung in der Notfallmedizin entwickelt.
Emerade wird ausschließlich in die äußere Oberschenkelmuskulatur injiziert. Die Injektion erfolgt, sobald der Fertigpen leicht in den Oberschenkel gedrückt wird. Dies kann auch durch die Kleidung erfolgen. Emerade besitzt nur eine Öffnung an der Nadelseite und keine auf der gegenüberliegenden.
Art der Anwendung
Die Hinweise zur Handhabung müssen sorgfältig beachtet werden, um ein unbeabsichtigte Injektion zu vermeiden. Es wird auch dringend geraten, den Patienten nahestehende Personen (z.B. Eltern, Pflegepersonal, Lehrer) über den korrekten Gebrauch von Emerade aufzuklären. Emerade sollte nur in den äußeren Oberschenkel injiziert werden.
Eine Injektion wird ausgelöst, wenn Emerade in den Oberschenkel gedrückt wird. Dies kann auch durch die Kleidung erfolgen.
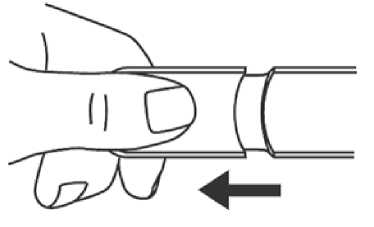
1. Entfernen Sie die Schutzkappe der Nadel
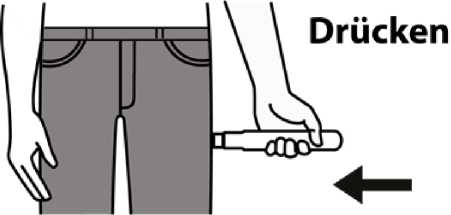
2. Legen Sie Emerade an die
Außenseite des Oberschenkels an und drücken Sie gegen den Oberschenkel.
Sie hören einen Klick, wenn die Injektion in den Muskel erfolgt.
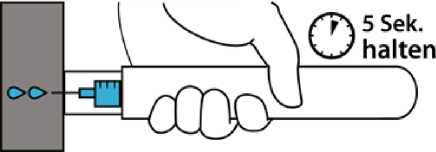
3. Halten Sie Emerade für ca. 5
Sekunden gegen den Oberschenkel. Massieren Sie danach leicht den Bereich der Injektionsstelle
Suchen Sie sofort einen Arzt auf.
Die Nadel in Emerade ist vor, während und nach der Injektion geschützt.
Sobald die Injektion abgeschlossen ist, wird im Sichtfenster durch Anheben des Etiketts der Kolben sichtbar.
Manchmal reicht eine Einzeldosis von Epinephrin (Adrenalin) nicht aus, um die Symptome einer schweren allergischen Reaktion vollständig aufzuheben. Aus diesem Grund wird Ihr Arzt Ihnen wahrscheinlich mehr als einen Emerade verschreiben. Wenn sich Ihre Beschwerden nicht verbessern oder sich innerhalb von 5 bis 15 Minuten nach der ersten Injektion verschlechtert haben, sollten Sie oder Ihre Begleitperson eine zweite Injektion anwenden. Deshalb sollten Sie immer mehr als einen Emerade bei sich tragen.
Emerade wird nur zur Notfallbehandlung eingesetzt. Sie müssen Sich zur weiteren Behandlung immer an Ihren Arzt oder an das nächstgelegene Krankenhaus wenden. Informieren Sie Ihren Arzt darüber, dass Sie diese Injektion mit Epinephrin angewendet haben. Nehmen Sie den gebrauchten Auto-Injektor dazu mit.
Hinweise für den Patienten / die Betreuungsperson zum Verhalten nach der Anwendung von Emerade, siehe Abschnitt 4.2.
Entfernen Sie die Schutzkappe nur wenn eine Injektion erforderlich ist.
Nach der Injektion verbleibt eine Restmenge an Flüssigkeit in dem Fertigpen. Der Fertigpen kann nicht erneut verwendet werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
Anweisungen zu Handhabung werden auf dem Etikett, der Faltschachtel und in der Packungsbeilage beschreiben.
Auto-Injektoren ohne Nadeln stehen für Übungszwecke zur Verfügung.
7. INHABER DER ZULASSUNG
PharmaSwiss Ceska republika s.r.o., Jankovcova 1569/2c 170 00 Prag 7 Tschechische Republik
8. ZULASSUNGSNUMMER(N)
Emerade 150 Mikrogramm: 86870.00.00 Emerade 300 Mikrogramm: 86871.00.00 Emerade 500 Mikrogramm: 86872.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
Datum der Erteilung der Zulassung 24 Juli 2013
10. STAND DER INFORMATION
Juni 2016
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
Im Mitvertrieb:
Dr. Gerhard Mann chem.-pharm. Fabrik GmbH Brunsbütteler Damm 165-173 13581 Berlin Deutschland
10