Enalapril Al 5
Fachinformation Enalapril AL
Fachinformation Enalapril AL
dem Zustand des Patienten (siehe unten).
Enalapril AL wird 1-mal täglich verabreicht.
Bei leichter Hypertonie beträgt die empfohlene Anfangsdosis 5-10 mg Enalaprilmaleat.
Bei Patienten mit stark aktiviertem Renin-Angiotensin-Aldosteron-System (z.B. bei renaler Hypertonie, Salz-und/oder Volumenmangel, Herzdekompensation oder schwerer Hypertonie) kann es zu einem übermäßigen Blutdruckabfall bei Therapiebeginn kommen. Bei diesen Patienten ist die Therapie mit 5 mg Enalaprilmaleat oder einer geringeren Dosis sowie unter engmaschiger ärztlicher Überwachung einzuleiten.
Eine vorausgegangene Therapie mit hoch dosierten Diuretika kann zu Volumenmangel führen, so dass die Gefahr einer Hypotonie bei Therapiebeginn mit Enalapril besteht. Bei diesen Patienten ist die Therapie mit 5 mg Enalaprilmaleat oder einer geringeren Dosis einzuleiten. Wenn möglich, sollten die Diuretika 2-3 Tage lang abgesetzt werden, bevor die Therapie mit Enalapril AL eingeleitet wird. Die Nierenfunktion und Serum-KaliumWerte sollten überwacht werden.
Die übliche Erhaltungsdosis beträgt 20 mg Enalaprilmaleat täglich. Die maximale Erhaltungsdosis beträgt 40 mg Enalaprilmaleat pro Tag.
Herzinsuffizienz/Asymptomatische linksventrikuläre Dysfunktion Enalapril AL wird bei der Behandlung der symptomatischen Herzinsuffizienz üblicherweise zusätzlich zu Diuretika und - wenn angezeigt - Digitalis oder Betablockern angewendet.
Bei Patienten mit symptomatischer Herzinsuffizienz oder asymptomatischer linksventrikulärer Dysfunktion beträgt die Anfangsdosis von Enalaprilmaleat 2,5 mg. Die Therapie ist unter engmaschiger ärztlicher Überwachung einzuleiten, um die anfängliche Wirkung auf den Blutdruck zu ermitteln. Kommt es nach Einleitung einer Therapie mit Enalapril AL bei Herzinsuffizienz nicht zu einer symptomatischen Hypotonie oder ist diese behoben, sollte die Dosis schrittweise auf die übliche Erhaltungsdosis von 20 mg Enalaprilmaleat gesteigert werden. Die Erhaltungsdosis kann als Einzeldosis gegeben oder auf 2 Gaben verteilt werden, je nach Verträglichkeit. Diese Dosistitration sollte über einen Zeitraum von 2-4 Wochen erfolgen. Die Maximaldosis von 40 mg Enalaprilmaleat pro Tag wird auf 2 Gaben verteilt.
Empfohlene Dosistitration von Enalapril AL bei Patienten mit Herzinsuffizienz/ asymptomatischer linksventrikulärer Dysfunktion:
|
Woche |
Enalaprilmaleat-Dosis |
|
Woche 1 |
Tag 1-3: 2,5 mg/Tag* als Einzeldosis Tag 4-7: 5 mg/Tag auf 2 Gaben verteilt |
|
Woche 2 |
10 mg/Tag als Einzeldosis oder auf 2 Gaben verteilt |
|
Wochen 3 und 4 |
20 mg/Tag als Einzeldosis oder auf 2 Gaben verteilt |
1. Bezeichnung der Arzneimittel Enalapril AL 2,5
(Enalaprilmaleat 2,5 mg pro Tablette) Enalapril AL 5
(Enalaprilmaleat 5 mg pro Tablette) Enalapril AL 10
(Enalaprilmaleat 10 mg pro Tablette) Enalapril AL 20
(Enalaprilmaleat 20 mg pro Tablette)
Wirkstoff: Enalaprilmaleat
2. Qualitative und quantitative Zusammensetzung
Enalapril AL 2,5
1 Tablette enthält:
2,5 mg Enalaprilmaleat
Enalapril AL 5
1 Tablette enthält:
5 mg Enalaprilmaleat
Enalapril AL 10
1 Tablette enthält:
10 mg Enalaprilmaleat
Enalapril AL 20
1 Tablette enthält:
20 mg Enalaprilmaleat
Sonstige Bestandteile: u.a. Lactose
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Tabletten
Enalapril AL 2,5
Runde, weiße, bikonvexe Tablette
Enalapril AL 5
Runde, weiße, bikonvexe Tablette mit einseitiger Bruchkerbe (Snap Tab)
Enalapril AL 10
Runde, rotbraune, gesprenkelte, bikonvexe Tablette mit einseitiger Bruchkerbe (Snap Tab)
Enalapril AL 20
Runde, hellorange, gesprenkelte, bikonvexe Tablette mit einseitiger Bruchkerbe (Snap Tab)
4. Klinische Angaben
4.1 Anwendungsgebiete
- Behandlung der Hypertonie.
- Behandlung der symptomatischen Herzinsuffizienz.
- Prävention der symptomatischen
Herzinsuffizienz bei Patienten mit asymptomatischer linksventrikulärer Dysfunktion (linksventrikuläre
Ejektionsfraktion [LVEF] < 35%)
4.2 Dosierung, Art und Dauer der Anwendung
Die Resorption von Enalapril AL wird durch Nahrungsaufnahme nicht beeinflusst.
Die Dosis sollte individuell dem Zustand des Patienten (siehe Abschnitt
4.4) und der Wirkung auf den Blutdruck angepasst werden.
Hypertonie
Die Anfangsdosis beträgt 5 mg bis maximal 20 mg Enalaprilmaleat, je nach Schweregrad der Hypertonie und
* Besondere Vorsichtsmaßnahmen für Patienten mit eingeschränkter Nierenfunktion oder unter DiuretikaTherapie sind zu beachten (siehe Abschnitt 4.4).
Vor und nach Beginn der Therapie mit Enalapril AL sollten Blutdruck und Nierenfunktion engmaschig überwacht werden (siehe Abschnitt 4.4), da über Hypotonie und (seltener)
nachfolgendes Nierenversagen
berichtet wurde. Bei Patienten, die mit Diuretika behandelt werden, sollte -falls möglich - deren Dosis vor Beginn der Behandlung mit Enalapril AL verringert werden. Eine hypotone
Reaktion bei Therapiebeginn mit
Enalapril AL bedeutet nicht, dass auch während der Dauerbehandlung mit Enalapril AL solche Reaktionen
auftreten werden und schließt die Weiterbehandlung mit dem Arzneimittel nicht aus. Serum-Kalium und die Nierenfunktion sollten ebenfalls überwacht werden.
Dosierung bei eingeschränkter Nierenfunktion
Grundsätzlich sollten die Abstände zwischen den Anwendungen von
Enalaprilmaleat verlängert und/oder die Dosis reduziert werden.
|
Kreatinin-Clearance (Kr-Cl) |
Anfangsdosis Enalaprilmaleat |
|
30 <Kr-Cl< 80 ml/min |
5 -10 mg/Tag |
|
10 <Kr-Cl< 30 ml/min |
2,5 mg/Tag |
|
Kr-Cl < 10 ml/min |
2,5 mg/Tag an Dialysetagen* |
* Siehe Abschnitt 4.4: HämodialysePatienten. Enalaprilat ist dialysierbar. An dialysefreien Tagen richtet sich die Dosis nach der Blutdrucksenkung.
Ältere Patienten
Die Dosis sollte sich nach der Nierenfunktion des Patienten richten (siehe Abschnitt 4.4: Nierenfunktionseinschränkung).
Pädiatrische Patienten Die Daten aus klinischen Studien zur Anwendung von Enalapril AL bei pädiatrischen Patienten mit Hypertonie sind begrenzt (siehe Abschnitte 4.4, 5.1 sowie 5.2).
Bei Patienten, die Tabletten schlucken können, sollte die Dosis individuell dem Zustand des Patienten und der Blutdrucksenkung angepasst werden.
Die empfohlene Anfangsdosis beträgt
2,5 mg Enalaprilmaleat für Patienten mit einem Körpergewicht von 20 bis < 50 kg und 5 mg Enalaprilmaleat für Patienten mit einem Körpergewicht a 50 kg.
Enalapril AL wird 1-mal täglich angewendet.
Die Dosierung sollte sich nach den Erfordernissen des Patienten richten, wobei ein Maximum von 20 mg Enalaprilmaleat/Tag für Patienten mit einem Körpergewicht von 20 bis < 50 kg und von 40 mg Enalaprilmaleat/Tag für Patienten 50 kg nicht überschritten werden sollte (siehe Abschnitt 4.4).
Enalapril AL wird nicht für
Neugeborene und pädiatrische Patienten mit einer glomerulären Filtrationsrate < 30 ml/min/1,73 m2 empfohlen, da keine Daten dazu vorliegen.
Hinweis:
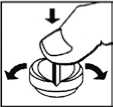
Enalapril AL 5 /-10/-20 Tabletten (Snap Tabs) werden mit der Bruchkerbe nach oben auf eine harte Unterlage gelegt. Durch leichten Daumendruck von oben werden die Tabletten (Snap Tabs) in zwei gleich große Teile geteilt.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen Enalapril, einen der sonstigen Bestandteile dieser Arzneimittel oder gegen einen anderen ACE-Hemmer.
- Anamnestisch bekanntes, durch
vorhergehende Therapie mit einem ACE-Hemmer ausgelöstes
angioneurotisches Ödem.
- Hereditäres oder idiopathisches Angioödem.
- 2. und 3. Trimenon der Schwangerschaft (siehe Abschnitte
4.4 und 4.6).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Symptomatische Hypotonie Bei komplikationsloser Hypertonie werden selten symptomatische Hypotonien beobachtet.
Bei hypertonen Patienten kommt es unter Therapie mit Enalapril eher zu einer symptomatischen Hypotonie, wenn ein Volumenmangel vorliegt, z.B. aufgrund einer Diuretika-Therapie, salzarmer Diät, Dialyse, Durchfall oder Erbrechen (siehe Abschnitte 4.5 und 4.8). Bei Patienten mit Herzinsuffizienz
- mit oder ohne einhergehender Niereninsuffizienz - wurden symptomatische Hypotonien beobachtet. Insbesondere Patienten mit schweren Graden der Herzinsuffizienz, die als Ausdruck des Schweregrades ihrer Erkrankung eine Therapie mit hoch dosierten Schleifendiuretika, Hyponatriämie oder Nierenfunktionseinschränkungen aufweisen, können davon betroffen sein. Bei diesen Patienten ist die Behandlung unter ärztlicher Überwachung einzuleiten und im weiteren Verlauf immer dann engmaschig zu überwachen, wenn die Dosis von Enalapril AL und/oder des Diuretikums neu eingestellt wird. Ähnlich ist auch bei Patienten mit ischämischer Herzerkrankung oder zerebrovaskulären Erkrankungen vorzugehen, bei denen
ein übermäßiger Blutdruckabfall zu einem Myokardinfarkt oder einem zerebralen Insult führen könnte.
Falls es zu einer Hypotonie kommt, sollte der Patient in eine liegende Position gebracht werden und - falls erforderlich - eine intravenöse Kochsalzinfusion erhalten. Eine vorübergehende hypotone Reaktion ist keine Kontraindikation für die weitere Behandlung, die normalerweise problemlos durchgeführt werden kann, sobald sich der Blutdruck nach einer Volumensubstitution normalisiert hat.
Bei manchen HerzinsuffizienzPatienten mit normalem oder niedrigem Blutdruck kann der systemische Blutdruck durch die Anwendung von Enalapril AL noch weiter absinken. Diese nicht unerwartete Wirkung ist normalerweise kein Grund, das Arzneimittel abzusetzen. Wird der Blutdruckabfall symptomatisch, kann es notwendig werden, die Dosis von Enalapril AL zu reduzieren und/oder das Diuretikum und/oder Enalapril AL abzusetzen.
Aorten- oder Mitralklappenstenose/hyper-trophe Kardiomyopathie ACE-Hemmer sollten - wie alle Vasodilatatoren - bei Patienten mit einer linksventrikulären Klappenobstruktion und Ausflussbehinderung mit besonderer Vorsicht angewendet werden. Bei Kreislaufschock und hämodynamisch deutlicher Ausflussbehinderung sollte ihre Anwendung vermieden werden.
Nierenfunktionsstörungen Bei Patienten mit eingeschränkter Nierenfunktion (Kreatinin-Clearance < 80 ml/min) sollte die Initialdosis von Enalapril der Kreatinin-Clearance des Patienten angepasst werden (siehe Abschnitt 4.2). Die Wahl der Erhaltungsdosis richtet sich nach dem Ansprechen des Patienten auf die Behandlung. Eine routinemäßige Kontrolle von Serum-Kalium und Serum-Kreatinin erfolgt im Rahmen der üblichen medizinischen Betreuung dieser Patienten.
Insbesondere bei Patienten mit schwerer Herzinsuffizienz oder zugrunde liegenden
Nierenerkrankungen, einschließlich Nierenarterienstenose, wurde über Nierenversagen im Zusammenhang mit der Anwendung von Enalapril berichtet. Bei rechtzeitiger Diagnose und entsprechender Therapie ist ein
Nierenversagen unter Enalapril
Therapie normalerweise reversibel.
Bei manchen Hypertonikern ohne vorbestehende Nierenerkrankung kann es unter der Kombination von Enalapril mit einem Diuretikum zum Anstieg von Serum-Harnstoff und -Kreatinin
kommen. Eine Dosisreduktion von Enalapril und/oder ein Absetzen des Diuretikums können erforderlich sein. In diesen Fällen ist an eine möglicherweise zugrunde liegende
Nierenarterienstenose zu denken (siehe Abschnitt 4.4: Renale Hypertonie).
Renovaskuläre Hypertonie Patienten mit beidseitiger
Nierenarterienstenose oder
Arterienstenose bei nur einer
funktionsfähigen Niere sind unter ACE-Hemmer-Therapie besonders
gefährdet, einen Blutdruckabfall oder eine Niereninsuffizienz zu entwickeln. Es kann zum Verlust der Nierenfunktion kommen, wobei oft nur leichte
Veränderungen des Serum-Kreatinins bestehen. Bei diesen Patienten ist die Therapie unter engmaschiger ärztlicher Überwachung mit niedrigen Dosen, vorsichtiger Titration und unter
Kontrolle der Nierenfunktion einzuleiten.
Nierentransplantation Hinsichtlich der Behandlung mit Enalapril von Patienten mit frischer Nierentransplantation bestehen keine Erfahrungen. Daher wird die Behandlung mit Enalapril AL für diese Patienten nicht empfohlen.
Leberversagen
Selten wurde unter ACE-Hemmer-Behandlung ein Syndrom beobachtet, das mit cholestatischem Ikterus oder Hepatitis beginnt und bis zur fulminanten hepatischen Nekrose (manchmal mit letalem Ausgang) fortschreitet. Der Pathomechanismus dieses Syndroms ist unklar. Patienten, die unter ACE-Hemmern einen Ikterus oder einen deutlichen Anstieg der Leberenzyme entwickeln, müssen den ACE-Hemmer absetzen und entsprechend behandelt werden.
Neutropenie/Agranulozytose Unter ACE-Hemmer-Therapie wurden Neutropenie/Agranulozytose, Thrombozytopenie und Anämie berichtet. Bei Patienten mit normaler Nierenfunktion und ohne besondere Risikofaktoren tritt selten eine Neutropenie auf. Enalapril soll bei Patienten mit Kollagenosen mit Gefäßbeteiligung, unter Therapie mit Immunsuppressiva, Allopurinol,
Procainamid oder bei Vorliegen mehrerer dieser Risikofaktoren mit äußerster Vorsicht angewendet werden, insbesondere bei vorbestehender Einschränkung der Nierenfunktion. Bei manchen dieser Patienten traten schwere Infektionen auf, die in einigen Fällen auch nicht auf intensive Antibiotika-Therapie ansprachen. Wenn Enalapril bei solchen Patienten angewendet wird, ist eine regelmäßige Kontrolle der Leukozytenzahl angeraten und die Patienten sollten angewiesen werden, ihrem Arzt alle Anzeichen einer Infektion zu berichten.
Überempfindlichkeit/angioneurotisches
Ödem
Angioneurotische Ödeme mit Beteiligung von Gesicht, Extremitäten, Lippen, Zunge, Glottis und/oder Kehlkopf wurden unter ACE-Hemmern einschließlich Enalapril berichtet. Sie können zu jedem Zeitpunkt während der Therapie auftreten. In solchen Fällen ist Enalapril AL sofort abzusetzen. Der Patient ist sorgfältig zu überwachen, um eine vollständige Rückbildung der Symptome vor der Entlassung aus der Klinik sicherzustellen. Auch in jenen Fällen, in denen die Schwellung auf die Zunge begrenzt ist, ohne Atembeschwerden zu verursachen, sollten die Patienten gegebenenfalls länger beobachtet werden, da eine Behandlung mit
Diabetes mellitus,
Ereignisse -Dehydratation, Herzdekompensation, Azidose und eine Therapie mit
Diuretika (z.B
interkurrente insbesondere akute metabolische gleichzeitige kaliumsparenden Spironolacton,
Antihistaminika und Kortikosteroiden unzureichend sein kann.
Sehr selten verliefen angioneurotische Ödeme mit Beteiligung des Kehlkopfes oder der Zunge letal. Bei Patienten, bei denen Zunge, Glottis oder Kehlkopf betroffen sind, besteht das Risiko einer Atemwegsobstruktion, insbesondere bei jenen Patienten mit einem operativen Eingriff an den Atemwegen in der Krankengeschichte. Sobald Zunge, Glottis oder Kehlkopf betroffen sind, so dass eine
Atemwegsobstruktion droht, ist unverzüglich eine geeignete Therapie einzuleiten (z.B. subkutane Gabe von 0,3 ml-0,5 ml Adrenalin
[1:1.000 verdünnt]) und/oder sind Maßnahmen zur Sicherung der Durchgängigkeit der Atemwege zu treffen.
Im Vergleich mit Patienten nicht schwarzer Hautfarbe wurde bei Patienten schwarzer Hautfarbe eine höhere Inzidenz von Angioödemen unter ACE-Hemmern berichtet.
Patienten mit anamnestisch bekanntem, nicht durch einen ACE-Hemmer ausgelösten Angioödem können besonders gefährdet sein, ein Angioödem zu entwickeln, wenn sie einen ACE-Hemmer erhalten (siehe auch Abschnitt 4.3).
Anaphylaktoide Reaktionen während einer Desensibilisierungstherapie gegen Insektengifte
Selten kam es während einer Desensibilisierungstherapie gegen Insektengifte und gleichzeitiger Anwendung eines ACE-Hemmers zu lebensbedrohlichen anaphylaktoiden Reaktionen. Diese Reaktionen können vermieden werden, indem man die ACE-Hemmer-Therapie vor jeder Desensibilisierung zeitweise
unterbricht.
Anaphylaktoide Reaktionen während einer LDL-Apherese Selten kam es während einer Low-Density-Lipoprotein (LDL)-Apherese mit Dextransulfat und gleichzeitiger Anwendung eines ACE-Hemmers zu lebensbedrohlichen anaphylaktoiden Reaktionen. Diese Reaktionen können vermieden werden, indem man die ACE-Hemmer-Therapie vor jeder Apherese zeitweise unterbricht.
Hämodialyse-Patienten Bei Anwendung von High-Flux-Membranen (z.B. “AN 69”) im Rahmen einer Dialyse und gleichzeitiger Behandlung mit einem ACE-Hemmer wurde über anaphylaktoide Reaktionen berichtet. Bei diesen Patienten ist daher entweder eine andere Dialysemembran oder ein Antihypertensivum einer anderen Substanzklasse zu verwenden.
Hypoglykämie
Diabetische Patienten, die mit oralen Antidiabetika oder Insulin behandelt werden, sollten bei Beginn einer ACE-Hemmer-Therapie angewiesen werden, auf Hypoglykämien zu achten, insbesondere im ersten Monat der kombinierten Therapie (siehe Abschnitt
4.5).
Husten
Im Zusammenhang mit der Anwendung von ACE-Hemmern wurde über Husten berichtet. Typischerweise besteht kein Auswurf, der Husten ist hartnäckig und klingt nach Absetzen der Therapie ab. Ein durch ACE-Hemmer induzierter Husten sollte auch bei der Differentialdiagnose des Hustens in Betracht gezogen werden.
Operation/Anästhesie Bei Patienten, die einer größeren Operation unterzogen werden oder eine Anästhesie mit Substanzen, die den Blutdruck senken, erhalten, hemmt Enalapril als Reaktion auf die kompensatorische Reninsekretion die Bildung von Angiotensin II. Sollte es aufgrund dieses Mechanismus zu einer Hypotonie kommen, kann sie durch Volumensubstitution korrigiert werden.
Hyperkaliämie
Ein Anstieg der Serum-KaliumKonzentration wurde bei manchen Patienten unter ACE-Hemmer-Therapie einschließlich Enalapri beobachtet. Risikofaktoren für die Entwicklung einer Hyperkaliämie schließen ein: Niereninsuffizienz, Verschlechterung der Nierenfunktion, Alter (> 70 Jahre),
Eplerenon, Triamteren oder Amilorid), Kaliumpräparaten oder kaliumhaltiger Salzsubstitution sowie eine
gleichzeitige Therapie mit anderen Arzneimitteln, die zu einem Anstieg der Serum-Kalium-Werte führen können (z.B. Heparin), ein. Die Anwendung von Kaliumpräparaten, kaliumsparenden Diuretika oder kaliumhaltiger Salzsubstitution kann insbesondere bei Patienten mit eingeschränkter Nierenfunktion zu einem signifikanten Kaliumanstieg führen. Eine
Hyperkaliämie kann schwerwiegende, manchmal auch letale Arrhythmien verursachen. Ist die gleichzeitige Anwendung von Enalapril mit einer der o.g. Substanzen angezeigt, sollte diese mit Vorsicht und unter regelmäßiger Überwachung der Serum-Kalium-Werte erfolgen (siehe Abschnitt 4.5).
Lithium
Die Kombination von Lithium und Enalapril wird im Allgemeinen nicht empfohlen (siehe Abschnitt 4.5).
Anwendung bei pädiatrischen Patienten Zur Anwendung von Enalapril bei Kindern über 6 Jahren mit Hypertonie liegen begrenzte Daten zur
Wirksamkeit und Verträglichkeit vor. Zu den anderen Indikationen gibt es keine Daten. Begrenzte Daten zur
Pharmakokinetik liegen für Kinder ab 2 Monaten vor (siehe auch Abschnitte 4.2, 5.1 und 5.2). Enalapril AL wird für Kinder ausschließlich für die Indikation Hypertonie empfohlen.
Enalapril AL wird nicht für Neugeborene und für pädiatrische Patienten mit einer glomerulären Filtrationsrate < 30 ml/min/1,73 m2 empfohlen, da keine Daten dazu vorliegen (siehe Abschnitt 4.2).
Schwangerschaft und Stillzeit Eine Behandlung mit ACE-Hemmern sollte nicht während der Schwangerschaft begonnen werden. Bei Patientinnen mit
Schwangerschaftswunsch sollte eine Umstellung auf eine alternative blutdrucksenkende Behandlung mit geeignetem Sicherheitsprofil für Schwangere erfolgen, es sei denn, eine Fortführung der Behandlung mit ACE-Hemmern ist zwingend erforderlich. Wird eine Schwangerschaft festgestellt, ist die Behandlung mit ACE-Hemmern unverzüglich zu beenden und, wenn erforderlich, eine alternative Therapie zu beginnen (siehe Abschnitte 4.3 und
4.6).
Während der Stillzeit wird die Anwendung von Enalapril nicht empfohlen (siehe Abschnitte 4.6 und 5.2).
Ethnische Unterschiede Wie andere ACE-Hemmer senkt Enalapril offenbar bei Patienten schwarzer Hautfarbe den Blutdruck weniger stark als bei Patienten nicht schwarzer Hautfarbe, vermutlich weil bei der schwarzen Bevölkerung mit Hypertonie häufig ein niedriger Plasma-Renin-Spiegel vorliegt.
Lactose:
Diese Arzneimittel enthalten Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Enalapril AL nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Kaliumsparende Diuretika oder Kaliumpräparate
ACE-Hemmer mildern den
Kaliumverlust durch Diuretika. Kaliumsparende Diuretika (z.B.
Spironolacton, Eplerenon, Triamteren oder Amilorid), Kaliumpräparate oder kaliumhaltige Salzersatzmittel können zu einem signifikanten Anstieg des Serum-Kaliums führen. Wenn die gleichzeitige Anwendung aufgrund einer nachgewiesenen Hypokaliämie angezeigt ist, sollte sie mit Vorsicht und unter häufiger Überprüfung des SerumKaliums erfolgen (siehe Abschnitt 4.4).
Diuretika (Thiazide oder Schleifendiuretika)
Eine vorangegangene hoch dosierte Diuretika-Therapie kann zu Volumenmangel und damit zum Risiko einer Hypotonie bei Therapiebeginn mit Enalapril führen (siehe Abschnitt 4.4). Die hypotensive Wirkung kann durch Absetzen des Diuretikums, einem Ausgleich des Volumenmangels bzw. Gabe von Salz oder durch die Einleitung der Therapie mit Enalapril in niedriger Dosierung vermindert werden.
Andere Antihypertensiva Die gleichzeitige Anwendung mit anderen Antihypertensiva kann die blutdrucksenkende Wirkung von Enalapril verstärken. Auch die gleichzeitige Anwendung von Nitroglyzerin und anderen Nitraten oder anderen Vasodilatatoren kann den Blutdruck weiter senken.
Lithium
Unter der gleichzeitigen Anwendung von ACE-Hemmern und Lithium wurden reversible Anstiege der SerumLithium-Konzentrationen und toxische Effekte berichtet. Eine gleichzeitige Therapie mit Thiaziddiuretika kann die Serum-Lithium-Konzentrationen und damit das Risiko einer Lithium-Toxizität unter einer ACE-Hemmer-Therapie erhöhen. Die Anwendung von Enalapril mit Lithium wird deshalb nicht empfohlen; sollte diese Kombination aber erforderlich sein, sind die SerumLithium-Konzentrationen sorgfältig zu überwachen (siehe Abschnitt 4.4).
Trizyklische Antidepressiva/Neurolep-tika/Anästhetika/Narkotika Die gleichzeitige Anwendung bestimmter Narkosemittel, trizyklischer Antidepressiva und Neuroleptika mit ACE-Hemmern kann zu einer verstärkten Blutdrucksenkung führen (siehe Abschnitt 4.4).
Nichtsteroidale Antiphlogistika (NSAIDs) Die Dauertherapie mit NSAIDs kann die antihypertensive Wirkung eines ACE-Hemmers abschwächen.
NSAIDs (einschließlich COX-2-Hemmern) und ACE-Hemmer wirken bezüglich des Anstiegs von SerumKalium additiv und können so zu einer Verschlechterung der Nierenfunktion führen. Diese ist gewöhnlich reversibel. Selten kann es auch zu akutem Nierenversagen kommen,
insbesondere bei Patienten mit eingeschränkter Nierenfunktion (z. B. bei älteren oder Patienten mit Volumenmangel, einschließlich der Patienten unter Diuretikatherapie). Der Flüssigkeitsmangel bei Patienten sollte ausgeglichen und die Nierenfunktion sollte während und regelmäßig nach der gleichzeitigen Therapie überwacht werden.
Gold
Nitritoide Reaktionen (mit Symptomen wie Flush, Übelkeit, Erbrechen und Hypotonie) wurden selten bei Patienten berichtet, die unter einer Therapie mit Goldinjektionslösungen (Natriumauro-thiomalat) gleichzeitig ACE-Hemmer einschließlich Enalapril erhielten.
Sympathomimetika
Sympathomimetika können die blutdrucksenkende Wirkung von ACE-Hemmern abschwächen.
Antidiabetika
Epidemiologische Studien weisen auf eine mögliche Verstärkung der blutzuckersenkenden Wirkung bei gleichzeitiger Anwendung von ACE-Hemmern und Antidiabetika (Insulin, orale Antidiabetika) hin, so dass das Risiko einer Hypoglykämie besteht. Diese Fälle treten offenbar insbesondere in den ersten Wochen
der kombinierten Behandlung sowie bei Patienten mit eingeschränkter Nierenfunktion auf.
Alkohol
Alkohol verstärkt die blutdrucksenkende Wirkung von ACE-Hemmern.
Acetylsalicylsäure, Thrombolytika und Betablocker
Enalapril kann problemlos gleichzeitig mit Acetylsalicylsäure (in zur kardiovaskulären Prophylaxe
geeigneten Dosierungen),
Thrombolytika und Betablockern angewendet werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die Anwendung von ACE-Hemmern wird im 1. Schwangerschaftstrimester nicht empfohlen (siehe Abschnitt 4.4). Die Anwendung von ACE-Hemmern im 2. und 3. Schwangerschaftstrimester ist kontraindiziert (siehe Abschnitte 4.3 und 4.4).
Es liegen keine endgültigen epidemiologischen Daten hinsichtlich eines teratogenen Risikos nach Anwendung von ACE-Hemmern während des 1.
Schwangerschaftstrimesters vor; ein geringfügig erhöhtes Risiko kann jedoch nicht ausgeschlossen werden. Sofern ein Fortsetzen der ACE-Hemmer-Therapie nicht als notwendig erachtet wird, sollten Patientinnen, die planen, schwanger zu werden, auf eine alternative antihypertensive Therapie mit geeignetem Sicherheitsprofil für Schwangere umgestellt werden. Wird eine Schwangerschaft festgestellt, ist eine Behandlung mit ACE-Hemmern unverzüglich zu beenden und, wenn erforderlich, eine alternative Therapie zu beginnen.
Es ist bekannt, dass eine Therapie mit ACE-Hemmern während des 2. und 3. Schwangerschaftstrimesters fetotoxische Effekte (verminderte Nierenfunktion, Oligohydramnion, verzögerte Schädelossifikation) und neonatal-toxische Effekte
(Nierenversagen, Hypotonie,
Hyperkaliämie) hat (siehe auch Abschnitt 5.3). Im Falle einer Exposition mit ACE-Hemmern ab dem 2. Schwangerschaftstrimester werden Ultraschalluntersuchungen der
Nierenfunktion und des Schädels empfohlen.
Säuglinge, deren Mütter ACE-Hemmer eingenommen haben, sollten häufig wiederholt auf Hypotonie untersucht werden (siehe auch Abschnitte 4.3 und 4.4).
Stillzeit
Einige wenige pharmakokinetische Daten zeigen, dass sehr geringe Konzentrationen in der Muttermilch erreicht werden (siehe Abschnitt 5.2). Auch wenn diese Konzentrationen als klinisch nicht relevant erscheinen, wird die Anwendung von Enalapril AL während des Stillens von Frühgeborenen sowie in den ersten Wochen nach der Entbindung nicht empfohlen, da ein mögliches Risiko von kardiovaskulären und renalen Effekten beim Säugling besteht und für eine Anwendung in der Stillzeit keine ausreichende klinische Erfahrung vorliegt.
Wenn die Säuglinge älter sind, kann die Anwendung von Enalapril AL bei stillenden Müttern erwogen werden, wenn die Behandlung für die Mutter als notwendig erachtet wird und der Säugling sorgfältig überwacht wird.
Fertilität
In tierexperimentellen Studien ergaben sich keine Hinweise auf eine Auswirkung von Enalapril auf die Fertilität (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bei der aktiven Teilnahme am Straßenverkehr oder beim Bedienen von Maschinen ist zu beachten, dass gelegentlich Schwindel oder Schwächegefühl auftreten können.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1000 bis < 1/100) Selten (> 1/10 000 bis < 1/1000)
Sehr selten (< 1/10 000), einschließlich Einzelfälle
Häufigkeit nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Untersuchungen
Häufig. Hyperkaliämie, Anstieg von Serum-Kreatinin.
Gelegentlich. Anstieg von SerumHarnstoff, Hyponatriämie.
Selten. Anstieg der Leberenzyme, Anstieg von Serum-Bilirubin.
Herz-/Kreislauferkrankungen Sehr häufig. Schwindel.
Häufig. Hypotonie (einschließlich orthostatische Hypotonie), Synkope, Schmerzen im Brustkorb,
Herzrhythmusstörungen, Angina
pectoris, Tachykardie.
Gelegentlich. Palpitationen,
Myokardinfarkt oder zerebraler Insult*, vermutlich infolge übermäßigen Blutdruckabfalls bei
Hochrisikopatienten (siehe Abschnitt 4.4),.
Selten. Raynaud-Phänomen.
Erkrankungen des Blutes und des Lymphsystems
Gelegentlich. Anämie (einschließlich aplastische und hämolytische Anämie).
Selten. Neutropenie, Abnahme von Hämoglobin und Hämatokrit, Thrombozytopenie, Agranulozytose, Knochenmarksdepression, Panzyto-penie, Lymphknotenschwellung,
Autoimmunkrankheiten.
Erkrankungen des Nervensystems Häufig: Kopfschmerzen, Depressionen.
Gelegentlich'. Verwirrtheitszustände,
Schläfrigkeit, Schlaflosigkeit,
Nervosität, Parästhesien, Vertigo.
Selten: Verändertes Träumen,
Schlafstörungen.
Augenerkrankungen
Sehr häufig. Verschwommensehen.
Erkrankungen der Atemwege, des Brustraums und Mediastinums Sehr häufig. Husten.
Häufig. Dyspnoe.
Gelegentlich: Rhinorrhö,
Halsschmerzen und Heiserkeit, Bronchospasmus/Asthma.
Selten: Pulmonale Infiltrate, Rhinitis, allergische Alveolitis/eosinophile
Pneumonie.
Erkrankungen_des
Gastrointestinaltrakts Sehr häufig Übelkeit.
Häufig. Diarrhö, Bauchschmerzen, Geschmacksveränderungen.
Gelegentlich: Ileus, Pankreatitis,
Erbrechen, Dyspepsie, Obstipation, Appetitlosigkeit, Magenreizung,
Mundtrockenheit, peptisches Ulkus.
Selten: Stomatitis/aphthöse Ulzera-tionen, Glossitis.
Sehr selten: Intestinales angio-
neurotisches Ödem.
Erkrankungen der Nieren und Harnwege
Gelegentlich: Nierenfunktionsstörungen, Nierenversagen, Proteinurie.
Selten: Oligurie.
Erkrankungen der Haut und des Unterhautzellgewebes Häufig. Ausschlag,
Überempfindlichkeit/angioneurotisches Ödem: angioneurotische Ödeme mit Beteiligung von Gesicht, Extremitäten, Lippen, Zunge, Glottis und/oder Kehlkopf wurden berichtet (siehe Abschnitt 4.4).
Gelegentlich: Diaphorese, Pruritus, Urtikaria, Alopezie.
Selten: Erythema multiforme, StevensJohnson-Syndrom, exfoliative
Dermatitis, toxische epidermale Nekrolyse, Pemphigus, Erythroderma.
Ein Symptomenkomplex wurde berichtet, der mit einigen oder allen der folgenden Nebenwirkungen
einhergehen kann: Fieber, Serositis, Vaskulitis, Myalgien/Myositis,
Arthralgien/Arthritis, positive ANA-Titer, erhöhte BSG, Eosinophilie und Leukozytose. Hautausschlag,
Photosensibilität oder andere dermatologische Manifestationen können auftreten.
Endokrine Erkrankungen
Häufigkeit nicht bekannt: Syndrom der
inadäquaten ADH-Sekretion (SIADH).
Stoffwechsel- und Ernährungsstörungen
Gelegentlich: Hypoglykämie (siehe
Abschnitt 4.4).
Allgemeine Erkrankungen und
Beschwerden_am
Verabreichungsort Sehr häufig Asthenie.
Häufig. Müdigkeit.
Gelegentlich: Muskelkrämpfe, Flush, Tinnitus, Unwohlsein, Fieber.
Leber- und Gallenerkrankungen Selten: Leberversagen, Hepatitis -hepatozellulär oder cholestatisch, einschließlich hepatischer Nekrose, Cholestase (einschließlich Ikterus).
Erkrankungen_der
Geschlechtsorgane und der Brustdrüse
Gelegentlich: Impotenz.
Selten: Gynäkomastie.
* Die Inzidenzen entsprachen in klinischen Studien denen der Kontrollgruppen unter Plazebo oder einer aktiven Vergleichssubstanz.
4.9 Überdosierung
Es liegen nur begrenzte Daten zu Überdosierungen beim Menschen vor. Als auffälligste Merkmale einer Überdosierung wurden bisher schwere Hypotonie (Eintritt etwa 6 Stunden nach Tabletteneinnahme) mit gleichzeitiger Blockade des Renin-Angiotensin-Systems und Stupor berichtet. Als weitere Symptome im Zusammenhang mit einer Überdosierung von ACE-Hemmern können Kreislaufversagen, Elektrolytverluste, Nierenversagen, Hyperventilation, Tachykardie,
Palpitationen, Bradykardie, Schwindel, Angstgefühl und Husten auftreten.
Nach Einnahme von 300 mg bzw. 440 mg Enalapril wurden 100- bzw. 200fach höhere Serumkonzentrationen von Enalaprilat als unter therapeutischen Dosen festgestellt.
Zur Behandlung einer Überdosierung wird die intravenöse Infusion von Kochsalzlösung empfohlen. Im Falle eines Blutdruckabfalls soll der Patient in Schocklagerung gebracht werden. Falls verfügbar, kann auch eine Therapie mit einer Angiotensin-II-Infusion und/oder einer intravenösen Katecholamininfusion in Erwägung gezogen werden. Wurden die Tabletten erst kurz zuvor eingenommen, sollten Maßnahmen zur Elimination von Enalaprilmaleat getroffen werden (z. B. Erbrechen, Magenspülung, Anwendung von Adsorbentien oder Natriumsulfat). Enalaprilat kann durch Hämodialyse aus dem Kreislauf entfernt werden (siehe Abschnitt 4.4). Bei therapierefraktärer Bradykardie ist ein Schrittmacher indiziert. Die
Vitalparameter, Elektrolyt- und
Kreatinin-Konzentrationen im Serum sind ständig zu überwachen.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische
Klassifizierung
Angiotensin-Converting-Enzym-
Hemmer
ATC-Code: C09AA02
Enalaprilmaleat ist das Maleatsalz von Enalapril, einem Abkömmling von 2 Aminosäuren, L-Alanin und L-Prolin. Das Angiotensin-Converting-Enzym (ACE) ist eine Peptidyl-Dipeptidase, welche die Umwandlung von Angiotensin I zu der vasokonstriktorisch wirksamen Substanz Angiotensin II katalysiert. Nach Resorption wird Enalaprilmaleat zu Enalaprilat hydrolisiert, welches ACE hemmt. Die ACE-Hemmung bewirkt eine Abnahme von Angiotensin II im Plasma. Dies führt zu einer erhöhten Plasmareninaktivität (infolge des Wegfalls der negativen Rückkopplung auf die Reninsekretion) und einer Abnahme der Aldosteronsekretion.
ACE ist mit Kininase II identisch. Daher ist es möglich, dass Enalapril auch den Abbau von Bradykinin, einem stark vasodepressorischen Peptid, hemmt. Welche Rolle dieser Mechanismus für die therapeutischen Wirkungen von Enalapril spielt, ist noch unklar.
Der blutdrucksenkende Mechanismus von Enalapril wird zwar in erster Linie auf die Hemmung des Renin-Angiotensin-Aldosteron-Systems zurückgeführt; dennoch wirkt Enalapril sogar bei Patienten mit niedrigem Reninspiegel antihypertensiv.
Die Anwendung von Enalapril bei hypertonen Patienten führt zu einer Blutdrucksenkung im Liegen und im Stehen, ohne dass die Herzfrequenz signifikant ansteigt.
Eine symptomatische orthostatische Hypotonie tritt selten auf. Bei manchen Patienten kann es einige Wochen dauern, bis die Behandlung zu einer optimalen Blutdrucksenkung führt. Ein abruptes Absetzen von Enalapril ging nicht mit einem übermäßigen Blutdruckanstieg einher.
Eine wirksame Hemmung der ACE-Aktivität tritt normalerweise 2-4 Stunden nach Einnahme einer Einzeldosis von Enalapril ein. Das Einsetzen der antihypertensiven Wirkung wurde meist nach 1 Stunde, die maximale Blutdrucksenkung 4-6 Stunden nach Einnahme beobachtet. Die Wirkdauer ist dosisabhängig. Unter den empfohlenen Dosierungen zeigte es sich jedoch, dass die antihypertensive und hämodynamische Wirkung mindestens 24 Stunden lang anhielt.
Bei Patienten mit essenzieller Hypertonie zeigten hämodynamische Studien, dass die Blutdrucksenkung mit einer Abnahme des peripheren arteriellen Widerstandes und einer Zunahme des Herzminutenvolumens einherging, die Herzfrequenz aber kaum verändert war. Nach Einnahme
von Enalapril nahm die Nierendurchblutung zu, die glomeruläre Filtrationsrate blieb unverändert. Es gab keine Anzeichen einer Salz- oder Flüssigkeitsretention. Bei Patienten, die vor Behandlung mit Enalapril eine niedrige glomeruläre Filtrationsrate hatten, stieg diese jedoch an.
In klinischen Kurzzeitstudien bei Patienten mit Nierenerkrankung mit und ohne Diabetes wurde nach Einnahme von Enalapril eine Abnahme der Albuminurie sowie der
Urinausscheidung von IgG und Gesamtprotein beobachtet.
Bei gemeinsamer Anwendung mit Diuretika vom Thiazidtyp sind die blutdrucksenkenden Wirkungen von Enalapril zumindest additiv. Enalapril kann die Entwicklung einer thiazidinduzierten Hypokaliämie verringern oder verhindern.
Bei Patienten mit Herzinsuffizienz unter Therapie mit Digitalis und Diuretika führte die Behandlung mit Enalapril (oral oder i.v.) zu einer Abnahme des peripheren Widerstandes und des Blutdruckes. Das Herzminutenvolumen nahm zu; die Herzfrequenz, die bei Herzinsuffizienzpatienten normalerweise erhöht ist, nahm dagegen ab. Der Lungenkapillardruck war ebenfalls reduziert. Die körperliche Belastbarkeit und der Grad der Herzinsuffizienz (nach den Kriterien der New York Heart Association) wurden ebenfalls verbessert. Diese Wirkungen blieben bei Langzeittherapie erhalten.
Bei Patienten mit leichter bis mittlerer Herzinsuffizienz verzögerte Enalapril die Progression der Dilatation/ Vergrößerung des Herzens und der Herzinsuffizienz, erkennbar an der Reduktion des linksventrikulären enddiastolischen und systolischen Volumens und der Verbesserung der Ejektionsfraktion.
In einer multizentrischen, randomisier-ten, doppelblinden, Plazebo-kontrollier-ten Studie (SOLVD Präventionsstudie) wurde eine Population mit asymptomatischer linksventrikulärer Dysfunktion (LVEF < 35%) untersucht. 4.228 Patienten wurden randomisiert und erhielten entweder Plazebo (n=2.117) oder Enalapril (n=2.111). In der Plazebo-Gruppe kam es zu 818 Fällen von Herzinsuffizienz bzw. Todesfällen (38,6%), in der EnalaprilGruppe dagegen in 630 Fällen (29,8%) (Risikoreduktion: 29%; 95% CI: 21-36%; p<0,001). 518 Patienten der Plazebo-Gruppe (24,5%) und 434 der Enalapril-Gruppe (20,6%) starben an einer neu aufgetretenen oder sich verschlechternden Herzinsuffizienz oder wurden deshalb ins Krankenhaus eingewiesen (Risikoreduktion: 20%; 95% CI: 9-30%; p<0,001).
In einer multizentrischen,
randomisierten, doppelblinden,
Plazebo-kontrollierten Studie (SOLVD Behandlungsstudie) wurde eine Population mit symptomatischer Herzinsuffizienz aufgrund systolischer Dysfunktion (EF< 35%) untersucht. 2.569 Patienten, deren symptomatische
Herzinsuffizienz konventionell
behandelt wurde, wurden in eine Plazebo-Gruppe (n=1.284) oder eine Enalapril-Gruppe (n=1.285)
randomisiert. In der Plazebo-Gruppe kam es zu 510 Todesfällen (39,7%), im Vergleich dazu in der Enalapril-Gruppe zu 452 Todesfällen (35,2%) (Risikoreduktion: 16%; 95% CI: 5-26%; p=0,0036). In der Plazebogruppe kam es zu 461 Todesfällen kardiovaskulärer Ursache im Vergleich zu 399 Fällen in der Enalapril-Gruppe (Risikoreduktion: 18%; 95% CI: 6-28%; p<0,002); dies ist vor allem auf eine Abnahme der Todesfälle aufgrund fortschreitender Herzinsuffizienz zurückzuführen (251 in der Plazebo-Gruppe vs. 209 in der Enalapril-Gruppe, Risikoreduktion 22%, 95% CI: 6-35%). Weniger Patienten starben aufgrund einer
Verschlechterung ihrer Herzinsuffizienz oder wurden deshalb ins Krankenhaus eingewiesen (736 in der PlazeboGruppe und 613 in der EnalaprilGruppe; Risikoreduktion 26%; 95% CI: 18-34%; p<0,0001). Insgesamt senkte Enalapril in der SOLVD Studie bei Patienten mit linksventrikulärer Dysfunktion das Risiko, einen Myokardinfarkt zu erleiden um 23% (95% CI: 11-34%; p<0,001) und das Risiko, aufgrund einer instabilen Angina pectoris ins Krankenhaus eingewiesen zu werden, um 20% (95% CI: 9-29%,
p< 0,001).
Bei pädiatrischen Patienten über 6 Jahren mit Hypertonie liegen begrenzte Daten zur Anwendung von Enalapril vor. In einer klinischen Studie mit 110 hypertonen pädiatrischen Patienten im Alter von 6-16 Jahren erhielten Patienten mit einem Gewichfe 20 kg und einer glomerulären Filtrationsrate > 30 ml/min/1,73m2 und Patienten mit einem Gewicht < 50 kg entweder 0,625 mg, 2,5 mg oder 20 mg Enalapril pro Tag; Patienten mit einem Gewicht a 50 kg erhielten entweder 1,25 mg, 5 mg oder 40 mg Enalapril pro Tag. Die 1-mal tägliche Gabe von Enalapril senkte den Blutdruck in Abhängigkeit von der Dosis. Die dosisabhängige Blutdrucksenkung von Enalapril zeigte sich übereinstimmend in allen Subgruppen (Alter, Tanner-Stadium, Geschlecht, ethnische Zugehörigkeit). Allerdings scheinen die niedrigsten Dosierungen von 0,625 mg bzw. 1,25 mg (entsprechend durchschnittlich 0,02 mg/kg/Tag) keine gleichmäßige blutdrucksenkende Wirksamkeit zu haben. Die Maximaldosis, die untersucht wurde, war 0,58 mg/kg/Tag (bis zu 40 mg). Das Nebenwirkungsprofil bei Kindern unterschied sich nicht von dem bei Erwachsenen.
5.2 Pharmakokinetische Eigenschaften
Enalapril wird nach oraler Einnahme rasch resorbiert, wobei die maximalen Plasmakonzentrationen innerhalb 1 Stunde erreicht werden. Nach oraler Einnahme von Enalapril in Tablettenform beträgt die Resorption ungefähr 60 %, basierend auf der Wiederfindungsrate im Urin. Die Resorptionsrate nach oraler Einnahme von Enalapril AL wird nicht durch das
Vorhandensein von Nahrung im Magendarmtrakt beeinflusst.
Nach der Resorption wird oral aufgenommenes Enalapril rasch weitgehend zu Enalaprilat hydrolysiert, einem potenten Angiotensin-Converting-Enzym-Hemmer. Die
Spitzenplasmakonzentrationen von Enalaprilat zeigen sich ca. 4 Stunden nach oraler Gabe einer EnalaprilTablette. Die effektive Akkumulationshalbwertszeit von Enalaprilat nach oralen Mehrfachgaben beträgt 11 Stunden. Bei Probanden mit normaler Nierenfunktion wurden die Steady-State-Serum-Konzentrationen von Enalaprilat ca. 4 Tage nach Therapiebeginn erreicht.
Im Bereich der therapeutisch relevanten Konzentrationen liegt die Plasmaproteinbindung von Enalaprilat beim Menschen nicht über 60 %.
Außer der Konversion zu Enalaprilat liegen keine weiteren Hinweise für einen signifikanten Metabolismus von Enalapril vor.
Die Ausscheidung von Enalaprilat erfolgt überwiegend renal. Die Hauptbestandteile im Urin sind Enalaprilat, das ca. 40 % der Dosis ausmacht, und unverändertes Enalapril (ca. 20 %).
Nierenfunktionseinschränkung Die Enalapril- und Enalaprilat-Exposition sind bei Patienten mit Niereninsuffizienz erhöht.
Bei Patienten mit leichter bis mäßiger Niereninsuffizienz (Kreatinin-Clearance 40-60 ml/min) war die Steady-State-AUC von Enalaprilat nach der Anwendung von 5 mg/Tag etwa doppelt so groß wie bei Patienten mit normaler Nierenfunktion. Bei schwerer Niereninsuffizienz (Kreatinin-Clearance £ 30 ml/min), war die AUC etwa 8-mal größer. Die effektive Halbwertszeit von Enalaprilat nach Mehrfachdosen ist bei Niereninsuffizienz in diesem Stadium verlängert, das Erreichen des Steady-State ist verzögert (siehe Abschnitt 4.2).
Enalaprilat kann mittels Hämodialyse aus dem Kreislauf entfernt werden. Enalaprilat ist mit einer Rate von 62 ml/min dialysierbar.
Kinder und Jugendliche Eine pharmakokinetische Studie mit verschiedenen Dosierungen wurde bei 40 hypertonen Mädchen und Jungen im Alter von 2 Monaten bis zu 16 Jahren durchgeführt, die oral 0,07 - 0,14 mg/kg Enalaprilmaleat/Tag erhielten.
Insgesamt ergab diese Studie bezüglich der Pharmakokinetik von Enalaprilat keine größeren Unterschiede zwischen Kindern und den bekannten Daten von
Erwachsenen. Die Daten weisen auf eine Vergrößerung der AUC (bei Normierung auf Dosen pro
Körpergewicht) mit zunehmendem Alter hin; diese Vergrößerung der AUC ist jedoch nicht zu beobachten, wenn die Daten auf die Körperoberfläche normiert werden. Im Steady-State betrug die mittlere effektive
6.6
7.
8.
9.
10.
11.
Akkumulationshalbwertszeit von
Enalaprilat 14 Stunden.
5.3 Präklinische Daten zur Sicherheit
Aus den präklinischen Daten (übliche Untersuchungen zur pharmakologischen Verträglichkeit, zur Toxizität bei wiederholt verabreichten Dosen, zur Genotoxizität und zum kanzerogenen Potenzial) ergaben sich keine Hinweise auf eine besondere Gefährdung für den Menschen. Entsprechend den Studien zur Reproduktionstoxizität hat Enalapril keine Wirkungen auf Fruchtbarkeit und Fortpflanzung bei Ratten und wirkt nicht teratogen. In einer Studie, in der weibliche Ratten Enalapril vor der Paarung und während der Gestationszeit erhielten, kam es während der Säugeperiode zu einer erhöhten Todesrate bei den Jungtieren. Es wurde nachgewiesen, dass die Substanz plazentagängig ist und in die Muttermilch übergeht. Die Klasse der ACE-Hemmer wirkt nachweislich fetotoxisch (Schädigung und/oder Tod des Feten), wenn sie im 2. oder 3. Trimenon gegeben werden.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Enalapril AL 2,5 Enalapril AL 5
Hyprolose, Lactose-Monohydrat, Magne-siumstearat (Ph. Eur.), Maisstärke,
Natriumhydrogencarbonat, Talkum
Enalapril AL 10
Lactose-Monohydrat, Magnesiumstearat (Ph. Eur.), Maisstärke, Natrium
hydrogencarbonat, Talkum, Eisen(III)-oxid (E 172)
Enalapril AL 20
Lactose-Monohydrat, Magnesiumstearat (Ph. Eur.), Maisstärke, Natrium
hydrogencarbonat, Talkum, Eisen(III)-oxid (E 172), Eisen(III)-hydroxid-oxid (E 172)
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit Enalapril AL 2,5
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Enalapril AL 5 Enalapril AL 10 Enalapril AL 20
Die Dauer der Haltbarkeit beträgt 3 Jahre.
Arzneimittel sollen nach Ablauf des Verfallsdatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Enalapril AL 2,5
Nicht über 25°C lagern.
In der Originalverpackung aufbe
wahren, um den Inhalt vor Feuchtigkeit zu schützen.
Enalapril AL 5 Enalapril AL 10 Enalapril AL 20
Nicht über 30° lagern.
In der Originalverpackung aufbe
wahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Polyamid/Aluminium/PVC-Aluminium-
Blisterpackungen
Enalapril AL 2,5
OP mit 30 Tabletten OP mit 50 Tabletten OP mit 100 Tabletten
Enalapril AL 5
OP mit 30 Tabletten OP mit 50 Tabletten OP mit 100 Tabletten
Enalapril AL 10
OP mit 30 Tabletten OP mit 50 Tabletten OP mit 100 Tabletten
Enalapril AL 20
OP mit 30 Tabletten OP mit 50 Tabletten OP mit 100 Tabletten
Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Inhaber der Zulassung
ALIUD® PHARMA GmbH Gottlieb-Daimler-Straße 19 D-89150 Laichingen
Telefon: 07333/9651-0 Telefax: 07333/21499 Internet: www.aliud.de E-Mail: info@aliud.de
Zulassungsnummern
Enalapril AL 2,5
46858.00.00
Enalapril AL 5
46858.01.00
Enalapril AL 10
46858.02.00
Enalapril AL 20
46858.03.00
Datum der Erteilung der Zulassung/ Verlängerung der Zulassung
21. März 2000/20. Oktober 2008
Stand der Information
Mai 2011
Verkaufsabgrenzung
Verschreibungspflichtig
ALIUD® PHARMA 0511-00 Seite 7