Entocort Rektal
Fachinformation
(Zusammenfassung der Merkmale des Arzneimittels/SmPC)
1. Bezeichnung des Arzneimittels
Entocort® rektal
2.3 mg, Tabletten und Flüssigkeit zur Herstellung einer Rektalsuspension
2. Qualitative und quantitative Zusammensetzung
1 Tablette zur Herstellung einer Rektalsuspension enthält:
2.3 mg Budesonid
Sonstige Bestandteile mit bekannter Wirkung: Lactose, Methyl-4-hydroxybenzoat, Propyl-4-hydroxybenzoat
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. Darreichungsform
Tablette und Flüssigkeit zur Herstellung einer Rektalsuspension
Die Tabletten sind schwach gelb, kreisförmig und bikonvex. Auf einer Tablettenseite tragen sie die Prägung „ b A i” , auf der anderen Seite „ 2.3” . Die beigefügte Flüssigkeit zur Herstellung einer Rektalsuspension ist klar und farblos.
4. Klinische Angaben
4.1 Anwendungsgebiete
Akutbehandlung leichter bis mittelschwerer Colitis ulcerosa, die auf das Rektum und das Colon sigmoideum beschränkt ist.
4.2
Dosierung und Art der Anwendung
Es gilt folgende Dosierungsempfehlung:
1 Entocort rektal Klysma pro Tag (entsprechend 2 mg Budesonid).
Entocort rektal soll nach Zubereitung der Rektalsuspension vor dem Schlafengehen in den Enddarm eingeführt werden.
Die Dauer der Anwendung richtet sich nach dem Krankheitsbild; sie beträgt in der Regel 4 Wochen. Wenn nach einer Behandlungsdauer von 4 Wochen keine Remission eingetreten ist, kann die Behandlung weitere 4 Wochen durchgeführt werden. In der Regel wird die volle Wirkung nach 2 -4 Wochen erreicht.
Hinweise zur Zubereitung und Anwendung von Entocort rektal:
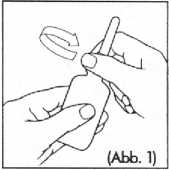
1. Die Rektalkanüle mit der Schutzkappe von der Flasche entfernen (Abb. 1).
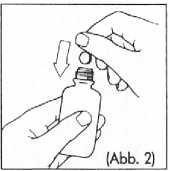
2. Die Tablette zur Herstellung einer Rektalsuspension aus der Aluminiumpackung nehmen und in die Flasche geben (Abb. 2).
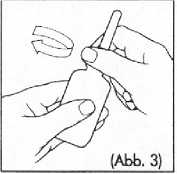
3. Die Rektalkanüle wieder auf die Flasche setzen, mit der Schutzkappe fest verschließen
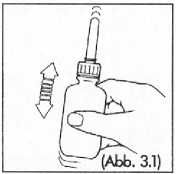
(Abb. 3) und die Flasche kräftig schütteln (Abb. 3.1). Die Schüttelzeit für die Zubereitung des Klistiers sollte mindestens 30 Sekunden betragen; bzw. so lange, bis die Tablette vollständig gelöst ist.
Die fertige Rektalsuspension (leicht gelblich) sollte handwarm sein und ist zum sofortigen Gebrauch bestimmt:
Ein Plastikhandschutz ist für die hygienische Anwendung des Klysmas beigelegt.
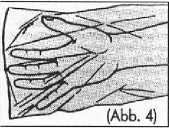
4. Der Patient legt sich auf die linke Seite.
Die Hand in die Schutzhülle stecken (Abb. 4) und die Flasche vor dem Entfernen der Schutzkappe nochmals kräftig schütteln (Abb. 4.1).
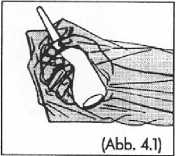
Die Schutzkappe entfernen und die Rektalkanüle in den Enddarm (Rektum) einführen.
Den Inhalt der Flasche langsam und mit leichtem Druck in den Darm entleeren.
Nach Entfernung der Flasche den Plastikhandschuh mit der freien Hand über den Handrücken und die Flasche zurückziehen (Abb. 4.2).
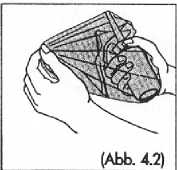
5. Erneut auf die linke Seite legen und 5 Minuten in dieser Position bleiben.
6. Die eingeführte Rektalsuspension soll möglichst lange im Darm behalten werden.
Einem unmittelbar nach der Anwendung auftretenden Stuhldrang soll nicht sofort nachgegeben werden.
Da sich die Plastikflasche nicht vollständig entleeren lässt, verbleibt ein Restvolumen von ungefähr 15 ml im Klysma zurück; daraus erklärt sich, dass 2 mg statt 2,3 mg Budesonid zur Anwendung gelangen.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff, Milchprotein, Methyl-4-hydroxybenzoat, Propyl-4-hydroxybenzoat oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Ferner darf das Produkt bei schweren lokalen Infektionen des Darms durch Bakterien, Viren oder Pilze nicht angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Es können die für systemische Kortikoide typischen Nebenwirkungen auftreten. Mögliche systemische Wirkungen schließen ein Glaukom mit ein.
Vorsicht ist geboten, wenn der Patient an Infektionen oder anderen Beschwerden leidet, bei denen Glukokortikoide unerwünschte Wirkungen hervorrufen könnten.
Erfahrungen mit der Behandlung von Kindern liegen nur begrenzt vor, deshalb sollte Entocort rektal bei Kindern nicht angewendet werden.
Nach längerer oraler oder parenteraler Gabe von Kortikoiden mit hoher systemischer Wirksamkeit und anschließender Umstellung auf Entocort rektal kann die Funktion der Nebennierenrinde eingeschränkt sein. Eine Therapieumstellung ist daher langsam vorzunehmen. Die orale oder parenterale Kortikoiddosis darf nur schrittweise reduziert werden. Unter Umständen ist die Kontrolle des Plasmakortisolspiegels erforderlich.
Während der Umstellungsphase können bei einigen Patienten unspezifische Beschwerden wie Gelenk- und Muskelschmerzen auftreten. Wenn in seltenen Fällen Symptome wie Müdigkeit, Kopfschmerzen, Übelkeit und Erbrechen auftreten, sollte ein unzureichender Kortikoideffekt als Ursache in Erwägung gezogen werden. In diesem Fall kann gelegentlich eine zeitweise Erhöhung der Dosis systemisch wirksamer Kortikoide erforderlich sein.
Bei der Umstellung von oraler bzw. parenteraler Kortikoidtherapie mit hoher systemischer Wirksamkeit auf Entocort rektal können Begleiterkrankungen wie Allergien (allergische Hauterscheinungen, allergischer Schnupfen) wieder auftreten, die vorher durch die systemische Wirkung der oralen bzw. parenteralen Steroidmedikation unterdrückt wurden.
Eine Leberfunktionsstörung beeinflusst die Elimination von Kortikoiden. Dadurch kommt es unter der oralen Behandlung mit Budesonid, ähnlich wie unter der Behandlung mit anderen Glukokortikoiden, zu einer reduzierten Eliminationsrate und zu einer Zunahme der systemischen Verfügbarkeit. Auf mögliche systemische Wirkungen ist zu achten, deshalb sollen die Plasmakortisolwerte regelmäßig kontrolliert werden.
In-vivo-Untersuchungen haben gezeigt, dass die orale Verabreichung von Ketoconazol (das bekanntlich die CYP3A4-Aktivität in der Leber und der Darmschleimhaut hemmt) die systemische Verfügbarkeit von oralem Budesonid um ein Vielfaches erhöht (siehe auch 4.5). Daher kann nicht ausgeschlossen werden, dass auch die gleichzeitige Anwendung von Entocort rektal und Ketoconazol zu einer erhöhten systemischen Verfügbarkeit von Budesonid führen kann. Die gleichzeitige Anwendung mit Ketoconazol oder anderen stark wirksamen CYP3A4-Inhibitoren sollte vermieden werden. Wenn dies nicht möglich ist, sollte der Zeitraum zwischen den entsprechenden
Therapien so lang wie möglich sein. Eine Reduzierung der Budesonid-Dosis sollte ebenfalls in Erwägung gezogen werden (siehe auch Abschnitt 4.5).
Bei chronischer Anwendung von Entocort rektal in extrem hohen Dosen können systemische Kortikoidwirkungen wie Hyperkortizismus und eine Hemmung der Nebennierenfunktion auftreten. Die Darreichungsform, das Klysma, und die Art der Anwendung machen jedoch eine länger andauernde Überdosierung unwahrscheinlich.
Die Anwendung von Entocort rektal kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Frauen, die auch Östrogene oder orale Kontrazeptiva erhielten, sind erhöhte Plasmaspiegel und verstärkte Kortikoidwirkungen beobachtet worden. Ein niedrig dosiertes orales Kombinationskontrazeptivum, das die Plasmakonzentration von oralem Prednisolon mehr als verdoppelt, hatte jedoch keinen signifikanten Effekt auf die Plasmakonzentration von oralem Budesonid.
Die gleichzeitige Gabe von Omeprazol in der empfohlenen Dosierung bewirkte keine Veränderung der Pharmakokinetik von oralem Budesonid, während die gleichzeitige Gabe von Cimetidin einen leichten Effekt ausübte, der klinisch jedoch keine Bedeutung hat.
Der Metabolismus von Budesonid erfolgt in erster Linie über CYP3A4, eine Untergruppe des Cytochrom-P-450-Enzyms. Inhibitoren dieses Enzyms, z. B. Ketoconazol, Itraconazol, Ciclosporin, Ethinylestradiol, Troleandomycin und HIV-Proteasehemmer, können daher die systemische Verfügbarkeit von Budesonid um ein Vielfaches erhöhen (siehe auch Abschnitt 4.4). Die Kombination sollte vermieden werden, da keine Daten vorliegen auf die sich eine Dosierungsempfehlung stützen könnte.. Wenn dies nicht möglich ist, sollte der Zeitraum zwischen den entsprechenden Therapien so lang wie möglich sein. Eine Reduzierung der Budesonid-Dosis sollte ebenfalls in Erwägung gezogen werden.
Die Hemmung des Metabolismus anderer Arzneimittel durch Budesonid via CYP3A4 ist unwahrscheinlich aufgrund der geringen Affinität von Budesonid zu diesem Enzym.
Die gleichzeitige Anwendung mit CYP3A4-Induktoren (wie z. B. Carbamazepin) kann möglicherweise die Verfügbarkeit von Budesonid reduzieren, so dass eine erhöhte Dosis erforderlich sein könnte.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Eine Anwendung in der Schwangerschaft sollte vermieden werden, es sei denn, es liegen überzeugende Gründe für die Behandlung mit Entocort rektal vor. Es liegen nur wenige Daten zum Ausgang der Schwangerschaft bei Anwendung von oral verabreichtem Budesonid beim Menschen vor. Obwohl Daten über die inhalative Anwendung von Budesonid bei einer großen Anzahl von schwangeren Frauen keine Hinweise auf eine nachteilige Wirkung ergaben, liegt die maximale Plasmakonzentration von Budesonid während einer Behandlung mit Entocort rektal vermutlich höher als nach inhalativ angewendetem Budesonid. In Tierstudien verursachte Budesonid, wie auch andere Glukokortikoide, Anomalien in der Entwicklung des Fetus (siehe auch Abschnitt 5.3). Die klinische Relevanz für den Menschen ist unklar. Frauen im gebärfähigen Alter sollten vor der Behandlung mit Entocort rektal eine mögliche Schwangerschaft ausschließen und während der Behandlung geeignete Maßnahmen zur Schwangerschaftsverhütung treffen.
Stillzeit
Budesonid geht in die Muttermilch über (es liegen Daten zur Exkretion nach inhalativer Anwendung vor). Aufgrund der höheren Dosierung von Entocort rektal kann die Budesonid-Konzentration in der Muttermilch bis zu 10-mal höher sein als bei der inhalativen Anwendung von Budesonid. Bei Anwendung von therapeutischen Dosen von Entocort rektal sind jedoch nur geringe Auswirkungen auf den Säugling zu erwarten. Die Entscheidung für das Stillen oder Abstillen bzw. über einen Verzicht auf die Budesonid-Therapie muss sorgfältig gegen den Nutzen des Stillens für das Kind und den Nutzen der Therapie für die Frau abgewogen werden.
Fertilität
Es sind keine Daten über die Wirkung von Budesonid auf die Fertilität beim Menschen verfügbar.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Entocort rektal hat keinen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1000 bis < 1/100), selten (> 1/10 000 bis < 1/1000), sehr selten (< 1/10 000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Folgende Nebenwirkungen wurden - gegliedert nach Organsystemen - beobachtet: Erkrankungen des Gastrointestinaltrakts
Häufig: gastrointestinale Störungen, wie z. B. Blähungen, Übelkeit und Durchfall
Erkrankungen der Haut und des Unterhautzellgewebes Häufig: Hautreaktionen (Urtikaria und Exantheme)
Psychiatrische Erkrankungen Gelegentlich: Unruhe, Schlaflosigkeit
Augenerkrankungen Nicht bekannt: Glaukom
Erkrankungen des Immunsystems
Sehr selten: anaphylaktische Reaktionen
Endokrine Erkrankungen
Selten: Anzeichen oder Symptome, wie z. B. Akne oder eine Unterfunktion der
Nebenniere, die auf systemische Glukokortikoideffekte hinweisen
Die Wahrscheinlichkeit für das Auftreten von systemischen Glukokortikoidwirkungen wird für Entocort rektal aufgrund der geringeren Beeinflussung des Hypothalamus-Hypophysenvorderlappen-Nebennierenrinden-Regelkreises wesentlich niedriger eingeschätzt als für oral oder rektal angewendete systemisch wirksame Glukokortikoide.
In seltenen Fällen können bei rektaler Anwendung von Kortikoide Anzeichen und Symptome systemischer Glukokortikoidwirkungen, einschließlich Funktionsminderung der Nebenniere, auftreten. Diese Wirkungen sind vermutlich abhängig von Dosierung, Behandlungsdauer, gleichzeitiger oder vorausgegangener Kortikoid-Einnahme und individueller Empfindlichkeit. Weitere mögliche, durch Glukokortikoide ausgelöste Nebenwirkungen unter der Behandlung mit Entocort rektal sind Nebenwirkungen wie Gewichtszunahme, Erhöhung des Blutzuckers, Osteoporose, Abwehrschwäche gegen Infektionen, Magengeschwür, Haut- und Muskelatrophie, Hirsutismus, Blutdruckanstieg, psychische Störungen und verzögerte Wundheilung. Das Risiko solcher Nebenwirkungen ist allerdings für Entocort rektal aufgrund der lokalen Wirkung niedriger als bei der Gabe von systemisch wirksamen Glukokortikoiden.
Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen. Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Berichte über akute Vergiftungen und/oder Todesfälle nach einer Überdosierung von Glukokortikoiden sind selten. Klinisch relevante Symptome sind nach einer akuten Überdosierung von Entocort rektal, selbst nach sehr hohen Dosen, daher sehr selten. Im Falle einer akuten Überdosierung steht kein spezifisches Antidot zur Verfügung. Wurden versehentlich hohe Dosen der beigefügten Tablette eingenommen, so besteht die Behandlung aus einer sofortigen Magenspülung oder Erbrechen und einer anschließenden unterstützenden und symptomatischen Therapie.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: topisches Glukokortikoid
ATC-Code: A07EA06
Budesonid ist ein Glukokortikoid mit hoher lokaler Kortikoidwirkung und besitzt eine antientzündliche, antiallergische, antiexsudative und antiödematöse Aktivität. Durch diese Eigenschaften werden folgende Wirkungen erreicht:
1. Hemmung der Bildung, Speicherung und Freisetzung von Mediatoren aus Mastzellen, Basophilen und Makrophagen,
2. Abdichtung der epithelialen und endothelialen Membranen,
3. Abnahme der entzündlichen Erscheinungen (Ödem, zelluläre Infiltration).
Als spezifischer Wirkmechanismus von Budesonid wird die Induktion spezifischer Proteine diskutiert, wie z. B. Makrocortin. Makrocortin greift durch Hemmung der Phospholipase A2 in den Arachidonsäurestoffwechsel ein und verhindert so die Bildung entzündungsauslösender Mediatoren, wie z. B. Leukotriene.
Aufgrund der raschen Metabolisierung von Budesonid in der Leber sind auch bei Langzeitanwendungen in therapeutischen Dosen klinisch relevante unerwünschte systemische Steroideffekte, wie z. B. eine Depression der körpereigenen Kortisolproduktion, nicht zu erwarten.
Kinder und Jugendliche
In einer 4-wöchigen, einfach verblindeten, randomisierten, referenzkontrollierten Studie mit Parallelgruppen wurde die klinische Wirksamkeit und Sicherheit von rektal verabreichten Glukokortikosteroiden bei 47 Kindern mit ulzerativer Colitis verglichen. 23 Kinder (im Alter von 7-15 Jahren) wurden randomisiert und mit Entocort rektal behandelt, 24 Kinder (im Alter von 6-15 Jahren) mit einem Prednisolon-Klysma. Der primäre Wirksamkeitsendpunkt war Remission, definiert durch endoskopisch festgestellte Verbesserung und fehlende klinische Symptome einer ulzerativen Colitis. Die Remissionsrate betrug nach 4 Wochen 50 % in der Entocort-Gruppe und 71 % in der Prednisolon-Klysma-Gruppe. Der Unterschied war statistisch nicht signifikant. Der primäre Sicherheitsendpunkt war Funktionsminderung der Nebenniere, definiert durch die Veränderung der Plasmakortisolspiegel nach ACTH-Stimulation. In Woche 4 wurden statistisch signifikante Unterschiede in den Prozentzahlen der Patienten mit normaler Funktion der Nebenniere festgestellt (Entocort 73 %, Prednisolon-Klysma 33 %) (Studie LD-008-0003).
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach oraler Verabreichung beträgt die systemische Verfügbarkeit von Budesonid ca. 10 %. Die systemische Verfügbarkeit nach rektaler Verabreichung von Entocort rektal beträgt bei gesunden Probanden ca. 15 % (zwischen 3 und 50 %). Wie bei rektal verabreichten Arzneimitteln mit hohem First-pass-Metabolismus zu erwarten ist, ist die Variationsbreite größer als nach oraler Verabreichung. Die Ursache dafür liegt in individuellen Unterschieden im rektalen venösen Abfluss und der daraus resultierenden Umgehung der Leber. Nach rektaler Verabreichung von Budesonid erfolgt die Resorption rasch und ist nach 3 Stunden im Wesentlichen abgeschlossen.
Verteilung
Das Verteilungsvolumen von Budesonid liegt bei 3 l/kg. Die Plasmaproteinbindung beträgt im Durchschnitt 85 - 90 %. Die mittlere Plasmaspitzenkonzentration nach rektaler Verabreichung von 2 mg Budesonid beträgt 2 - 3 nmol/l (zwischen 1 - 9 nmol/l) und wird innerhalb von 1,5 Stunden erreicht.
Biotransformation
Budesonid wird in sehr hohem Maße (bis zu 90 %) bei der ersten Leberpassage in Metaboliten mit geringer Glukokortikoidaktivität umgewandelt. Die Glukokortikoidaktivität der Hauptmetaboliten 6-beta-Hydroxybudesonid und 16-alpha-Hydroxyprednisolon beträgt weniger als 1 % der Aktivität von Budesonid. Budesonid wird überwiegend über CYP3A4, eine Untergruppe des Cytochrom-P-450-Enzyms, metabolisiert.
Elimination
Die Metaboliten werden unverändert oder in Form von Konjugaten vorwiegend renal ausgeschieden. Im Urin ist kein unverändertes Budesonid wiedergefunden worden. Budesonid hat eine hohe systemische Clearance (ca. 1,2 l/min), und die Plasmahalbwertszeit nach intravenöser Verabreichung beträgt im Mittel 2 - 3 Stunden.
Linearität
Die Pharmakokinetik von Budesonid ist linear zur Dosis (was dadurch belegt wird, dass nach oraler
Verabreichung von 3,9 und 15 mg Budesonid in Form von Entocort Kapseln die Werte für Cmax und AUC proportional zur Dosis ansteigen).
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität
Die akute Toxizität von Budesonid wurde bei Ratten und Mäusen untersucht. Die nachfolgende Tabelle gibt die Ergebnisse wieder.
|
Spezies |
Applikationsart |
LDso (mg/kg) |
|
Maus |
oral |
> 800 |
|
Ratte |
subkutan |
20 |
|
Ratte |
oral |
400 |
Subakute und chronische Toxizität
Budesonid wurde inhalativ über 12 Monate bei Hunden und Ratten verabreicht. Selbst bei 10- bis 40fach höheren Dosen als im klinischen Gebrauch wurden keine lokalen Effekte in den Atemwegen beobachtet.
Reproduktionstoxizität
Glukokortikoide zeigen in Tierversuchen teratogene Aktivitäten (z. B. Gaumenspalte, skelettale Anomalien). Die klinische Relevanz dieser Eigenschaften ist bisher nicht geklärt. Budesonid zeigte bei Nagern die schon von anderen Glukokortikoiden bekannten Veränderungen; diese waren bei Budesonid im Vergleich zu anderen bekannten topischen Kortikoiden jedoch oft weniger ausgeprägt.
Mutagenität
Die mutagenen Eigenschaften von Budesonid wurden an sechs unterschiedlichen Testmodellen überprüft. Budesonid zeigte in keinem dieser Tests mutagene oder klastogene Eigenschaften.
Kanzerogenität
In einer Kanzerogenitätsstudie wurde eine erhöhte Inzidenz von Gliomen im Gehirn männlicher Ratten gefunden, die in einer Wiederholungsstudie nicht verifiziert werden konnte. In dieser Studie unterschied sich die Inzidenz der mit Verum behandelten Gruppen (Budesonid, Prednisolon, Triamcinolonacetonid) und der Kontrollgruppe nicht.
Leberveränderungen (vornehmlich hepatozelluläre Neoplasmen), die sowohl in der ersten Kanzerogenitätsstudie als auch in der Wiederholungsstudie für Budesonid gefunden wurden, traten in gleichem Maße auch bei den Referenzglukokortikoiden auf. Diese Effekte sind höchstwahrscheinlich als Rezeptoreffekt zu interpretieren und stellen somit einen Klasseneffekt dar.
Pharmazeutische Angaben
6.
6.1 Liste der sonstigen Bestandteile
Lactose, Lactose-Monohydrat, Crospovidon, hochdisperses Siliciumdioxid, Magnesiumstearat (Ph.Eur.), Riboflavinphosphat-Natrium (Ph.Eur.)
1 Klysma mit 115 ml Flüssigkeit zur Herstellung einer Rektalsuspension enthält:
92 mg, entspricht 0,8 mg/ml Methyl-4-hydroxybenzoat (Ph.Eur.) und
23 mg, entspricht 0,2 mg/ml Propyl-4-hydroxybenzoat (Ph.Eur.) als Konservierungsmittel,
Natriumchlorid, gereinigtes Wasser
6.2 Inkompatibilitäten
Inkompatibilitäten sind bisher nicht bekannt.
6.3 Dauer der Haltbarkeit
Die Haltbarkeit von Entocort rektal beträgt 2 Jahre.
Das gebrauchsfertige Klysma soll sofort nach der Zubereitung angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
- Aluminiumblisterpackung
- LDPE-Flasche mit einer Rektalkanüle
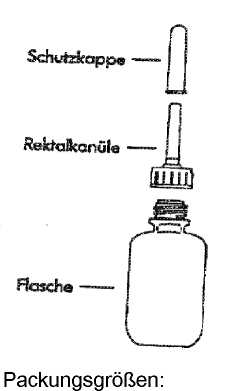
7 Tabletten Entocort rektal, 7 Klysmen mit je 115 ml Flüssigkeit zur Herstellung einer Rektalsuspension und 7 Plastikhandschuhe [N 1]
28 (4 x 7 Tabletten und 4 x 7 Klysmen) Tabletten und Klysmen (Klinikpackung)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
AstraZeneca GmbH
22876 Wedel
Telefon: 0 41 03 / 70 80
Telefax: 0 41 03 / 708 32 93
E-Mail: azinfo@astrazeneca.com
8. Zulassungsnummer
28247.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
16.01.1997/05.05.2003
10. Stand der Information
September 2013
11. Verkaufsabgrenzung
Verschreibungspflichtig