Estramustin-Uropharm 280 Mg Hartkapseln
F achinformation
(Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
Estramustin-Uropharm® 280 mg Hartkapseln W irkstoff: Estramustin-17 ß-dihydrogenphosphat
2. Qualitative und quantitative Zusammensetzung
Estramustin-Uropharm® 280 mg Hartkapseln
1 Hartkapsel Estramustin-Uropharm® 280 mg enthält:
Estramustin-17ß-dihydrogenphosphat, Dinatriumsalz 303,6 mg entsprechend Estramustin-17ß-dihydrogenphosphat 280 mg
Hilfsstoffe siehe unter Abschnitt 6.1.
3. Darreichungsform
Hartkapsel
4. Klinische Angaben 4.1Anwendungsgebiete
Palliative Behandlung des fortgeschrittenen hormonrefraktären Prostatakarzinoms
4.2 Dosierung, Art und Dauer der Anwendung
Die Behandlung mit Estramustinphosphat sollte nur von Ärzten erfolgen, die in der Tumortherapie erfahren sind.
Initialdosierung:
Estramustin-Uropharm® 280 mg: 3 x 1 Hartkapsel/Tag über 4 Wochen
Zeigt sich nach 4 Wochen eine subjektive Besserung, wird die Therapie fortgesetzt.
Erhaltungsdosierung:
Estramustin-Uropharm® 280 mg: 2 x 1 Hartkapsel/Tag; bei Bedarf (z. B. hohes Körpergewicht)
3 x 1 Hartkapsel/Tag
Estramustin-Uropharm® 280 mg Hartkapseln sollten mindestens 1 Stunde vor oder frühestens 2 Stunden nach dem Essen (dazu zählen auch Milch und Milchprodukte) eingenommen werden. Estramustin-Uropharm® 280 mg Hartkapseln sollen nicht zusammen mit Milch oder Milchprodukten, calcium-, magnesium- oder aluminumhaltigen Präparaten (z.B. Antazida) sowie calciumreichem Mineralwasser mit einem Calcium-Gehalt über 200 mg/l eingenommen werden. Hat die Initialtherapie Erfolg, so muss die Therapie mit Estramustin-Uropharm® 280 mg dauerhaft bis zum Auftreten einer objektiv messbaren Progression fortgesetzt werden. Therapieabbruch kann ein rasches Fortschreiten der Krankheit bewirken.
4.3 Gegenanzeigen
Estramustin-Uropharm® 280 mg sollte bei Patienten mit folgender Anamnese nicht verwendet werden:
• bekannte Überempfindlichkeit gegen Estradiol oder N-Lost
• schwere Herz- und Lebererkrankungen
• aktive Thrombophlebitis oder thromboembolische Störungen (z.B. tiefe oder oberflächliche V enenentzündung)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vorsicht wird empfohlen bei Patienten mit vorangegangener Thrombophlebitis, Thrombose oder thromboembolischen Störungen, insbesondere wenn diese in Zusammenhang mit einer Estrogentherapie standen, sowie bei Patienten mit zerebrovaskulären oder koronaren Erkrankungen, peptischen Ulkuserkrankungen und Herpes zoster.
Estramustin kann den Calcium-Phosphat-Stoffwechsel beeinflussen. Es darf daher nur mit Vorsicht bei Patienten angewendet werden, welche unter Ossifikationsstörungen leiden, insbesondere wenn gleichzeitig eine Niereninsuffizienz und Hyperkalzämie vorliegen.
Estramustin-Uropharm® 280 mg und dessen Metaboliten können erbgutschädigend wirken. Männern, die mit Estramustin-Uropharm® 280 mg behandelt werden, wird daher empfohlen, während der Behandlung und bis 6 Monate danach kein Kind zu zeugen und sich vor Therapiebeginn wegen der Möglichkeit einer irreversiblen Infertilität durch die Therapie mit Estramustin-Uropharm® 280 mg über eine Spermakonservierung beraten zu lassen. Da nicht bekannt ist, ob Estramustin-Uropharm® 280 mg oder dessen Metaboliten mit dem Ejakulat ausgeschieden werden, sollten Kondome beim Geschlechtsverkehr verwendet werden.
Estramustin wird von Patienten mit eingeschränkter Leberfunktion schlecht metabolisiert. Patienten mit eingeschränkter Leber- und Nierenfunktion müssen regelmäßig überwacht werden.
Blutbild und Leberfunktionstests sollten in regelmäßigen Abständen erstellt werden.
Patienten mit Erkrankungen, die durch Wasserretention negativ beeinflusst werden können (z.B. Epilepsie, Migräne oder Nierenfunktionsstörungen), bedürfen sorgfältiger Überwachung.
Da es zur Einschränkung der Glukosetoleranz kommen kann, wird eine ständige Kontrolle der Diabetespatienten unter Estramustin-Uropharm® 280 mg-Therapie empfohlen.
Es wurde über das Auftreten von arterieller Hypertonie berichtet. Aus diesem Grund sind regelmäßige Blutdruckkontrollen angezeigt.
Zur Gynäkomastieprophylaxe wird eine Mamillenbestrahlung empfohlen.
Zur Beachtung:
Estrogenhaltige Arzneimittel beeinflussen das endokrine und hepatische System und können daher die entsprechenden Laborparameter verändern.
Immunsuppressive Wirkungen/Erhöhte Infektanfälligkeit
Impfungen mit lebenden oder abgeschwächten lebenden Erregern bei Patienten, die durch Chemotherapie, einschließlich Estramustin, immunsupprimiert sind, können zu schweren oder fatalen Infekten führen. Bei Patienten, die Estramustin erhalten, müssen Impfungen mit Lebenderregern vermieden werden. Inaktivierte oder Totimpfstoffe können appliziert werden, die
Impfantwort kann jedoch abgeschwächt sein.
4.5 Wechselwirkungen mit anderen Mitteln und sonstige Wechselwirkungen
Polyvalente Ionen können mit Estramustin-17ß-dihydrogenphosphat (Estramustinphosphat; EMP) schwerlösliche Salze bilden. Calciumreiche Nahrung wie Milch oder Milchprodukte sowie calcium-, magnesium- oder aluminumhaltige Präparate und Mineralwasser mit einem Calciumgehalt über 200 mg/l können somit zu einem Wirkungsverlust von oral gegebenem Estramustinphosphat führen und sind im Zusammenhang mit der Einnahme von Estramustin-Uropharm® 280 mg Hartkapseln zu vermeiden.
Von Estrogenen weiß man, dass sie sowohl die therapeutischeWirksamkeit als auch die Toxizität von trizyklischen Antidepressiva, vermutlich durch eine Hemmung ihres Metabolismus,verstärken.
Eine Wechselwirkung zwischen Estramustin und ACE-Hemmern kann möglicherweise zu einem erhöhten Risiko für angioneurotische Ödeme führen.
4.6 Schwangerschaft und Stillzeit
Die Anwendung von Estramustin-Uropharm® 280 mg bei Frauen ist kontraindiziert.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen
Gastrointestinale und kardiovaskuläre Nebenwirkungen können zu einer Beeinträchtigung beim Führen von Kraftfahrzeugen und der Bedienung von Maschinen führen.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: Sehr häufig: mehr als 1 von 10 Behandelten
Häufig: weniger als 1 von 10, aber mehr als 1 von 100 Behandelten
Gelegentlich: weniger als 1 von 100, aber mehr als 1 von 1.000 Behandelten
Selten: weniger als 1 von 1.000, aber mehr als 1 von 10.000 Behandelten
Sehr selten: weniger als 1 von 10.000 Behandelten, einschließlich gemeldeter Einzelfälle
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
|
häufig |
gelegentlich |
selten |
nicht bekannt | |
|
Untersuchungen |
Blutbildveränderungen (Anämie, Leukopenie, Thrombozytopenie) 1 | |||
|
Herzerkrankungen |
Herzinsuffizienz (eingeschränkte Herzfunktion) sowie ischämischen Beschwerden (Beschwerden infolge verringerter Durchblutung) bis hin zum Herzinfarkt. Diese Nebenwirkungen sind zu einem hohen Prozentsatz schwerwiegend | |||
|
Erkrankungen des Blutes und des Lymphsystems |
Hyophosphatämie (vermindertem Phosphatgehalt im Blut) durch gesteigerte renale (durch die Niere) Phosphatausscheidung | |||
|
Erkrankungen des Gastrointestinaltraktes |
Zu Beginn der Therapie Übelkeit, Erbrechen, Appetitlosigkeit und Durchfall 2 | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hautreizungen, Ausschläge, Juckreiz und Allergien | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelschwäche | |||
|
Gefäßerkrankungen |
Thromboembolien (Verschluß von Arterien durch Blutpfropfen), Ödemen (W asseransammlungen im Gewebe). Diese Nebenwirkungen sind zu einem hohen Prozentsatz schwerwiegend |
Hypertonie |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen in Einzelfällen: Quincke-Ödem (allergisch bedingte Gesichtsschwellung) Larynx-Ödem. In vielen berichteten Fällen, einschließlich einem mit fatalem Ausgang, erhielten diese Patienten ACE-Hemmer als Begleitmedikation. Beim Auftreten eines angioneurotischen Ödems muss die Therapi mit Estramustin sofort abgebrochen werden. | |||
|
Leber- und Gallenerkrankungen | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Gynäkomastie (Vergrößerung der Brustdrüse), Libido-und Potenzverlust (Verlust des Geschlechtstriebes und der Zeugungskraft) |
Kurzdauernde Schmerzen oder Mißempfindungen (Hitzegefühl) im Bereich des Perineums (Dammes) und der Prostata (Vorsteherdrüse) | ||
|
Psychiatrische Erkrankungen |
Depression, Kopfschmerzen, Verwirrung und Lethargie |
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Berichte über eine akute Überdosierung liegen nicht vor. Es ist eine Verstärkung der Nebenwirkungen, insbesondere der gastrointestinalen Symptome, zu erwarten. Magenspülung und symptomatische Behandlung werden empfohlen. Die hämatologischen und hepatischen Parameter sollten mindestens sechs Wochen lang kontrolliert werden.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmokotherapeutische Gruppe: Zytostatika, Metastasenhemmer ATC-Code: L01XX11
Estramustinphosphat ist ein Zytostatikum. Bei der Verbindung handelt es sich um ein in 17ß-Stellung phosphoryliertes Estradiolderivat, das jedoch keine Affinität zum Estrogenrezeptor aufweist, da die phenolische OH-Gruppe mit Nor-Stickstoff-Lost zum Urethan verestert ist. Auch wirkt die Verbindung selbst, aufgrund der geringen Nucleophilie des Stickstoffes, nicht als Alkylans. Estramustinphosphat wird vollständig dephosphoryliert; dabei entstehen die zytotoxisch aktiven Substanzen Estramustin und durch Oxidation Estromustin.
Ca. 10 - 15% der beiden zytotoxischen Metaboliten werden durch Esterasen zu Estradiol und Estron (Verhältnis 1:10) gespalten. Über den Verbleib und das weitere Schicksal des dabei freiwerdenden N-Lost ist wenig bekannt. Da Karbamidasen im tumorösen Prostatagewebe nachgewiesen werden können, ist nicht auszuschließen, dass N-Lost möglicherweise zum zytostatischen Effekt von Estramustinphosphat beiträgt. Untersuchungen hierüber liegen jedoch bisher nicht vor.
In vitro wirken Estramustinphosphat bzw. die aktiven Metaboliten Estra- und Estromustin zytotoxisch auf die Prostatakarzinom-Zellinien PC-1013L, PC-3 und DU 145. Für Estramustinphosphat und Estramustin wurden antimitotische und antimikrotubuläre Effekte festgestellt, die vermutlich durch nachgewiesene Interaktionen mit Mikrotubuli-assoziierten- und tau-Proteinen zustande kommen. Im Prostata-, Prostatakarzinom- und benignen ProstatahyperplasieGewebe werden Estra- und Estromustin an das sogenannte Estramustin-bindende-Protein gebunden, in vivo wurde jedoch lediglich eine Anreicherung von Estramustin im Prostatakarzinom beobachtet.
Estramustinphosphat zeigt eine wachstumshemmende Wirkung, an den experimentellen Prostatakarzinomen PC 82, PCEW und R-3327, jedoch nicht am Prostataschuppenzellkarzinom 11095 und am Prostataadenokarzinom, Linie I.
Die estrogenen Komponenten wirken via Hypophysen-Gonadenachse durch Senkung der LH- und FSH-Produktion auf die Testes und reduzieren somit die Androgenproduktion. Die Folge ist ein Absinken des Testosteronspiegels auf Kastratniveau innerhalb einer Woche. Die estrogenen Komponenten wirken zusätzlich zytotoxisch durch Hemmung der 5-a-Reduktase.
Bei oraler Applikation von radioaktiv markiertem Estramustinphosphat beträgt die Resorptionsquote ca. 75%.
Calciumionen und polyvalente Metallionen können mit oral verabreichtem Estramustinphosphat schwerlösliche Salze bilden. Dadurch wird die Resorption von EMP vermindert und es kommt zu einem Wirkungsverlust.
EMP ist ein ,,Pro-drug‘‘ und wird nach oraler Gabe im Gastrointestinaltrakt unter Bildung von Estramustin rasch dephosphoryliert. Unverändertes Estramustinphosphat ist im Plasma selbst nicht nachweisbar.
Nach intravenöser Applikation kann im Plasma unverändertes EMP nachgewiesen werden, es wird jedoch schnell (Eliminationshalbwertszeit 1,2 Stunden) durch Abspaltung des Phosphatrestes zu Estramustin metabolisiert. Dieser Metabolisierungsschritt zum Estramustin erfolgt in diesem Fall direkt im Plasma sowie in zahlreichen Geweben. Estramustinphosphat ist zu 99% an Plasmaproteine gebunden.
Im weiteren Schritt wird Estramustin durch partielle Oxidation der 17ß-Hydroxygruppe zum Hauptmetaboliten Estromustin metabolisiert. Estramustin und Estromustin haben eine hohe Eiweißbindung und wirken zytotoxisch. Die Eliminationshalbwertszeit des Hauptmetaboliten Estromustin beträgt ca. 80 Stunden. Beide Metaboliten werden durch Hydrolyse zu den Estrogenen Estradiol und Estron metabolisiert.
Nach oraler oder intravenöser Gabe kommt es zu einem linearen Plasmaspiegelverlauf. Bei Langzeittherapie bleibt der Steady-State-Level unverändert.
Estramustin und Estromustin werden biliär ausgeschieden und erscheinen nicht im Urin. Estradiol und Estron unterliegen einer weiteren Metabolisierung und werden teilweise im Urin ausgeschieden.
Die Metaboliten Estramustin und Estromustin sind nach Gabe von EMP im Prostatagewebe nachweisbar. Bei Untersuchungen an Patienten wurden im Tumorgewebe höhere Estramustin- und Estromustinspiegel gefunden als im Plasma. Im Tumorgewebe konnte ein Protein nachgewiesen werden, welches möglicherweise dafür verantwortlich ist, dass Estramustin und Estromustin in das Prostatakarzinomgewebe aufgenommen werden.
Bioverfügbarkeit
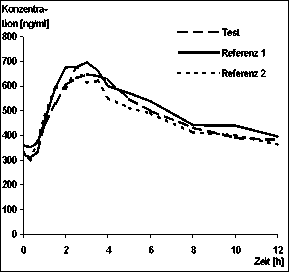
Eine Bioverfügbarkeits-Untersuchung von Estramustin-Uropharm® 280 mg im Vergleich zu zwei Referenzpräparaten wurde im Jahr 1999 mit 24 Patienten durchgeführt.
Die pharmakokinetischen Parameter wurden im Steady-State für den wirksamen Metaboliten Estromustin nach oraler Gabe von Estramustinphosphat ermittelt (siehe Tabelle). Die Ergebnisse dieser Studie zeigen, dass das Testpräparat bioäquivalent zu den beiden Referenzpräparaten bezüglich Rate und Ausmaß der Absorption ist.
|
Testpräparat |
Referenzpräparat 1 |
Referenzpräparat 2 | |
|
maximale Plasmakonzentration Cmax (ng/ml): |
782,87 ± 290,21 |
824,02 ± 280,68 |
774,97 ± 290,17 |
|
Zeitpunkt der max. Plasmakonzentration tmax (h): |
2,76 ± 1,12 |
2,71 ± 0,88 |
2,32 ± 0,75 |
|
Fläche unter der Konzentrations-ZeitKurve AUC0-12h (ng • h/ml): |
5796,10 ± 2375,30 |
6140,72 ± 2134,70 |
5684,29 ± 2065,45 |
Angabe der Werte als Mittelwert und Streubreite.
Mittlere Plasmaspiegelverläufe von Estromustin:
5.3 Präklinische Daten zur Sicherheit
Bei Ratten und Mäusen ist die orale LD50 von Estramustinphosphat größer als 2000 mg/kg. Die intravenöse LD50 beträgt 440 und 192 mg/kg bei Mäusen und Ratten und liegt bei Hunden zwischen 400 und 800 mg/kg. Primäre Zielorgane nach einer Einzeldosis sind die hämolymphopoetischen und endokrinen Systeme sowie die männlichen und weiblichen Fortpflanzungsorgane.
Die toxischen Wirkungen nach Mehrfachgabe wurden bei Ratten, Hunden und Affen untersucht. Bei diesen Spezies waren die primären Zielorgane nach oraler und intravenöser Gabe von Estramustinphosphat die hämolymphopoetischen und endokrinen Systeme sowie die männlichen und weiblichen Fortpflanzungsorgane, Bei Hunden und Affen waren die Veränderungen in diesen Organen/Systemen hauptsächlich auf die Estrogenwirkung des Wirkstoffs zurückzuführen, während bei den Ratten sowohl Estrogen- als auch zytotoxische Wirkungen beobachtet werden.
In reproduktionstoxikologischen Studien traten bereits in Dosierungen, die unterhalb der humantherapeutischen Dosis lagen, Effekte auf die Fertilität, den Schwangerschaftsverlauf, die Geburt sowie die prä- und postnatale Entwicklung der Nachkommen auf. Teratogene Effekte wurden bei Ratten beobachtet.
Estramustinphosphat induziert in geeigneten Modellsystemen numerische Chromosomenaberrationen (aneugenes Potential). Anders als Nor-Stickstoff-Lost zeigt Estramustinphosphat dagegen kein mutagenes und klastogenes Potential.
6.1 Liste der sonstigen Bestandteile
Estramustin-Uropharm 280 mg enthält:
Talkum, hochdisperses Siliciumdioxid, Natriumdodecylsulfat, Magnesiumstearat (Ph.Eur.), Gelatine, Farbstoffe (E 127, E 132, E 172), Titandioxid (E 171)
6.2 Inkompatibilitäten
Entfällt bei oraler Verabreichung.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Lagerungshinweise
Nicht über +25 °C lagern.
6.5 Art und Inhalt des Behältnisses
PVC/Alu Blisterpackung mit 30, 50 und 100 Hartkapseln
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Arzneimittel nicht über den Hausmüll, sondern nur über eine Apotheke entsorgen!
7. Pharmazeutischer Unternehmer
Uropharm AG
Erfurtstraße 64
53125 Bonn
Tel.: 0228-9180009
Fax.: 0228-9180010
e-mail: info@uropharm.de
8. Zulassungsnummer: 52389.01.00
9. Datum der Zulassung / Verlängerung der Zulassung:
8. Juni 2004 / 19. April 2013
10. Stand der Information:
Februar 2014
11. Verkaufsabgrenzung:
V erschreibungspflichtig
Seite 9
Diese Nebenwirkungen waren i.d.R. nach Reduzierung der Dosis auf die Hälfte, bzw. nach kurzzeitigem Absetzen des Präparates reversibel. Nach Abklingen der Symptome sollte die volle Dosis wieder verabreicht werden.
Die Gabe von Antiemetika oder eine vorübergehende Dosisreduzierung (1-2 Wochen) können hier hilfreich sein.