Ezetimib-Ratiopharm 10 Mg Tabletten
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS/
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Ezetimib-ratiopharm® 10 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Tablette enthält 10 mg Ezetimib.
Sonstiger Bestandteil mit bekannter Wirkung:
Jede Tablette enthält 35 mg Lactose-Monohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
8,2 mm x 4,1 mm große, weiße, bikonvexe, kapselförmige Tabletten mit der Prägung „10“ auf einer Seite.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Primäre Hypercholesterinämie
Ezetimib-ratiopharm® wird zusammen mit einem HMG-CoA-Reduktase-Hemmer (Statin) zusätzlich zu einer Diät angewendet bei Patienten mit primärer (heterozygoter familiärer und nicht familiärer) Hypercholesterinämie, bei denen die Therapie mit einem Statin allein nicht ausreicht.
Eine Monotherapie mit Ezetimib-ratiopharm® wird zusätzlich zu einer Diät angewendet bei Patienten mit primärer (heterozygoter familiärer und nicht familiärer) Hypercholesterinämie, wenn ein Statin als ungeeignet erachtet oder nicht vertragen wird.
Prävention kardiovaskulärer Ereignisse
Ezetimib-ratiopharm® wird angewendet als Zusatztherapie zu einer bestehenden Statintherapie oder zu Beginn einer Statintherapie zur Reduktion des Risikos für kardiovaskuläre Ereignisse (siehe Abschnitt 5.1) bei Patienten mit koronarer Herzkrankheit (KHK) und akutem Koronarsyndrom in der Vorgeschichte.
Homozygote familiäre Hypercholesterinämie (HoFH)
Ezetimib-ratiopharm® wird in Kombination mit einem Statin zusätzlich zu einer Diät angewendet bei Patienten mit homozygoter familiärer Hypercholesterinämie. Die Patienten können weitere begleitende Therapien (wie LDL-Apherese) erhalten.
4.2 Dosierung und Art der Anwendung
Dosierung
Die empfohlene Dosierung beträgt eine Tablette Ezetimib-ratiopharm® 10 mg Tabletten pro Tag. Ezetimib-ratiopharm® 10 mg Tabletten kann zu jeder Tageszeit unabhängig von den Mahlzeiten eingenommen werden.
Wenn Ezetimib-ratiopharm® zusätzlich zu einem Statin verordnet wird, sollte entweder die angegebene übliche Anfangsdosis des betreffenden Statins oder die bereits angewandte höhere Statindosis fortgeführt werden. Dabei muss die Dosierungsanleitung des entsprechenden Statins beachtet werden.
Anwendung bei Patienten mit koronarer Herzkrankheit (KHK) und akutem Koronarsyndrom in der Vorgeschichte
Zur zusätzlichen Senkung des Risikos für kardiovaskuläre Ereignisse bei Patienten mit koronarer Herzkrankheit und akutem Koronarsyndrom in der Vorgeschichte kann Ezetimib-ratiopharm® in Kombination mit einem Statin mit nachgewiesenem kardiovaskulären Nutzen gegeben werden.
Gemeinsame Gabe mit Anionenaustauschern
Die Einnahme von Ezetimib-ratiopharm® sollte mindestens 2 Stunden vor oder mindestens 4 Stunden nach der Einnahme eines Anionenaustauschers erfolgen.
Ältere Patienten
Für ältere Patienten ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2).
Kinder und Jugendliche
Die Behandlung ist von einem Facharzt einzuleiten.
Kinder und Jugendliche ab 6 Jahren: Die Sicherheit und Wirksamkeit von Ezetimib bei Kindern im Alter von 6 bis 17 Jahren ist nicht erwiesen. Zurzeit vorliegende Daten werden in den Abschnitten 4.4, 4.8, 5.1 und 5.2 beschrieben; eine Dosierungsempfehlung kann jedoch nicht gegeben werden.
Wenn Ezetimib-ratiopharm® zusammen mit einem Statin verordnet wird, sind die Dosierungsempfehlungen für die Anwendung des Statins bei Kindern zu beachten.
Kinder unter 6 Jahren: Die Sicherheit und Wirksamkeit von Ezetimib bei Kindern unter 6 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Eingeschränkte Leberfunktion
Für Patienten mit leichter Leberinsuffizienz (Child-Pugh-Score 5-6) ist keine Dosisanpassung erforderlich. Für Patienten mit mäßiger (Child-Pugh-Score 7-9) oder schwerer (Child-Pugh-Score > 9) Einschränkung der Leberfunktion wird die Behandlung mit Ezetimib nicht empfohlen (siehe Abschnitte 4.4 und 5.2).
Eingeschränkte Nierenfunktion
Für Patienten mit Nierenfunktionsstörungen ist keine Dosisanpassung erforderlich (siehe Abschnitt 5.2).
Art der Anwendung Zum Einnehmen.
Der Patient sollte eine geeignete lipidsenkende Diät einhalten, die er auch während der Therapie mit Ezetimib-ratiopharm® 10 mg Tabletten fortsetzen sollte.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Wenn Ezetimib-ratiopharm® zusammen mit einem Statin verordnet wird, informieren Sie sich bitte in der Zusammenfassung der Merkmale (Fachinformation) des betreffenden Arzneimittels.
In der Schwangerschaft und Stillzeit ist eine Therapie mit Ezetimib-ratiopharm® zusammen mit einem Statin kontraindiziert.
Bei Patienten mit aktiver Lebererkrankung oder ungeklärter persistierender Erhöhung der Serum-Transaminasen ist Ezetimib zusammen mit einem Statin kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wenn Ezetimib-ratiopharm® zusammen mit einem Statin verordnet wird, informieren Sie sich bitte in der Zusammenfassung der Merkmale (Fachinformation) des betreffenden Arzneimittels.
Leberenzyme
In kontrollierten Studien wurden bei Patienten, die Ezetimib zusammen mit einem Statin erhielten, aufeinanderfolgende Erhöhungen der Transaminasenwerte (auf mindestens das Dreifache des oberen Normwertes [ULN]) beobachtet. Wenn Ezetimib-ratiopharm® zusammen mit einem Statin gegeben wird, sollte die Leberfunktion bei Behandlungsbeginn sowie gemäß den Anweisungen für das betreffende Statin überprüft werden (siehe Abschnitt 4.8).
In der IMPROVE-IT-Studie (IMProved Reduction of Outcomes: Vytorin Efficacy International Trial) erhielten 18.144 Patienten mit koronarer Herzkrankheit und akutem Koronarsyndrom in der Vorgeschichte randomisiert entweder einmal täglich Ezetimib/Simvastatin 10 mg/40 mg (n = 9.067) oder einmal täglich Simvastatin 40 mg (n = 9.077). Während der medianen Nachbeobachtung von 6,0 Jahren betrug die Inzidenz aufeinanderfolgender Erhöhungen der Transaminasenwerte (auf mindestens das Dreifache des oberen Normwertes) 2,5 % in der Ezetimib/Simvastatin-Gruppe und 2,3 % in der Simvastatin-Monotherapie-Gruppe (siehe Abschnitt 4.8).
In einer kontrollierten klinischen Studie, in der mehr als 9.000 Patienten mit chronischer Nierenerkrankung randomisiert entweder einmal täglich 10 mg Ezetimib in Kombination mit 20 mg Simvastatin (n = 4.650) oder Placebo (n = 4.620) erhielten (mediane Nachbeobachtung 4,9 Jahre), betrug die Inzidenz aufeinanderfolgender Erhöhungen der Transaminasenwerte (auf mehr als das Dreifache des oberen Normwertes) 0,7 % unter Ezetimib in Kombination mit Simvastatin und 0,6 % unter Placebo (siehe Abschnitt 4.8).
Skelettmuskulatur
Nach Markteinführung von Ezetimib wurden Fälle von Myopathie und Rhabdomyolyse berichtet. Die meisten Patienten, die eine Rhabdomyolyse entwickelten, nahmen gleichzeitig mit Ezetimib ein Statin ein. Jedoch wurde eine Rhabdomyolyse sehr selten unter Monotherapie mit Ezetimib sowie sehr selten nach Anwendung von Ezetimib als Zusatztherapie zu Arzneimitteln berichtet, die bekanntermaßen mit einem erhöhten Rhabdomyolyserisiko verbunden sind. Bei Verdacht auf eine Myopathie aufgrund muskulärer Symptomatik oder bei Diagnose einer Myopathie durch Erhöhungen der Kreatin-Phosphokinase (CPK) auf mehr als das Zehnfache des oberen Normwertes sollten Ezetimib und die Begleittherapie mit einem Statin und/oder anderen Arzneimitteln, die ein Rhabdomyolyserisiko beinhalten, sofort abgesetzt werden. Alle Patienten, die auf Ezetimib-ratiopharm® eingestellt werden, sollten über das Risiko einer Myopathie aufgeklärt und aufgefordert werden, unklare Muskelschmerzen, -empfindlichkeit oder -schwäche umgehend mitzuteilen (siehe Abschnitt 4.8).
In der IMPROVE-IT-Studie erhielten 18.144 Patienten mit koronarer Herzkrankheit und akutem Koronarsyndrom in der Vorgeschichte randomisiert entweder einmal täglich Ezetimib/Simvastatin 10 mg/40 mg (n = 9.067) oder einmal täglich Simvastatin 40 mg (n = 9.077). Während der medianen Nachbeobachtung von 6,0 Jahren betrug die Inzidenz einer Myopathie 0,2 % in der Ezetimib/Simvastatin-Gruppe und 0,1 % in der Simvastatin-Monotherapie-Gruppe. Myopathie war definiert als Muskelschwäche oder Muskelschmerzen ungeklärter Ursache mit einer Erhöhung des Serumkreatinins auf mindestens das Zehnfache des oberen Normwertes oder zwei aufeinanderfolgende Erhöhungen des Serumkreatinins auf mindestens das Fünf- bis zum Zehnfachen des oberen Normwertes. Die Inzidenz einer Rhabdomyolyse betrug 0,1 % in der Ezetimib/Simvastatin-Gruppe und 0,2 % in der Simvastatin-Monotherapie-Gruppe. Rhabdomyolyse war definiert als Muskelschwäche oder Muskelschmerzen ungeklärter Ursache mit einer Erhöhung des Serumkreatinins auf mindestens das Zehnfache des oberen Normwertes mit Nachweis einer Nierenschädigung, zwei aufeinanderfolgenden Erhöhungen des Serumkreatinins auf mindestens das Fünf- bis zum Zehnfachen des oberen Normwertes mit Nachweis einer Nierenschädigung oder ein Serumkreatininwert von > 10.000 I.E./l ohne Nachweis einer Nierenschädigung (siehe Abschnitt 4.8).
In einer klinischen Studie, in der mehr als 9.000 Patienten mit chronischer Nierenerkrankung randomisiert entweder einmal täglich 10 mg Ezetimib in Kombination mit 20 mg Simvastatin (n = 4.650) oder Placebo (n = 4.620) (mediane Nachbeobachtung 4,9 Jahre) erhielten, betrug die Inzidenz für Myopathie/Rhabdomyolyse 0,2 % unter Ezetimib in Kombination mit Simvastatin bzw. 0,1 % unter Placebo (siehe Abschnitt 4.8).
Eingeschränkte Leberfunktion
Aufgrund fehlender Daten zu Auswirkungen einer erhöhten Exposition mit Ezetimib bei Patienten mit mäßiger oder schwerer Leberinsuffizienz wird Ezetimib für diese Patienten nicht empfohlen (siehe Abschnitt 5.2).
Kinder und Jugendliche
Die Wirksamkeit und Sicherheit von Ezetimib bei Patienten im Alter von 6 bis 10 Jahren mit heterozygoter familiärer oder nicht familiärer Hypercholesterinämie wurden in einer 12-wöchigen kontrollierten klinischen Studie untersucht. Die Auswirkungen von Ezetimib bei einer Behandlungsdauer von > 12 Wochen wurden in dieser Altersklasse nicht untersucht (siehe Abschnitte 4.2, 4.8, 5.1 und 5.2).
Ezetimib wurde bei Patienten unter 6 Jahren nicht untersucht (siehe Abschnitte 4.2 und 4.8).
Die Wirksamkeit und Sicherheit von Ezetimib zusammen mit Simvastatin bei Patienten im Alter von 10 bis 17 Jahren mit heterozygoter familiärer Hypercholesterinämie wurden in einer kontrollierten klinischen Studie mit heranwachsenden Jungen (Tanner-Stadium II oder darüber) und Mädchen (mindestens 1 Jahr nach der Menarche) untersucht.
In dieser begrenzten kontrollierten Studie war im Allgemeinen keine Auswirkung auf Wachstum oder sexuelle Entwicklung bei den heranwachsenden Jungen oder Mädchen erkennbar, auch keine Auswirkung auf die Länge des Menstruationszyklus der Mädchen. Jedoch wurde die Auswirkung von Ezetimib über einen längeren Zeitraum als 33 Wochen auf Wachstum und sexuelle Entwicklung nicht untersucht (siehe Abschnitte 4.2 und 4.8).
Die Sicherheit und Wirksamkeit von Ezetimib in Kombination mit Simvastatin in Dosen über 40 mg pro Tag wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren nicht untersucht.
Die Sicherheit und Wirksamkeit von Ezetimib in Kombination mit Simvastatin wurden bei Kindern unter 10 Jahren nicht untersucht (siehe Abschnitte 4.2 und 4.8).
Die Langzeitwirkung einer Therapie mit Ezetimib bei Patienten unter 17 Jahren auf die Reduktion von Morbidität und Mortalität im Erwachsenenalter wurde nicht untersucht.
Fibrate
Die Sicherheit und Wirksamkeit von Ezetimib bei Gabe zusammen mit Fibraten ist nicht erwiesen. Wenn bei einem Patienten unter Ezetimib und Fenofibrat ein Verdacht auf eine Cholelithiasis besteht, sind Untersuchungen der Gallenblase angezeigt und diese Therapie sollte abgesetzt werden (siehe Abschnitte 4.5 und 4.8).
Ciclosporin
Eine Therapie mit Ezetimib-ratiopharm® ist bei Patienten, die mit Ciclosporin behandelt werden, mit Vorsicht einzuleiten. Bei Patienten, die Ezetimib-ratiopharm® und Ciclosporin erhalten, sollten die Ciclosporin-Konzentrationen überwacht werden (siehe Abschnitt 4.5).
Antikoagulanzien
Bei Gabe von Ezetimib-ratiopharm® zusätzlich zu Warfarin, einem anderen Cumarin-Antikoagulans, oder Fluindion ist die „International Normalized Ratio“ (INR) entsprechend zu überwachen (siehe Abschnitt 4.5).
Sonstiger Bestandteil
Ezetimib-ratiopharm® enthält Lactose. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Ezetimib-ratiopharm® nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
In präklinischen Studien wurde gezeigt, dass Ezetimib die Enzyme des Cytochrom-P450-Metabolismus nicht induziert. Es wurden keine klinisch bedeutsamen pharmakokinetischen Wechselwirkungen zwischen Ezetimib und Arzneimitteln beobachtet, die bekanntermaßen über die Cytochrom-P450-Enzyme 1A2, 2D6, 2C8, 2C9 und 3A4 oder N-Acetyltransferase metabolisiert werden.
In klinischen Wechselwirkungsstudien hatte Ezetimib bei gleichzeitiger Anwendung keinen Einfluss auf die Pharmakokinetik von Dapson, Dextromethorphan, Digoxin, oralen Kontrazeptiva (Ethinylestradiol und Levonorgestrel), Glipizid, Tolbutamid oder Midazolam. Cimetidin hatte bei gleichzeitiger Anwendung mit Ezetimib keinen Einfluss auf die Bioverfügbarkeit von Ezetimib.
Antazida
Die gleichzeitige Anwendung von Antazida verminderte die Resorptionsrate von Ezetimib, beeinflusste aber nicht die Bioverfügbarkeit von Ezetimib. Der verminderten Resorptionsrate wird keine klinische Bedeutung beigemessen.
Colestyramin
Die gleichzeitige Anwendung von Colestyramin verkleinerte die mittlere Fläche unter der Kurve (AUC) von Gesamt-Ezetimib (Ezetimib und glukuronidiertes Ezetimib) um ca. 55 %. Die verstärkte Senkung des LDL-Cholesterins durch Hinzufügen von Ezetimib zu Colestyramin könnte durch diese Wechselwirkung vermindert werden (siehe Abschnitt 4.2).
Fibrate
Bei Patienten unter Fenofibrat und Ezetimib sollte der Arzt das mögliche Risiko einer Cholelithiasis und einer Gallenblasenerkrankung berücksichtigen (siehe Abschnitt 4.4 und 4.8).
Wenn bei einem Patienten unter Ezetimib und Fenofibrat ein Verdacht auf eine Cholelithiasis besteht, sind Untersuchungen der Gallenblase angezeigt und diese Therapie sollte abgesetzt werden (siehe Abschnitt 4.8).
Die gleichzeitige Anwendung von Fenofibrat oder Gemfibrozil erhöhte die Gesamtkonzentration von Ezetimib mäßig (auf das ca. 1,5- bzw. 1,7-Fache).
Die gleichzeitige Anwendung von Ezetimib mit anderen Fibraten wurde nicht untersucht.
Fibrate können die Cholesterinausscheidung über die Galle erhöhen und so zu Cholelithiasis führen. In Tierstudien führte Ezetimib manchmal zu erhöhten Cholesterinwerten in der Galle, jedoch nicht bei allen Tierarten (siehe Abschnitt 5.3). Ein lithogenes Risiko bei der therapeutischen Anwendung von Ezetimib kann nicht ausgeschlossen werden.
Statine
Bei der gleichzeitigen Anwendung von Ezetimib mit Atorvastatin, Simvastatin, Pravastatin, Lovastatin, Fluvastatin oder Rosuvastatin wurden keine klinisch signifikanten pharmakokinetischen Wechselwirkungen festgestellt.
Ciclosporin
In einer Studie mit acht Patienten, die nach einer Nierentransplantation mit einer Kreatinin-Clearance > 50 ml/min stabil auf eine Ciclosporin-Dosis eingestellt waren, war nach Gabe einer Einzeldosis von 10 mg Ezetimib die mittlere AUC von Gesamt-Ezetimib 3,4-fach vergrößert (Bereich von 2,3- bis 7,9-fach), verglichen mit einer gesunden Kontrollpopulation einer anderen Studie (n = 17) unter Ezetimib allein. In einer weiteren Studie wies ein Nierentransplantationspatient mit schwerer Niereninsuffizienz, der Ciclosporin und zahlreiche andere Arzneimittel erhielt, im Vergleich zu den anderen Kontrollpersonen unter Ezetimib allein eine 12-fach größere Gesamt-Ezetimib-Exposition auf. In einer zweiphasigen Crossover-Studie mit 12 gesunden Probanden führte die tägliche Anwendung von 20 mg Ezetimib über 8 Tage mit einer Einzeldosis von 100 mg Ciclosporin an Tag 7 zu einer mittleren 15%igen Vergrößerung der AUC von Ciclosporin (Bereich von 10%iger Verkleinerung bis 51%iger Vergrößerung), verglichen mit einer Einzeldosis von 100 mg Ciclosporin allein. Es wurde keine kontrollierte Studie zum Einfluss von gleichzeitig verabreichtem Ezetimib auf die Ciclosporin-Exposition nach einer Nierentransplantation durchgeführt. Eine Therapie mit Ezetimib ist bei Patienten, die mit Ciclosporin behandelt werden, mit Vorsicht einzuleiten. Bei Patienten, die Ezetimib und Ciclosporin erhalten, sollten die Ciclosporin-Konzentrationen überwacht werden (siehe Abschnitt 4.4).
Antikoagul anzi en
In einer Studie an 12 gesunden erwachsenen Männern hatte die gleichzeitige Anwendung von Ezetimib (10 mg einmal täglich) keine signifikante Wirkung auf die Bioverfügbarkeit von Warfarin und auf die Prothrombinzeit. Nach Markteinführung wurde jedoch über Erhöhungen der INR bei Patienten unter Therapie mit Warfarin oder Fluindion berichtet, die zusätzlich Ezetimib erhielten. Bei zusätzlicher Gabe von Ezetimib zu Warfarin, einem anderen Cumarin-Antikoagulans, oder Fluindion ist die INR entsprechend zu überwachen (siehe Abschnitt 4.4).
Kinder und Jugendliche
Studien zur Erfassung von Wechselwirkungen wurden nur bei Erwachsenen durchgeführt.
4.6 Fertilität, Schwangerschaft und Stillzeit
Ezetimib zusammen mit einem Statin ist während der Schwangerschaft und der Stillzeit kontraindiziert. Informieren Sie sich bitte dazu in der Zusammenfassung der Merkmale (Fachinformation) des betreffenden Statins (siehe Abschnitt 4.3).
Schwangerschaft
Ezetimib darf bei schwangeren Frauen nur angewendet werden, wenn es unbedingt erforderlich ist.
Es liegen keine klinischen Daten zur Anwendung von Ezetimib bei Schwangeren vor. Tierstudien zur Monotherapie mit Ezetimib lassen keine direkt oder indirekt schädlichen Wirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung erkennen (siehe Abschnitt 5.3).
Stillzeit
Ezetimib darf während der Stillzeit nicht angewendet werden. Studien an Ratten haben gezeigt, dass Ezetimib in die Muttermilch übergeht. Es ist nicht bekannt, ob Ezetimib in die menschliche Muttermilch übergeht.
Fertilität
Es liegen keine Daten aus klinischen Studien zu den Auswirkungen von Ezetimib auf die menschliche Fertilität vor. Ezetimib hatte keine Auswirkungen auf die Fertilität von männlichen oder weiblichen Ratten (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Jedoch sollte man beim Führen eines Kraftfahrzeugs oder beim Bedienen von Maschinen beachten, dass über Schwindel berichtet wurde.
4.8 Nebenwirkungen
Tabellarische Übersicht der Nebenwirkungen (klinische Studien und Erfahrungen nach Markteinführung)
In klinischen Studien von bis zu 112 Wochen Dauer wurden 2.396 Patienten mit 10 mg Ezetimib allein, 11.308 Patienten zusammen mit einem Statin und 185 Patienten zusammen mit Fenofibrat behandelt. Nebenwirkungen waren normalerweise leicht ausgeprägt und von vorübergehender Natur. Die Gesamtinzidenz der Nebenwirkungen war jener unter Placebo ähnlich; ebenso war die Abbruchrate aufgrund von Nebenwirkungen unter Ezetimib jener unter Placebo vergleichbar.
Ezetimib allein oder zusammen mit einem Statin:
Folgende Nebenwirkungen wurden bei Patienten unter Ezetimib allein (n = 2.396) häufiger als unter Placebo (n = 1.159) oder bei Patienten unter Ezetimib zusammen mit einem Statin (n = 11.308) häufiger als unter einem Statin allein (n = 9.361) beobachtet. Nebenwirkungen, welche nach Markteinführung berichtet wurden, beziehen sich auf die Anwendung von Ezetimib allein oder zusammen mit einem Statin.
Die Häufigkeit der unten aufgeführten Nebenwirkungen wird wie folgt definiert:
Sehr häufig (> 1/10); häufig (> 1/100, < 1/10); gelegentlich (> 1/1.000, < 1/100); selten (> 1/10.000, < 1/1.000); sehr selten (< 1/10.000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Tabelle 1. Ezetimib-Monotherapie
|
Systemorganklasse |
Nebenwirkungen |
Häufigkeit |
|
Untersuchungen |
Erhöhungen von ALT und/oder AST, CPK-Erhöhungen im Blut; Erhöhung der Gamma-Glutamyltransferase, anomale Leberfunktionswerte |
Gelegentlich |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten |
Gelegentlich |
|
Erkrankungen des Gastrointestinaltrakts |
Bauchschmerzen, Diarrhö, Flatulenz |
Häufig |
|
Dyspepsie, gastroösophageale Refluxkrankheit, Übelkeit |
Gelegentlich | |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Arthralgie, Muskelkrämpfe, Nackenschmerzen |
Gelegentlich |
|
Stoffwechsel- und Ernährungsstörungen |
Verminderter Appetit |
Gelegentlich |
|
Gefäßerkrankungen |
Flush, Hypertonie |
Gelegentlich |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Fatigue |
Häufig |
|
Schmerzen im Brustkorb, Schmerzen |
Gelegentlich |
Tabelle 2. Weitere Nebenwirkungen unter Ezetimib zusammen mit einem Statin
|
Systemorganklasse |
Nebenwirkungen |
Häufigkeit |
|
Untersuchungen |
Erhöhungen der ALT und/oder AST |
Häufig |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Häufig |
|
Parästhesien |
Gelegentlich |
Tabelle 2. Weitere Nebenwirkungen unter Ezetimib zusammen mit einem Statin
|
Systemorganklasse |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Gastrointestinaltrakts |
Trockener Mund, Gastritis |
Gelegentlich |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Pruritus, Ausschlag, Urtikaria |
Gelegentlich |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Myalgie |
Häufig |
|
Rückenschmerzen, Muskelschwäche, Schmerzen in den Extremitäten |
Gelegentlich | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie, peripheres Ödem |
Gelegentlich |
Tabelle 3. Erfahrungen nach Markteinführung (mit oder ohne Statin)
|
Systemorganklasse |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie |
Nicht bekannt |
|
Erkrankungen des Nervensystems |
Schwindel, Parästhesien |
Nicht bekannt |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe |
Nicht bekannt |
|
Erkrankungen des Gastrointestinaltrakts |
Pankreatitis, Obstipation |
Nicht bekannt |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Erythema multiforme |
Nicht bekannt |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen |
Myalgie, Myopathie/Rhabdomyolyse (siehe Abschnitt 4.4) |
Nicht bekannt |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Asthenie |
Nicht bekannt |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Urtikaria, Anaphylaxie und Angioödem |
Nicht bekannt |
|
Leber- und Gallenerkrankungen |
Hepatitis, Cholelithiasis, Cholezystitis |
Nicht bekannt |
|
Psychiatrische Erkrankungen |
Depression |
Nicht bekannt |
Ezetimib zusammen mit Fenofibrat:
Erkrankungen des Gastrointestinaltrakts: Bauchschmerzen (häufig).
In einer multizentrischen, doppelblinden, placebokontrollierten klinischen Studie wurden Patienten mit gemischter Hyperlipidämie untersucht; 625 Patienten wurden bis zu 12 Wochen und 576 Patienten bis zu ein Jahr behandelt. In dieser Studie beendeten 172 Patienten unter Ezetimib und Fenofibrat eine 12-wöchige Therapie, und 230 Patienten unter Ezetimib und Fenofibrat (darunter 109 Patienten, die in den ersten 12 Wochen nur Ezetimib erhalten hatten) beendeten eine 1-jährige Therapie. Die Studie war nicht angelegt, um selten auftretende Ereignisse in den Behandlungsgruppen zu vergleichen. Die Inzidenzen (95%-KI) für klinisch bedeutsame Erhöhungen der Serum-Transaminasen (aufeinanderfolgende Werte von mehr als dem Dreifachen des oberen Normwertes) betrugen nach Adjustierung hinsichtlich der Exposition 4,5 % (1,9; 8,8) unter Monotherapie mit Fenofibrat und 2,7 % (1,2; 5,4) unter Ezetimib zusammen mit Fenofibrat. Die entsprechenden Inzidenzen für eine Cholezystektomie betrugen 0,6 % (0,0; 3,1) unter Monotherapie mit Fenofibrat und 1,7 % (0,6; 4,0) unter Ezetimib zusammen mit Fenofibrat (siehe Abschnitte 4.4 und 4.5).
Kinder und Jugendliche (6-17 Jahre)
In einer Studie mit Kindern (6 bis 10 Jahre) mit heterozygoter familiärer oder nicht familiärer Hypercholesterinämie (n = 138) wurden Erhöhungen von ALT und/oder AST (aufeinanderfolgende Werte von mindestens dem Dreifachen des oberen Normwertes) bei 1,1 % (1 Patient) der Patienten unter Ezetimib im Vergleich zu 0 % der Patienten in der Placebo-Gruppe beobachtet. Es traten keine CPK-Erhöhungen (auf mindestens das Zehnfache des oberen Normwertes) auf. Es wurden keine Fälle von Myopathie berichtet.
In einer weiteren Studie mit heranwachsenden Patienten (10 bis 17 Jahre) mit heterozygoter familiärer Hypercholesterinämie (n = 248) wurden Erhöhungen von ALT und/oder AST (aufeinanderfolgende Werte von mindestens dem Dreifachen des oberen Normwertes) bei 3 % (4 Patienten) der Patienten unter Ezetimib/Simvastatin beobachtet, im Vergleich zu 2 % (2 Patienten) unter Simvastatin-Monotherapie; für CPK-Erhöhungen (auf mindestens das Zehnfache des oberen Normwertes) lagen diese Werte bei 2 % (2 Patienten) bzw. bei 0 %. Es wurden keine Fälle von Myopathie berichtet.
Diese Studien waren nicht zum Vergleich seltener Nebenwirkungen geeignet.
Patienten mit koronarer Herzkrankheit und akutem Koronarsyndrom in der Vorgeschichte In der IMPROVE-IT-Studie (siehe Abschnitt 5.1), in der 18.144 Patienten entweder mit Ezetimib/Simvastatin 10 mg/40 mg (n = 9.067; 6 % der Patienten wurden auf Ezetimib/Simvastatin 10 mg/80 mg hochtitriert) oder Simvastatin 40 mg (n = 9.077; 27 % der Patienten wurden auf Simvastatin 80 mg hochtitriert) behandelt wurden, zeigten sich innerhalb der medianen Nachbeobachtung von 6,0 Jahren bei beiden Behandlungsgruppen ähnliche Sicherheitsprofile. Die Behandlungsabbruchrate aufgrund von Nebenwirkungen betrug 10,6 % bei Patienten unter Ezetimib/Simvastatin und 10,1 % bei Patienten unter Simvastatin. Die Inzidenz einer Myopathie betrug 0,2 % in der Ezetimib/Simvastatin-Gruppe und 0,1 % in der Simvastatin-Monotherapie-Gruppe. Myopathie war definiert als Muskelschwäche oder Muskelschmerzen ungeklärter Ursache mit einer Erhöhung des Serumkreatinins auf mindestens das Zehnfache des oberen Normwertes oder zwei aufeinanderfolgende Erhöhungen des Serumkreatinins auf mindestens das Fünf- bis zum Zehnfachen des oberen Normwertes. Die Inzidenz einer Rhabdomyolyse betrug 0,1 % in der Ezetimib/Simvastatin-Gruppe und 0,2 % in der Simvastatin-Monotherapie-Gruppe. Rhabdomyolyse war definiert als Muskelschwäche oder Muskelschmerzen ungeklärter Ursache mit einer Erhöhung des Serumkreatinins auf mindestens das Zehnfache des oberen Normwertes mit Nachweis einer Nierenschädigung, zwei aufeinanderfolgende Erhöhungen des Serumkreatinins auf mindestens das Fünf- bis zum Zehnfachen des oberen Normwertes mit Nachweis einer Nierenschädigung oder ein Serumkreatinin von > 10.000 I.E./l ohne Nachweis einer Nierenschädigung. Die Inzidenz aufeinanderfolgender Erhöhungen der Transaminasenwerte (auf mindestens das Dreifache des oberen Normwertes) betrug 2,5 % in der Ezetimib/Simvastatin-Gruppe und 2,3 % in der Simvastatin-Monotherapie-Gruppe (siehe Abschnitt 4.4). Nebenwirkungen in Verbindung mit der Gallenblase wurden bei 3,1 % der Patienten unter Ezetimib/Simvastatin im Vergleich zu 3,5 % der Patienten unter Simvastatin berichtet. Die Inzidenz stationärer Einweisungen aufgrund einer Cholezystektomie betrug 1,5 % bei beiden Behandlungsgruppen. Krebserkrankungen (definiert als jegliche neu diagnostizierte maligne Erkrankung) wurden im Verlauf der Studie bei 9,4 % beziehungsweise 9,5 % der Patienten diagnostiziert.
Patienten mit chronischer Nierenerkrankung
In der SHARP-Studie („Study of Heart and Renal Protection“) (siehe Abschnitt 5.1), in der mehr als 9.000 Patienten einmal täglich mit 10 mg Ezetimib in einer Fixkombination mit 20 mg Simvastatin (n = 4.650) oder Placebo (n = 4.620) behandelt wurden, ergaben sich bei einer medianen Nachbeobachtung von 4,9 Jahren zwischen beiden Patientengruppen vergleichbare Sicherheitsprofile. In dieser Studie wurden lediglich schwerwiegende Nebenwirkungen und Behandlungsabbrüche als Folge jeglicher Nebenwirkungen erfasst. Die Abbruchraten aufgrund von Nebenwirkungen waren vergleichbar (10,4 % der Patienten unter Ezetimib in Kombination mit Simvastatin und 9,8 % der Patienten unter Placebo). Die Inzidenz für Myopathie/Rhabdomyolyse betrug bei den mit Ezetimib in Kombination mit Simvastatin behandelten Patienten 0,2 % und 0,1 % in der Placebo-Gruppe. Aufeinanderfolgende Erhöhungen der Transaminasenwerte (auf mehr als das Dreifache des oberen Normwertes) wurden bei 0,7 % der Patienten unter Ezetimib in Kombination mit Simvastatin und bei 0,6 % der Patienten in der Placebo-Gruppe festgestellt. Im Rahmen dieser Studie wurde keine statistisch signifikante Erhöhung der Inzidenz von vorab definierten Nebenwirkungen festgestellt, einschließlich Krebserkrankungen (9,4 % unter Ezetimib in Kombination mit Simvastatin, 9,5 % unter Placebo), Hepatitis, Cholezystektomie oder Komplikationen mit Gallensteinen oder Pankreatitis.
Laborwerte
In kontrollierten klinischen Monotherapie-Studien war die Inzidenz klinisch bedeutsamer Erhöhungen der Serum-Transaminasen (aufeinanderfolgende Erhöhungen der ALT und/oder AST auf mindestens das Dreifache des oberen Normwertes) unter Ezetimib (0,5 %) und Placebo (0,3 %) ähnlich. In Koadministrationsstudien betrug diese Inzidenz 1,3 % bei Patienten, die Ezetimib zusammen mit einem Statin erhielten, und 0,4 % bei Patienten, die nur mit einem Statin behandelt wurden. Diese Erhöhungen waren im Allgemeinen asymptomatisch, standen nicht im Zusammenhang mit einer Cholestase und kehrten nach Absetzen der Therapie oder im Laufe der Behandlung auf den Ausgangswert zurück (siehe Abschnitt 4.4).
In klinischen Studien wurde über CPK-Erhöhungen (auf mehr als das Zehnfache des oberen Normwertes) bei 4 von 1.674 Patienten (0,2 %) unter Ezetimib allein im Vergleich zu 1 von 786 Patienten (0,1 %) unter Placebo sowie bei 1 von 917 Patienten (0,1 %) unter Ezetimib mit einem Statin im Vergleich zu 4 von 929 Patienten (0,4 %) unter einem Statin allein berichtet. Ezetimib war nicht mit einem gegenüber dem jeweiligen Kontrollarm (Placebo oder Statin allein) erhöhten Auftreten einer Myopathie oder Rhabdomyolyse assoziiert (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
In klinischen Studien wurde die Einnahme von 50 mg Ezetimib/Tag bei 15 gesunden Probanden bis zu 14 Tage lang oder die Einnahme von 40 mg Ezetimib/Tag bei 18 Patienten mit primärer Hypercholesterinämie bis zu 56 Tage lang im Allgemeinen gut vertragen. Bei Tieren wurden nach oral gegebenen Einzeldosen von 5.000 mg Ezetimib/kg an Ratten und Mäusen sowie von 3.000 mg Ezetimib/kg an Hunden keine toxischen Effekte beobachtet.
Einige Fälle von Überdosierung mit Ezetimib wurden berichtet; meistens traten keine Nebenwirkungen auf. Die berichteten Nebenwirkungen waren nicht schwerwiegend. Im Fall einer Überdosierung sollten symptomatische und unterstützende Maßnahmen ergriffen werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Mittel, die den Lipidstoffwechsel beeinflussen.
ATC-Code: C10AX09
Wirkmechanismus
Ezetimib gehört einer neuartigen Klasse von lipidsenkenden Stoffen an, die selektiv die intestinale Resorption von Cholesterin und verwandten Phytosterinen hemmen. Ezetimib ist nach oraler Einnahme wirksam; sein Wirkmechanismus unterscheidet sich von dem anderer Klassen cholesterinsenkender Stoffe (z. B. Statine, Anionenaustauscher [Harze], Fibrinsäurederivate und Phytosterine). Auf molekularer Ebene greift Ezetimib am Steroltransporter Niemann-Pick C1-Like 1 (NPC1L1) an, der für die intestinale Aufnahme von Cholesterin und Phytosterinen verantwortlich ist.
Ezetimib lagert sich am Bürstensaum des Dünndarms an und hemmt die Cholesterinresorption, was zu einem verminderten Transport von Cholesterin aus dem Darm in die Leber führt. Statine reduzieren die Cholesterinsynthese in der Leber, und gemeinsam führen diese unterschiedlichen Wirkmechanismen zu einer komplementären Cholesterinsenkung. In einer zweiwöchigen klinischen Studie an 18 Patienten mit Hypercholesterinämie hemmte Ezetimib im Vergleich zu Placebo die intestinale Cholesterinresorption um ca. 54 %.
Pharmakodynamische Wirkungen
Eine Reihe von präklinischen Studien wurde durchgeführt, um die Selektivität von Ezetimib für die Hemmung der Cholesterinresorption zu bestimmen. Ezetimib hemmte die Resorption von radioaktiv markiertem [14C]-Cholesterin ohne Wirkung auf die Resorption von Triglyzeriden, Fettsäuren, Gallensäuren, Progesteron, Ethinylestradiol oder der fettlöslichen Vitamine A und D.
Epidemiologische Studien ergaben einen direkten Zusammenhang zwischen der kardiovaskulären Morbidität und Mortalität und den Gesamtcholesterin- und LDL-Cholesterinwerten sowie einen inversen Zusammenhang mit dem HDL-Cholesterinwert.
Die Gabe von Ezetimib in Kombination mit einem Statin reduziert wirksam das Risiko für kardiovaskuläre Ereignisse bei Patienten mit koronarer Herzkrankheit und akutem Koronarsyndrom in der Vorgeschichte.
Klinische Wirksamkeit und Sicherheit
In kontrollierten klinischen Studien führte Ezetimib bei Patienten mit Hypercholesterinämie entweder als Monotherapie oder zusammen mit einem Statin gegeben zu einer signifikanten Reduktion der Werte von Gesamtcholesterin, LDL-Cholesterin, Apolipoprotein B und Triglyzeriden und erhöhten HDL-Cholesterinwerten.
Primäre Hypercholesterinämie
In einer doppelblinden, placebokontrollierten achtwöchigen Studie wurden 769 Patienten mit Hypercholesterinämie untersucht. Diese Patienten wurden bereits mit einer Statin-Monotherapie behandelt, ohne das Ziel des National Cholesterol Education Program (NCEP) hinsichtlich des LDL-Cholesterinwerts zu erreichen (2,6-4,1 mmol/l [100-160 mg/dl] je nach Ausgangssituation). Sie wurden randomisiert und erhielten entweder 10 mg Ezetimib oder Placebo zusätzlich zu ihrer laufenden Statin-Therapie.
Von den Patienten unter Statin-Therapie, deren Ausgangswert für LDL-Cholesterin bei Studienbeginn den Zielwert nicht erreicht hatte (etwa 82 %), erreichten bis zum Endpunkt der Studie unter Ezetimib signifikant mehr Patienten, die auf eine Behandlung mit Ezetimib randomisiert wurden, den LDL-Cholesterin-Zielwert (72 %) im Vergleich zu den Patienten unter Placebo (19 %). Der Unterschied in der entsprechenden Senkung des LDL-Cholesterins war signifikant (25 % für Ezetimib vs. 4 % für Placebo). Außerdem senkte Ezetimib zusätzlich zu einer laufenden Statin-Therapie im Vergleich zu Placebo signifikant die Werte von Gesamtcholesterin, Apolipoprotein B, Triglyzeriden und erhöhte die HDL-Cholesterinwerte. Ezetimib zusätzlich zu einer Statin-Therapie senkte im Vergleich zum Ausgangswert den Medianwert des C-reaktiven Proteins um 10 %, Placebo um 0 %.
In zwei doppelblinden, randomisierten, Placebokontrollierten 12-wöchigen Studien wurden 1.719 Patienten mit primärer Hypercholesterinämie untersucht. 10 mg Ezetimib senkten signifikant die Werte von Gesamtcholesterin (13 %), LDL-Cholesterin (19 %), Apolipoprotein B (14 %) und Triglyzeriden (8 %) und erhöhten den HDL-Cholesterinwert (3 %) im Vergleich zu Placebo.
Außerdem hatte Ezetimib keinen Einfluss auf die Plasmakonzentrationen der fettlöslichen Vitamine A, D und E, keinen Einfluss auf die Prothrombinzeit, und wie andere lipidsenkende Arzneimittel beeinträchtigte es nicht die Produktion von Kortikosteroiden in der Nebennierenrinde.
In einer multizentrischen, doppelblinden, kontrollierten klinischen Studie (ENHANCE) erhielten 720 Patienten mit heterozygoter familiärer Hypercholesterinämie 2 Jahre lang randomisiert entweder 10 mg Ezetimib in Kombination mit 80 mg Simvastatin (n = 357) oder 80 mg Simvastatin (n = 363). Das primäre Ziel der Studie war, die Wirkung einer Ezetimib/Simvastatin-Kombinationstherapie im
Vergleich zur Simvastatin-Monotherapie auf die Dicke der Intima media (Intima media thickness [IMT]) der A. carotis zu untersuchen. Die Bedeutung dieses Surrogatmarkers für die kardiovaskuläre Morbidität und Mortalität ist noch unklar.
Der primäre Endpunkt, die Änderung der mittleren IMT aller sechs Karotissegmente, unterschied sich in den Ultraschall-B-Messungen nicht signifikant (p = 0,29) zwischen den beiden Behandlungsgruppen. 10 mg Ezetimib in Kombination mit 80 mg Simvastatin begrenzte während der 2-jährigen Studiendauer die IMT-Verdickung auf 0,0111 mm, Simvastatin 80 mg allein auf 0,0058 mm (mittlerer Ausgangswert der IMT der A. carotis entsprach 0,68 mm bzw. 0,69 mm).
10 mg Ezetimib in Kombination mit 80 mg Simvastatin senkte die Werte von LDL-Cholesterin, Gesamtcholesterin, Apolipoprotein B und Triglyzeriden signifikant stärker als 80 mg Simvastatin allein. Die prozentuale Erhöhung des HDL-Cholesterins war in beiden Behandlungsgruppen ähnlich. Die Nebenwirkungen, die unter der Kombination von 10 mg Ezetimib mit 80 mg Simvastatin berichtet wurden, entsprachen dem bekannten Sicherheitsprofil.
Kinder und Jugendliche
In einer multizentrischen, doppelblinden, kontrollierten Studie erhielten 138 Patienten (59 Jungen und 79 Mädchen) zwischen 6 und 10 Jahren (Durchschnittsalter 8,3 Jahre) mit heterozygoter familiärer oder nicht familiärer Hypercholesterinämie (HeFH) und LDL-Cholesterin-Ausgangswerten zwischen 3,74 und 9,92 mmol/l über einen Zeitraum von 12 Wochen randomisiert entweder 10 mg Ezetimib oder Placebo.
Nach 12 Wochen führte Ezetimib im Vergleich zu Placebo zu einer signifikanten Erniedrigung von Gesamtcholesterin (-21 % vs. 0 %), LDL-Cholesterin (-28 % vs. -1 %), Apolipoprotein B (-22 % vs. -1 %) und Non-HDL-Cholesterin (-26 % vs. 0 %). Die Ergebnisse der beiden Behandlungsgruppen waren in Bezug auf Triglyzeride und HDL-Cholesterin ähnlich (-6 % vs. +8 % bzw. +2 % vs. +1 %).
In einer multizentrischen, doppelblinden, kontrollierten Studie wurden 142 Jungen (Tanner-Stadium II und darüber) und 106 Mädchen nach der Menarche im Alter von 10 bis 17 Jahren (Durchschnittsalter 14,2 Jahre) mit heterozygoter familiärer Hypercholesterinämie (HeFH) und LDL-Cholesterin-Ausgangswerten von 4,1 bis 10,4 mmol/l untersucht. Sie erhielten randomisiert 6 Wochen entweder 10 mg Ezetimib mit Simvastatin (10, 20 oder 40 mg) oder Simvastatin allein (10, 20 oder 40 mg), danach 27 Wochen Ezetimib zusammen mit 40 mg Simvastatin oder 40 mg Simvastatin allein sowie im Anschluss daran in einer offenen Studienverlängerung 20 Wochen Ezetimib mit Simvastatin (10 mg, 20 mg oder 40 mg).
Nach 6 Wochen führte die gemeinsame Gabe von Ezetimib und Simvastatin (alle Dosen) zu signifikant niedrigeren Werten von Gesamtcholesterin (38 % vs. 26 %), LDL-Cholesterin (49 % vs.
34 %), Apolipoprotein B (39 % vs. 27 %) und Non-HDL-Cholesterin (47 % vs. 33 %) als Simvastatin (alle Dosen) allein. Die Ergebnisse der Triglyzeridwerte (-17 % vs. -12 %) und HDL-Cholesterin (+7 % vs. +6 %) waren in beiden Behandlungsgruppen ähnlich. Nach 33 Wochen stimmten die Ergebnisse mit den Werten nach 6 Wochen überein, wobei signifikant mehr Patienten unter Ezetimib zusammen mit 40 mg Simvastatin (62 %) das gemeinsame Behandlungsziel des NCEP („National Cholesterol Education Program“) und der AAP („American Academy of Pediatrics“) (< 2,8 mmol/l [110 mg/dl]) für LDL-Cholesterin erreichten als Patienten unter 40 mg Simvastatin (25 %). Nach 53 Wochen, dem Ende der offenen Studienverlängerung, wurden die Wirkungen auf die Lipidwerte beibehalten.
Die Sicherheit und Wirksamkeit von Ezetimib in Kombination mit Simvastatin in Dosen über 40 mg pro Tag wurden bei Kindern und Jugendlichen im Alter von 10 bis 17 Jahren nicht untersucht. Die Sicherheit und Wirksamkeit von Ezetimib in Kombination mit Simvastatin wurden bei Kindern unter 10 Jahren nicht untersucht.
Die Langzeitwirkung der Therapie mit Ezetimib bei Patienten unter 17 Jahren auf die Reduktion von Morbidität und Mortalität im Erwachsenenalter wurde nicht untersucht.
Prävention kardiovaskulärer Ereignisse
Im Rahmen der IMPROVE-IT-Studie, einer multizentrischen, randomisierten, doppelblinden, aktivkontrollierten Studie wurden 18.144 Patienten untersucht, die innerhalb von 10 Tagen nach stationärer Einweisung aufgrund eines akuten Koronarsyndroms (entweder akuter Myokardinfarkt [MI] oder instabile Angina pectoris [UA]) in die Studie eingeschlossen wurden. Bei Vorstellung mit akutem Koronarsyndrom hatten die Patienten, die nicht mit einer lipidsenkenden Therapie vorbehandelt waren, LDL-Cholesterinwerte von < 125 mg/dl (< 3,2 mmol/l) und Patienten, die bereits mit einer lipidsenkenden Therapie vorbehandelt waren, von < 100 mg/dl (< 2,6 mmol/l). Alle Patienten wurden im Verhältnis 1:1 randomisiert entweder Ezetimib/Simvastatin 10 mg/40 mg (n = 9.067) oder Simvastatin 40 mg (n = 9.077) zugeordnet und im Median über 6,0 Jahre nachbeobachtet.
Die Patienten waren im Mittel 63,6 Jahre alt, 76 % waren Männer, 84 % waren kaukasischer Herkunft und 27 % waren Diabetiker. Der durchschnittliche LDL-Cholesterinwert zum Zeitpunkt des Studieneinschlussereignisses lag bei den Patienten unter lipidsenkender Vortherapie (n = 6.390) bei 80 mg/dl (2,1 mmol/l) und bei den Patienten ohne lipidsenkende Vortherapie (n = 11.594) bei 101 mg/dl (2,6 mmol/l). Vor der stationären Aufnahme aufgrund von akutem Koronarsyndrom (Studieneinschlussereignis) erhielten 34 % der Patienten eine Therapie mit einem Statin. Zum Untersuchungszeitpunkt nach einem Jahr lag der durchschnittliche LDL-Cholesterinwert unter fortlaufender Behandlung bei den Patienten in der Ezetimib/Simvastatin-Gruppe bei 53,2 mg/dl (1,4 mmol/l) und in der Simvastatin-Monotherapie-Gruppe bei 69,9 mg/dl (1,8 mmol/l). Bei den Patienten unter fortlaufender Studienmedikation wurden grundsätzlich die Lipidwerte erhoben.
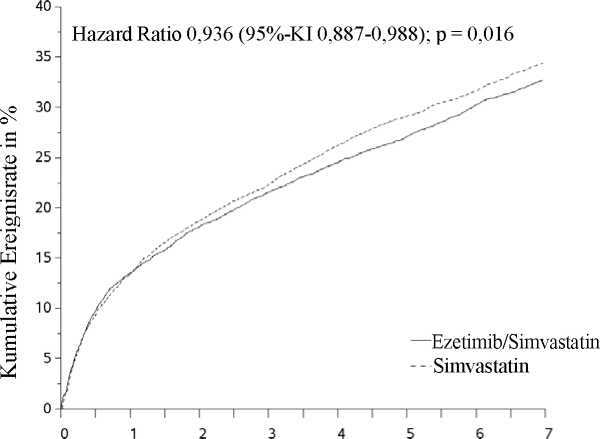
Der primäre Endpunkt war eine Kombination der Ereignisse kardiovaskulärer Tod, schwere (major) koronare Ereignisse (MCE; definiert als nicht tödlicher Myokardinfarkt, nachgewiesene instabile Angina pectoris mit erforderlicher stationärer Einweisung oder jegliche, mindestens 30 Tage nach Randomisierung erfolgte koronare Revaskularisierung) und nicht tödlicher Schlaganfall. Die Studie zeigte, dass eine Behandlung mit Ezetimib als Zusatztherapie zu Simvastatin hinsichtlich der Reduktion von Ereignissen des primären kombinierten Endpunkts aus kardiovaskulärem Tod, MCE sowie nicht tödlichem Schlaganfall im Vergleich zu einer Behandlung mit Simvastatin allein einen zusätzlichen Nutzen aufweist (relative Risikoreduktion um 6,4 %, p = 0,016). Der primäre Endpunkt trat bei 2.572 von 9.067 Patienten (Kaplan-Meier[KM]-Ereignisrate nach 7 Jahren von 32,72 %) in der Ezetimib/Simvastatin-Gruppe und bei 2.742 von 9.077 Patienten (KM-Ereignisrate nach 7 Jahren von 34,67 %) in der Simvastatin-Monotherapie-Gruppe auf (siehe Abbildung 1 und Tabelle 1). Bei gemeinsamer Gabe von Ezetimib und anderen Statinen mit nachgewiesener Risikoreduktion von kardiovaskulären Ereignissen ist ein ähnlicher Nutzen zu erwarten. Die Gesamtsterblichkeit war in dieser Hochrisikogruppe unverändert (siehe Tabelle 4).
Insgesamt ergab sich ein Nutzen bei Betrachtung sämtlicher Schlaganfälle, jedoch wurde ein geringer, nicht signifikanter Anstieg hämorrhagischer Schlaganfälle in der Ezetimib/Simvastatin-Gruppe im Vergleich zur Simvastatin-Monotherapie-Gruppe beobachtet (siehe Tabelle 1). Das Risiko für hämorrhagischen Schlaganfall bei gemeinsamer Anwendung von Ezetimib mit einem stärker wirksamen Statin wurde im Rahmen von langfristigen Endpunktstudien nicht untersucht.
Die Wirkung der Behandlung mit Ezetimib/Simvastatin entsprach in vielen Untergruppen einschließlich Geschlecht, Alter, ethnische Herkunft, Diabetes mellitus in der Vorgeschichte, Ausgangslipidwerte, vorhergehende Statintherapie, vorangegangener Schlaganfall und Bluthochdruck im Allgemeinen den Gesamtergebnissen.
Abbildung 1: Effekt von Ezetimib/Simvastatin auf den primären kombinierten Endpunkt aus kardiovaskulärem Tod, schweren koronaren Ereignissen sowie nicht tödlichem Schlaganfall
1906
1857
7371 6801 6375 5839 4284 3301
7455 6799 6327 5729 4206 3284
Zeit seit Randomisierung (Jahre)
Risikopatienten Ezetimib/Simvastatin out? Simvastatin ; t
Tabelle 4. Schwere kardiovaskuläre Ereignisse nach Behandlungsgruppe bei allen randomisierten Patienten der IMPROVE-IT-Studie
|
Outcome |
Ezetimib/Simvast atin 10 mg/40 mga (n = 9.067) |
Simvastatin 40 mgb (n = 9.077) |
Hazard Ratio (95%-KI) |
p- Wert | ||
|
n |
K-M %c |
n |
K-M %c | |||
|
Primärer kombinierter Wirksamkeitsendpunkt | ||||||
|
(Kardiovaskulärer Tod, schwere koronare Ereignisse und nicht tödlicher Schlaganfall) |
2.572 |
32,72 % |
2.74 2 |
34,67 % |
0,936 (0,887; 0,988) |
0,016 |
|
Sekundäre kombinierte Wirksamkeitsendpunkte | ||||||
|
Tod durch KHK, nicht tödlicher Myokardinfarkt, dringliche koronare Revaskularisierung nach 30 Tagen |
1.322 |
17,52 % |
1.44 8 |
18,88 % |
0,912 (0,847; 0,983) |
0,016 |
|
Schwere koronare Ereignisse, nicht tödlicher Schlaganfall, Tod (jegliche Ursache) |
3.089 |
38,65 % |
3.24 6 |
40,25 % |
0,948 (0,903; 0, 996) |
0,035 |
|
Kardiovaskulärer Tod, nicht tödlicher Myokardinfarkt, instabile Angina pectoris mit erforderlicher stationärer Einweisung, jegliche Revaskularisierung, nicht tödlicher Schlaganfall |
2.716 |
34,49 % |
2.86 9 |
36,20 % |
0,945 (0,897; 0, 996) |
0,035 |
|
Komponenten des primären kombinierten Endpunkts sowie ausgewählte Wirksamkeitsendpunkte (erstmaliges Auftreten eines jeweiligen Ereignisses zu jeglichem Zeitpunkt) | ||||||
|
Kardiovaskulärer Tod |
537 |
6,89 % |
538 |
6,84 % |
1,000 (0,887; 1,127) |
0,997 |
|
Schwere koronare Ereignisse | ||||||
|
Nicht tödlicher Myokardinfarkt |
945 |
12,77 % |
1.083 |
14,41 % |
0,871 (0,798; 0, 950) |
0,002 |
|
Instabile Angina pectoris mit erforderlicher stationärer Einweisung |
156 |
2,06 % |
148 |
1,92 % |
1,059 (0,846; 1,326) |
0,618 |
|
Koronare Revaskularisierung nach 30 Tagen |
1.690 |
21,84 % |
1.793 |
23,36 % |
0,947 (0,886; 1,012) |
0,107 |
|
Nicht tödlicher Schlaganfall |
245 |
3,49 % |
305 |
4,24 % |
0,802 (0,678; 0,949) |
0,010 |
|
Myokardinfarkt (tödlich und nicht tödlich) |
977 |
13,13 % |
1.11 8 |
14,82 % |
0,872 (0,800; 0,950) |
0,002 |
|
Schlaganfall (tödlich und nicht tödlich) |
296 |
4,16 % |
345 |
4,77 % |
0,857 (0,734; 1,001) |
0,052 |
|
Nicht hämorrhagischer Schlaganfalld |
242 |
3,48 % |
305 |
4,23 % |
0,793 (0,670; 0,939) |
0,007 |
|
Hämorrhagischer Schlaganfall |
59 |
0,77 % |
43 |
0,59 % |
1,377 (0,930; 2,040) |
0,110 |
|
Tod jeglicher Ursache |
1.215 |
15,36 % |
1.23 1 |
15,28 % |
0,989 (0,914; 1,070) |
0,782 |
a 6 % wurden auf Ezetimib/Simvastatin 10 mg/80 mg hochtitriert b 27 % wurden auf Simvastatin 80 mg hochtitriert c Kaplan-Meier-Schätzung nach 7 Jahren
d beinhaltet ischämischen Schlaganfall und nicht näher spezifizierten Schlaganfall
Prävention schwerer vaskulärer Ereignisse bei chronischer Nierenerkrankung Die SHARP-Studie (Study of Heart and Renal Protection) war eine multinationale, randomisierte, placebokontrollierte, doppelblinde Studie mit 9.438 Patienten mit chronischer Nierenerkrankung, wobei ein Drittel der Patienten zu Studienbeginn dialysepflichtig war. Insgesamt wurden 4.650 Patienten der Fixkombination 10 mg Ezetimib mit 20 mg Simvastatin und 4.620 Patienten der Placebo-Gruppe zugewiesen und über einen medianen Zeitraum von 4,9 Jahren beobachtet. Die Patienten waren im Mittel 62 Jahre alt, 63 % waren Männer, 72 % waren kaukasischer Abstammung und 23 % waren Diabetiker. Die nicht dialysepflichtigen Patienten hatten eine mittlere geschätzte glomeruläre Filtrationsrate (eGFR) von 26,5 ml/min/1,73 m2. Es gab keine Einschlusskriterien hinsichtlich der Lipidparameter. Zu Studienbeginn betrug die mittlere LDL-Cholesterin-Konzentration 108 mg/dl. Einschließlich der Patienten, die keine Studienmedikation mehr einnahmen, betrug nach einem Jahr Behandlungsdauer die Reduktion des LDL-Cholesterinspiegels relativ zu Placebo 26 % bei alleiniger Gabe von 20 mg Simvastatin und 38 % unter 10 mg Ezetimib in Kombination mit 20 mg Simvastatin.
Der im Studienprotokoll der SHARP-Studie festgelegte primäre Vergleich war eine Intention-to-treat(ITT)-Analyse „schwerer vaskulärer Ereignisse“ („MVE“; definiert als nicht tödlicher Myokardinfarkt [MI] oder Herztod, Schlaganfall oder jegliche Behandlung zur Revaskularisierung) bei ausschließlich den Patienten, die anfänglich in die Studiengruppen unter Ezetimib/Simvastatin (n = 4.193) oder Placebo (n = 4.191) randomisiert wurden. Die Sekundäranalysen schlossen sowohl die Untersuchung des kombinierten Endpunktes (MVE) als auch die darin enthaltenen einzelnen Endpunkte über die gesamte auf Ezetimib/Simvastatin (n = 4.650) oder Placebo (n = 4.620) (zu Studienbeginn oder zum Zeitpunkt nach 1 Jahr) randomisierte Studienpopulation ein.
Die primäre Endpunktanalyse zeigte, dass Ezetimib in Kombination mit Simvastatin das Risiko von schweren vaskulären Ereignissen signifikant mit einer relativen Risikoreduktion von 16 % (p = 0,001)
senkte (749 Patienten mit Ereignissen in der Placebo-Gruppe versus 639 Patienten in der Ezetimib/Simvastatin-Gruppe).
Allerdings ermöglichte das Studiendesign keine Aussage zum Beitrag des Einzelbestandteils Ezetimib zur Wirksamkeit im Sinne einer signifikanten Risikoreduktion von schweren vaskulären Ereignissen bei Patienten mit chronischer Nierenerkrankung.
Die einzelnen Komponenten des MVE-Kombinationsereignisses bei allen randomisierten Patienten sind in Tabelle 5 dargestellt. Ezetimib in Kombination mit Simvastatin reduzierte signifikant das Risiko eines Schlaganfalls und jeglicher Revaskularisierung. Bezüglich nicht tödlichem Myokardinfarkt und Herztod bestand ein nicht signifikanter, numerischer Vorteil von Ezetimib in Kombination mit Simvastatin gegenüber Placebo.
Tabelle 5: Schwere vaskuläre Ereignisse bei allen in der SHARP-Studie randomisierten Patienten aufgeführt nach Behandlungsgruppea
|
Outcome |
10 mg Ezetimib in Kombination mit 20 mg Simvastatin (n = 4.650) |
Placebo |
Relatives Risiko |
n-Wert |
|
(n = 4.620) |
(95%-KI) | |||
|
Schwere vaskuläre Ereignisse (MVE) |
701 (15,1 %) |
814 (17,6 %) |
0,85 (0,77-0,94) |
0,001 |
|
Nicht tödlicher MI |
134 (2,9 %) |
159 (3,4 %) |
0,84 (0,66-1,05) |
0,12 |
|
Herztod |
253 (5,4 %) |
272 (5,9 %) |
0,93 (0,78-1,10) |
0,38 |
|
Jeglicher Schlaganfall |
171 (3,7 %) |
210 (4,5 %) |
0,81 (0,66-0,99) |
0,038 |
|
Nicht hämorrhagischer Schlaganfall |
131 (2,8 %) |
174 (3,8 %) |
0,75 (0,60-0,94) |
0,011 |
|
Hämorrhagischer Schlaganfall |
45 (1,0 %) |
37 (0,8 %) |
1,21 (0,78-1,86) |
0,40 |
|
Jegliche Revaskularisierung |
284 (6,1 %) |
352 (7,6 %) |
0,79 (0,68-0,93) |
0,004 |
|
Schwere (major) atherosklerotische Ereignisse (MAE)b |
526 (11,3 %) |
619 (13,4 %) |
0,83 (0,74-0,94) |
0,002 |
a Intention-to-treat-Analyse aller Patienten, welche in der SHARP-Studie in die Behandlungsarme Ezetimib/Simvastatin oder Placebo randomisiert wurden (initial oder nach einem Jahr) b MAE: definiertes Kombinationsereignis einschließlich nicht tödlicher Myokardinfarkt (MI), koronar bedingter Tod, nicht hämorrhagischer Schlaganfall oder jegliche Revaskularisierung
Die mit Ezetimib in Kombination mit Simvastatin erzielte absolute Senkung von LDL-Cholesterin war bei den Patienten, die zu Anfang der Studie niedrigere LDL-Cholesterinspiegel (< 2,5 mmol/l) hatten oder dialysepflichtig waren, im Vergleich zu den übrigen Patienten geringer. Die Risikoreduktion bei diesen beiden Patientengruppen war entsprechend vermindert.
Homozygote familiäre Hypercholesterinämie (HoFH)
In eine doppelblinde, randomisierte zwölfwöchige Studie wurden 50 Patienten mit klinischer und/oder genotypischer Diagnose einer homozygoten familiären Hypercholesterinämie eingeschlossen, die Atorvastatin oder Simvastatin (40 mg) mit oder ohne begleitende LDL-Apherese erhielten. Ezetimib zusammen mit Atorvastatin (40 oder 80 mg) oder Simvastatin (40 oder 80 mg) senkte die Werte von LDL-Cholesterin signifikant um 15 % im Vergleich zu Dosiserhöhungen der Monotherapie mit Simvastatin oder Atorvastatin von 40 mg auf 80 mg.
Aortenstenose
Die SEAS-Studie (Simvastatin and Ezetimibe for the Treatment of Aortic Stenosis) war eine multizentrische, doppelblinde, placebokontrollierte Studie mit einer medianen Dauer von 4,4 Jahren, an der 1.873 Patienten mit asymptomatischer Aortenstenose (AS) - dokumentiert durch mittels Dopplermessungen ermittelte maximale Fließgeschwindigkeit („Peakflow“) in der Aorta im Bereich von 2,5 bis 4,0 m/s - teilnahmen. Es wurden nur Patienten eingeschlossen, für die keine Statinbehandlung zur Reduktion des Risikos einer atherosklerotischen kardiovaskulären Erkrankung als notwendig erachtet wurde. Die Patienten wurden im Verhältnis 1:1 randomisiert und erhielten entweder Placebo oder eine Kombination aus 10 mg Ezetimib und 40 mg Simvastatin täglich.
Der primäre Endpunkt war eine Kombination schwerer kardiovaskulärer Ereignisse (major cardiovascular events [MCE]) und umfasste kardiovaskulären Tod, chirurgischen Ersatz einer Aortenklappe (aortic valve replacement [AVR]), Herzinsuffizienz (congestive heart failure [CHF]) als Folge einer fortschreitenden AS, nicht tödlicher Myokardinfarkt, Einsetzen eines aorto-koronaren Bypasses (coronary artery bypass grafting [CABG]), perkutane koronare Intervention (percutaneous coronary intervention [PCI]), Krankenhauseinweisung wegen instabiler Angina pectoris und nicht hämorrhagischen Schlaganfall. Die wichtigsten sekundären Endpunkte waren aus Untergruppen der Ereigniskategorien des primären Endpunkts zusammengesetzt.
Im Vergleich zu Placebo führte die Kombination von 10 mg Ezetimib und 40 mg Simvastatin nicht zu einer signifikanten Verringerung des Risikos für MCE. Der primäre Endpunkt trat bei 333 Patienten (35,3 %) in der Ezetimib/Simvastatin-Gruppe und bei 355 Patienten (38,2 %) in der Placebo-Gruppe auf (Hazard Ratio in der Ezetimib/Simvastatin-Gruppe: 0,96; 95%-Konfidenzintervall: 0,83 bis 1,12; p = 0,59). Die Aortenklappe wurde bei 267 Patienten (28,3 %) in der Ezetimib/Simvastatin-Gruppe und bei 278 Patienten (29,9 %) in der Placebo-Gruppe (Hazard Ratio: 1,00; 95%-KI: 0,84 bis 1,18; p = 0,97) ersetzt. Ein ischämisches kardiovaskuläres Ereignis erlitten weniger Patienten in der Ezetimib/Simvastatin-Gruppe (n = 148) als in der Placebo-Gruppe (n = 187) (Hazard Ratio: 0,78; 95%-KI: 0,63 bis 0,97; p = 0,02), hauptsächlich aufgrund der kleineren Anzahl an Patienten, die einen Koronarbypass erhielten.
Es kam in der Ezetimib/Simvastatin-Gruppe häufiger zu Krebsfällen (105 vs. 70, p = 0,01). Die klinische Bedeutung dieser Beobachtung ist unklar, da sich in der größeren SHARP-Studie die Gesamtzahl der Krebsfälle nicht unterschied (438 in der Ezetimib/Simvastatin-Gruppe versus 439 in der Placebo-Gruppe), so dass die Beobachtung aus der SEAS-Studie durch die SHARP-Studie nicht bestätigt werden konnte.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach oraler Gabe wird Ezetimib rasch resorbiert und weitgehend zu einem pharmakologisch aktiven Phenol-Glukuronid (Ezetimib-Glukuronid) konjugiert. Die mittlere Plasmaspitzenkonzentration (Cmax) wird für Ezetimib-Glukuronid nach 1-2 Stunden und für Ezetimib nach 4-12 Stunden erreicht. Die absolute Bioverfügbarkeit von Ezetimib kann nicht bestimmt werden, da die Substanz in wässrigen Lösungen, welche zur Injektion geeignet sind, praktisch unlöslich ist.
Eine gleichzeitige Nahrungsaufnahme (Mahlzeiten mit hohem Fettgehalt oder fettfreie Mahlzeiten) hatte keinen Einfluss auf die orale Bioverfügbarkeit von Ezetimib, wenn es in der Form von Ezetimib 10 mg Tabletten angewendet wurde. Ezetimib-ratiopharm® 10 mg Tabletten kann unabhängig von den Mahlzeiten eingenommen werden.
Verteilung
Ezetimib ist beim Menschen zu 99,7 %, Ezetimib-Glukuronid zu 88-92 % an Plasmaproteine gebunden.
Biotransformation
Ezetimib wird vor allem im Dünndarm und der Leber über Glukuronidkonjugation (eine Phase-II-Reaktion) metabolisiert und anschließend über die Galle ausgeschieden. In allen untersuchten Spezies wurde ein minimaler oxidativer Metabolismus (eine Phase-I-Reaktion) beobachtet. Ezetimib und Ezetimib-Glukuronid sind die hauptsächlichen im Plasma nachgewiesenen Substanzen, wobei Ezetimib ca. 10-20 % und Ezetimib-Glukuronid ca. 80-90 % der Gesamtwirkstoffkonzentration im Plasma ausmachen. Ezetimib und Ezetimib-Glukuronid werden langsam aus dem Plasma mit Hinweisen auf einen signifikanten enterohepatischen Kreislauf eliminiert. Die Halbwertszeit von Ezetimib und Ezetimib-Glukuronid beträgt ca. 22 Stunden.
Elimination
Nach oraler Gabe einer radioaktiv markierten Dosis von 20 mg [14C]-Ezetimib an Probanden finden sich ca. 93 % der gesamten Radioaktivität im Plasma als Gesamt-Ezetimib. Über einen Beobachtungszeitraum von 10 Tagen wurden ca. 78 % der eingenommenen radioaktiven Dosis in den Fäzes und 11 % im Urin wiedergefunden. Nach 48 Stunden war keine Radioaktivität mehr im Plasma nachweisbar.
Spezielle Patientengruppen Kinder und Jugendliche
Die Pharmakokinetik von Ezetimib ist bei Kindern ab 6 Jahren ähnlich wie bei Erwachsenen. Pharmakokinetische Daten für Kinder unter 6 Jahren liegen nicht vor. Klinische Erfahrungen zur Behandlung von Kindern und Jugendlichen umfassen Patienten mit homozygoter familiärer Hypercholesterinämie, heterozygoter familiärer Hypercholesterinämie.
Ältere Patienten
Die Plasmakonzentrationen von Gesamt-Ezetimib sind bei älteren Patienten (ab 65 Jahren) etwa doppelt so hoch wie bei jüngeren Patienten (18-45 Jahre). Die Senkung des LDL-Cholesterinwerts und das Sicherheitsprofil sind jedoch bei älteren und jüngeren mit Ezetimib behandelten Probanden vergleichbar. Deshalb ist keine Dosisanpassung für ältere Patienten erforderlich.
Eingeschränkte Leberfunktion
Nach einer Einzeldosis von 10 mg Ezetimib bei Patienten mit leichter Leberinsuffizienz (Child-Pugh-Score 5 oder 6) war die mittlere AUC für Gesamt-Ezetimib ca. 1,7-mal größer als jene für gesunde Probanden. In einer 14-tägigen Studie mit wiederholter Gabe (10 mg pro Tag) bei Patienten mit mäßiger Leberinsuffizienz (Child-Pugh-Score 7-9) war die mittlere AUC für Gesamt-Ezetimib am 1. und am 14. Tag ca. 4-mal größer als die von gesunden Probanden. Für Patienten mit leichter Leberinsuffizienz ist keine Dosisanpassung erforderlich. Da die Folgen einer erhöhten Exposition mit Gesamt-Ezetimib bei Patienten mit mäßiger oder schwerer Leberinsuffizienz (Child-Pugh-Score > 9) nicht bekannt sind, wird Ezetimib für diese Patienten nicht empfohlen (siehe Abschnitt 4.4).
Eingeschränkte Nierenfunktion
Nach einer Einzeldosis von 10 mg Ezetimib bei Patienten mit schwerer Nierenerkrankung (n = 8; mittlere Kreatinin-Clearance < 30 ml/min/1,73 m2) war die mittlere AUC für Gesamt-Ezetimib im Vergleich zu der bei gesunden Probanden (n = 9) ca. 1,5-mal größer. Diesem Ergebnis wird keine klinische Bedeutung beigemessen. Daher ist keine Dosisanpassung für Patienten mit eingeschränkter Nierenfunktion erforderlich.
Ein zusätzlicher Patient in dieser Studie (nach Nierentransplantation unter multipler Arzneimitteltherapie, u. a. Ciclosporin) hatte eine 12-fach höhere Exposition mit Gesamt-Ezetimib.
Geschlecht
Die Plasmakonzentrationen von Gesamt-Ezetimib sind bei Frauen etwas höher (ca. 20 %) als bei Männern. Unter Therapie mit Ezetimib sind sowohl die Senkung des LDL-Cholesterinwerts als auch das Sicherheitsprofil bei Männern und Frauen vergleichbar. Daher ist keine geschlechtsabhängige Dosisanpassung erforderlich.
5.3 Präklinische Daten zur Sicherheit
In Tierstudien zur chronischen Toxizität von Ezetimib wurden keine Zielorgane für toxische Wirkungen identifiziert. Bei Hunden war nach 4-wöchiger Behandlung mit Ezetimib (> 0,03 mg/kg/Tag) die Cholesterinkonzentration in der Blasengalle um das 2,5- bis 3,5-Fache erhöht. In einer Studie an Hunden über ein Jahr wurde bei Dosen bis zu 300 mg/kg/Tag jedoch keine erhöhte Inzidenz von Cholelithiasis oder anderen hepatobiliären Effekten beobachtet. Die Bedeutung dieser Daten für den Menschen ist nicht bekannt. Ein lithogenes Risiko bei der therapeutischen Anwendung von Ezetimib kann nicht ausgeschlossen werden.
In Koadministrationsstudien mit Ezetimib und Statinen wurden im Wesentlichen toxische Effekte beobachtet, die für die Behandlung mit Statinen typisch sind. Manche toxischen Effekte waren stärker ausgeprägt als bei Monotherapie mit Statinen. Dieses wird auf pharmakokinetische und pharmakodynamische Interaktionen bei Koadministrationsbehandlung zurückgeführt. Derartige Interaktionen traten in den klinischen Studien nicht auf. Myopathien traten bei Ratten nur bei Exposition mit Dosen auf, die um ein Vielfaches über der humantherapeutischen Dosis lagen (ca. 20-facher AUC-Level für Statine und 500- bis 2.000-facher AUC-Level für die aktiven Metaboliten).
In einer Reihe von In-vivo- und In-vitro-Assays zeigte Ezetimib allein oder zusammen mit Statinen kein genotoxisches Potenzial. Langzeitstudien zum kanzerogenen Potential von Ezetimib verliefen negativ.
Ezetimib hatte weder einen Einfluss auf die Fertilität von männlichen oder weiblichen Ratten, noch erwies es sich bei Ratten und Kaninchen als teratogen, auch beeinflusste es nicht die prä- oder postnatale Entwicklung. Ezetimib war bei trächtigen Ratten und Kaninchen unter multiplen Dosen von
1.000 mg/kg/Tag plazentagängig. Die gleichzeitige Gabe von Ezetimib und Statinen war bei Ratten nicht teratogen. Bei trächtigen Kaninchen wurde eine geringe Anzahl von Skelettmissbildungen (Blockwirbelbildung an Brust- und Schwanzwirbeln, verminderte Anzahl an Schwanzwirbeln) beobachtet. Die Koadministration von Ezetimib mit Lovastatin führte zu embryoletalen Effekten.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat Vorverkleisterte Stärke (Mais) Mikrokristalline Cellulose (PH 101) Croscarmellose-Natrium (Typ A)
Povidon K 30 Natriumdodecylsulfat Hochdisperses Siliciumdioxid Stearinsäure Poloxamer 407
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Ezetimib-ratiopharm® 10 mg Tabletten sind in PVC/ACLAR/PVC-Aluminium-Blisterpackungen zu 14, 28, 28 x 1, 30, 30 x 1, 50, 90, 90 x 1, 98, 98 x 1,100, 105 oder 120 Tabletten oder in HDPE-Flaschen mit kindergesichertem Polypropylen Verschluss mit interner Versiegelung zur Induktionsversiegelung und einem Behälter mit Trocknungsmittel aus Kieselgel zu 100 oder 105 Tabletten verpackt.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
ratiopharm GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER(N)
94070.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 2. September 2016
10. STAND DER INFORMATION
September 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
20