Faktor Viii Sdh Intersero 1000
Fachinformation
Faktor VIII SDH Intersero
1. Bezeichnung der Arzneimittel Faktor VIII SDH Intersero 250 Faktor VIII SDH Intersero 500 Faktor VIII SDH Intersero 1000
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung Aus Plasma vom Menschen gewonnener Blutgerinnungsfaktor VIII
2. Qualitative und quantitative Zusammensetzung
Eine Durchstechflasche enthält nominell 250, 500 bzw. 1000 I.E. aus Plasma vom Menschen gewonnenen Blutgerinnungsfaktor VIII. Faktor VIII SDH Intersero 250 bzw. Faktor VIII SDH Intersero 500 enthält nach Lösen des Pulvers in 5 ml bzw. 10 ml Wasser für Injektionszwecke ca. 50 I.E./ml Blutgerinnungsfaktor VIII vom Menschen. Faktor VIII SDH Intersero 1000 enthält nach Lösen des Pulvers in 10 ml Wasser für Injektionszwecke ca. 100 I.E./ml Blutgerinnungsfaktor VIII vom Menschen. Zur Bestimmung der Stärke (I.E.) wird der chromogene Faktor VIII-Gerinnungstest gemäß Europäischem Arzneibuch verwendet; die spezifische Aktivität von Faktor VIII SDH Intersero 250, 500 bzw. 1000 beträgt ca. 100 I.E./mg Protein. Hergestellt aus Plasma menschlicher Spender. Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Pulver und Lösungsmittel zur Herstellung einer Injektionslösung. Weißes Pulver und klares, farbloses Lösungsmittel zur Herstellung einer Injektionslösung.
4. Klinische Angaben
4.1 Anwendungsgebiete
Prophylaxe und Therapie von Blutungen bei
- Hämophilie A (angeborenem Faktor VIII-Mangel)
- Erworbenem Faktor VIII-Mangel.
Behandlung von Patienten mit Faktor VIII-Inhibitor.
Dieses Produkt enthält den von Willebrand-Faktor nicht in pharmakologisch wirksamer Menge und ist daher nicht für die Behandlung der von Willebrand-Krankheit indiziert.
4.2 Dosierung und Art der Anwendung
Die Behandlung sollte unter Überwachung eines Arztes erfolgen, der mit der Therapie von Hämophilie A vertraut ist.
Dosierung
Die Dosierung und Dauer der Substitutionstherapie sind abhängig von der Schwere des Faktor VIII-Mangels sowie von Lokalisation und Ausmaß der Blutung und vom klinischen Zustand des Patienten. Die verabreichten Faktor VIII-Einheiten werden in Internationalen Einheiten (I.E.) angegeben, abgeleitet vom aktuellen WHO-Standard für Faktor VIII-Produkte. Die Faktor VIII-Aktivität im Plasma wird entweder als Prozentsatz (bezogen auf normales Humanplasma) oder in Internationalen Einheiten (bezogen auf den Internationalen Standard für Faktor VIII im Plasma) angegeben. Eine Internationale Einheit (I.E.) Faktor VIII-Aktivität entspricht der Menge an Faktor VIII in einem Milliliter normalen menschlichen Plasmas.
Die Berechnung der erforderlichen Faktor VIII-Dosierung basiert auf dem empirischen Befund, dass die Gabe von 1 Internationalen Einheit (I.E.) Faktor VIII pro kg Körpergewicht die Faktor VIII-Aktivität im Plasma um 1% - 2% - bezogen auf den Normalwert - anhebt. Die benötigte Dosierung wird mit folgender Formel berechnet: Benötigte Einheiten = Körpergewicht (kg) x gewünschter Faktor VIII-Anstieg (%) x 0,5
Die Dosis und die Häufigkeit der Verabreichung sollten sich immer an der klinischen Wirksamkeit im Einzelfall orientieren. Im Fall der aufgeführten Blutungsereignisse sollte die Faktor VIII-Aktivität im entsprechenden Zeitraum nicht unter das angegebene Niveau (in % der Norm) fallen. Die folgende Tabelle kann als Richtlinie für die Dosierung bei Blutungsereignissen und chirurgischen Eingriffen dienen:
|
Schwere der Blutung/ Art des chirurgischen Eingriffs |
Benötigter Faktor VIII-Plasmaspiegel (%) |
Häufigkeit der Dosierung (Stunden)/Behandlungsdauer (Tage)_ |
|
Blutungen: | ||
|
Gelenkblutungen im Frühstadium, Muskelblutungen, Blutungen im Mundbereich |
20 - 40 |
Injektion alle 12 bis 24 Stunden; mindestens 1 Tag, bis die (durch Schmerzen erkennbare) Blutung sistiert bzw. Wundheilung erreicht ist. |
|
Ausgeprägtere Gelenkblutungen, Muskelblutungen oder Hämatome |
30 - 60 |
Injektion alle 12 bis 24 Stunden für 3 bis 4 Tage oder länger wiederholen, bis die Schmerzen und akute Behinderungen beseitigt sind. |
|
Lebensbedrohliche Blutungen |
60 - 100 |
Injektion alle 8 bis 24 Stunden wiederholen, bis die Gefahr vorüber ist. |
|
Chirurgische Eingriffe | ||
|
Kleinere Eingriffe einschließlich Zahnextraktionen |
30 - 60 |
Injektion alle 24 Stunden; mindestens 1 Tag, bis die Wundheilung erreicht ist. |
|
Größere Eingriffe (prä- und post-operativ) |
80 - 100 |
Injektion alle 8 bis 24 Stunden wiederholen, bis ausreichende Wundheilung erreicht ist; dann für mindestens weitere 7 Tage einen Faktor VIII-Spiegel von 30 % bis 60 % aufrechterhalten. |
Prophylaxe
Zur Langzeitprophylaxe von Blutungen bei Patienten mit schwerer Hämophilie A sollte die reguläre Dosis 20 bis 40 I.E. Faktor VIII pro kg Körpergewicht im Abstand von 2 - 3 Tagen betragen. In manchen Fällen, besonders bei jüngeren Patienten, können kürzere Dosierungsabstände oder höhere Dosen erforderlich sein.
Während des Behandlungsverlaufs wird, zur Steuerung der zu verabreichenden Dosis und der Häufigkeit der Injektionen, eine angemessene Bestimmung der Faktor VIII-Plasmaspiegel angeraten. Besonders bei größeren chirurgischen Eingriffen ist eine genaue Überwachung der Substitutionstherapie durch Bestimmung des Blutgerinnungsstatus (Faktor VIII-Aktivität) unerlässlich. Einzelne Patienten können sich in ihrer Reaktion auf Faktor VIII unterscheiden, verschiedene in vivo-Wiederfindungsraten erreichen und unterschiedliche Halbwertszeiten aufweisen. Patienten sollten regelmäßig auf die Bildung von Hemmkörpern gegen Faktor VIII überwacht werden. Falls die erwarteten Faktor VIII-Aktivitäten im Plasma nicht erreicht werden oder die Blutung mit einer angemessenen Dosis nicht beherrscht wird, muss ein Hemmkörpertest durchgeführt werden. Bei einem Hemmkörpertiter von weniger als 10 BE/ml kann durch die Verabreichung von zusätzlichem Blutgerinnungsfaktor VIII vom Menschen die Blutung gestillt werden. Bei Patienten mit Hemmkörpertitern über 10 BE oder mit hoher anamnestischer Immunantwort auf Faktor VIII muss die Anwendung von aktiviertem Prothrombinkomplexkonzentrat (aPPSB) oder aktiviertem Faktor VII (FVIIa) in Betracht gezogen werden. Diese Patienten sollten nur unter Aufsicht eines Arztes behandelt werden, der Erfahrung mit der Behandlung von Hämophiliepatienten mit Faktor VIII-Inhibitoren hat. Siehe auch Abschnitt 4.4.
Nicht vorbehandelte Patienten Es liegen keine Daten vor.
Kinder und Jugendliche
Es liegen ungenügende Erfahrungen über die Behandlung von Kindern unter 6 Jahren vor.
Art der Anwendung
Das Produkt wird intravenös verabreicht. Es wird empfohlen, die maximale Infusionsrate von Faktor VIII SDH Intersero (2 - 3 ml/min.) nicht zu überschreiten. Hinweise zur Rekonstitution des Arzneimittels vor der Anwendung, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1. genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Überempfindlichkeit
Wie bei jedem intravenös zu verabreichenden proteinhaltigen Produkt sind allergische Überempfindlichkeitsreaktionen möglich. Das Produkt enthält Spuren anderer humaner Proteine außer Faktor VIII. Die Patienten sind darüber zu informieren, dass die Behandlung sofort abgebrochen und ein Arzt konsultiert werden muss, wenn Symptome einer Überempfindlichkeitsreaktion auftreten. Patienten sollen über das mögliche Auftreten von frühen Zeichen einer Überempfindlichkeitsreaktion, wie z. B. Ausschlag, generalisierte Urtikaria, Brustenge, Stridor, Hypotonie und Anaphylaxis informiert werden. Beim Auftreten eines Schocks ist die medizinische Standardtherapie bei Schock durchzuführen.
Hemmkörper (Inhibitoren)
Die Bildung von neutralisierenden Antikörpern (Hemmkörpern) gegen Faktor VIII ist eine bekannte Komplikation der Hämophilie A-Therapie. Diese Hemmkörper sind üblicherweise IgG-Immunglobuline, die die gerinnungsfördernde Aktivität des Faktor VIII beeinträchtigen. Sie werden mit einem modifizierten Testverfahren bestimmt und in Bethesda-Einheiten (BE) pro Mililiter Plasma angegeben. Das Risiko der Bildung von Hemmkörpern korreliert mit der Exposition gegenüber Faktor VIII und ist innerhalb der ersten 20 Expositionstage am höchsten. Die Bildung von Hemmkörpern nach den ersten 100 Expositionstagen ist selten.
Fälle rezidivierender Hemmkörper (niedriger Titer) wurden nach Wechsel von einem Faktor VIII-Präparat auf ein anderes bei vorbehandelten Patienten mit mehr als 100 Expositionstagen, die zuvor Hemmkörper gebildet hatten, beobachtet. Daher wird empfohlen, nach einem Präparate-Wechsel alle Patienten sorgfältig auf das Auftreten von Hemmkörpern zu überwachen.
Allgemein sollten alle mit humanem Blutgerinnungsfaktor VIII-Präparaten behandelten Patienten mittels geeigneter klinischer Untersuchungen und Labortests sorgfältig auf die Bildung von Hemmkörpern überwacht werden. Falls die erwarteten Faktor VIII-Aktivitäten im Plasma nicht erreicht werden oder die Blutung mit einer angemessenen Dosis nicht beherrscht wird, muss ein Hemmkörpertest durchgeführt werden. Bei Patienten mit hohen Hemmkörperspiegeln ist die Faktor VIII-Therapie möglicherweise nicht wirksam und es sollten therapeutische Alternativen in Erwägung gezogen werden. Diese Patienten sollten nur unter Aufsicht eines Arztes behandelt werden, der Erfahrung mit der Behandlung von Hämophilie-Patienten mit Faktor VIII-Inhibitoren hat.
Katheter-bedingte Komplikationen
Bei Patienten, die einen zentralen Venenkatheter benötigen, ist das Risiko für Katheter-bedingte Komplikationen zu berücksichtigen. Dazu gehören lokale Infektionen, Bakteriämie und Thrombosen im Bereich des Katheters.
Übertragbare Infektionserreger
Standardmaßnahmen zur Verhütung von Infektionen durch die Verabreichung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, sind Spenderauswahl, Testung einzelner Spenden und von Plasmapools auf spezifische Infektionsmarker und Einführung effektiver Herstellungsschritte zur Inaktivie-rung/Eliminierung von Viren. Dennoch kann bei Verabreichung von Arzneimitteln, die aus menschlichem Blut oder Plasma hergestellt wurden, die Möglichkeit der Übertragung von Erregern nicht völlig ausgeschlossen werden. Dies trifft auch für bisher unbekannte oder neu auftretende Viren und andere Erreger zu. Die ergriffenen Maßnahmen werden als wirksam gegen umhüllte Viren wie Human-Immunodeficiency-Virus (HIV), Hepatitis B-Virus (HBV) und Hepatitis C-Virus (HCV) sowie gegen das nicht umhüllte Hepatitis A-Virus (HAV) angesehen. Die ergriffenen Maßnahmen sind möglicherweise bei nicht umhüllten Viren wie Parvovirus B19 von begrenztem Wert. Eine Parvovirus B19-Infektion kann schwere Erscheinungen bei schwangeren Frauen (fetale Infektion) und Patienten mit einer Immunschwäche oder verstärkter Erythropoese (z. B. bei hämolytischer Anämie) hervorrufen. Bei Patienten, die regelmä-ßig/wiederholt aus Plasma vom Menschen gewonnene Faktor VIII-Präparate erhalten, sollten entsprechende Impfungen (Hepatitis A und B) vorgesehen werden. Es wird dringend empfohlen, bei jeder Behandlung mit Faktor VIII SDH Intersero 250, 500 bzw. 1000 den Namen und die Chargenbezeichnung des Präparats zu dokumentieren, um auf diese Weise eine Verbindung zwischen Patient und Produktcharge herzustellen.
Natriumgehalt
Eine Durchstechflasche enthält bis zu 1,4 mmol (32,2 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter Natrium-kontrollierter (natriumar-mer/kochsalzarmer) Diät.
Kinder und Jugendliche
Die für Erwachsene beschriebenen besonderen Warnhinweise und Vorsichtsmaßnahmen für die Anwendung sind auch bei Kindern und Jugendlichen zu beachten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Es wurden keine Studien zu Erfassung von Wechselwirkungen durchgeführt.
Es wurden keine Wechselwirkungen zwischen Präparaten mit Blutgerinnungsfaktor VIII vom Menschen und anderen Arzneimitteln beschrieben.
4.6 Fertilität, Schwangerschaft und Stillzeit Fertilität
Es liegen keine Daten zur Fertilität vor.
Schwangerschaft und Stillzeit
Reproduktionsstudien bei Tieren wurden mit Faktor VIII SDH Intersero nicht durchgeführt. Aufgrund des seltenen Auftretens von Hämophilie A bei Frauen liegen über die Anwendung von Faktor VIII SDH Intersero während der Schwangerschaft und Stillzeit keine Erfahrungen vor. Faktor VIII SDH Intersero sollte daher nur bei eindeutiger Indikationsstellung angewandt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Faktor VIII SDH Intersero hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen Zusammenfassung des Sicherheitsprofils
Überempfindlichkeit oder allergische Reaktionen (wie z. B. Quincke-Ödem, Brennen und Stechen an der Injektionsstelle, Schüttelfrost, Hautrötungen, generalisierte Urtikaria, Kopfschmerz, Ausschlag, Hypotonie, Lethargie, Übelkeit, nervöse Unruhe, Tachykardie, Brustenge, Kribbeln, Erbrechen, Stridor) wurden selten beobachtet. Diese können in manchen Fällen zu schwerer Anaphylaxie (einschließlich Schock) führen. Patienten mit Hämophilie A können neutralisierende Antikörper (Hemmkörper) gegen Faktor VIII entwickeln. Diese Situation manifestiert sich in unzureichender klinischer Wirksamkeit. Es wird empfohlen, in einem solchen Fall ein spezialisiertes Hämophilie-Zentrum zu kontaktieren.
Für Informationen über die Sicherheit in Hinblick auf übertragbare Erreger siehe Abschnitt 4.4.
Tabellarische Auflistung der Nebenwirkungen
Die unten dargestellte Tabelle entspricht der MedDRA-Systemorganklassen-Klassifikation.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt: sehr häufig: >1/10; häufig: >1/100 und <1/10; gelegentlich: >1/1.000 und <1/100; selten: >1/10.000 und <1/1.000; sehr selten: <1/10.000 einschließlich Einzelfälle.
|
Systemorganklassen gemäß MedDRA-Datenbank |
Nebenwirkungen |
Häufigkeit |
|
Erkrankungen des Nervensystems |
Hirnblutungen |
Sehr selten |
|
Erkrankungen des Blutes und des Lymphsystems |
Anämie |
Sehr selten |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Exanthem, Urtikaria, Erythem |
Sehr selten |
|
Untersuchungen |
Anti-Faktor VIII-Antikörper positiv |
Sehr selten |
Im Zusammenhang mit der Verabreichung von Faktor VIII SDH Intersero 250, 500 und 1000 wurden im Rahmen von klinischen Studien, Anwendungsbeobachtungen, Spontanmeldungen und routinemäßigen Literaturrecherchen folgende Nebenwirkungshäufigkeiten berichtet: __
Beschreibung ausgewählter Nebenwirkungen Überempfindlichkeit
Bei Patienten, die mit Faktor VIII-haltigen Präparaten behandelt wurden, wurden Überempfindlichkeits- oder anaphylaktische Reaktionen beschrieben (mit beispielsweise Angioödem, Schüttelfrost, Flushing, Urtikaria, Kopfschmerzen, Hypotonie, Schmerzen an der Injektionsstelle, Lethargie, Übelkeit, Pruritus, Hautausschlag, Ruhelosigkeit, Tachykardie, Beschwerden im Brustkorb, Parästhesien, Fieber, Erbrechen, pfeifender Atem). In einigen Fällen entwickelten sich aus diesen Reaktionen schwere anaphylaktische Reaktionen (wie anaphylaktischer Schock).
Faktor VIII-Hemmung
Patienten mit Hämophilie A können neutralisierende Antikörper (Hemmkörper) gegen Faktor VIII-haltige Präparate entwickeln. Diese Situation manifestiert sich in unzureichender klinischer Wirksamkeit (z.B. Blutungen). Es wird empfohlen, in einem solchen Fall ein spezialisiertes Hämophilie-Zentrum zu kontaktieren. Das Auftreten von hemmenden Antikörpern ist eine bekannte Komplikation der Behandlung von Personen mit Hämophilie A.
Kinder und Jugendliche
Es wird erwartet, dass Häufigkeit, Art und Schweregrad von Nebenwirkungen bei Kindern und Jugendlichen denen bei Erwachsenen entsprechen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Str. 51-59, 63225 Langen, Tel: 06103 770, Fax: 06103 771234, Internetseite www.pei.de, anzuzeigen.
4.9 Überdosierung
Es wurden keine Fälle von Überdosierung berichtet.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihämorrhagika: Blutgerinnungsfaktor VIII ATC-Code: B02BD02.
Der Faktor VIII/von Willebrand-Faktor(vWF)-Komplex besteht aus zwei Molekülen (Faktor VIII und von Willebrand-Faktor) mit unterschiedlichen physiologischen Funktionen. Wird einem Hämophilie A-Patienten Faktor VIII injiziert, so bindet dieser im Blutkreislauf an den von Willebrand-Faktor. Der aktivierte Faktor VIII wirkt als Kofaktor für den aktivierten Faktor IX und beschleunigt die Bildung von aktiviertem Faktor X (Faktor Xa) aus Faktor X. Faktor Xa aktiviert Prothrombin zu Thrombin. Dieses setzt dann aus Fibrinogen Fibrin frei und die Gerinnselbildung kann erfolgen. Hämophilie A ist eine geschlechtsgebundene erbliche Störung der Blutgerinnung aufgrund erniedrigter Faktor VIII-Plasmaspiegel. Dies führt entweder spontan oder in Folge unfallbedingter oder chirurgischer Traumata zu starken Blutungen in Gelenken, Muskeln oder inneren Organen. Durch die Substitutionstherapie werden die Faktor VIII-Plasmaspiegel erhöht, wodurch eine temporäre Korrektur des Faktor VIII-Mangels ermöglicht und die Blutungstendenz korrigiert wird. Zusätzlich zur Rolle des Faktor VIII-schützenden Proteins vermittelt der von Willebrand- Faktor das Haften der Thrombozyten bei Gefäßverletzungen und spielt eine Rolle bei der Thrombozytenaggregation.
5.2 Pharmakokinetische Eigenschaften
Nach intravenöser Gabe nimmt die Faktor VIII-Aktivität exponentiell biphasisch ab. In der Initialphase vollzieht sich die Verteilung zwischen dem intravaskulären Raum und den übrigen Verteilungsräumen (Körperflüssigkeiten) mit einer Plasma-Halbwertszeit von 1 bis 8 Stunden. In der nachfolgenden Phase liegt die Halbwertszeit zwischen 5 und 18 Stunden, mit einem Mittel von ca. 12 Stunden. Dies entspricht offenbar der physiologischen Halbwertszeit. Die ,,incremental recovery" von Faktor VIII SDH Intersero beträgt ca. 0,020 ± 0,003 [I.E./ml]/[I.E./kg KG]. Nach intravenöser Gabe von 1 I.E. Faktor VIII pro kg KG beträgt die Faktor VIII-Aktivität ca. 2 %. Weitere pharmakokinetische Parameter für Faktor VIII SDH Intersero sind:
- Fläche unter der Kurve (area under the curve, AUC): ca. 17 I.E.-h/ml.
- Mittlere Verweildauer (mean residence time, MRT): ca. 15 h.
- Clearance: ca. 155 ml/h.
5.3 Präklinische Daten zur Sicherheit
Blutgerinnungsfaktor VIII vom Menschen (aus dem Konzentrat) ist ein normaler Bestandteil des menschlichen Plasmas und unterscheidet sich in seinen Wirkungen nicht von dem endogenen Faktor VIII. Prüfungen der Toxizität bei einmaliger Verabreichung sind nicht aussagefähig, da höhere Dosen bei den Tieren zu einer Volumenüberlastung führen. Toxizitätsprüfungen mit wiederholter Verabreichung sind im
Tierversuch aufgrund der Antikörperbildung gegen heterologes Protein nicht durchführbar.
Auch das Mehrfache der für den Menschen pro Kilogramm Körpergewicht empfohlenen Dosis zeigt bei Labortieren keine toxischen Wirkungen. Da es im Zusammenhang mit der klinischen Anwendung von Blutgerinnungsfaktor VIII vom Menschen bisher keine Hinweise auf kanzerogene und mutagene Wirkungen gibt, werden entsprechende Tierversuche nicht als erforderlich angesehen.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Pulver: Glycin, Natriumchlorid, Natriumcitrat, Calciumchlorid Lösungsmittel: Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, darf Faktor VIII SDH Intersero nicht mit anderen Arzneimitteln gemischt werden. Es sollte nur das beigefügte Infusionsbesteck verwendet werden, da ein Therapieversagen aufgrund der Adsorption von Faktor VIII an den Innenflächen einiger anderer Infusionsbestecke auftreten kann.
6.3 Dauer der Haltbarkeit 2 Jahre
Das Präparat soll nach dem ersten Öffnen sofort verabreicht werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25° C lagern. Nicht einfrieren. Durchstechflaschen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
1 Packungseinheit Faktor VIII SDH Intersero 250, 500 bzw. 1000 enthält:
1 Durchstechflasche mit Pulver (20 ml) Glastyp I gemäß Ph.Eur. Gefriertrocknungsstopfen aus Halobutyl-Kautschuk Typ I gemäß Ph.Eur.
1 Durchstechflasche mit Lösungsmittel (5 ml, 10 ml) Glastyp I gemäß Ph.Eur. Injektionsstopfen aus Halobutyl-Kautschuk Typ I gemäß Ph.Eur.
Die Packung enthält zusätzlich:
1 Einmalspritze (5 ml, 10 ml), 1 Transfersystem, 2 Alkoholtupfer, 1 Pflaster, 1 Venenpunktionsbesteck.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Das rekonstituierte Arzneimittel muss vor der Verabreichung visuell auf Partikel und Verfärbung überprüft werden. Die Lösung muss klar oder leicht opaleszent sein. Verabreichen Sie keine Lösungen, die trüb (wolkig) sind oder Ablagerungen enthalten. Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den geltenden Vorschriften zu beseitigen.
Hinweise für die Anwendung und Handhabung:
Lösen des Pulvers:
- Lösungsmittel (Wasser für Injektionszwecke) und Pulver in den ungeöffneten Flaschen auf Zimmertemperatur erwärmen. Wird zum Erwärmen ein Wasserbad benutzt, muss sorgfältig darauf geachtet werden, dass das Wasser nicht mit den Kappen oder Stopfen der Durchstechflaschen in Berührung kommt. Ansonsten kann es zur Kontamination des Arzneimittels kommen.
- Kappe von der Pulverflasche und der Flasche mit Wasser entfernen, um den zentralen Teil des Gummistopfens freizulegen.
- Die Stopfen mit einer keimtötenden Flüssigkeit reinigen.
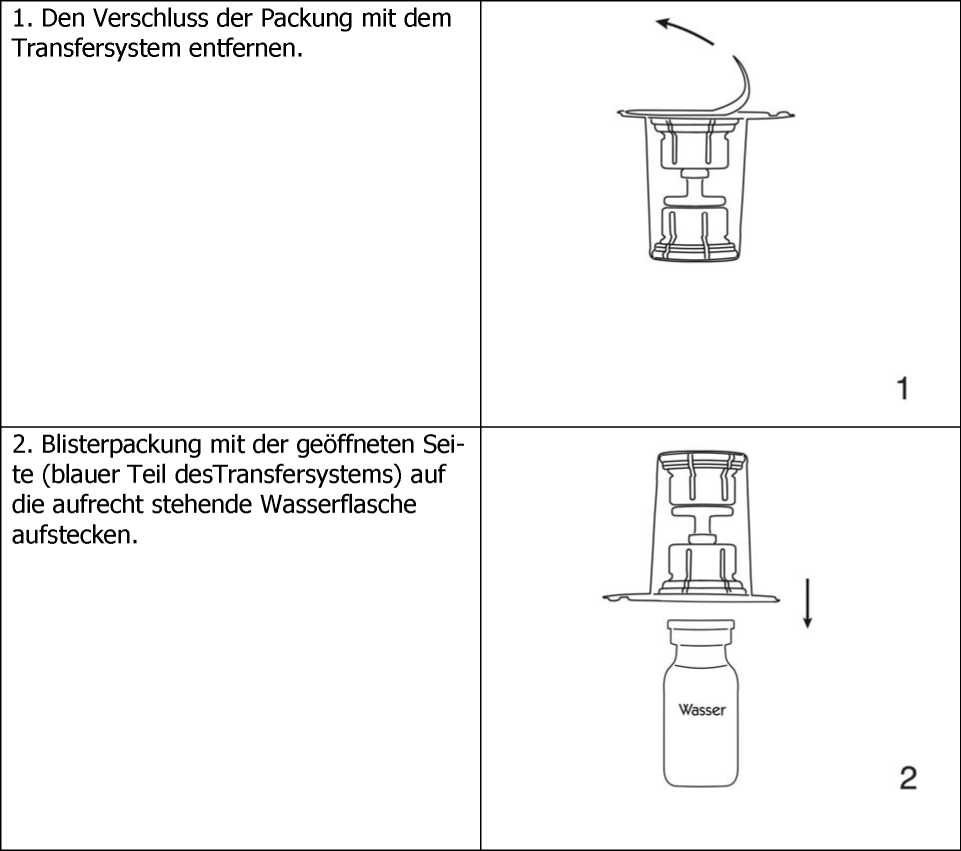
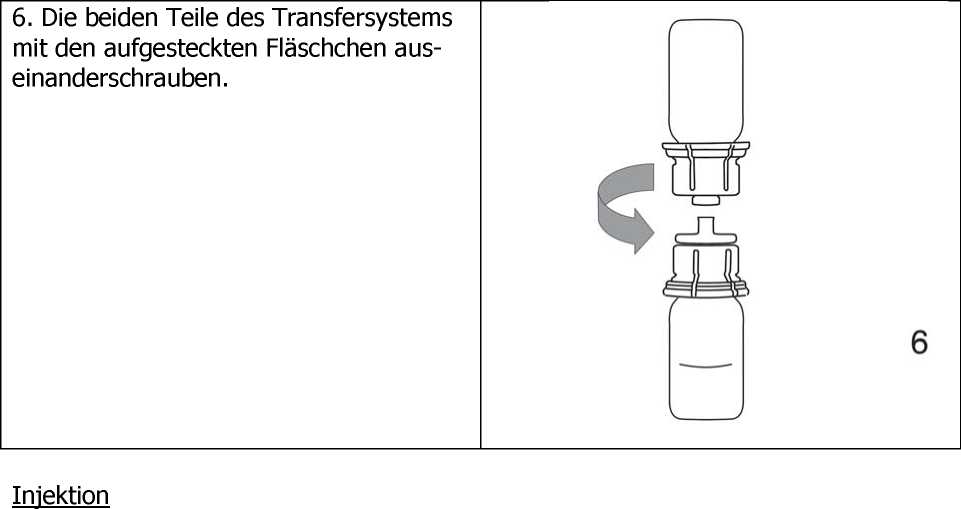
3. Entfernen der Blisterpackung. Dadurch wird der durchscheinende Teil des Transfersystems freigelegt.
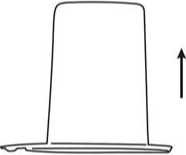
4. Die Wasserflasche mit dem aufgesteckten Transfersystem wird um 180° gedreht und auf die aufrecht stehende Präparateflasche aufgesteckt. Durch das Vakuum in der Präparateflasche fließt das Lösungsmittel auf das Lyophilisat.
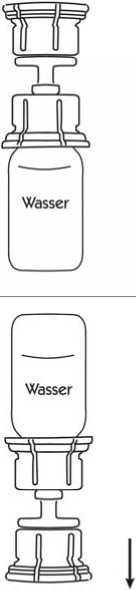


5. Durch leichtes Aufdrehen der beiden verbundenen Teile des Transfersystems entweicht eventuell vorhandenes Restvakuum. Dies erleichtert das Auflösen des Lyophilisats. Solange vorsichtig schwenken, bis das gesamte Produkt gelöst ist (Schaumbildung vermeiden!). Die Lösung ist klar oder leicht opaleszent (milchig glänzend).
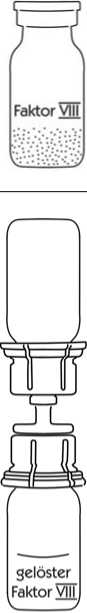
4
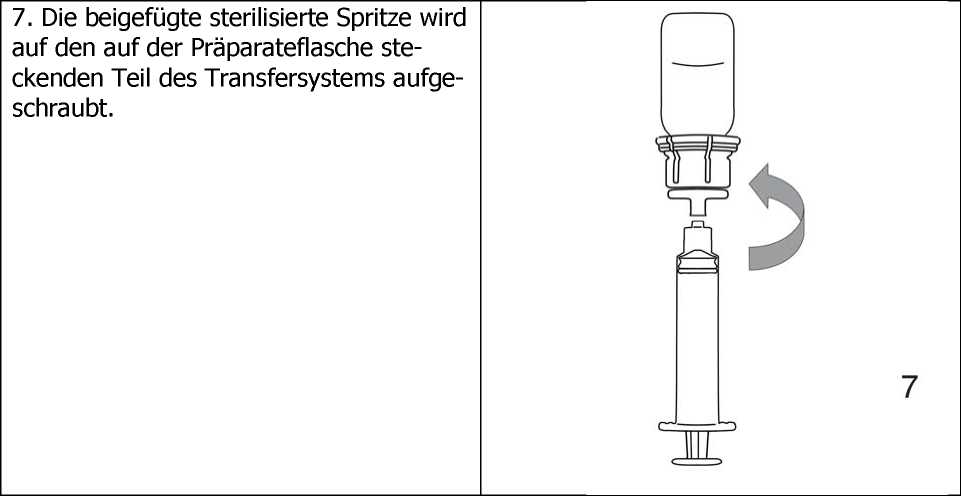
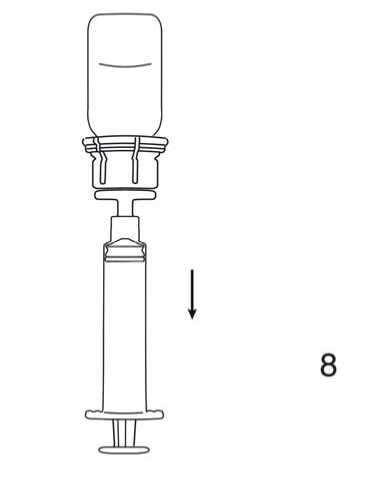
8. Nach Drehen des Komplexes aus Präparateflasche und aufgesteckter Spritze um 180° wird das gelöste Präparat aufgezogen.
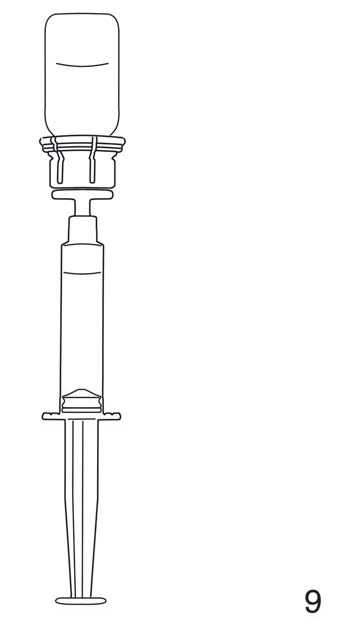
9. Nach vollständiger Überführung des gelösten Präparates in die Spritze wird der durchscheinende Teil des Transfersystems mit der leeren Präparateflasche abgeschraubt.
- Das Venenpunktionsbesteck mit dem Luer-Lock-Anschluss auf die Spritze aufschrauben und die Injektionslösung langsam intravenös injizieren. Injektionsgeschwindigkeit: 2 - 3 ml pro Minute.
Nach Gebrauch des Venenpunktionsbestecks kann dessen Nadel durch die Schutzklappe gesichert werden.
7. Inhaber der Zulassung Intersero GmbH Am Klingenweg 13 65396 Walluf Telefon: 06123-795510
8. Zulassungsnummern
Faktor VIII SDH Intersero 250: 16844.00.00 Faktor VIII SDH Intersero 500: 16844.01.00 Faktor VIII SDH Intersero 1000: 16844.02.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung 6. 11. 1991/6. 11. 1996/6. 11. 2001/2. 8. 2006
10. Stand der Information Juni 2014
11. Verschreibungsstatus/Apothekenpflicht Verschreibungspflichtig
12. Sonstige Hinweise Herkunftsländer des Blutplasmas:
Deutschland, Österreich, Belgien, USA, Niederlande, Schweiz, Ungarn, Tschechische Republik
Es wird auf die Dokumentationspflicht gemäß Transfusionsgesetz hingewiesen.
Seite 13 von 13