Fentavera 50 Mikrogramm/Stunde Transdermales Pflaster
Gebrauchsinformation: Information für Anwender
Fentavera 50 Mikrogramm/Stunde transdermales Pflaster Wirkstoff: Fentanyl
Zur Anwendung bei Kindern ab 2 Jahren und Erwachsenen
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter.
Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht:
1. Was ist Fentavera und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Fentavera beachten?
3. Wie ist Fentavera anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Fentavera aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. WAS IST FENTAVERA UND WOFÜR WIRD ES ANGEWENDET?
Fentavera ist ein stark wirksames Schmerzmittel, dessen schmerzstillende Wirkungen über zentrale Angriffspunkte zustande kommen.
Erwachsene:
Fentavera wird angewendet bei schweren chronischen Schmerzen, die nur mit starken Schmerzmitteln (Opioidanalgetika) ausreichend behandelt werden können und einer längeren, kontinuierlichen Behandlung bedürfen.
Kinder:
Fentavera wird angewendet bei schweren chronischen Schmerzen, die nur mit starken Schmerzmitteln (Opioidanalgetika) ausreichend behandelt werden können und einer längeren, kontinuierlichen Behandlung bedürfen, bei Kindern ab 2 Jahren, die bereits mit Opioidanalgetika behandelt werden.
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON FENTAVERA BEACHTEN? Fentavera darf nicht angewendet werden,
- wenn Sie allergisch gegen Fentanyl, Erdnuss, Soja oder einen der in Abschnitt 6. genannten sonstigen Bestandteile sind
- bei kurzfristigen Schmerzzuständen, z.B. nach operativen Eingriffen
- bei schwerer Beeinträchtigung der Funktion des zentralen Nervensystems, z. B. durch Hirnverletzungen
- bei einer schweren Beeinträchtigung der Atemfunktion
Besondere Vorsicht bei der Anwendung von Fentavera ist erforderlich:
Bitte sprechen Sie mit Ihrem Arzt, bevor Sie Fentavera anwenden.
Warnhinweis
Fentavera ist ein Arzneimittel, das für Kinder lebensbedrohlich sein kann. Das trifft auch auf bereits benutzte transdermale Pflaster zu. Bedenken Sie, dass das Aussehen des Arzneimittels für ein Kind verlockend sein kann, was in einigen Fällen tödliche Folgen haben könnte.
Fentavera kann außerdem lebensbedrohliche Nebenwirkungen bei Personen haben, die nicht regelmäßig verordnete opioidhaltige Arzneimittel anwenden.
Dieses Arzneimittel soll nur unter Aufsicht von in der Schmerztherapie erfahrenen Ärzten angewendet werden.
Ihr Arzt wird die Behandlung mit Fentavera als Teil eines Gesamtkonzeptes zur Schmerzbehandlung einsetzen und Sie regelmäßig auf Ihr individuelles Ansprechen auf Fentavera überwachen.
Da stark wirksame Schmerzmittel eine Beeinträchtigung der Atmung hervorrufen können, sollte Fentavera nur vorsichtig unter besonders sorgfältiger Überwachung und geringer dosiert eingesetzt werden bei Patienten mit:
- einer bestehenden Beeinträchtigung der Atmung (Atemdepression); Asthma; auch nach Entfernung des transdermalen Pflasters muss mit dem Bestehenbleiben oder Wiederauftreten einer eingeschränkten Atemtätigkeit gerechnet werden, daher müssen Sie auf solche Anzeichen hin beobachtet werden. Die Wahrscheinlichkeit dieser Nebenwirkung steigt mit zunehmender Dosis, zentral dämpfende Arzneimittel können sie verstärken (siehe Abschnitt „Anwendung von Fentavera zusammen mit anderen Arzneimitteln“)
- Lungenerkrankungen, z. B. chronisch obstruktive Lungenerkrankung (COPD), da Ihr Atemantrieb reduziert werden kann
- eingeschränkter Leber- und/oder Nierenfunktion, da die Ausscheidung von Fentanyl verzögert sein kann.
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich,
- wenn bei Ihnen schwere Nebenwirkungen aufgetreten sind. Sie sollten nach Entfernen von Fentavera noch für mindestens 24 Stunden oder, je nach Symptomen, länger überwacht werden.
- wenn Sie Kopfverletzungen, Hirntumoren, Anzeichen von erhöhtem Hirndruck, Bewusstseinsstörungen oder im Koma gelegen haben. Hier können Opioide den klinischen Verlauf von Kopfverletzungen verschleiern.
- wenn Sie einen zu langsamen, unregelmäßigen Herzschlag (Bradyarrhythmie) haben.
- wenn Sie einen niedrigen Blutdruck haben oder mit zu wenig Flüssigkeit versorgt sind (Hypo-volämie); dies sollte vor Beginn einer Behandlung mit Fentavera behandelt werden.
- wenn Sie ein höheres Lebensalter erreicht haben.
- wenn Sie unter chronischer Verstopfung leiden.
- wenn bei Ihnen eine Darmlähmung vorliegt oder vermutet wird: die Anwendung von Fentavera muss beendet werden.
- wenn Sie an einer bestimmten Muskelerkrankung (Myasthenia gravis) leiden.
- wenn Sie unter einer Arzneimittelsucht oder Alkoholsucht leiden bzw. bei Ihnen eine Vorgeschichte von Drogenmissbrauch besteht.
Eine wiederholte Anwendung von Opioiden kann zu einer Gewöhnung, d. h. zu körperlicher und seelischer (psychischer) Abhängigkeit führen. Eine durch die ärztlich empfohlene Therapie bedingte Gewöhnung durch die Gabe von Opioiden ist jedoch selten (siehe Abschnitt "Welche Nebenwirkungen sind möglich?").
Fentavera nicht zerschneiden. Die Pflaster sollten vor der Anwendung kontrolliert werden. Ein geteiltes, zerschnittenes oder in irgendeiner Weise beschädigtes Pflaster sollte nicht angewendet werden.
Haften des Pflasters auf einer anderen Person
Die Pflaster dürfen ausschließlich auf der Haut der Person zur Anwendung kommen, für die es ärztlich verordnet wurde. Es wurde von Fällen berichtet, bei denen das Pflaster nach engerem Körperkontakt oder während der gemeinsamen Nutzung eines Bettes, unbeabsichtigt auf der Haut eines Familienmitgliedes haftete. Das Haften eines Pflasters auf einer anderen Person (insbesondere einem Kind) kann zu einer Überdosis führen. In einem solchen Fall muss das Pflaster sofort entfernt und medizinische Hilfe eingeholt werden.
Fieber/äußere Wärmeanwendung
Es gibt Hinweise darauf, dass sich die Fentanylkonzentration im Blut möglicherweise um ein Drittel erhöht, wenn die Temperatur der Haut auf 40 °C ansteigt. Daher sollte bei Fieber unverzüglich mit einem Arzt Kontakt aufgenommen werden. Es ist darauf zu achten, dass die Stelle, an der das Pflaster angebracht wurde, keinen Wärmequellen ausgesetzt werden darf. Dazu gehören u. a. Heizkissen und -decken, geheizte Wasserbetten, Wärme- oder Bräunungsstrahler, intensive Sonnenbäder, Wärmflaschen, Sauna und ausgedehnte heiße (Whirlpool-) Bäder.
Kinder und Jugendliche
Fentavera sollte bei Kindern, die bisher nicht mit Opioiden behandelt wurden nicht angewendet werden. Es besteht die Möglichkeit einer schweren oder lebensbedrohenden Atemstörung.
Bei Kindern unter 2 Jahren wurde Fentavera nicht untersucht. Fentavera sollte ausschließlich mit Opioiden vorbehandelten Kindern ab 2 Jahren verabreicht werden (siehe Abschnitt "Wie ist Fentavera anzuwenden?"). Bei Kindern unter 2 Jahren soll Fentavera nicht angewendet werden.
Damit das Pflaster von kleinen Kindern nicht eigenständig entfernt und verzehrt werden kann, ist Vorsicht bei der Auswahl der Applikationsstelle geboten. Das Haften des Pflasters sollte daher sorgfältig überprüft und das Pflaster ggf. nachträglich fixiert werden. Außerdem sollte das Pflaster vom Klinikpersonal, dem Arzt oder einer erwachsenen Begleitperson und keinesfalls vom Kind selbst appliziert bzw. abgenommen und entsorgt werden. Fentavera soll vor und nach Gebrauch für Kinder unzugänglich aufbewahrt werden.
Auswirkungen bei Fehlgebrauch zu Dopingzwecken
Die Anwendung von Fentavera kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von Fentavera als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
Anwendung von Fentavera zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden, auch wenn es sich um nicht verschreibungspflichtige Arzneimittel handelt.
Bei gleichzeitiger Anwendung folgender Substanzen ist mit einer wechselseitigen Verstärkung der zentral dämpfenden Wirkung zu rechnen und das Auftreten von beeinträchtigter Atmung, niedrigem Blutdruck und starker Schläfrigkeit/Bewusstlosigkeit sowie Ableben ist möglich:
• stark wirksame Schmerzmittel
• Beruhigungs- oder Schlafmittel
• Mittel zur Vollnarkose und Muskelerschlaffung (wenn bei Ihnen ein ärztlicher oder zahnärztlicher Eingriff mit Betäubung/Narkose durchgeführt werden soll, informieren Sie den Arzt oder Zahnarzt, dass Sie Fentavera anwenden)
• Phenothiazine (Arzneimittel zur Behandlung psychiatrischer Erkrankungen)
• Mittel gegen Angstzustände
• müde machende Antihistaminika
• Alkohol
Bei gleichzeitiger Anwendung bestimmter Substanzen (CYP3A4-Inhibitoren) kann der Abbau von Fentanyl in der Leber vermindert sein, was zu einer Verstärkung oder Verlängerung der therapeutischen Wirkungen und der Nebenwirkungen führen kann, z. B.:
• Ritonavir, Nelfinavir (Arzneimittel gegen Viren)
• Ketoconazol, Itraconazol, Fluconazol, Voriconazol (Arzneimittel gegen Pilzerkrankungen)
• Troleandomycin, Clarithromycin (Antibiotika)
• Nefazodon (Arzneimittel gegen Depressionen)
• Verapamil, Diltiazem (zur Behandlung bestimmter Herzerkrankungen und Bluthochdruck)
• Amiodaron (zur Behandlung von Herzrhythmusstörungen).
Bei gleichzeitiger Anwendung bestimmter Substanzen (CYP3A4-Induktoren) kann der Abbau von Fentanyl in der Leber verstärkt sein, was zu einer Verminderung der therapeutischen Wirkung führen kann, z. B.:
• Rifampicin (Antibiotikum)
• Carbamazepin, Phenobarbital, Phenytoin (zur Behandlung der Epilepsie)
Wenn diese Substanzen (CYP3A4-Induktoren) wieder abgesetzt werden, kann dies zu einer Verstärkung oder Verlängerung der Wirkungen und Nebenwirkungen von Fentanyl führen. Hierdurch kann eine Atemlähmung verursacht werden. In dieser Situation ist eine spezielle Patientenüberwachung und Dosisanpassung erforderlich.
Sie sollten Fentavera nicht anwenden, wenn Sie zur Zeit MAO-Hemmer (zur Behandlung von Depressionen oder der Parkinson-Krankheit) einnehmen oder in den letzten 14 Tagen eingenommen haben.
Bitte teilen Sie Ihrem Arzt mit, wenn Sie bestimmte Arzneimittel gegen Depressionen, bekannt als Serotonin-Wiederaufnahmehemmer (SSRI), Serotonin-Noradrenalin-Wiederaufnahmehemmer (SNRI) oder Monoaminooxidasehemmer (MAOH) einnehmen. Ihr Arzt muss jegliche Anwendung dieser Arzneimittel wissen, da ihre Kombination mit Fentavera das Risiko eines Serotonin-Syndroms, eines poteniell lebensbedrohenden Zustands, erhöhen kann.
Wenn Sie Fentavera anwenden, sollten Sie bestimmte andere Schmerzmittel wie Buprenorphin, Nalbuphin oder Pentazocin nicht anwenden, weil diese teilweise einigen Wirkungen des Fentanyls (z. B. der Schmerzstillung) entgegenwirken und bei Opioid-Abhängigen Entzugserscheinungen auslösen können.
Anwendung von Fentavera zusammen mit Nahrungsmitteln und Getränken
Patienten, die mit Fentavera behandelt werden, sollten keinen Alkohol zu sich nehmen. Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Schwangerschaft
Zur Anwendung von Fentanyl, dem Wirkstoff von Fentavera, bei Schwangeren liegen keine ausreichenden Daten vor. Deshalb sollten Sie Fentavera während der Schwangerschaft nicht anwenden, es sei denn, Ihr Arzt entscheidet, dass die Behandlung notwendig ist.
Bei längerfristiger Anwendung von transdermalem Fentanyl während der Schwangerschaft durch die Mutter besteht ein Risiko für ein Neugeborenen-Entzugssyndrom bei den Neugeborenen.
Die Anwendung von Fentavera während der Geburt wird nicht empfohlen, weil Fentanyl die Plazenta passiert und beim Neugeborenen Probleme mit der Atmung verursachen kann.
Stillzeit
Fentanyl geht in die Muttermilch über. Deshalb sollte das Stillen während der Behandlung mit Fentavera und für mindestens 72 Stunden nach der Entfernung des Pflasters unterbrochen werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Fentavera kann einen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen haben.
Bei stabil auf Fentavera eingestellten Patienten ist - ohne weitere Beeinflussung durch andere Wirkstoffe - im Allgemeinen eine wesentliche Beeinträchtigung der Verkehrstauglichkeit nicht zu erwarten. Insbesondere bei Behandlungsbeginn, Dosiserhöhung und Kombination mit anderen Medikamenten kann jedoch im Einzelfall das Reaktionsvermögen soweit beeinträchtigt sein, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen eingeschränkt ist. Daher ist Vorsicht geboten.
Fentavera enthält Sojaöl
Wenn Sie überempfindlich (allergisch) gegenüber Erdnuss oder Soja sind, dürfen Sie dieses Arzneimittel nicht anwenden.
3. WIE IST FENTAVERA ANZUWENDEN?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arztes an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Die empfohlene Dosis beträgt:
Erwachsene
Ermittlung der benötigten Dosis (Dosiseinstellung)
Ihr Arzt entscheidet, welche Stärke der Fentavera-Produktreihe am besten für Sie geeignet ist. Ihr Arzt trifft diese Entscheidung aufgrund
- der Stärke Ihrer Schmerzen
- Ihres Allgemeinzustandes und
- der Schmerzbehandlung, die Sie bislang erhalten haben.
Wenn Sie zuvor noch keine starken Schmerzmittel erhalten haben, sollte die Behandlung mit der niedrigsten Wirkstärke begonnen werden.
Da die Fentanyl-Konzentration im Blut langsam ansteigt, sollte die bisherige Schmerzbehandlung im Gegenzug langsam verringert werden, bis die schmerzstillende Wirkung von Fentavera erreicht ist. Grundsätzlich kann die maximale schmerzstillende Wirkung erst nach ca. 24 Stunden beurteilt werden. Bei der Umstellung von anderen stark wirksamen Schmerzmitteln auf Fentavera sollte zuerst der 24-Stundenbedarf des bisher angewendeten stark wirksamen Schmerzmittels von Ihrem Arzt errechnet werden.
Besondere Patientengruppen
Bei älteren Patienten und solchen mit eingeschränkter Leber- oder Nierenfunktion kann es erforderlich sein, die Dosis zu verringern.
Kinder und Jugendliche zwischen 2 und 16 Jahren
Kindern von 2 bis 16 Jahren sollte nur dann Fentavera verordnet werden, wenn diese zuvor mit mindestens 30 mg oralem Morphin pro Tag oder einem anderen Morphin gleichwertigen Schmerzmittel (Morphinäquivalent) behandelt worden sind.
Ihr Arzt wird die Fentavera-Dosis wie folgt berechnen:
• Bei Kindern, die 30 mg bis 44 mg orales Morphinäquivalent pro Tag erhielten, sollte die Behandlung mit einem Fentavera 12 Mikrogramm/Stunde transdermalen Pflaster begonnen werden.
• Bei Kindern, die 45 mg bis 134 mg orales Morphinäquivalent pro Tag erhielten, sollte die Behandlung mit zwei Fentavera 12 Mikrogramm/Stunde transdermalen Pflastern begonnen werden.
Für Kinder, die mehr als 90 mg orales Morphinäquivalent pro Tag erhielten, liegen bislang nur begrenzt Erfahrungen mit Fentavera vor. Wenn die schmerzlindernde Wirkung von Fentavera nicht ausreichend ist, wird eine zusätzliche Morphingabe oder ein anderes kurzwirksames Opioid verschrieben. Ihr Arzt kann, in Abhängigkeit von notwendiger, zusätzlicher Schmerzlinderung und dem Schmerzstatus des Kindes entscheiden, die Dosis zu erhöhen. Ihr Arzt sollte die Dosisanpassung in Schritten von 12 pg/h (Mikrogramm pro Stunde) Fentanyl vornehmen.
Jugendliche ab 16 Jahren
Die Dosierung für Jugendliche ab 16 Jahren kann sich an der Erwachsenendosierung orientieren.
Erhaltungsdosis
Bei unzureichender schmerzstillender Wirkung nach 72 Stunden, kann die Dosis schrittweise erhöht werden, bis die gewünschte Schmerzlinderung erzielt wird. Die dazu notwendigen Dosisanpassungen werden von Ihrem Arzt berechnet. Möglicherweise zusätzlich erforderliche Schmerzmittel sowie das Schmerzempfinden des Patienten sollten berücksichtigt werden.
Gleichzeitige Anwendung mehrerer Pflaster
Falls die erforderliche Dosis 100 Mikrogramm Fentanyl pro Stunde übersteigt, können mehrere Pflaster mit unterschiedlicher Wirkstärke gleichzeitig angewendet werden.
Zusätzliche oder alternative Methoden der Schmerzbehandlung sollten in Betracht gezogen werden, wenn die notwendige Dosierung 300 Mikrogramm Fentanyl pro Stunde übersteigt.
Umstellung der Behandlung
Soll von der Behandlung mit Fentavera auf ein anderes stark wirksames Schmerzmittel umgestellt werden, wird das Pflaster entfernt und die Dosis des neuen Schmerzmittels anhand der Schmerzbeurteilung des Patienten angepasst.
Bei einigen Patienten sind nach Umstellung oder einer Verringerung der Dosis OpioidEntzugserscheinungen möglich. Deshalb wird, wenn ein Absetzen von Fentavera erforderlich ist, eine schrittweise Dosisreduzierung empfohlen.
Wie und wann sollte Fentavera angewendet werden?
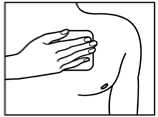
Direkt nach der Entnahme aus der Verpackung und dem Entfernen beider Teile der Schutzfolie wird Fentavera auf ein unbehaartes oder von Haaren befreites (mit Schere, nicht rasieren) Hautareal im Bereich des Oberkörpers (Brust, Rücken, Oberarm) aufgeklebt. Bei kleinen Kindern sollte das Pflaster auf dem Rücken aufgebracht werden, damit das transdermale Pflaster vom Kind nicht entfernt werden kann.
Vor dem Aufkleben sollten Sie die Haut vorsichtig mit sauberem Wasser (keine Reinigungsmittel verwenden!) reinigen und gut abtrocknen. Das transdermale Pflaster wird dann mit leichtem Druck der flachen Hand (ca. 30 Sekunden lang) aufgeklebt. Achten Sie darauf, dass die zu beklebende Stelle keine kleinen Verletzungen (z. B. durch Bestrahlung oder Rasur) und keine Hautreizungen aufweist. Da das transdermale Pflaster nach außen hin durch eine wasserdichte Abdeckfolie geschützt wird, kann es auch beim Duschen getragen werden.
Auf die für das Aufkleben des Pflasters ausgewählte Hautstelle dürfen keine Cremes, Öle, Lotionen oder Puder aufgetragen werden, um das Kleben des Pflasters nicht zu beeinträchtigen.
Öffnen Sie den Beutel bitte erst unmittelbar vor Benutzung des Pflasters. Anleitung zum Öffnen des kindersicheren Beutels:
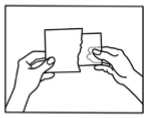


1) Sie finden eine Markierung am Beutel die Ihnen zeigt, wo Sie den Beutel einschneiden können (benutzen Sie eine Schere).
2) Reißen Sie den Beutel mit Hilfe der Einschnitte der Länge nach auf.
3) Öffnen Sie den Beutel und nehmen Sie das Pflaster heraus.
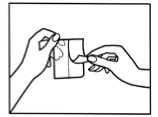
Entfernen Sie dann die Abziehfolie von einer Hälfte des Pflasters, dabei ist es wichtig eine Berührung der Klebefläche zu vermeiden.
Nachdem Sie die eine Hälfte des Pflasters auf die Haut geklebt haben, können Sie nun die andere Hälfte der Abziehfolie entfernen.
Jetzt drücken Sie das Pflaster für 30 - 60 Sekunden mit der flachen Hand fest auf die Haut. Achten Sie bitte auch auf eine gute Haftung der Kleberänder.
Waschen Sie sich Ihre Hände nach dem Aufkleben des Pflasters bitte ohne Anwendung von Reinigungsmitteln.
Das Pflaster darf nicht geteilt, zerschnitten oder in irgendeiner Weise beschädigt werden.
Befolgen Sie die Anweisungen Ihres Arztes immer sorgfältig und befragen Sie ihn, bevor Sie die Behandlung ändern oder abbrechen.
Wie lange sollte Fentavera angewendet werden?
Ein Wechsel des transdermalen Pflasters sollte nach 72 Stunden (3 Tagen) erfolgen. Falls im Einzelfall erforderlich, darf nicht eher als nach 48 Stunden gewechselt werden, da sonst mit einem erhöhten Nebenwirkungsrisiko (vor allem Einschränkung der Atemfunktion) gerechnet werden muss. Sie müssen jeweils eine neue Hautstelle wählen. Jeder Hautbereich kann erst 7 Tage nach Entfernen des Pflasters erneut benutzt werden. Der schmerzstillende Effekt kann nach Entfernung des transdermalen Pflasters für einige Zeit bestehen bleiben.
Wenn sich nach Abziehen des transdermalen Pflasters Rückstände auf der Haut befinden, können Sie diese mit reichlich Wasser und Seife entfernen. Die Reinigung sollte keinesfalls mit Alkohol oder anderen Lösungsmitteln durchgeführt werden, da diese - bedingt durch die Wirkung des transdermalen Pflasters - die Haut durchdringen könnten.
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, wenn Sie den Eindruck haben, dass die Wirkung von Fentavera zu stark oder zu schwach ist.
Wenn Sie eine größere Menge von Fentavera angewendet haben, als Sie sollten
Wenn Sie mehr Pflaster aufgeklebt haben als verordnet, entfernen Sie die Pflaster und informieren Sie Ihren Arzt, um mit ihm das weitere Vorgehen zu besprechen.
Das wichtigste Zeichen einer Überdosierung ist eine eingeschränkte Atmung, d. h. der Patient atmet zu langsam oder zu schwach. Wenn dies auftritt, entfernen Sie das Pflaster und informieren Sie umgehend einen Arzt. Halten Sie die Person durch Sprechen oder gelegentliches Rütteln wach, während Sie auf den Arzt warten.
Andere Anzeichen und Symptome einer Überdosierung sind:
• Benommenheit
• niedrige Körpertemperatur
• langsamer Herzschlag
• herabgesetzter Spannungszustand der Muskulatur
• starke Schläfrigkeit
• Verlust der kontrollierten Muskelbewegung
• Verkleinerung der Pupillen
• Krämpfe
Wenn Sie die Anwendung von Fentavera vergessen haben
Wenden Sie unter keinen Umständen die doppelte Dosis an wenn Sie die vorherige Anwendung vergessen haben.
Falls von Ihrem Arzt nicht anders verordnet, sollten Sie Ihr Pflaster alle 72 Stunden (alle 3 Tage) zur gleichen Tageszeit wechseln. Wenn Sie vergessen haben, Ihr Pflaster zu wechseln, dann machen Sie dies, sobald Sie sich daran erinnern. Informieren Sie Ihren Arzt, wenn Sie erst sehr spät bemerken, dass Sie das Wechseln des Pflasters vergessen haben, da Sie möglicherweise in diesem Fall zusätzliche Schmerzmittel benötigen.
Wenn Sie die Anwendung von Fentavera abbrechen
Falls Sie die Behandlung unterbrechen oder beenden möchten, sprechen Sie vorher mit Ihrem Arzt.
Eine Langzeitanwendung von Fentavera kann zu einer körperlichen Abhängigkeit führen.
Wenn Sie aufhören, das Pflaster anzuwenden, können Sie sich daher unwohl fühlen.
Da das Risiko von Entzugserscheinungen größer ist, wenn die Behandlung plötzlich beendet wird, sollten Sie niemals selbständig die Anwendung von Fentavera beenden, sondern immer zuerst Ihren Arzt fragen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Wie alle Arzneimittel kann dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Das wichtigste Zeichen einer Überdosierung ist eine eingeschränkte Atmung, d. h. der Patient atmet zu langsam oder zu schwach. Wenn dies auftritt, entfernen Sie das Pflaster und informieren
Sie umgehend einen Arzt. Halten Sie die Person durch Sprechen oder gelegentliches Rütteln wach, während Sie auf den Arzt warten.
Die nachfolgenden Nebenwirkungsangaben basieren auf klinischen Studien an Erwachsenen und Kindern sowie Beobachtungen in klinischer Anwendung bei Erwachsenen nach Zulassung.
Wenn Sie von einer der nachfolgend genannten Nebenwirkungen betroffen sind, wenden Sie Fentavera nicht weiter an und suchen Sie Ihren Arzt möglichst umgehend auf.
Sehr häufig (kann mehr als 1 von 10 Behandelten betreffen):
• Schläfrigkeit, Schwindel, Kopfschmerzen
• Übelkeit, Erbrechen, Verstopfung
Häufig (kann bis zu 1 von 10 Behandelten betreffen):
• Überempfindlichkeit des Immunsystems
• Appetitlosigkeit
• Schlaflosigkeit, Depression, Angstgefühl, Verwirrtheitszustand, Halluzinationen
• Zittern, Taubheitsgefühl
• Augenbindehautentzündung (Konjunktivitis)
• Drehschwindel
• Herzklopfen, zu schneller Herzschlag
• Bluthochdruck
• Atemnot
• Durchfall, Mundtrockenheit, (Ober-) Bauchschmerzen, Verdauungsstörung
• Schwitzen, Juckreiz, Hautausschlag, Hautrötung
• Muskelkrämpfe
• Harnverhalt
• Erschöpfung (Fatigue), Wasseransammlungen im peripheren Gewebe, schnelle Ermüdbarkeit, Unpässlichkeit (Malaise), Kältegefühl
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen):
• Unruhezustände, Desorientiertheit, Euphorie
• herabgesetzte Empfindung von Sinnesreizen (Hypästhesie), Krampfanfälle (einschließlich klonischer und Grand-mal-Anfälle), Erinnerungslücken, Sprachstörungen, Bewusstseinseinschränkungen, Bewusstlosigkeit
• verschwommenes Sehen
• verlangsamter Herzschlag, Blaufärbung der Haut aufgrund von Sauerstoffmangel (Zyanose)
• erniedrigter Blutdruck
• Abflachung der Atmung, Atemnot
• Darmverschluss
• Ekzem, allergische Hautreaktion, Hauterkrankung, Hautentzündung (nach Kontakt)
• Muskelzucken
• Erektionsstörung, sexuelle Funktionsstörung
• Reaktion an der Anwendungsstelle, grippeähnliche Erkrankung, Gefühl von Körpertemperaturschwankungen, Überempfindlichkeit an der Anwendungsstelle, Entzugserscheinungen, Fieber
Selten (kann bis zu 1 von 1.000 Behandelten betreffen):
• Verengung der Pupille (Miosis)
• unregelmäßiger Herzschlag (Arrhythmien)
• Erweiterung der Blutgefäße (Vasodilatation)
• Atemstillstand, verminderte Lungenbelüftung (Hypoventilation)
• unvollständiger Darmverschluss
• Hautentzündung an der Anwendungsstelle, Ekzem an der Anwendungsstelle
Sehr selten (kann bis zu 1 von 10.000 Behandelten betreffen):
• schmerzhafte Blähungen
• Verminderung der Harnausscheidung (Oligurie), Blasenschmerzen (Zystalgie)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar):
• lebensbedrohliche allergische Reaktion (anaphylaktischer Schock), allergische Reaktionen unterschiedlicher Ursache (anaphylaktisch oder anaphylaktoid)
• verlangsamte Atmung
Andere mögliche Nebenwirkungen
Gewöhnung, d. h. körperliche und seelische (psychische) Abhängigkeit können sich bei wiederholter Anwendung von Fentavera entwickeln (siehe Abschnitt " Warnhinweise und Vorsichtsmaßnahmen ").
Bei Umstellung von anderen stark wirksamen Opioiden auf Fentavera oder bei abruptem Abbruch der Therapie kann es bei einigen Patienten zu Entzugserscheinungen, wie z. B. Übelkeit, Erbrechen, Durchfall, Angstzuständen und Kältezittern kommen (siehe Abschnitt " Warnhinweise und Vorsichtsmaßnahmen ").
Sehr selten wurde berichtet, dass es durch längerfristige Anwendung von Fentavera während der Schwangerschaft zu Entzugserscheinungen beim Neugeborenen gekommen ist (siehe Abschnitt " Warnhinweise und Vorsichtsmaßnahmen ").
Sojaöl kann sehr selten allergische Reaktionen hervorrufen.
Zusätzliche Nebenwirkungen bei Kindern und Jugendlichen
Bei Kindern und Jugendlichen entsprach das Nebenwirkungsprofil dem der Erwachsenen. Neben den bei der Schmerzbehandlung von schwer kranken Kindern üblicherweise zu erwartenden Nebenwirkungen wurden keine weiteren Risiken bei bestimmungsgemäßem Gebrauch von Fentavera bei Kindern ab einem Alter von 2 Jahren bekannt. Sehr häufig wurde in den Studien mit schwer kranken Kindern über Fieber, Kopfschmerzen, Erbrechen, Übelkeit, Verstopfung, Durchfall und Juckreiz berichtet.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, 53174 Bonn: Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. WIE IST FENTAVERA AUFZUBEWAHREN?
Fentavera Pflaster sollen vor und nach Gebrauch für Kinder unzugänglich aufbewahrt werden.
Sie dürfen dieses Arzneimittel nach dem auf dem Behältnis und der äußeren Umhüllung nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Hinweis zur Entsorgung
Verwendete Pflaster sollten mit den Klebeflächen aneinandergeklebt werden und dann sicher entsorgt werden. Insbesondere für Kinder kann ein unbeabsichtigter Kontakt mit bereits benutzten oder unbenutzten Pflastern tödliche Folgen haben. Nicht verwendete Pflaster sollten in der Apotheke abgegeben werden.
6. INHALT DER PACKUNG UND WEITERE INFORMATIONEN
Was Fentavera enthält
Der Wirkstoff ist Fentanyl.
1 transdermales Pflaster enthält 10,2 mg Fentanyl in einem Pflaster von 17 cm2 und setzt 50 Mikrogramm Fentanyl pro Stunde frei.
Die sonstigen Bestandteile sind:
Matrix: Poly[(2-ethylhexyl)acrylat-co-vinylacetat] (50:50), Aloe-vera-Blätter Extrakt Öl (auf Basis
von Sojaöl, Tocopherolacetat), Kolophonium
Schutzfolie: Poly(ethylenterephthalat), Polyester, silikonisiert
Trägerfolie mit Aufdruck: Poly(ethylenterephthalat)-Folie, Drucktinte
Wie Fentavera aussieht und Inhalt der Packung
Transdermales Pflaster
Undurchsichtiges, farbloses, rechteckiges Pflaster mit abgerundeten Ecken und dem Aufdruck „Fentanyl 50 gg/h“ auf der Trägerfolie; abgepackt in einzelne versiegelte Beutel.
Fentavera ist in Packungen mit 5, 10 und 20 transdermalen Pflastern erhältlich.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller
Acino AG Am Windfeld 35 D-83714 Miesbach
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen
Deutschland: Fentavera 50 Mikrogramm/Stunde transdermales Pflaster
Spanien: Fentanilo Matrix Acino 50 microgramos/hora Parche
transdermico EFG
Vereinigtes Königreich: Fencino 50 micrograms/h transdermal patch
Diese Gebrauchsinformation wurde zuletzt genehmigt im Oktober 2014.
v025-Oktober 2014