Flusalio 50 Mikrogramm/500 Mikrogramm/Dosis Einzeldosiertes Pulver Zur Inhalation
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Flumetor 50 Mikrogramm/250 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation Flumetor 50 Mikrogramm/500 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Flumetor 50 Mikrogramm/250 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation Jede Einzeldosis Flumetor enthält 50 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 250 Mikrogramm Fluticason-17-propionat.
Sonstige(r) Bestandteil(e) mit bekannter Wirkung: Enthält 24,677 mg LactoseMonohydrat.
Flumetor 50 Mikrogramm/500 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation Jede Einzeldosis Flumetor enthält 50 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 500 Mikrogramm Fluticason-17-propionat.
Sonstige(r) Bestandteil(e) mit bekannter Wirkung: Enthält 24,427 mg LactoseMonohydrat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Einzeldosiertes Pulver zur Inhalation.
Flumetor enthält zwei Arzneimittel, verpackt als Einzeldosis in einer Blisterpackung mit 2 Kammern, die im Inhalator Elpenhaler aufbewahrt werden.
Die Folie schützt das Pulver zur Inhalation vor der Wirkung der Umgebungsbedingungen.
Jede Dosis ist in einer Blisterpackung mit 2 Kammern vordosiert.
Jeder Umkarton enthält einen Inhalator Elpenhaler mit 60 Blisterpackungen.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Flumetor ist nur zur Anwendung bei Erwachsenen bestimmt.
Asthma
Flumetor ist indiziert für die regelmäßige Behandlung von Asthma bronchiale, bei der die Anwendung von langwirksamem Beta2-Agonisten und inhalativem Kortikoid in Kombination angezeigt ist:
- bei Patienten, die mit inhalativen Kortikoiden und kurzwirksamen Beta2-Agonisten zur
bedarfsweisen Inhalation nicht ausreichend eingestellt sind oder
- bei Patienten, die mit inhalativen Kortikoiden und langwirksamen Beta2-Agonisten ausreichend eingestellt sind.
Chronisch-obstruktive Lungenerkrankung (COPD)
Flumetor ist angezeigt für die symptomatische Behandlung von Patienten mit schwerer COPD (FEV1 < 60 % des Normwertes) und wiederholt aufgetretenen Exazerbationen, die trotz regelmäßiger bronchienerweiternder Therapie signifikante Symptome aufweisen.
4.2 Dosierung und Art der Anwendung
Dosierung
Patienten sollten darauf hingewiesen werden, dass es für den optimalen Behandlungserfolg erforderlich ist, Flumetor täglich anzuwenden, auch wenn sie symptomfrei sind.
Patienten sollten sich regelmäßig weiterhin vom Arzt untersuchen lassen, so dass die Dosisstärke von Flumetor , die sie erhalten, optimal bleibt und nur nach ärztlichem Rat geändert wird. Die Dosis sollte so angepasst werden, dass eine effektive Kontrolle der Symptome mit der niedrigsten Dosierung erreicht wird. Wird unter zweimal täglicher Inhalation der niedrigsten Dosisstärke von der Kombination eine gute Symptomkontrolle erreicht, könnte der nächste Schritt darin bestehen, ein Kortikoid allein zu inhalieren. Patienten, die einen langwirksamen Beta2-Agonisten benötigen, könnten alternativ auf eine einmal tägliche Inhalation von Salmeterol/ Fluticasonpropionat heruntertitriert werden, wenn im Ermessen des Arztes eine Kontrolle des Krankheitsbildes gewährleistet ist. Bei der möglichen Einmaldosierung sollten die Patienten, die in der Vorgeschichte nächtliche Symptome aufweisen, spätabends und die Patienten, die in der Vorgeschichte überwiegend tagsüber Symptome aufweisen, morgens inhalieren.
Patienten sollte die Dosisstärke von Flumetor verordnet werden, die die für den Schweregrad der Erkrankung geeignete Dosis an Fluticasonpropionat enthält. Der behandelnde Arzt sollte sich bewusst sein, dass etwa die halbe Tagesdosis Fluticasonpropionat (in Mikrogramm) bei Asthmapatienten so wirksam ist wie die ganze Tagesdosis anderer inhalativer Steroide; z. B. entsprechen 100 Mikrogramm Fluticasonpropionat etwa 200 Mikrogramm (FCKW-haltigem) Beclometasondipropionat oder Budesonid. Wenn ein Patient Dosierungen außerhalb des empfohlenen Behandlungsschemas benötigen sollte, sollten ausreichende Dosierungen eines BetaAgonisten und/oder eines Kortikoids verschrieben werden.
Empfohlene Dosis:
Asthma
Erwachsene:
Eine Inhalation von 50 Mikrogramm Salmeterol und 250 Mikrogramm Fluticasonpropionat zweimal täglich oder
Eine Inhalation von 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticasonpropionat zweimal täglich.
Bei Erwachsenen mit mittelschwerem Asthma bronchiale (definiert als: Patienten mit täglichen Symptomen, mit täglicher Anwendung von Akutmedikation und mit mittelschwerer bis schwerer Einschränkung des Atemflusses), für die eine schnelle Asthmakontrolle essentiell ist, kann eine Kurzzeit-Anwendung von Flumetor in Form einer Initialbehandlung in Betracht gezogen werden. In diesen Fällen ist die empfohlene Einstiegsdosierung 2-mal täglich 1 Inhalation mit 50 Mikrogramm Salmeterol und 100 Mikrogramm Fluticasonpropionat. Sobald eine Asthmakontrolle erreicht ist, sollte die Behandlung überprüft und erwogen werden, ob auf die Inhalation mit einem Kortikoid allein reduziert werden kann. Während der schrittweisen Verringerung der Dosierung sollte der Patient regelmäßig kontrolliert werden.
Waren ein oder zwei Kriterien des Schweregrads nicht erfüllt, zeigte sich kein klarer Nutzen der Kombinationsbehandlung gegenüber einer Inhalation von Fluticasonpropionat allein als Initialbehandlung. Im Allgemeinen bleiben inhalative Kortikoide für die meisten Patienten die erste Behandlungsempfehlung. ist nicht vorgesehen für die Initialbehandlung bei leichtem Asthma bronchiale. Die Stärke Flumetor 50 Mikrogramm/100 Mikrogramm ist nicht angemessen für Erwachsene und Kinder mit schwerem Asthma bronchiale; es wird empfohlen, die geeignete Dosierung von inhalativem Kortikoid allein festzulegen , bevor eine fixe Kombination bei Patienten mit schwerem Asthma bronchiale eingesetzt werden kann.
COPD
Erwachsene:
Eine Inhalation von 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticasonpropionat zweimal täglich.
Besondere Patientengruppen:
Bei älteren Patienten oder bei Patienten mit eingeschränkter Nierenfunktion ist keine Anpassung der Dosis erforderlich. Für die Anwendung von Flumetor bei Patienten mit eingeschränkter Leberfunktion liegen keine Daten vor.
Kinder und Jugendliche
Flumetor darf bei Kindern und Jugendlichen nicht angewendet werden.
Art der Anwendung
Flumetor ist nur zur Inhalation bestimmt.
4.3 Gegenanzeigen
Überempfindlichkeit gegen einen der Wirkstoffe oder einen der in Abschnitt 6.1. genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Das Behandlungsschema von Asthma bronchiale sollte im Allgemeinen einem schrittweisen Vorgehen folgen. Das Ansprechen der Patienten auf die Behandlung sollte klinisch und durch Lungenfunktionstests kontrolliert werden.
Flumetor sollte nicht für die Akutbehandlung von Asthmasymptomen eingesetzt werden, für die ein schnell- und kurzwirksamer Bronchodilatator benötigt wird.
Patienten sollten darauf hingewiesen werden, ihre Arzneimittel für die Behandlung eines akuten Asthmaanfalles jederzeit bei sich zu haben.
Eine Behandlung mit Flumetor sollte nicht während einer Exazerbation oder bei sich signifikant verschlechterndem oder akut verschlimmerndem Asthma begonnen werden.
Während der Behandlung mit Flumetor können schwere asthma-assoziierte unerwünschte Ereignisse und Exazerbationen auftreten. Die Patienten sollten aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat einzuholen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese nach Therapiebeginn mit Flumetor verschlimmern.
Ein erhöhter Gebrauch von kurzwirksamen Bronchodilatatoren zur Behandlung von Symptomen ist ein Anzeichen für eine Verschlechterung des Krankheitsbildes, und diese Patienten sollten von einem Arzt untersucht werden.
Eine plötzliche und zunehmende Verschlechterung der Beschwerden ist potenziell lebensbedrohlich, und der Patient sollte dringend von einem Arzt untersucht werden. In diesem Fall ist eine Erhöhung der Kortikoiddosis in Betracht zu ziehen. Der Patient sollte auch dann von einem Arzt untersucht werden, wenn die derzeitige Dosierung von Flumetor für eine adäquate Kontrolle des Asthma bronchiale nicht ausreicht.
Sobald eine Kontrolle der Asthmasymptome erreicht ist, kann in Betracht gezogen werden, die Dosis von Flumetor stufenweise auf die niedrigste wirksame Dosis zu verringern. Während die Dosierung schrittweise erniedrigt wird, ist eine regelmäßige Überprüfung des Patienten wichtig.
Es sollte die niedrigste wirksame Dosis von Flumetor eingesetzt werden (siehe Abschnitt 4.2).
Bei Patienten mit Asthma oder COPD sollte eine zusätzliche Therapie mit Corticosteroiden in Betracht gezogen werden.
Bei Asthma-Patienten sollte wegen des Risikos einer Exazerbation die Behandlung mit Flumetor nicht abrupt abgebrochen werden. Die Behandlung sollte unter ärztlicher Aufsicht schrittweise reduziert werden. Bei COPD-Patienten kann das Absetzen der Therapie auch mit einer Verschlechterung der Symptome verbunden sein, es sollte deshalb von einem Arzt überwacht werden.
Wie alle kortikoidhaltigen Arzneimittel zur Inhalation ist Flumetor bei Patienten mit Lungentuberkulose mit Vorsicht anzuwenden.
Flumetor können in seltenen Fällen Herzrhythmusstörungen, z. B. supraventrikuläre Tachykardie, Extrasystolen und Vorhofflimmern, und bei hohen therapeutischen Dosierungen eine geringe vorübergehende Reduktion des Serumkaliumspiegels verursachen. Deshalb ist Flumetor bei Patienten mit schweren kardiovaskulären Erkrankungen, Herzrhythmusstörungen, Diabetes mellitus, Thyreotoxikose, unkorrigierter Hypokaliämie oder bei Patienten mit einer Prädisposition zu niedrigen Serumkaliumspiegeln mit Vorsicht anzuwenden.
Es ist sehr selten über einen Anstieg der Blutglukosespiegel berichtet worden (siehe 4.8 Nebenwirkungen), und dies sollte bei der Verordnung für Patienten mit Diabetes mellitus in der Vorgeschichte berücksichtigt werden.
Wie bei anderer Inhalationsbehandlung können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens nach der Anwendung ausgelöst werden. Die Anwendung von Flumetor sollte dann unverzüglich abgebrochen, der Patient untersucht und, wenn notwendig, eine alternative Behandlung begonnen werden.
Flumetor enthält Lactose. Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Die Umstellung des Patienten auf die Behandlung mit Flumetor sollte mit Vorsicht durchgeführt werden, insbesondere, wenn anzunehmen ist, dass die Nebennierenrindenfunktion durch eine frühere systemische Kortikoidbehandlung beeinträchtigt ist.
Systemische Effekte können bei der Behandlung mit jedem inhalativen Kortikoid auftreten, insbesondere unter hohen Dosierungen, die für einen langen Zeitraum verschrieben werden. Diese Effekte sind allerdings unter der Inhalationsbehandlung viel weniger wahrscheinlich als unter der oralen Gabe von Kortikoiden. Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Verminderung der Knochendichte, Katarakt und Glaukom ein. Deshalb ist es wichtig, den Patienten regelmäßig zu kontrollieren und die Dosis des inhalativen Kortikoids auf die niedrigste Dosis zu reduzieren, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann.
Die Inhalation von hohen Dosierungen inhalativer Kortikoide über einen längeren Zeitraum kann zu einer Nebennierenrindensuppression und akuter adrenaler Krise führen. Sehr seltene Fälle von Nebennierenrindensuppression und akuter adrenaler Krise wurden auch bei Dosen zwischen 500 Mikrogramm und weniger als 1000 Mikrogramm beschrieben. Eine akute adrenale Krise kann möglicherweise durch Umstände wie Verletzung, Operation, Infektion oder jede schnelle Dosisreduktion ausgelöst werden. Die Symptome sind typischerweise unspezifisch wie z. B. Appetitlosigkeit, Bauchschmerzen, Gewichtsverlust, Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Hypotonie, Bewusstseinstrübung, Hypoglykämie und Krampfanfälle.
Während Stressperioden oder im Rahmen einer geplanten Operation sollte eine zusätzliche systemische Gabe von Kortikoiden in Betracht gezogen werden.
Eine Inhalationsbehandlung mit Fluticasonpropionat sollte den Bedarf an oralen Kortikoiden vermindern. Die Umstellung von oral kortikoidpflichtigen Patienten auf die Inhalationsbehandlung und ihre anschließende Betreuung erfordern eine sorgfältige Überwachung, da sich die durch eine langfristige systemische Kortikoidtherapie eingeschränkte Nebennierenrindenfunktion nur allmählich normalisiert. Patienten, die in der Vorgeschichte hohe Dosierungen systemisch applizierter Kortikoide erhielten, sind durch eine solche möglicherweise noch bestehende Suppression ebenfalls gefährdet. Bei allen Patienten mit eingeschränkter Nebennierenrindenfunktion sollte geprüft werden, ob in Notfallsituationen und besonderen Stresssituationen die Anwendung oraler Kortikoide notwendig ist. Je nach Ausmaß der Nebennierenfunktionsstörung muss vor elektiven Maßnahmen der Rat eines Facharztes eingeholt werden.
Ritonavir kann die Plasmakonzentration von Fluticasonpropionat erheblich erhöhen. Deshalb sollte eine gleichzeitige Anwendung vermieden werden, es sei denn, der mögliche Nutzen für den Patienten überwiegt das Risiko systemischer KortikoidNebenwirkungen. Ebenso besteht ein erhöhtes Risiko systemischer Nebenwirkungen bei Kombination von Fluticasonpropionat mit anderen potenten Inhibitoren des Enzyms CYP3A (siehe Abschnitt 4.5).
Im Rahmen der TORCH-Studie wurde bei Patienten mit COPD, die mit Salmeterol/ Fluticasonpropionat 50/500 Mikrogramm zweimal täglich behandelt wurden, im Vergleich zu Placebo sowie in den Studien SCO40043 und SCO1000250, in denen die niedrigere, nicht für Patienten mit COPD zugelassene Dosis von Salmeterol/ Fluticasonpropionat 50/ 250 Mikrogramm zweimal täglich mit nur Salmeterol 50 Mikrogramm zweimal täglich verglichen wurde, häufiger über Infektionen der unteren Atemwege (insbesondere Pneumonie und Bronchitis) berichtet (siehe Abschnitt 4.8 und 5.1). Die Inzidenz von Pneumonie in der Salmeterol/ Fluticasonpropionat-Gruppe war in allen Studien vergleichbar.
In der TORCH-Studie war bei älteren Patienten, Patienten mit einem niedrigen Body-Mass-Index (< 25 kg/m2) und Patienten mit sehr schwerer Erkrankung (FEV1 < 30 % des vorhergesagten Normwerts) das Risiko einer Pneumonie, unabhängig von der Behandlung, am höchsten. Ärzte sollten bei Patienten mit COPD besonders auf das mögliche Auftreten einer Pneumonie oder einer anderen Infektion der unteren Atemwege achten, da die Symptome solcher Infektionen sich mit denen einer Exazerbation häufig überschneiden. Hatte ein Patient mit schwerer COPD bereits eine Pneumonie, sollte die Behandlung mit Salmeterol/ Fluticasonpropionat überdacht werden.
Daten aus einer großen klinischen Studie (Salmeterol Multi-Center Asthma Research Trial, SMART) weisen darauf hin, dass afro-amerikanische Patienten unter Salmeterol ein höheres Risiko für schwere atemwegsbedingte Ereignisse oder Todesfälle haben als unter Placebo (siehe Abschnitt 5.1). Es ist nicht bekannt, ob dies auf pharmakogenetische oder andere Faktoren zurückzuführen ist. Patienten mit schwarzafrikanischer oder afro-karibischer Abstammung sollten daher aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat zu suchen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese unter der Anwendung von Flumetor verschlechtern.
Bei gleichzeitiger Anwendung von systemischem Ketoconazol ist die systemische Salmeterolexposition signifikant erhöht. Dies kann zu einer erhöhten Inzidenz systemischer Nebenwirkungen führen (z.B. Verlängerung des QTc-Intervalls und Palpitationen). Eine gleichzeitige Behandlung mit Ketoconazol oder anderen potenten CYP3A4-Hemmern sollte daher vermieden werden, es sei denn, der Nutzen übersteigt das potenziell erhöhte Risiko systemischer Nebenwirkungen einer Salmeterolbehandlung (siehe Abschnitt 4.5).
Die Anwendung von Flumetor kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Sowohl die Behandlung mit nicht-selektiven als auch mit selektiven Beta-Blockern sollte vermieden werden, es sei denn, es gibt zwingende Gründe für deren Anwendung.
Die gleichzeitige Anwendung anderer beta-adrenerger Arzneimittel kann potentiell additiv wirken.
Fluticasonpropionat
Unter normalen Umständen werden nach inhalativer Anwendung aufgrund eines ausgeprägten First-Pass-Metabolismus und einer hohen systemischen Clearance durch das Cytochrom P450 3A4 in Darm und Leber niedrige Plasmakonzentrationen von Fluticasonpropionat erreicht. Daher sind durch Fluticasonpropionat vermittelte, klinisch relevante Wechselwirkungen unwahrscheinlich.
In einer Interaktionsstudie an gesunden Probanden erhöhten 2-mal täglich 100 mg Ritonavir (ein hochpotenter Inhibitor des Cytochrom P450 3A4) die Plasmakonzentrationen von nasal appliziertem Fluticasonpropionat mehrere hundert Mal, mit der Folge deutlich reduzierter Serum-Kortisolspiegel. Für die inhalative Anwendung von Fluticasonpropionat liegen entsprechende Informationen nicht vor, jedoch ist ein deutlicher Anstieg der Plasmaspiegel von Fluticasonpropionat zu erwarten. Über Fälle von Cushing-Syndrom und adrenaler Suppression wurde berichtet. Die Kombination sollte vermieden werden, sofern der Nutzen das erhöhte Risiko systemischer Kortikoid-Nebenwirkungen nicht überwiegt.
In einer kleinen Studie an gesunden Probanden erhöhte Ketoconazol, ein etwas weniger potenter Inhibitor von CYP3A, die Fluticasonpropionat-Exposition nach einer einzelnen Inhalation um 150 %. Dies reduzierte, verglichen mit Fluticasonpropionat alleine, das Kortisol im Plasma stärker. Bei gleichzeitiger Behandlung mit anderen potenten Inhibitoren von CYP3A, wie z. B. Itraconazol, ist ebenfalls eine Zunahme der systemischen Fluticasonpropionat-Exposition und des Risikos systemischer Nebenwirkungen zu erwarten. Deshalb ist Vorsicht geboten, und eine LangzeitBehandlung mit solchen Arzneimitteln sollte, wenn möglich, vermieden werden.
Salmeterol
Potente CYP3A4-Hemmer
Eine Kombinationstherapie von Ketoconazol (400 mg, oral, einmal täglich) mit Salmeterol (50 Mikrogramm, inhalativ, zweimal täglich) bei 15 gesunden Probanden über einen Zeitraum von 7 Tagen führte zu einem signifikant erhöhten Plasmaspiegel von Salmeterol (1,4-fache Cmax und 15-fache AUC). Dies kann, verglichen mit einer alleinigen Behandlung mit Salmeterol oder Ketoconazol, zu einer erhöhten Inzidenz anderer systemischer Nebenwirkungen der Salmeteroltherapie (z.B. Verlängerung des QTc-Intervalls und Palpitationen) führen (siehe Abschnitt 4.4).
In Bezug auf Blutdruck, Herzfrequenz sowie Glucose- und Kaliumkonzentration im Blut wurden keine klinisch signifikanten Auswirkungen beobachtet. Die gleichzeitige Verabreichung von Ketoconazol führte weder zu einer erhöhten Eliminationshalbwertszeit von Salmeterol noch zu einer erhöhten Akkumulation von Salmeterol bei wiederholten Gaben.
Die gleichzeitige Verabreichung von Ketoconazol sollte vermieden werden, es sei denn, der Nutzen übersteigt das potentiell erhöhte Risiko systemischer Nebenwirkungen einer Salmeteroltherapie. Ein ähnliches Wechselwirkungsrisiko mit anderen potenten CYP3A4-Hemmern (z.B. Itraconazol, Telithromycin, Ritonavir) ist wahrscheinlich.
Moderate CYP 3A4-Hemmer
Bei 15 gesunden Probanden ergab eine gleichzeitige Verabreichung von Erythromycin (500 mg, oral, dreimal täglich) und Salmeterol (50 Mikrogramm, inhalativ, zweimal täglich) über einen Zeitraum von 6 Tagen eine leicht, aber statistisch nicht signifikant erhöhte Salmeterolspiegel (1,4-fache Cmax und 1,2-fache AUC). Die gleichzeitige Gabe von Erythromycin war nicht mit schwerwiegenden Nebenwirkungen assoziiert.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Einige Daten zur Wirkung bei schwangeren Frauen (zwischen 300-1000 Schwangerschaften) weisen weder auf eine zu Fehlbildungen führende Toxizität noch auf feto-/ neonatale Toxizität von Salmeterol und Fluticasonpropionat hin. Tierexperimentelle Untersuchungen zeigten eine Reproduktionstoxizität nach Verabreichung von Beta-2-Adrenorezeptor-Agonisten und Glucocorticosteroiden (siehe Abschnitt 5.3).
Schwangeren Frauen soll Flumetor nur dann verabreicht werden, wenn der erwartete Nutzen für die Mutter höher ist als jegwegliches potentielles Risiko für den Fötus.
Bei der Behandlung von schwangeren Frauen sollte die niedrigste wirksame Dosis Fluticasonpropionat angewendet werden, die eine angemessene Asthmakontrolle gewährleistet.
Stillzeit
Es ist nicht bekannt, ob Salmeterol und Fluticasonpropionat oder ihre Metaboliten in die Muttermilch sezerniert werden.
In Studien wurde gezeigt, dass Salmeterol und Fluticasonpropionat und ihre Metaboliten bei laktierenden Ratten in die Milch sezerniert werden.
Ein Risiko für Neugeborene/ Säuglinge, die gestillt werden, kann nicht ausgeschlossen werden. Eine Entscheidung muss darüber getroffen werden, ob das Stillen des Kindes oder die Therapie mit Flumetor eingestellt wird. Dabei müssen der Vorteil des Stillens für das Kind und der Nutzen der Therapie für die Mutter berücksichtigt werden.
Fertilität
Zu Auswirkungen beim Menschen liegen keine Daten vor. Jedoch zeigten tierexperimentelle Untersuchungen keine Auswirkungen von Salmeterol oder Fluticasonpropionat auf die Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Da Flumetor Salmeterol und Fluticasonpropionat enthält, können diejenigen Nebenwirkungen nach Art und Schweregrad erwartet werden, die mit jedem der beiden Wirkstoffe verbunden sind. Es gibt keinen Hinweis dafür, dass zusätzliche Nebenwirkungen nach einer gemeinsamen Anwendung der beiden Wirkstoffe auftreten.
Nebenwirkungen, die bei der Anwendung von Salmeterol oder Fluticasonpropionat auftraten, sind nachfolgend aufgeführt, geordnet nach Systemorganklassen und Häufigkeit. Die Häufigkeiten sind wie folgt definiert: sehr häufig (> 1/10), häufig (>
1/100, < 1/10), gelegentlich (> 1/1.000, < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000) und nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) . Die Häufigkeiten wurden von den Daten klinischer Studien abgeleitet. Die Inzidenz bei Placebo wurde nicht berücksichtigt.
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen & |
Candidiasis (Soorbefall) im Mund- und |
Häufig |
|
parasitäre |
Rachenraums |
Häufig1, 3 5 |
|
Erkrankungen |
Pneumonie | |
|
Bronchitis |
Häufig1,3 | |
|
Erkrankungen des |
Überempfindlichkeitsreaktionen mit | |
|
Immunsystems |
folgenden Symptomen: | |
|
Überempfindlichkeitsreaktionen mit Hautbeteiligung |
Selten | |
|
Angioödem (überwiegend faziales und oropharyngeales Ödem), |
Selten | |
|
Atembeschwerden (Dyspnoe) |
Gelegentlich | |
|
Atembeschwerden (Bronchospasmus) |
Selten | |
|
Anaphylaktische Reaktionen einschließlich anaphylaktischer Schock |
Selten | |
|
Endokrine |
Cushing-Syndrom, cushingoide |
Selten4 |
|
Erkrankungen |
Erscheinungen, adrenale Suppression, Wachstumsverzögerungen bei Kindern und Jugendlichen, verminderte Knochendichte | |
|
Stoffwechsel- und |
Hypokaliämie |
Häufig3 |
|
Ernährungsstörungen |
Hyperglykämie |
Selten4 |
|
Psychiatrische Erkrankungen |
Angstzustände Schlafstörungen und Verhaltensänderungen einschließlich psychomotorischer Hyperaktivität und Reizbarkeit (überwiegend bei Kindern) |
Gelegentlich Selten |
|
Depressionen, aggressives Verhalten (überwiegend bei Kindern) |
Nicht bekannt | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen Tremor |
Sehr häufig1 Gelegentlich |
|
Augenerkrankungen |
Katarakt, Glaukom |
Selten4 |
|
Herzerkrankungen |
Palpitationen Tachykardie Kardiale Arrhythmien (einschließlich Vorhofflimmern, supraventrikuläre Tachykardie und Extrasystolen) Angina pectoris |
Gelegentlich Gelegentlich Selten Gelegentlich |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Nasopharyngitis Irritationen der Rachenschleimhaut Heiserkeit/ Dysphonie Sinusitis Paradoxe Bronchospasmen |
Sehr häufig2, 3 Gelegentlich Häufig Häufig1,3 Selten4 |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Kontusionen |
Häufig1, 3 |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelkrämpfe Traumatische Frakturen Arthralgie Myalgie |
Gelegentlich Häufig1, 3 Häufig Häufig |
1 Häufig bei Placebo berichtet 2Sehr häufig bei Placebo berichtet
3In einer Studie zu COPD über einen Zeitraum von 3 Jahren berichtet 4Siehe Abschnitt 4.4 5Siehe Abschnitt 5.1
Beschreibung ausgewählter Nebenwirkungen
Über die pharmakologischen Nebenwirkungen einer Beta2-Agonisten-Behandlung, wie Tremor, Palpitationen und Kopfschmerzen ist berichtet worden. Sie sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab.
Durch den Fluticasonpropionat-Anteil können bei einigen Patienten Heiserkeit und Candidiasis (Soorbefall) im Mund- und Rachenraum auftreten. Sowohl Heiserkeit als auch dem Auftreten einer Candidiasis kann vorgebeugt werden, indem nach der Anwendung von Flumetor der Mund mit Wasser ausgespült bzw. gegurgelt wird. Bei symptomatischer Candidiasis empfiehlt sich die lokale Behandlung mit einem gegen diese Pilzerkrankung wirksamen Arzneimittel. Die Anwendung von Flumetor sollte währenddessen fortgeführt werden.
In Studien mit Patienten mit COPD wurde von Pneumonien berichtet (siehe Abschnitt 5.1).
Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Verminderung der Knochendichte, Katarakt und Glaukom ein (siehe Abschnitt 4.4).
Es ist sehr selten über Hyperglykämie berichtet worden (siehe Abschnitt 4.4).
Wie bei anderen Inhalationstherapien können paradoxe Bronchospasmen auftreten (siehe Abschnitt 4.4).
4.9 Überdosierung
Aus klinischen Studien liegen keine Daten zur Überdosierung mit Flumetor vor. Im Folgenden sind jedoch Daten zur Überdosierung mit den Einzelwirkstoffen aufgeführt:
Die Anzeichen und Symptome einer Überdosierung mit Salmeterol sind Tremor, Kopfschmerzen und Tachykardie. Die bevorzugten Antidote sind kardioselektive BetaBlocker, die bei Patienten mit Bronchospasmen in der Vorgeschichte mit Vorsicht anzuwenden sind. Wenn die Behandlung mit Flumetor aufgrund einer Überdosierung des Beta-Agonisten-Anteils des Arzneimittels abgebrochen werden muss, sollte die Anwendung einer geeigneten Kortikoid-Ersatzbehandlung in Erwägung gezogen werden. Zusätzlich kann eine Hypokaliämie auftreten, und eine Kaliumsubstitution sollte in Erwägung gezogen werden.
Akute Überdosierung: Die kurzzeitige Inhalation von höheren als den therapeutisch empfohlenen Dosierungen von Fluticasonpropionat kann zu einer zeitweiligen Suppression der Nebennierenrindenfunktion führen. Diese erfordert keine Notfallbehandlung, da die Nebennierenrindenfunktion innerhalb weniger Tage wieder hergestellt ist, wie durch Plasma-Kortisol-Messungen belegt wurde.
Chronische Überdosierung von inhaliertem Fluticasonpropionat: Siehe Abschnitt 4.4: Risiko einer Nebennierenrindensuppression: Die Kontrolle der adrenalen Reserve kann notwendig sein. In den Fällen einer Überdosierung mit Fluticasonpropionat kann die Behandlung mit Flumetor in einer geeigneten Dosierung zur Kontrolle der Symptome weiter fortgeführt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Sympathomimetika und andere Mittel bei obstruktiven Atemwegserkrankungen ATC-Code: R03AK06
Klinische Studien mit Salmeterol/ Fluticasonpropionat bei Patienten mit Asthma Eine 12-monatige Studie („Gaining Optimal Asthma Control”, GOAL) an 3416 erwachsenen und jugendlichen Patienten mit persistierendem Asthma bronchiale verglich die Sicherheit und Wirksamkeit von Salmeterol/ Fluticasonpropionat mit dem inhalativen Kortikoid Fluticasonpropionat allein, um zu prüfen, ob die Zielkriterien des Asthmamanagements erreichbar sind.
Die Dosis des inhalativen Kortikoids allein und die Dosis der Kombination wurden alle 12 Wochen bis zum Erreichen einer **vollständigen Asthmakontrolle oder der Maximaldosis der Studienmedikation erhöht. Die Ergebnisse von GOAL zeigten, dass unter Behandlung mit Salmeterol/ Fluticasonpropionat mehr Patienten eine Asthmakontrolle erreichten als Patienten unter dem inhalativen Kortikoid allein und diese Kontrolle wurde bei einer niedrigeren Kortikoiddosis erreicht.
Gute Asthmakontrolle wurde mit Salmeterol/ Fluticasonpropionat schneller als mit inhalativem Kortikoid (ICS) allein erreicht. Die Behandlungszeit, bis 50% der Patienten erstmals eine gute Asthmakontrolle über eine Woche erreichten, betrug bei den mit Salmeterol/ Fluticasonpropionat behandelten Patienten 16 Tage, bei den mit ICS behandelten 37 Tage. In der Subgruppe der steroid-naiven Patienten betrug die Behandlungszeit bis zur oben beschriebenen Asthmakontrolle bei den mit Salmeterol/ Fluticasonpropionat behandelten Patienten 16 Tage, bei den mit ICS behandelten Patienten 23 Tage.
Die Gesamtstudienergebnisse zeigten folgendes:
|
Patienten (in Prozent), die über 12 Monate *gute Asthmakontrolle und “vollständige Asthmakontrolle erreichten | ||||
|
Behandlung vor Studiebeginn |
Salmeterol/ Fluticasonpropionat |
Fluticasonpropionat | ||
|
Gute |
Vollständige |
Gute |
Vollständige | |
|
Kontrolle |
Kontrolle |
Kontrolle |
Kontrolle | |
|
Kein ICS (Monotherapie mit SABA) |
78 % |
50 % |
70 % |
40 % |
|
Niedrig dosiertes ICS (< 500 |jg BDP oder entsprechende Dosis eines anderen ICS/Tag) |
75 % |
44 % |
60 % |
28 % |
|
Mittlere Dosis ICS (500-1000 jg BDP oder entsprechende Dosis eines anderen ICS/Tag) |
62 % |
29 % |
47 % |
16 % |
|
Gepoolte Ergebnisse über die 3 Behandlungsstufen |
71 % |
41 % |
59 % |
28 % |
*Gut kontrolliertes Asthma: gelegentliche Symptome oder gelegentliche Anwendung von SABA oder vorhergesagte Lungenfunktion kleiner 80 % und kein Aufwachen in der Nacht, keine Exazerbationen und keine Nebenwirkungen, die eine Änderung der Therapie erfordern.
**Vollständige Asthmakontrolle: keine Symptome, keine Anwendung von SABA, Lungenfunktion größer als bzw. gleich 80 % der vorhergesagten Lungenfunktion, kein Aufwachen in der Nacht, keine Exazerbationen und keine Nebenwirkungen, die eine Änderung der Therapie erfordern.
Die Ergebnisse dieser Studie lassen darauf schließen, dass Salmeterol/ Fluticasonpropionat zweimal täglich 50/ 100 Mikrogramm bei Patienten mit mittelschwerem, persistierendem Asthma, bei denen eine schnelle Asthmakontrolle notwendig ist, als initiale Erhaltungstherapie in Betracht gezogen werden kann (siehe Abschnitt 4.2).
In einer doppelblinden, randomisierten, Parallelgruppenstudie an 318 Patienten mit persistierendem Asthma im Alter von mindestens 18 Jahren wurde die Sicherheit und Verträglichkeit einer Anwendung von 2-mal täglich 2 Inhalationen (doppelte Dosierung) Salmeterol/ Fluticasonpropionat Diskus über 2 Wochen untersucht. Die Studie zeigte, dass die Verdoppelung der Inhalationen der jeweiligen Wirkstärke von Salmeterol/ Fluticasonpropionat für bis zu 14 Tage zu einem geringen Anstieg der durch BetaAgonisten verursachten Nebenwirkungen führte (Tremor: 1 Patient [1 %] versus 0; Palpitationen: 6 [3 %] versus 1 [< 1 %]; Muskelkrämpfe: 6 [3 %] versus 1 [< 1 %] und dass eine ähnliche Inzidenz von Nebenwirkungen beobachtet wurde, die auf die Anwendung von inhalativen Kortikoiden zurückzuführen ist: (z. B. orale Candidiasis: 6 [6 %] versus 16 [8 %]; Heiserkeit: 2 [2 %] versus 4 [2 %]), verglichen mit der Anwendung einer Inhalation 2-mal täglich. Der geringe Anstieg der durch BetaAgonisten verursachten Nebenwirkungen sollte berücksichtigt werden, wenn eine Verdoppelung der Dosierung von Salmeterol/ Fluticasonpropionat bei erwachsenen Patienten, die eine zusätzliche kurzfristige (bis zu 14 tägig) inhalative Kortikoidtherapie benötigen, vom Arzt in Betracht gezogen wird.
Klinische Studien mit Salmeterol/ Fluticasonpropionat bei Patienten mit COPD TORCH war eine 3-jährige Studie zur Beurteilung der Wirkung einer Behandlung mit Salmeterol/ Fluticasonpropionat zweimal täglich 50/ 500 Mikrogramm, Salmeterol zweimal täglich 50 Mikrogramm, Fluticasonpropionat (FP) zweimal täglich 500 Mikrogramm oder Placebo auf die Gesamtmortalität bei Patienten mit COPD.
Patienten mit COPD mit einer FEV1 < 60 % des vorhergesagten Normwerts zu Studienbeginn (vor Anwendung eines Bronchodilatators) wurden auf eine doppelt verblindete Therapie randomisiert. Während der Studie konnten die Patienten ihre gewöhnliche Therapie mit Ausnahme anderer inhalativer Corticosteroide, lang wirkender Bronchodilatatoren und systemischer Langzeit-Corticosteroide fortsetzen. Für alle Patienten wurde der Überlebensstatus nach 3 Jahren bestimmt, ungeachtet dessen, ob die Behandlung mit dem Prüfpräparat abgebrochen wurde. Als primärer Endpunkt wurde die Reduzierung der Gesamtmortalität nach 3 Jahren bei einer Behandlung mit Salmeterol/ Fluticasonpropionat verglichen mit Placebo festgelegt.
|
Placebo N=1524 |
Salmeterol 50 N=1521 |
FP 500 N=1534 |
Salmeterol/ FP 50/ 500 N=1533 | |
|
Gesamtmortalität nach 3 Jahren | ||||
|
Anzahl der Todesfälle (%) |
231 (15,2 %) |
205 (13,5 %) |
246 (16,0 %) |
193 (12,6 %) |
|
Hazard Ratio vs. Placebo (CI) |
entfällt |
0,879 (0,73; 1,06) |
1,060 (0,89; 1,27) |
0,825 (0,68; 1,00) |
|
P-Wert |
0,180 |
0,525 |
0,0521 | |
|
Hazard Ratio Salmeterol/ FP 50/ 500 vs. Bestandteile (CI) |
entfällt |
0,932 (0,77; 1,13) |
0,774 (0,64; 0,93) |
entfällt |
|
P-Wert |
0,481 |
0,007 | ||
|
1Nicht signifikanter P-Wert nach Anpassung für 2 Zwischenanalysen zum Vergleich der primären Wirksamkeit gemäß einer anhand des Raucherstatus stratifizierten Logrank-Analyse | ||||
Verglichen mit Placebo lag bei Patienten, die mit Salmeterol/ Fluticasonpropionat über einen Zeitraum von 3 Jahren behandelt wurden, tendenziell eine verbesserte Überlebenszeit vor. Die statistische Signifikanz von p < 0,05 konnte jedoch nicht erreicht werden.
Der prozentuale Anteil von Patienten, die innerhalb von 3 Jahren aufgrund einer COPD-bedingten Ursache gestorben sind, betrug 6,0 % unter Placebo, 6,1 % unter Salmeterol, 6,9 % unter FP und 4,7 % unter Salmeterol/ Fluticasonpropionat.
Der durchschnittliche Anteil mittelschwerer bis schwerer Exazerbationen pro Jahr war in der Salmeterol/ Fluticasonpropionat-Gruppe verglichen mit einer Therapie mit Salmeterol, FP und Placebo signifikant reduziert (mittlere Häufigkeit in der Salmeterol/ Fluticasonpropionat-Gruppe 0,85 verglichen mit 0,97 in der Salmeterol-, 0,93 in der FP- und 1,13 in der Placebo-Gruppe). Dies entspricht einer Reduzierung der Rate mittelschwerer bis schwerer Exazerbationen von 25 % (95 % CI: 19 % bis 31 %; p < 0,001) verglichen mit Placebo, 12 % verglichen mit Salmeterol (95 % CI: 5 % bis 19 %; p = 0,002) und 9 % verglichen mit FP (95 % CI: 1 % bis 16 %; p = 0,024). Im Vergleich zu Placebo reduzierten Salmeterol und FP signifikant die Exazerbationsrate um 15 % (95 % CI: 7 % bis 22 %; p < 0,001) bzw. 18 % (95 % CI: 11 % bis 24 %;
p < 0,001).
Die gesundheitsbezogene Lebensqualität gemäß dem SGRQ-Fragebogen zu Atemwegsbeschwerden (St George's Respiratory Questionnaire) wurde im Vergleich zu Placebo in allen Behandlungen mit dem Verum verbessert. Die durchschnittliche Verbesserung innerhalb von 3 Jahren betrug bei Salmeterol/ Fluticasonpropionat verglichen mit Placebo -3,1 Einheiten (95 % CI: -4,1 bis -2,1; p < 0,001), verglichen mit Salmeterol -2,2 Einheiten (p < 0,001) und verglichen mit FP 1,2 Einheiten (p = 0,017). Eine Verringerung um 4 Einheiten gilt als klinisch relevant.
Die geschätzte 3-Jahres-Wahrscheinlichkeit einer als unerwünschtes Ereignis berichteten Pneumonie lag bei 12,3 % für Placebo, 13,3 % für Salmeterol, 18,3 % für FP und 19,6 % für Salmeterol/ Fluticasonpropionat (Hazard Ratio von Salmeterol/ Fluticasonpropionat vs. Placebo: 1,64, 95 % CI: 1,33 bis 2,01, p < 0,001). Es gab keine erhöhte Mortalität aufgrund einer Pneumonie. Während der Behandlung betrug die Anzahl von hauptsächlich von einer Pneumonie verursachten Todesfälle 7 in der Placebo-, 9 in der Salmeterol-, 13 in der FP- und 8 in der Salmeterol/ Fluticasonpropionat-Gruppe. Es gab keine signifikante Differenz in der Wahrscheinlichkeit einer Knochenfraktur (5,1 % Placebo, 5,1 % Salmeterol, 5,4 % FP und 6,3 % Salmeterol/ Fluticasonpropionat; Hazard Ratio für Salmeterol/ Fluticasonpropionat vs. Placebo: 1,22, 95 % CI: 0,87 bis 1,72, p = 0,248).
Placebo-kontrollierte klinische Prüfungen über 6 und 12 Monate haben gezeigt, dass die regelmäßige Anwendung von Salmeterol/ Fluticasonpropionat 50/500 Mikrogramm die Lungenfunktion verbessert und Atemnot sowie die Anwendung von Bedarfsmedikation reduziert.
Bei den Studien SCO40043 und SCO100250 handelte es sich um randomisierte, doppelblinde Replikationsstudien im Parallelgruppendesign, in denen die Wirkung von Salmeterol/ Fluticasonpropionat 50/ 250 Mikrogramm zweimal täglich (eine Dosis, die in der Europäischen Union nicht zur Behandlung von COPD zugelassen ist) mit Salmeterol 50 Mikrogramm zweimal täglich auf die jährliche Rate von mittelschweren/ schweren Exazerbationen bei Patienten mit COPD mit einer FEV1 unter 50 % des vorhergesagten Wertes und anamnestisch bekannten Exazerbationen verglichen wurde. Mittelschwere/ schwere Exazerbationen wurden wie folgt definiert: sich verschlechternde Symptome, die eine Behandlung mit oralen Corticosteroiden und/ oder Antibiotika oder Klinikeinweisungen erforderten.
Die Studien begannen mit einer 4-wöchigen Run-in-Phase, in der alle Patienten offen Salmeterol/ FP 50/ 250 erhielten, um die COPD-Pharmakotherapie zu standardisieren und die Erkrankung vor der Randomisierung auf eine verblindete Studienmedikation über 52 Wochen zu stabilisieren. Die Patienten wurden 1:1 auf Salmeterol/ FP 50/ 250 (Gesamt-ITT n=776) oder Salmeterol (Gesamt-ITT n=778) randomisiert. Vor der Run-in-Phase setzten die Patienten die bisherige COPD-Medikation bis auf kurz wirksame Bronchodilatoren ab. Während des Behandlungszeitraums war die gleichzeitige Anwendung von inhalativen lang wirksamen Bronchodilatatoren (Beta-2-Agonisten and Anticholinergika), von Kombinationspräparaten mit Ipratropium/ Salbutamol, oralen Beta-2-Agonisten und Theophyllin-Präparaten nicht erlaubt. Orale Corticosteroide und Antibiotika waren für die akute Behandlung von COPD-Exazerbationen unter Beachtung der speziellen Richtlinien für die Anwendung erlaubt. Salbutamol setzten die Patienten während der Studien als Bedarfsmedikation ein.
Die Ergebnisse beider Studien zeigen, dass die Behandlung mit Salmeterol/ Fluticasonpropionat 50/ 250 zu einer signifikant geringeren jährlichen Rate von mittelschweren/ schweren COPD-Exazerbationen verglichen mit Salmeterol führte (SCO40043: 1,06 bzw. 1,53 pro Patientenjahr, relatives Risiko von 0,70, 95% CI: 0,58 bis 0,83, p<0,001; SCO100250: 1,10 bzw. 1,59 pro Patientenjahr, relatives Risiko von 0,70, 95% CI: 0,58 bis 0,83, p<0,001). Die Ergebnisse für die sekundären Wirksamkeitsparameter (Zeit bis zur ersten mittelschweren/ schweren Exazerbation, die jährliche Rate von Exazerbationen, die orale Corticosteroide erfordern, und die morgendliche prä-bronchodilatatorische FEV1) fielen deutlich zugunsten von Salmeterol/ Fluticasonpropionat 50/250 Mikrogramm zweimal täglich gegenüber Salmeterol aus. Die Profile unerwünschter Ereignisse waren annähernd vergleichbar mit Ausnahme einer höheren Inzidenz von Pneumonie und bekannten lokalen Nebenwirkungen (Candidiasis und Dysphonie) in der Gruppe mit Salmeterol/ Fluticasonpropionat 50/ 250 Mikrogramm zweimal täglich gegenüber Salmeterol. Ereignisse, die mit einer Pneumonie in Zusammenhang standen, wurden für 55 Patienten (7%) der Gruppe mit Salmeterol/ Fluticasonpropionat 50/ 250 Mikrogramm zweimal täglich und 25 Patienten (3%) in der Salmeterolgruppe berichtet. Die erhöhte Inzidenz von berichteten Pneumonien unter Salmeterol/ Fluticasonpropionat 50/ 250 Mikrogramm zweimal täglich erreicht eine ähnliche Größenordnung wie die Inzidenz, die nach Behandlung mit Salmeterol/ Fluticasonpropionat 50/ 500 Mikrogramm zweimal täglich in TORCH berichtet wurde.
SMART-Studie (Salmeterol Multi-Center Asthma Research Trial)
SMART war eine multizentrische, randomisierte, doppel-blinde, placebo-kontrollierte, Parallelgruppen-Studie in den USA über 28 Wochen.
In dieser Studie wurden randomisiert 13.176 Patienten einer Behandlung mit Salmeterol (50 Mikrogramm 2-mal täglich) und 13.179 Patienten Placebo zugeordnet, jeweils zusätzlich zu ihrer üblichen Asthma-Therapie. In die Studie wurden Patienten mit Asthma eingeschlossen, die 12 Jahre oder älter waren und zu diesem Zeitpunkt Asthma-Medikamente (aber keine langwirksamen Beta2-Sympathomimetika) anwendeten. Eine Basistherapie mit ICS wurde zu Studienbeginn dokumentiert, war aber in der Studie nicht gefordert. Primärer Endpunkt in SMART war die Gesamtanzahl der atemwegsbedingten Todesfälle und atemwegsbedingten lebensbedrohlichen Ereignisse.
Hauptergebnisse der SMART-Studie: primärer Endpunkt
|
Patientengruppe |
Anzahl der primären Endpunktereignisse / Patientenzahl |
Relatives Risiko | |
|
Salmeterol |
Placebo |
(95 % Konfidenzintervall) | |
|
Alle Patienten |
50/13176 |
36/13179 |
1,40 (0,91; 2,14) |
|
Patienten, die inhalative Steroide anwendeten |
23/6127 |
19/6138 |
1,21 (0,66; 2,23) |
|
Patienten, die keine inhalativen Steroide anwendeten |
27/7049 |
17/7041 |
1,60 (0,87; 2,93) |
|
Patienten afroamerikanischer Herkunft |
20/2366 |
5/2319 |
4,10 (1,54; 10,90) |
(Die Risiko-Angaben in Fettdruck sind statistisch signifikant bei 95% KonfidenzIntervall.)
Hauptergebnisse der SMART-Studie bei Anwendung inhalativer Steroide zu Studienbeginn: sekundäre Endpunkte
|
Anzahl der sekundären Endpunktereignisse / Patientenzahl |
Relatives Risiko (95 % Konfidenzintervall) | ||
|
Salmeterol |
Placebo | ||
|
Atemwegsbedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
10/6127 |
5/6138 |
2,01 (0,69; 5,86) |
|
Patienten, die keine inhalativen Steroide anwendeten |
14/7049 |
6/7041 |
2,28 (0,88; 5,94) |
|
Gesamtzahl asthmabedingter Todesfälle und lebensbedroh |
icher Ereignisse | ||
|
Patienten, die inhalative Steroide anwendeten |
16/6127 |
13/6138 |
1,24, (0,60; 2,58) |
|
Patienten, die keine inhalativen Steroide anwendeten |
21/7049 |
9/7041 |
2,39 (1,10; 5,22) |
|
Asthma-bedingte Todesfälle | |||
|
Patienten, die inhalative Steroide anwendeten |
4/6127 |
3/6138 |
1,35 (0,30; 6,04) |
|
Patienten, die keine inhalativen Steroide anwendeten |
9/7049 |
0/7041 | |
[*= konnte nicht berechnet werden, da in der Placebo-Gruppe keine entsprechenden Ereignisse eingetreten waren. Die Risikoangaben in Fettdruck sind statistisch signifikant (95% Konfidenz-Intervall)].
Die sekundären Endpunkte in der obigen Tabelle erreichten statistische Signifikanz in der Gesamt- Population. Die sekundären Endpunkte der „Gesamtzahl von Todesfällen und lebensbedrohlichen Ereignissen jeglicher Ursache“, „Todesfällen jeglicher Ursache“ und „Krankenhauseinweisungen jeglicher Ursache“ erreichten keine statistische Signifikanz in der Gesamt-Population.
Wirkmechanismus:
Flumetor enthält Salmeterol und Fluticasonpropionat, die verschiedene Wirkungsmechanismen haben.
Die beiden Wirkungsmechanismen werden im Folgenden dargestellt:
Salmeterol:
Salmeterol ist ein selektiver langwirkender (12 Stunden) Beta-2-Adrenozeptor-Agonist mit einer langen Seitenkette, die an die Exo-Seite des Rezeptors bindet.
Salmeterol bewirkt mit mindestens 12 Stunden eine länger anhaltende Bronchodilatation als herkömmliche kurzwirkende Beta-2-Agonisten in empfohlenen Dosierungen.
Fluticasonpropionat:
Das Glukokortikoid Fluticasonpropionat hat bei inhalativer Anwendung in den empfohlenen Dosierungen eine antientzündliche Wirkung in der Lunge. Hieraus resultiert eine Abnahme der Asthmasymptome und Exazerbationen, mit weniger Nebenwirkungen als bei einer systemischen Kortikoidtherapie.
5.2 Pharmakokinetische Eigenschaften
Nach inhalativer Anwendung von Salmeterol und Fluticasonpropionat in Kombination war die Pharmakokinetik jedes einzelnen Bestandteils mit der Kinetik vergleichbar, die sich bei voneinander getrennter Anwendung ergab.
Daher kann bei der Beurteilung der Pharmakokinetik jeder einzelne Wirkstoff getrennt betrachtet werden.
Salmeterol:
Salmeterol wirkt lokal in der Lunge, deshalb geben Plasmaspiegel keinen Hinweis auf therapeutische Wirkungen. Über die pharmakokinetischen Eigenschaften von Salmeterol sind außerdem nur begrenzte Daten verfügbar, da nach inhalativer Anwendung therapeutischer Dosierungen nur geringe Plasmakonzentrationen (ca. 200 pg/ml oder weniger) erreicht werden, die mit den verfügbaren Messmethoden technisch schwer zu bestimmen sind.
Fluticasonpropionat:
Die absolute Bioverfügbarkeit von inhaliertem Fluticasonpropionat bei Probanden liegt im Bereich von ca. 10 bis 30 % der angegebenen Dosis, abhängig vom verwendeten Inhalationsgerät. Bei Patienten mit Asthma bronchiale oder COPD ist ein geringeres Ausmaß der systemischen Exposition von inhaliertem Fluticasonpropionat beobachtet worden.
Die systemische Aufnahme findet hauptsächlich über die Lungen statt, und zwar anfangs schnell, dann verzögert. Der Rest der inhalierten Dosis kann zwar verschluckt werden, trägt aber aufgrund der geringen Wasserlöslichkeit und des vor-systemischen Metabolismus nur minimal zur systemischen Exposition bei, was eine orale Bioverfügbarkeit von weniger als 1 % zur Folge hat. Es zeigt sich ein linearer Anstieg der systemischen Exposition mit Erhöhung der inhalierten Dosis.
Fluticasonpropionat ist charakterisiert durch eine hohe Plasmaclearance (1150 ml/min), ein großes Verteilungsvolumen im Steady-State (ca. 300 l) und eine terminale Halbwertszeit von ca. 8 Stunden.
Die Plasmaproteinbindung beträgt 91 %.
Fluticasonpropionat wird sehr schnell aus dem Blutkreislauf entfernt. Hauptsächlich geschieht dies durch Metabolisierung durch das Cytochrom P450 Enzym CYP3A4 zu einem inaktiven Carboxylsäurederivat. Andere nicht identifizierte Metaboliten werden auch in den Fäzes gefunden.
Die renale Clearance von Fluticasonpropionat ist vernachlässigbar. Weniger als 5 % wird in Form von Metaboliten im Urin ausgeschieden. Der Großteil der Dosis wird in Form von Metaboliten und unveränderten Wirkstoffen in die Fäzes ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Die einzigen Bedenken in Bezug auf die Sicherheit bei der Anwendung am Menschen, die sich aus tierexperimentellen Untersuchungen zur getrennten Verabreichung von Salmeterolxinafoat und Fluticasonpropionat ableiten ließen, waren mit einer verstärkten pharmakologischen Wirkung assoziierte Effekte.
In tierexperimentellen Untersuchungen zur Reproduktion zeigte sich, dass Glucocorticoide Fehlbildungen hervorrufen können (Gaumenspalten, Skelettfehlbildungen). Diese Ergebnisse aus tierexperimentellen Untersuchungen scheinen jedoch für den Menschen in Anbetracht des empfohlenen Dosisbereichs nicht relevant zu sein. Tierexperimentelle Untersuchungen mit Salmeterolxinafoat ergaben nur bei hoher Exposition Hinweise auf eine embryofetale Toxizität. Bei Ratten wurden nach gleichzeitiger Anwendung in Dosierungen, die bekanntlich mit Glucocorticoid-induzierten Anomalien verbunden sind, eine erhöhte Inzidenz von Transpositionen der Nabelschnurarterien sowie eine unvollständige Ossifikation des Hinterhauptbeins festgestellt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Ein zweifarbiger Inhalator ist mit 60 Blisterpackungen (Alu-Alu-Folie) mit jeweils zwei Kammern zusammen mit einer Packungsbeilage in einer Faltschachtel verpackt. Jede Blisterpackung enthält eine Dosis der Arzneimittelkombination.
60 Dosen pro Packung.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Um eine korrekte Anwendung des Arzneimittels zu gewährleisten, sollte der Arzt oder Apotheker dem Patienten zeigen, wie der Inhalator richtig angewendet wird.
Hinweise für den Gebrauch und die Handhabung des Elpenhaler Diese Anweisungen für den Patienten erläutern die richtige Inhalation der beiden Arzneimittel, die in einer Blisterpackung mit 2 Kammern verpackt sind und im Elpenhaler aufbewahrt werden.
Beschreibung
Der Elpenhaler ist ein Inhalator, mit dem zwei Arzneimittel in Pulverform gleichzeitig inhaliert werden. Die beiden Arzneimittel bilden zusammen ein Kombinationspräparat. Jedes Arzneimittel ist getrennt voneinander in einem der zwei Kammern der speziell gestalteten Blisterpackung verpackt.
Die Blisterpackung mit 2 Kammern enthält eine Dosis des Kombinationspräparats.
Der Elpenhaler besteht aus 3 Teilen:


- Dem Mundstück und dessen Schutzkappe (1).
- Der Auflagefläche (2) zur Platzierung der Blisterpackung mit 2 Kammern.
- Dem Aufbewahrungsfach (3) zur Unterbringung der Blisterpackungen mit 2 Kammern.
Die 3 Teile sind miteinander verbunden und können einzeln geöffnet werden.
Auf der Auflagefläche befindet sich:
- 1 Befestigungspunkt (2A) zur Befestigung der Blisterpackung mit 2 Kammern.
- 2 Vertiefungen (2B) zur Aufnahme der zwei Kammern der Blisterpackung.
- 2 Führungsstege (2C) zur sicheren Positionierung der Blisterpackung mit 2 Kammern auf der Auflagefläche.
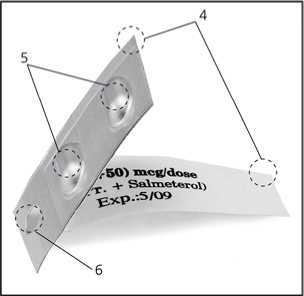
Eine Blisterpackung mit 2 Kammern enthält:
- 2 Folien (4).
- 2 Kammern (5), in einer befindet sich Salmeterol und in der anderen Fluticasonpropionat.
- 1 Loch (6).
Anwendung des Elpenhaler A. Vorbereitung des Geräts



Das Aufbewahrungsfach öffnen, eine Blisterpackung entnehmen und das Aufbewahrungsfach wieder schließen.
Schutzkappe vollständig vom Mundstück abnehmen.
Mundstück entsperren und nach hinten klappen, um die Auflagefläche freizulegen.
Die Blisterpackung mit 2 Kammern mit der glänzenden Seite nach oben halten.
Die Blisterpackung auf den Befestigungspunkt der Auflagefläche legen. Leicht auf die Blisterpackung drücken, um sicherzugehen, dass die Blisterpackung am Befestigungspunkt befestigt ist.
Die 2 Kammern der Blisterpackung passen nun in die dazu vorgesehenen Vertiefungen in der Auflagefläche und die Führungsstege stellen sicher, dass die Blisterpackung richtig positioniert ist.
Das Mundstück schließen und das überstehende Ende der Blisterpackung abziehen. Die Dosis kann nun inhaliert werden.
Das überstehende Ende sollte erst unmittelbar vor dem Inhalieren abgezogen werden.
Den Inhalator vom Mund entfernt halten.
B. Inhalation der Dosis


- Vollständig ausatmen und darauf achten, nicht auf das Mundstück des Inhalators auszuatmen.
- Den Elpenhaler zum Mund führen und die Lippen fest um das Mundstück schließen.
- Langsam und tief durch den Mund (und nicht durch die Nase) einatmen, bis die Lunge gefüllt ist.
- Atem etwa 5 Sekunden, oder so lange, wie es angenehm ist, anhalten und gleichzeitig den Inhalator aus dem Mund nehmen.
- Ausatmen und danach normal weiteratmen.
Das Mundstück öffnen. Das gesamte Pulver wurde inhaliert und die Kammern der Blisterpackung sind leer.
Die leere Blisterpackung entfernen und mit Schritt C fortfahren.
C. Reinigen des Geräts
- Nach jedem Gebrauch das Mundstück und die Auflagefläche mit einem trockenen Tuch oder trockenen Papiertuch abwischen. Zum Reinigen des Geräts kein Wasser verwenden.
- Mundstück schließen und Schutzkappe aufsetzen.
7. INHABER DER ZULASSUNG
ELPEN Pharmaceutical Co. Inc. 95 Marathonos Ave 190 09 Pikermi Attikis Griechenland
8. ZULASSUNGSNUMMERN
Flumetor 50 Mikrogramm/250 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation 84254.00.00
Flumetor 50 Mikrogramm/500 Mikrogramm/Dosis einzeldosiertes Pulver zur Inhalation
DATUM DER ERTEILUNG DER ZULASSUNG
9.
10.
[siehe Unterschrift]
STAND DER INFORMATION
VERKAUFSABGRENZUNG
Verschreibungspflichtig
11.