Flutide Mite 100 Diskus
1
Wortlaut der für die Fachinformation vorgesehenen Angaben
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Flutide® Junior 50 Diskus®
50 pg/Dosis, einzeldosiertes Pulver zur Inhalation Flutide® mite 100 Diskus®
100 pg/Dosis, einzeldosiertes Pulver zur Inhalation Flutide® 250 Diskus®
250 pg/Dosis, einzeldosiertes Pulver zur Inhalation Flutide® forte 500 Diskus®
500 pg/Dosis, einzeldosiertes Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Einzeldosis mit 12,5 mg Pulver von Flutide Junior 50 Diskus/Flutide mite 100 Diskus/Flutide 250 Diskus/Flutide forte 500 Diskus enthält:
50 pg/100 pg/250 pg/500 pg Fluticasonpropionat.
Sonstiger Bestandteil mit bekannter Wirkung: Lactose-Monohydrat
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Einzeldosiertes Pulver zur Inhalation
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Flutide Junior 50 Diskus/Flutide mite 100 Diskus/Flutide 250 Diskus/Flutide forte 500 Diskus Dauerbehandlung eines persistierenden Asthma bronchiale aller Schweregrade.
Flutide 250 Diskus/Flutide forte 500 Diskus
Behandlung der chronisch obstruktiven Lungenerkrankung (COPD) in Kombinationsbehandlung mit langwirksamen Bronchodilatatoren (z. B. langwirksame Beta-2-Sympathomimetika (LABA)).
Hinweis:
Flutide Diskus ist nicht zur Akutbehandlung eines Asthmaanfalles geeignet.
4.2 Dosierung und Art der Anwendung Dosierung
Die Dosierung von inhalativ appliziertem Fluticasonpropionat sollte für jeden Patienten so angepasst werden, dass eine Kontrolle der Beschwerden erreicht werden kann. Danach sollte die individuelle Erhaltungsdosis durch schrittweise Reduktion der Gesamttagesdosis ermittelt werden. Insgesamt sollte auf die niedrigste effektive Dosis eingestellt werden. Wenn geringere Konzentrationen an Fluticasonpropionat benötigt werden, so stehen eventuell niedriger dosierte Darreichungsformen (als Dosier-Aerosol bzw. Pulver zur Inhalation) zur Verfügung.
Bronchialasthma aller Schweregrade
Die Anfangsdosis sollte für jeden Patienten so angepasst werden, dass eine Kontrolle der Beschwerden erreicht werden kann. Danach sollte die individuelle Erhaltungsdosis durch schrittweise Reduktion der Gesamttagesdosis ermittelt werden.
Erwachsene und Jugendliche über 16 Jahre:
Initial wird je nach Schweregrad der Erkrankung folgende Dosierung empfohlen:
|
Leichtes Asthma |
2-mal täglich bis zu 250 pg Fluticasonpropionat |
|
Mittelschweres Asthma |
2-mal täglich 250 bis 500 pg Fluticasonpropionat |
|
Schweres Asthma |
2-mal täglich 500 pg bis 1,0 mg Fluticasonpropionat |
Die Erhaltungsdosis beträgt je nach Ansprechen auf die Behandlung 2-mal täglich bis zu 500 pg Fluticasonpropionat und sollte 2,0 mg nicht überschreiten. Tagesdosen oberhalb von 1,0 mg sollten nach Möglichkeit nicht längerfristig eingesetzt werden.
Bei jugendlichen und erwachsenen Asthmatikern, bei denen trotz der allgemein empfohlenen Dosierung von Fluticasonpropionat (bis zu 200 pg täglich) und trotz einer add-on Therapie mit einem langwirksamen Beta-2-Sympathomimetikum (LABA) keine optimale Asthmakontrolle erreicht wird, sollte eine Dosiserhöhung bis zu den oben aufgeführten Tageshöchstdosierungen in Erwägung gezogen werden.
Kinder über 4 Jahre:
2-mal täglich 50 bis 200 pg Fluticasonpropionat je nach Schweregrad der Erkrankung.
Das Bronchialasthma der Kinder über 4 Jahre ist bei der 2-mal täglichen Anwendung von 50 bis 100 pg Fluticasonpropionat normalerweise gut unter Kontrolle. Ansonsten kann zusätzlich die Dosis bis auf 2-mal täglich 200 pg Fluticasonpropionat erhöht werden.
In der Regel sollte die maximal zugelassene Tageshöchstdosis von 400 pg nicht überschritten werden. Tagesdosen oberhalb von 200 pg sollten längerfristig nicht eingesetzt werden.
Früh-, Neugeborene, Säuglinge und Kleinkinder:
Die Anwendung von Flutide Diskus bei Kindern unter 4 Jahren wird nicht empfohlen.
Dosierungsempfehlungen für Flutide Junior 50 Diskus/Flutide mite 100 Diskus/Flutide 250 Diskus/Flutide forte 500 Diskus
|
Einzeldosis (2-mal täglich anzuwenden) |
Einzeldosis (Fluticasonpropionat) |
Tagesdosis (Fluticasonpropionat) | |
|
Flutide Junior 50 Diskus |
1 Pulverinhalation |
50 pg |
100 pg |
|
Flutide mite 100 Diskus |
1 Pulverinhalation |
100 pg |
200 pg |
|
Flutide 250 Diskus |
1 Pulverinhalation |
250 pg |
500 pg |
|
Flutide forte 500 Diskus |
1 bis 2 Pulverinhalationen |
500 pg bis 1,0 mg |
1,0 mg bis 2,0 mg |
Spezielle Dosierungsangaben sind wie folgt zu beachten:
Flutide forte 500 Diskus
In wenigen Fällen sind bei Erwachsenen und Jugendlichen über 16 Jahre 2-mal täglich 500 ^g bis 1,0 mg Fluticasonpropionat notwendig (2-mal täglich 1 bis 2 Einzeldosen). Diese Dosis ist zur Behandlung von Kindern unter 16 Jahren nicht geeignet.
Hinweis:
Eine Überprüfung der Gesamttherapie der asthmatischen Erkrankung ist bei höheren Dosierungen empfehlenswert.
Chronisch obstruktive Lungenerkrankung (COPD)
Erwachsene:
2-mal täglich 500 ^g Fluticasonpropionat (entspricht 2-mal täglich 2 Pulverinhalationen Flutide 250 Diskus bzw. 2-mal täglich 1 Pulverinhalation Flutide forte 500 Diskus) als Ergänzung zu langwirksamen Bronchodilatatoren (z. B. LABAs).
Nur Flutide 250 Diskus und Flutide forte 500 Diskus sind für diese Dosierung geeignet.
Dosierung bei Patienten mit stark eingeschränkter Leberfunktion:
Bei Patienten mit stark eingeschränkter Leberfunktion sollte die Funktion der Nebennierenrinden regelmäßig kontrolliert werden. Wenn Anzeichen für eine Nebennierenrindeninsuffizienz festgestellt werden, ist die Fluticasonpropionat-Dosis schrittweise und unter sorgfältiger Überwachung zu reduzieren.
Art der Anwendung
Flutide Junior 50 Diskus/Flutide mite 100 Diskus/Flutide 250 Diskus/Flutide forte 500 Diskus enthalten den Wirkstoff in Pulverform und sind ausschließlich zur Inhalation bestimmt.
Patienten sollten auf die prophylaktische Natur der Behandlung mit inhalativem Fluticasonpropionat hingewiesen werden. Um die bestmögliche Wirkung zu erzielen, sollte Flutide Diskus regelmäßig -auch in beschwerdefreien Zeiten - eingesetzt werden. Grundsätzlich ist Flutide Diskus ein Arzneimittel zur Langzeitbehandlung.
Sollten Patienten feststellen, dass die Wirkung von kurzwirksamen Bronchodilatatoren nachlässt oder dass mehr Inhalationen als üblich benötigt werden, sollte ärztlicher Rat eingeholt werden.
Fluticasonpropionat sollte regelmäßig täglich angewendet werden.
Bronchialasthma aller Schweregrade
Eine therapeutische Wirkung tritt erfahrungsgemäß innerhalb von 4 bis 7 Tagen nach Behandlungsbeginn ein.
Chronisch obstruktive Lungenerkrankung (COPD)
Eine Besserung sollte innerhalb von 3 bis 6 Monaten beobachtet werden. Andernfalls wird eine Überprüfung der medikamentösen Therapie durch den behandelnden Arzt empfohlen.
Nach der Inhalation mit Flutide Diskus sollte der Mund ausgespült werden. Wenn möglich sollte Flutide Diskus vor einer Mahlzeit angewendet werden.
Bedienungsanleitung:
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen.
Bitte beachten Sie alle Punkte der Bedienungsanleitung sorgfältig.
Beschreibung des Diskus
Der Diskus ist in einer Schutzfolie verpackt. Die Umhüllung bietet Schutz vor Feuchtigkeit und sollte erst kurz vor der ersten Benutzung des Diskus geöffnet werden. Nach dem Öffnen sollte die Schutzfolie entsorgt werden.
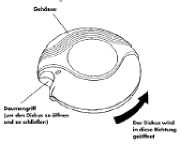
Geschlossen
Wenn Sie Ihren Diskus aus der Originalpackung genommen und die Schutzfolie entfernt haben, befindet sich der Diskus in „geschlossener” Stellung.
Geöffnet
Ein unbenutzter Diskus enthält 60 Einzeldosen Ihres Arzneimittels in Pulverform.
Jede Einzeldosis ist genau abgemessen und separat verpackt.
Wartung und Nachfüllen sind nicht erforderlich.
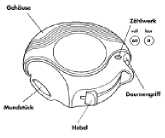
Das Gehäuse schützt Ihren Diskus, wenn er nicht in Gebrauch ist.
Das Zählwerk oben auf Ihrem Diskus zeigt Ihnen, wie viele Einzeldosen verbleiben. Die Zahlen 5 bis 0 erscheinen in ROT, um Sie darauf aufmerksam zu machen, dass nur noch wenige Einzeldosen übrig sind.
Wie Ihr Diskus funktioniert
Der Diskus ist einfach zu benutzen. Wenn Sie eine Einzeldosis inhalieren möchten, folgen Sie nur den 5 einfachen Schritten, wie beschrieben:
|
1. |
Öffnen |
|
2. |
Vorbereiten der Inhalation |
|
3. |
Inhalieren |
|
4. |
Schließen |
|
5. |
Mund ausspülen |
1. Öffnen
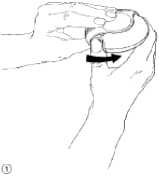
Um den Diskus zu öffnen, halten Sie ihn in einer Hand und legen den Daumen Ihrer anderen Hand auf den Daumengriff (Abb. 1). Schieben Sie den Daumengriff so weit wie möglich von sich weg.
2. Vorbereiten der Inhalation
Halten Sie den Diskus so, dass das Mundstück auf Sie gerichtet ist. Schieben Sie den Hebel so weit wie möglich von sich weg (Abb. 2), bis Sie ein Klicken hören. Ihr Diskus ist jetzt einsatzbereit. Die Freigabe der Einzeldosis wird durch das Zählwerk angezeigt (Verschieben Sie den Hebel nicht unnötig, denn dadurch werden überflüssige Einzeldosen freigegeben.).
3. Inhalieren
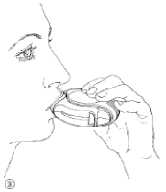
Bevor Sie mit der Inhalation beginnen, lesen Sie diese Hinweise bitte sorgfältig:
• Halten Sie den Diskus von Ihrem Mund entfernt.
Atmen Sie so weit wie möglich aus. Beachten Sie, dass Sie nicht in Ihren Diskus hineinatmen.
• Setzen Sie das Mundstück an Ihre Lippen (Abb. 3). Atmen Sie gleichmäßig und tief durch den Diskus ein, nicht durch die Nase.
• Nehmen Sie den Diskus von Ihrem Mund.
• Halten Sie Ihren Atem etwa 10 Sekunden an bzw. solange es Ihnen möglich ist.
• Atmen Sie langsam aus.
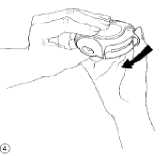
4. Schließen
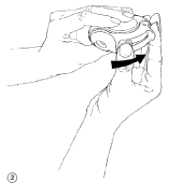
Um den Diskus zu schließen, legen Sie Ihren Daumen in den Daumengriff und schieben ihn so weit wie möglich zu sich zurück (Abb. 4).
Dadurch gelangt der Hebel automatisch in seine Ausgangsposition zurück. Ihr Diskus ist jetzt wieder für eine neue Inhalation einsatzbereit.
5. Mund ausspülen
Spülen Sie danach Ihren Mund mit Wasser und spucken dieses wieder aus.
Wiederholte Inhalation
Wenn Ihnen verordnet wurde, mehr als eine Einzeldosis zu inhalieren, wiederholen Sie bitte die Schritte 1 bis 4.
Beachten Sie bitte:
• Bewahren Sie Ihren Diskus trocken auf.
• Schließen Sie ihn, wenn Sie ihn nicht benutzen.
• Atmen Sie nicht in Ihren Diskus hinein.
• Verschieben Sie den Hebel nur, wenn Sie inhalieren wollen.
Beachten Sie bitte die empfohlene Dosis._
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Fluticasonpropionat oder Milchprotein.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Ein zunehmender Bedarf an kurzwirksamen Beta-2-Sympathomimetika zur Kontrolle der Asthmasymptome ist ein Anzeichen für eine Verschlechterung der Kontrolle des Asthma bronchiale. In diesen Fällen sollte die bestehende Therapie überprüft werden.
Eine plötzliche und zunehmende Verschlechterung der Asthmakontrolle kann potentiell lebensbedrohlich sein. In diesem Fall ist eine Erhöhung der Kortikoiddosis in Betracht zu ziehen. Bei Patienten mit einem erhöhten Risiko oder mit starken täglichen Schwankungen der Lungenfunktionswerte kann eine Überwachung der täglichen Peak-Flow-Werte angezeigt sein.
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Glukokortikoidgabe (siehe Abschnitt 4.9). Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerungen bei Kindern und Jugendlichen, Verminderung der Knochendichte, Katarakt und Glaukom ein und, seltener, eine Reihe von Wirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorischer Überaktivität, Schlafstörungen, Angst, Depression oder Aggression (besonders bei Kindern). Deshalb ist es wichtig, die Dosis des inhalativen Kortikoids auf die niedrigste Dosis zu reduzieren, mit der eine effektive Kontrolle des Asthmas aufrecht erhalten werden kann (siehe Abschnitt 4.8).
Es wird empfohlen, das Wachstum von Kindern, die eine Langzeittherapie mit inhalativ anzuwendenden Glukokortikoiden erhalten, regelmäßig zu kontrollieren.
Sehr selten wurde ein Anstieg des Blutzuckers berichtet (siehe Abschnitt 4.8). Dies sollte bei der Verordnung für Patienten mit anamnestisch bekanntem Diabetes mellitus berücksichtigt werden.
Bei schweren Leberfunktionsstörungen kann die Metabolisierung von Fluticasonpropionat verzögert sein, was zu erhöhten Plasmaspiegeln führen kann.
Patienten mit aktiver oder inaktiver Lungentuberkulose sollen während der inhalativen Anwendung von Fluticasonpropionat gleichzeitig mit einem Tuberkulostatikum behandelt werden.
Während der Anwendung nach Markteinführung gab es Berichte zu klinisch signifikanten Wechselwirkungen bei Patienten, die gleichzeitig Fluticasonpropionat und Ritonavir erhielten. Diese führten zu systemischen Kortikoid-Nebenwirkungen einschließlich Cushing-Syndrom und Nebennierenrindensuppression. Deshalb sollte die gleichzeitige Anwendung von Fluticasonpropionat und Ritonavir vermieden werden, außer der mögliche Nutzen für den Patienten überwiegt das Risiko systemischer Kortikoid-Nebenwirkungen (siehe Abschnitt 4.5).
Wie bei anderer Inhalationsbehandlung können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens nach der Anwendung ausgelöst werden. In diesem Fall sollte sofort ein kurzwirksamer Bronchodilatator mit schnellem Wirkungseintritt inhaliert werden. Die Behandlung mit Fluticasonpropionat soll unverzüglich abgebrochen werden, der Patient untersucht und ggf. alternative Therapien eingeleitet werden (siehe Abschnitt 4.8).
In sehr seltenen Fällen wurde unter einer inhalativen Behandlung mit Fluticasonpropionat ein Churg-Strauss-Syndrom beobachtet. Diese Fälle traten zumeist im Zusammenhang mit der Reduzierung oder dem Absetzen systemischer Glukokortikoide auf. Ein direkter Kausalzusammenhang ist nicht festgestellt worden.
Flutide 250 Diskus/Flutide forte 500 Diskus
Es gibt vermehrt Berichte über das mögliche Auftreten von Pneumonien bei Studien mit COPD-Patienten, die 500 pg Fluticasonpropionat erhalten (siehe Abschnitt 4.8). Ärzte sollten hinsichtlich einer möglichen Entwicklung einer Pneumonie bei Patienten mit COPD wachsam sein, da das klinische Erscheinungsbild einer Pneumonie und einer Exazerbation häufig überlappt.
Spezielle Therapiehinweise:
Eine mögliche verminderte Funktion der Nebennierenrinde sollte in Notfallsituationen (einschließlich Operationen) sowie in Stresssituationen immer berücksichtigt werden. Dies gilt insbesondere bei
Patienten, die hohe Dosen über einen längeren Zeitraum angewendet haben. Eine zusätzliche Behandlung mit Glukokortikoiden sollte entsprechend der vorliegenden klinischen Situation in Betracht gezogen werden (siehe Abschnitt 4.9).
Hinweise für nicht mit Glukokortikoiden vorbehandelte Patienten:
Bei Patienten, die zuvor keine oder nur gelegentlich eine kurzdauernde Behandlung mit Glukokortikoiden erhalten haben, sollte die vorschriftsmäßige, regelmäßige Anwendung von Fluticasonpropionat nach 4 bis 7 Tagen zu einer Verbesserung der Atmung führen.
Starke Verschleimung und entzündliche Veränderungen können allerdings die Bronchien so weit verstopfen, dass Fluticasonpropionat lokal nicht voll wirksam werden kann. In diesen Fällen sollte die Einleitung der Therapie mit systemischen Glukokortikoiden (beginnend mit 40 bis 60 mg Prednisonäquivalent pro Tag) ergänzt werden. Die inhalative Therapie wird nach der schrittweisen Reduktion der systemischen Glukokortikoide fortgesetzt.
Hinweise für das Absetzen einer inhalativen Therapie mit Glukokortikoiden:
Die Behandlung mit Fluticasonpropionat sollte nicht abrupt beendet werden. Ein Absetzen der Behandlung mit inhalativem Fluticasonpropionat sollte über eine schrittweise Dosisreduzierung erfolgen.
Hinweise für die Umstellung einer oralen auf eine inhalative Therapie mit Glukokortikoiden:
Bei vollständiger Kontrolle der mit der Erkrankung assoziierten Beschwerden kann eine Umstellung einer oralen auf eine inhalative Therapie mit Glukokortikoiden, schrittweise und unter regelmäßiger Kontrolle der Nebennierenrindenfunktion, erfolgen. Zu Beginn der Umstellung sollte Flutide Diskus für etwa 1 Woche zusätzlich verabreicht werden. Die Tagesdosis der systemischen Glukokortikoide wird im Abstand von 1 bis 2 Wochen um 2,5 mg Prednisonäquivalent reduziert.
Patienten sollten vom behandelnden Arzt darüber aufgeklärt werden, dass innerhalb der ersten Monate nach Therapieumstellung bzw. bei einer intermittierenden oralen Anwendung, aufgrund einer eventuell bestehenden Nebennierenrindeninsuffizienz mit einer inadäquaten endogenen Kortisolausschüttung, in besonderen Stresssituationen oder Notfällen (z. B. schwere Infektionen, Verletzungen, Operationen) ein zusätzlicher Bedarf an einer systemischen Glukokortikoidtherapie besteht.
Bei Umstellung von systemischen Glukokortikoiden auf die Inhalationsbehandlung mit Fluticasonpropionat können Allergien in Erscheinung treten, die durch die bisherige Behandlung unterdrückt wurden, z. B. allergische Rhinitis, allergische Hauterscheinungen.
Die Anwendung von Flutide Diskus kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Unter Normalbedingungen werden nach der Inhalation geringe Plasmakonzentrationen von Fluticasonpropionat erreicht, was auf den ausgeprägten First-Pass-Metabolismus und die hohe systemische Clearance, hervorgerufen durch das Cytochrom P450 3A4 in Darm und Leber, zurückzuführen ist. Daher sind durch Fluticasonpropionat vermittelte, klinisch signifikante Wechselwirkungen unwahrscheinlich.
Flutide Diskus kann die Wirksamkeit von Beta-2-Sympathomimetika zur Inhalation verstärken.
Eine Studie an gesunden Probanden zur Untersuchung von Wechselwirkungen hat gezeigt, dass durch die Anwendung von Ritonavir (ein starker Cytochrom P450 3A4 Inhibitor) die Plasmakonzentrationen von Fluticasonpropionat stark ansteigen können, was sich in deutlich verringerten Serumkortisolspiegeln äußert. Während der Anwendung nach Markteinführung gab es Berichte zu klinisch signifikanten Wechselwirkungen bei Patienten, die gleichzeitig Fluticasonpropionat und Ritonavir erhielten. Diese resultierten in systemischen Kortikoid-Nebenwirkungen einschließlich Cushing-Syndrom und Nebennierenrindensuppression.
Deshalb sollte die gleichzeitige Anwendung von Fluticasonpropionat und Ritonavir vermieden werden, außer der mögliche Nutzen für den Patienten überwiegt das Risiko systemischer KortikoidNebenwirkungen.
Studien haben gezeigt, dass andere Inhibitoren des Cytochrom P450 3A4 vemachlässigbare (Erythromycin) und geringe (Ketoconazol) Anstiege der systemischen Konzentration von Fluticasonpropionat ohne deutliche Reduktion der Serumkortisolkonzentrationen bewirken. Dennoch sollte eine gleichzeitige Anwendung mit potenten Cytochrom P450 3A4 Inhibitoren (wie z. B. Ketoconazol) aufgrund eines möglichen Anstiegs der systemischen Wirkungen von Fluticasonpropionat nur mit Vorsicht erfolgen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen nur begrenzte Daten mit der Behandlung von Fluticasonpropionat an schwangeren Frauen vor.
Ergebnisse einer retrospektiven, epidemiologischen Studie zeigten kein erhöhtes Risiko für schwere angeborene Fehlbildungen in Folge einer Fluticasonpropionat-Exposition während des ersten Trimesters der Schwangerschaft, verglichen mit anderen inhalativen Kortikosteroiden (siehe Abschnitt 5.1).
Die Anwendung von Fluticasonpropionat bei Schwangeren sollte nur in Betracht gezogen werden, wenn der erwartete Nutzen für die Mutter größer ist als das mögliche Risiko für den Fötus.
Bei der Behandlung von Schwangeren sollte die niedrigste wirksame Dosis an Fluticasonpropionat eingesetzt werden, die nötig ist, um eine adäquate Kontrolle der Asthmasymptome zu gewährleisten.
Stillzeit
Es ist nicht bekannt, ob Fluticasonpropionat/Metabolite in die Muttermilch übergehen. Präklinische Studien an Ratten haben gezeigt, dass Fluticasonpropionat/Metabolite in die Muttermilch übergehen. Ein Risiko für das Neugeborene/Kind kann nicht ausgeschlossen werden.
Es ist zu entscheiden, entweder abzustillen oder die Anwendung von Fluticasonpropionat zu beenden, wobei der Nutzen des Stillens für das Kind und der Nutzen der Therapie für die Mutter gegeneinander abgewogen werden müssen.
Fertilität
Es liegen keine Daten zur Fertilität beim Menschen vor. Tierexperimentelle Studien geben keine Hinweise auf Auswirkungen von Fluticasonpropionat auf die männliche oder weibliche Fertilität.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Fluticasonpropionat hat wahrscheinlich keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Nachfolgend sind die Nebenwirkungen nach Systemorganklassen und absoluter Häufigkeit (alle berichteten Ereignisse) aufgelistet. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Sehr häufige, häufige und gelegentliche Nebenwirkungen wurden allgemein aus den Daten der klinischen Prüfungen bestimmt. Seltene und sehr seltene Nebenwirkungen wurden allgemein aufgrund der Daten aus der Spontanerfassung nach Zulassung bestimmt.
Inhalativ anzuwendende Glukokortikoide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden.
|
Systemorganklassen |
Nebenwirkung |
Häufigkeit |
|
Infektionen und |
Candidose der Mund- und Rachenschleimhaut* |
Sehr häufig |
|
parasitäre Erkrankungen |
Pneumonien (bei COPD-Patienten) |
Häufig |
|
Ösophageale Candidose |
Selten | |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen der Haut (z. B. Hautausschlag, Urtikaria, Juckreiz) |
Gelegentlich |
|
Angioödem (überwiegend faziales und oropharyngeales Ödem), Atemwegsbeschwerden (Dyspnoe und/oder Bronchospasmus) und anaphylaktische Reaktionen |
Sehr selten | |
|
Endokrine Erkrankungen |
Mögliche systemische Nebenwirkungen beinhalten (siehe Abschnitt 4.4): Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung, Verminderung der Knochendichte, Katarakt, Glaukom |
Sehr selten |
Stoffwechsel- und Hyperglykämie Sehr selten
Ernährungsstörungen
|
Psychiatrische Erkrankungen |
Angstgefühle, Schlafstörungen und Verhaltensänderungen, einschließlich Hyperaktivität und Reizbarkeit (überwiegend bei Kindern) |
Sehr selten |
|
Depression, Aggression (überwiegend bei Kindern) |
Nicht bekannt | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Heiserkeit* * |
Häufig |
|
Paradoxer Bronchospasmus (siehe Abschnitt 4.4) |
Sehr selten | |
|
Nasenbluten |
Nicht bekannt | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Blutergüsse |
Häufig |
* Bei manchen Patienten kann die Inhalation von Fluticasonpropionat Candidose des Mund- und Rachenraumes (Soorbefall) verursachen. Deshalb sollte unmittelbar nach der Inhalation der Mund mit Wasser ausgespült werden. Wenn möglich sollte die Inhalation vor den Mahlzeiten durchgeführt werden. Beim symptomatischen Soorbefall empfiehlt sich eine lokale antimykotische Behandlung unter Fortsetzung der Inhalationsbehandlung mit Flutide Diskus.
** Fluticasonpropionat kann bei einigen Patienten Heiserkeit hervorrufen. Heiserkeit kann
vorgebeugt werden, indem sofort nach der Inhalation der Mund mit Wasser ausgespült wird.
Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die kurzzeitige Inhalation von höheren als den zugelassenen Dosierungen von Fluticasonpropionat kann zu einer zeitweiligen Nebennierenrindensuppression führen. In der Regel ist keine spezielle Notfallbehandlung erforderlich, da die Nebennierenrindenfunktion sich innerhalb weniger Tage erholt.
Wenn höhere als die zugelassenen Dosierungen über einen längeren Zeitraum angewendet werden, ist
eine signifikante adrenale Suppression möglich. Es gibt Berichte von sehr seltenen Fällen akuter adrenerger Krisen bei Kindern, die höhere als die zugelassenen Dosen (meist 1.000 pg/Tag und mehr) über einen längeren Zeitraum (mehrere Monate oder Jahre) inhalierten. Die beobachteten Symptome beinhalten Hypoglykämie, Bewusstseinstrübung und/oder Konvulsionen. Eine akute adrenale Krise kann potentiell durch Trauma, Operation, Infektion oder eine schnelle Dosisreduktion ausgelöst werden.
Behandlung
Bei Patienten, die höhere als die zugelassenen Dosierungen inhalieren, ist eine engmaschige Überwachung der Nebennierenrindenfunktion notwendig. Die Dosierung sollte schrittweise reduziert werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiasthmatikum, Glukokortikoid zur Inhalation, ATC-Code: R03BA05
Fluticasonpropionat entwickelt bei inhalativer Anwendung in der empfohlenen Dosierung eine ausgeprägte antientzündliche Wirkung in der Lunge und infolgedessen kommt es zu einer Abnahme der Asthmasymptome und Exazerbationen.
Die bei der systemischen Applikation von Glukokortikoiden möglichen Nebenwirkungen treten bei einer inhalativen Anwendung von Fluticasonpropionat nur in vergleichsweise sehr viel geringerer Ausprägung und nur bei wenigen Patienten auf. Die täglich gebildete Menge an Nebennierenrindenhormonen liegt auch bei chronischer Inhalationstherapie mit Fluticasonpropionat bei den meisten Patienten im Normalbereich.
Klinische Wirksamkeit und Sicherheit
Fluticasonpropionat-Medikationen bei Asthma während der Schwangerschaft
Eine beobachtende, retrospektive, epidemiologische Kohortenstudie, die elektronische Gesundheitsaufzeichnungen aus dem Vereinigten Königreich nutzt, wurde durchgeführt, um das Risiko für schwere angeborene Fehlbildungen (MCMs) aufgrund der Anwendung von inhalalativem Fluticasonpropionat alleine und einer Salmeterol-Fluticasonpropionat Kombination im ersten Trimester der Schwangerschaft, im Verhältnis zur Anwendung von inhalativen Kortikosteroiden (ICS) ohne Fluticasonpropionat, zu bewerten. Ein Placebo-Vergleich wurde in diese Studie nicht eingeschlossen.
Innerhalb der Asthma-Kohorte mit 5.362 Schwangerschaften, die ICS-Expositionen innerhalb des ersten Schwangerschafts-Trimesters aufwiesen, wurden 131 diagnostizierte MCMs identifiziert; 1.612 (30 %) erhielten Fluticasonpropionat oder Salmeterol-Fluticasonpropionat, von denen 42 diagnostizierte MCMs identifiziert wurden. Die adjustierte Odds Ratio für MCMs, die bis zu einem Jahr diagnostiziert wurden, lag bei 1,1 (95% KI: 0,5 - 2,3) bei Anwendung von Fluticasonpropionat gegenüber der Anwendung von ICS ohne Fluticasonpropionat für Frauen mit moderatem Asthma und bei 1,2 (95% KI: 0,7 - 2,0) für Frauen mit beträchtlichem bis schwerem Asthma. Es gab keinen Unterschied in Bezug auf das Risiko für MCMs in Folge der Anwendung von Fluticasonpropionat alleine gegenüber der Anwendung einer Kombination aus Salmeterol und Fluticasonpropionat während des ersten Trimesters. Die absoluten Risiken für MCMs über die Asthma-Schweregrade hinweg lagen zwischen 2,0 und 2,9 pro 100 Schwangerschaften bei Fluticasonpropionat-Exposition. Diese Ergebnisse sind vergleichbar mit den Ergebnissen einer Studie hinsichtlich 15.840 Schwangerschaften aus der GeneralPractice Research Database, bei denen keine Asthmatherapien stattfanden (2,8 MCM-Ereignisse auf 100 Schwangerschaften).
5.2 Pharmakokinetische Eigenschaften
Bioverfügbarkeit
Die pharmakokinetischen Eigenschaften von Fluticasonpropionat ähneln denen anderer Glukokortikoide. Die orale Bioverfügbarkeit von Fluticasonpropionat ist sehr niedrig (< 1 %). Gründe hierfür sind die relativ geringe Resorption aus dem Gastrointestinaltrakt sowie eine rasche Plasmaclearance. Diese wird hervorgerufen durch einen ausgeprägten First-Pass-Metabolismus in der Leber und Exkretion der Metaboliten über die Galle.
Nach inhalativer Applikation wird in Abhängigkeit von der Darreichungsform die absolute systemische Bioverfügbarkeit auf 12 bis 26 % geschätzt. Maximale Plasmaspiegel treten ca.
30 Minuten nach Inhalation auf. Je nach Untersuchungsmethode liegt die Plasmaproteinbindung zwischen 81 % und 95 %. Die Eliminationshalbwertszeit beträgt bei Erwachsenen ca. 2,8 h und liegt bei Kindern deutlich niedriger (1,5 h). In Abhängigkeit von verschiedenen Faktoren (Inhalationsgerät, Spacer, Inhalationstechnik, Partikelgröße) gelangen etwa 15 bis 20 % des inhalierten Fluticasonpropionats in die Lunge. Der Rest setzt sich im Mund-Nasen-Rachenraum ab und wird zum großen Teil verschluckt. Nach oraler Applikation werden 87 bis 100 % der Dosis zum großen Teil in unveränderter Form mit den Faeces ausgeschieden. Weniger als 5 % einer oral verabreichten Dosis werden über den Urin ausgeschieden, überwiegend in Form des Hauptmetaboliten (ein durch Hydrolyse gebildetes 17-Carboxylsäurederivat von Fluticasonpropionat) und seines Glucuronidkonjugates. Die systemische Aktivität des Hauptmetaboliten ist vernachlässigbar gering.
5.3 Präklinische Daten zur Sicherheit
Chronische Toxizität
Untersuchungen zur chronischen Toxizität an verschiedenen Tierspezies bei unterschiedlicher Applikationsart zeigten dosisabhängig Symptome der Glukokortikoidüberdosierung.
Inhalationsstudien an Ratten und Hunden bis zu 18 Monaten ergaben keine durch Fluticasonpropionat bedingten Veränderungen oder Reizungen des Respirationstraktes.
Mutagenität
In-vitro- und In-vivo-Untersuchungen unter Verwendung der üblichen Testsysteme ergaben für Fluticasonpropionat keine Hinweise auf ein mutagenes Potential.
Kanzerogenität
In Langzeituntersuchungen zum tumorigenen Potential an der Maus (oral) und an der Ratte (inhalativ) wurden keine Hinweise auf ein tumorauslösendes Potential gefunden.
Reproduktionstoxizität
Die inhalative Verabreichung von Fluticasonpropionat an Ratten während der Embryonalentwicklung hat bei einer Dosis von 5,5 pg/kg/Tag (Plasmakonzentration > 250 bis 600 pg/ml) keine embryotoxischen Wirkungen gezeigt. Höhere Dosierungen (26 und 69 pg/kg/Tag) führten zu verminderter Gewichtszunahme und leichten intrauterinen Wachstumsretardierungen.
Bei subkutaner Gabe von 5 pg/kg/Tag oder höher sind bei verschiedenen Tierspezies maternal-toxische Effekte, embryofetale Wachstumsstörungen und eine perinatale Sterblichkeit der Nachkommen beobachtet worden. Dosierungen von 150 pg/kg/Tag und höher verursachten bei Mäusen die für Glukokortikoide bekannten Gaumenspalten. Fertilitätsstörungen konnten bei Ratten weder in der F0- noch in der F1-Generation ausgelöst werden.
Für den Menschen liegen bisher keine Hinweise auf eine teratogene Wirkung vor. Es ist nicht bekannt, ob Fluticasonpropionat nach inhalativer Applikation in die Muttermilch übergeht. Nach systemischer Verabreichung sind Glukokortikoide in geringen Mengen in der Muttermilch nachgewiesen worden.
6. PHARMAZEUTISCHE ANGABEN
6.1
Liste der sonstigen Bestandteile
Lactose-Monohydrat.
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Flutide Junior 50 Diskus 18 Monate
Flutide mite 100 Diskus
2 Jahre
Flutide 250 Diskus
3 Jahre
Flutide forte 500 Diskus 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C lagern.
An einem trockenen Ort aufbewahren.
Der Diskus ist in einer Schutzfolie verpackt, die erst vor dem ersten Gebrauch des Diskus geöffnet werden sollte. Nach dem Öffnen sollte die Schutzfolie entsorgt werden.
6.5 Art und Inhalt der Behältnisse
Das Pulver zur Inhalation ist in Blistern aus einer beschichteten PVC-Bodenfolie mit einer ablösbaren Deckelverbundfolie enthalten. Der Blisterstreifen ist in einem Inhalationsgerät aus Plastik enthalten.
Der Diskus ist mit einer Schutzfolie umhüllt und in einer Faltschachtel verpackt.
Die Inhalationsgeräte enthalten:
Flutide Junior 50 Diskus
Packungen mit 60 Einzeldosen Pulver zur Inhalation Klinikpackungen:
Packungen mit 10 x 60 Einzeldosen
Flutide mite 100 Diskus/Flutide 250 Diskus/Flutide forte 500 Diskus Packungen mit 60 Einzeldosen Pulver zur Inhalation
Doppelpackungen mit 2 x 1 Packung mit 60 Einzeldosen Pulver zur Inhalation Klinikpackungen:
Packungen mit 10 x 60 Einzeldosen
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Ein Zählwerk am Diskus zeigt die Zahl der noch verbleibenden Einzeldosen an.
Hinweis:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen.
Kinder sollten dieses Arzneimittel nur unter Aufsicht eines Erwachsenen anwenden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 E-Mail: produkt.info@gsk.com http://www.glaxosmithkline .de
8. ZULASSUNGSNUMMERN
Flutide Junior 50 Diskus Zul.-Nr.: 30864.00.00
Flutide mite 100 Diskus Zul.-Nr.: 30864.01.00
Flutide 250 Diskus Zul.-Nr.: 30864.02.00
Flutide forte 500 Diskus Zul.-Nr.: 30867.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
Flutide Junior 50 Diskus/Flutide mite 100 Diskus/Flutide 250 Diskus
Datum der Erteilung der Zulassung: 30.11.1994
Datum der letzten Verlängerung der Zulassung: 13.06.2007
Flutide forte 500 Diskus
Datum der Erteilung der Zulassung: 09.12.1997
Datum der letzten Verlängerung der Zulassung: 13.06.2007
10. STAND DER INFORMATION
Januar 2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.