Flutihexal 250 Mikrogramm/Sprühstoß Druckgasinhaltion, Suspension
ZUSAMMENFASSUNG DER MERKMALE DES ARZNEIMITTELS
1. BEZEICHNUNG DES ARZNEIMITTELS
FlutiHEXAL® 250 Mikrogramm/Sprühstoß Druckgasinhalation, Suspension
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine abgemessene Dosis enthält 250 Mikrogramm Fluticason-17-propionat (abgegeben aus dem Ventil). Das entspricht einer aus dem Mundstück abgegebenen Dosis von 220 Mikrogramm Fluticason-17-propionat.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Suspension
Ein Inhalator, bestehend aus einem Druckbehälter aus einer Aluminiumlegierung mit einem Dosierventil, einem Auslöser und einer Staubschutzkappe.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Asthma bronchiale
FlutiHEXAL ist angezeigt für die Behandlung von Erwachsenen und Jugendlichen über 16 Jahren.
4.2 Dosierung und Art der Anwendung
FlutiHEXAL ist ausschließlich zur oralen Inhalation bestimmt.
Die Patienten sollten darauf hingewiesen werden, dass die Behandlung mit FlutiHEXAL prophylaktischer Natur ist und auch bei Symptomfreiheit regelmäßig durchgeführt werden muss.
Wenn die Patienten bemerken, dass die Wirksamkeit ihres kurz wirksamen Bronchodilatators nachlässt oder dass sie ihn häufiger als sonst anwenden müssen, müssen sie ihren Arzt konsultieren.
Je nach individuellem Ansprechen kann die Dosis angepasst werden, bis eine Symptomkontrolle erreicht ist, bzw. bis zur geringsten wirksamen Dosis reduziert werden. Wenn die Symptomkontrolle mit der niedrigsten verfügbaren Dosis von FlutiHEXAL (125 Mikrogramm je Sprühstoß) dauerhaft möglich ist, ist im nächsten Schritt die Umstellung auf ein anderes inhalatives Fluticason-Präparat mit geringerer Dosisstärke (50 Mikrogramm /Sprühstoß) zu erwägen. Die therapeutische Wirkung tritt innerhalb von 4 bis 7 Tagen ein.
Der verschreibende Arzt sollte berücksichtigen, dass die erforderliche Dosis Fluticasonpropionat nur etwa halb so hoch ist wie die anderer inhalativer Steroide. Beispielsweise sind 100 Mikrogramm Fluticason-17-propionat in etwa äquivalent zu 200 Mikrogramm Beclometasondipropionat (mit FCKW) oder Budesonid.
Dosierung für Erwachsene und Jugendliche über 16 Jahre: zweimal täglich 50500 Mikrogramm.
Bei schwerem Asthma oder Asthmaexazerbationen kann als Alternative zur oralen Kortikoidtherapie eine vorübergehende Dosissteigerung (auf bis zu 2000 Mikrogramm täglich bei Erwachsenen) erforderlich sein. Die therapeutische Wirkung ist dabei genau zu überwachen und zur Erhaltungstherapie sollte auf die niedrigste wirksame Dosis zurückgegangen werden.
Patienten, denen es schwerfällt, die Einatmung mit dem Aerosol-Sprühstoß zu synchronisieren, können FlutiHEXAL mit einem Volumatic Spacer anwenden.
Besondere Patientengruppen
Bei älteren Patienten oder Patienten mit Niereninsuffizienz ist keine Dosisanpassung erforderlich. Für Patienten mit Leberinsuffizienz liegen keine Erfahrungen vor.
Art der Anwendung
Es ist wichtig, die korrekte Inhalationstechnik dem Patienten zu erläutern (siehe auch Packungsbeilage und Hinweise zur Anwendung).
Prüfung des Inhalators
1. Bevor Sie den Inhalator zum ersten Mal benutzen, sollten Sie überprüfen, ob er richtig funktioniert. Drücken Sie mit Daumen und Zeigefinger leicht auf die Seitenflächen der Schutzkappe des Mundstücks und ziehen Sie die Kappe ab.
2. Schütteln Sie den Inhalator kräftig, halten Sie das Mundstück von sich abgewandt und drücken Sie auf den Behälter, um einen Sprühstoß zur Probe in die Luft abzugeben. Jedesmal, wenn Sie den Inhalator eine Woche oder länger nicht benutzt haben, sollten Sie zunächst zwei Sprühstöße des Arzneimittels in die Luft abgeben.
Anwendung des Inhalators
Wichtig ist, dass Sie bereits kurz vor der Auslösung des Inhalators anfangen, so langsam wie möglich einzuatmen.
1. Bei der Inhalation sollten Sie entweder stehen oder aufrecht sitzen.
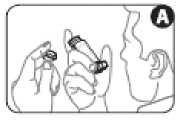
2. Ziehen Sie die Schutzkappe vom Mundstück ab. Vergewissern Sie sich, dass das Mundstück innen und außen sauber und frei von Fremdkörpern ist (Abbildung A).
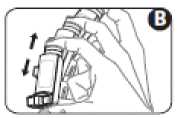
3. Schütteln Sie den Inhalator vier- oder fünfmal, um sicherzustellen, dass lose Fremdkörper entfernt werden und der Inhalt des Inhalators gleichmäßig durchmischt wird (Abbildung B).
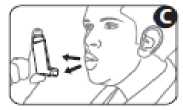
4. Halten Sie den Inhalator senkrecht; der Daumen stützt das Mundstück von unten. Atmen Sie so tief aus, wie es für Sie noch ohne Anstrengung möglich ist (Abbildung C). Atmen Sie noch nicht wieder ein.
5. Nehmen Sie das Mundstück in den Mund zwischen die Zähne und schließen Sie die Lippen um das Mundstück. Beißen Sie nicht auf das Mundstück (Abbildung D).
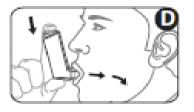
6. Atmen Sie durch den Mund ein. Drücken Sie kurz nach dem Beginn der Einatmung auf das obere Ende des Behälters und geben damit einen Sprühstoß des Arzneimittels ab. Atmen Sie währenddessen weiter gleichmäßig und langsam ein (Abbildung D).
7. Halten Sie den Atem an, nehmen Sie den Inhalator aus dem Mund und den Finger vom oberen Ende des Inhalators. Halten Sie den Atem ein paar Sekunden lang an (bzw. so lange, wie es für Sie ohne große Anstrengung möglich ist (Abbildung E)).
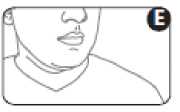
8. Wenn der Arzt Ihnen zwei Sprühstöße pro Anwendung verordnet, warten Sie bitte etwa eine halbe Minute, bevor Sie den zweiten Sprühstoß inhalieren. Wiederholen Sie für den zweiten Sprühstoß die Schritte 3 bis 7.
9. Spülen Sie danach Ihren Mund mit Wasser aus (bitte nicht schlucken, sondern ausspucken).
10. Setzen Sie nach der Inhalation die Schutzkappe immer sofort auf das Mundstück, um Verunreinigungen fernzuhalten. Setzen Sie die Schutzkappe fest auf, bis sie einrastet.
11. Üben Sie die ersten Male vor einem Spiegel. Wenn Sie oben am Inhalator oder an den Seiten Ihres Mundes „Nebel" aufsteigen sehen, sollten Sie die Inhalation wiederholen.
12. Jugendlichen oder Patienten mit schwachen Händen fällt die Inhalation eventuell leichter, wenn sie den Inhalator mit beiden Händen halten. Legen Sie in diesem Fall beide Zeigefinger auf das obere Ende des Inhalators und beide Daumen unter das Mundstück. Wenn es dann immer noch nicht besser klappt, kann ein Volumatic Spacer die Inhalation erleichtern. Lassen Sie sich von Ihrem Arzt, Apotheker oder dem medizinische Fachpersonal dazu beraten.
Reinigung des Inhalators
Damit der Inhalator nicht verstopft, sollte er mindestens einmal wöchentlich gereinigt werden.
Zur Reinigung des Inhalators:
• Ziehen Sie die Schutzkappe vom Mundstück ab.
• Ziehen Sie aber niemals den Metallbehälter aus dem Kunststoffgehäuse.
• Wischen Sie das Mundstück innen und außen sowie das Kunststoffgehäuse mit einem trockenen Tuch sauber.
• Setzen Sie die Schutzkappe wieder auf das Mundstück.
Legen Sie den Metallbehälter nicht in Wasser.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die Asthmabehandlung sollte nach dem Stufentherapieprogramm erfolgen. Das Ansprechen des Patienten auf die jeweilige Therapie sollte sowohl klinisch als auch durch Prüfung der Lungenfunktion überwacht werden.
Falls eine Bronchokonstriktion vorliegt, sollte diese vor Beginn der Anwendung von FlutiHEXAL behandelt werden, da sonst die Wirksamkeit vermindert sein kann. Regelmäßig sollte überprüft werden, ob die Inhalationstechnik des Patienten korrekt ist und der Sprühstoß des Inhalators mit der Einatmung synchronisiert wird, damit der Wirkstoff optimal in der Lunge deponiert wird. Während der Inhalation sollte der Patient möglichst sitzen oder stehen; der Inhalator ist für die Anwendung in senkrechter Haltung bestimmt. Fluticason-Inhalationen sind nicht zur akuten Symptomlinderung geeignet, hierfür ist die Inhalation eines kurz wirksamen Bronchodilatators erforderlich. Die Patienten sind anzuweisen, eine solche Nofallmedikation stets verfügbar zu haben.
Ein zunehmender Bedarf an kurz wirksamen ß2-Sympathomimetika zur akuten Symptomlinderung kann ein Zeichen für eine verschlechterte Asthmakontrolle sein und sollte Anlass geben, den Therapieplan des Patienten zu überprüfen.
Eine plötzliche und progrediente Verschlechterung der Asthmakontrolle kann lebensbedrohlich sein; eine Steigerung der Kortikoiddosis sollte daher erwogen werden. Bei Patienten mit einem erhöhten Exazerbationsrisiko kann eine tägliche Peak Flow-Messung sinnvoll sein.
Bei unzureichendem Ansprechen oder schweren Asthmaexazerbationen sollte die Dosis der Fluticasonpropionat-Inhalationen gesteigert werden sowie erforderlichenfalls die Anwendung von systemischen Kortikosteroiden und/oder bei Infektionen der Einsatz von Antibiotika erwogen werden.
Inhalative Kortikosteroide können systemische Nebenwirkungen verursachen, insbesondere wenn hohe Dosen über lange Zeiträume gegeben werden. Solche Reaktionen treten deutlich seltener auf als bei oraler Kortikosteroidgabe (siehe Abschnitt 4.9). Mögliche systemische Effekte sind Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Abnahme der Knochendichte, Katarakt, Glaukom sowie, seltener, verschiedene Veränderungen von Psyche und/oder Verhalten wie psychomotorische Hyperaktivität, Schlafstörungen, Angst, Depression oder Aggression (besonders bei Kindern). Deshalb ist es wichtig, dass die Dosis des inhalativen Kortikosteroids regelmäßig überprüft und auf das niedrigste Niveau reduziert wird, mit dem eine effektive Kontrolle des Asthmas aufrechterhalten werden kann (siehe Abschnitt 4.8).
Es gibt einzelne Patienten, die auf die Wirkungen inhalativer Kortikosteroide deutlich empfindlicher reagieren als die Allgemeinheit.
Eine Langzeittherapie mit hohen Dosen inhalativer Kortikosteroide kann zur Suppression der Nebennierenrindenfunktion mit akuter Addisonkrise führen. Sehr selten traten adrenale Suppression und Krisen bereits unter Dosen von 500-1000 Mikrogramm Fluticasonpropionat auf. Risikosituationen für eine Addisonkrise sind unter anderem Traumen, chirurgische Eingriffe, Infektionen oder eine abrupte Dosisreduktion. Die Symptome sind meist unspezifisch; es können Anorexie, Bauchschmerzen, Gewichtsabnahme, Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Bewusstseinseintrübung, Hypoglykämie und Krampfanfälle auftreten. In Notfallsituationen (internistisch oder chirurgisch) und absehbaren Situationen, die voraussichtlich Stress erzeugen, ist immer an die Möglichkeit einer residualen Beeinträchtigung der Nebennierenrindenfunktion zu denken und eine entsprechende Kortikosteroidtherapie zu erwägen (siehe Abschnitt 4.9).
Die systemische Resorption erfolgt überwiegend über die Lunge. Bei Verwendung eines Dosieraerosols mit dem Volumatic Spacer kann die Lungendeposition zunehmen; es ist zu beachten, dass damit auch das Risiko systemischer Nebenwirkungen ansteigt.
Die Inhalationsbehandlung mit Fluticason darf wegen des Risikos einer Exazerbation nicht abrupt abgesetzt werden, sondern sollte unter ärztlicher Aufsicht ausschleichend beendet werden.
Wie bei allen inhalativen Kortikoiden ist bei der Behandlung von Patienten mit aktiver oder latenter Lungentuberkulose besondere Vorsicht erforderlich.
Sehr selten wurde ein Anstieg des Blutzuckerspiegels beobachtet (siehe Abschnitt 4.8). Bei der Verordnung von FlutiHEXAL an Patienten mit Diabetes mellitus ist dies zu bedenken.
Wie bei fast allen Inhalationstherapien kann ein paradoxer Bronchospasmus auftreten, so dass es unmittelbar nach der Anwendung zu verstärktem Giemen kommt. In diesem Fall ist die Fluticason-Inhalation umgehend abzubrechen und entsprechend dem klinischen Befund ggf. eine alternative Therapie einzuleiten.
Seit der Markteinführung gab es Meldungen über klinisch relevante Wechselwirkungen bei Patienten, die gleichzeitig Fluticasonpropionat und Ritonavir erhielten: Unter dieser Kombination traten systemische Kortikoidwirkungen einschließlich Cushing-Syndrom und Nebennierenrindensuppression auf. Deshalb ist die gleichzeitige Anwendung von Fluticasonpropionat und Ritonavir zu vermeiden, sofern nicht der zu erwartende Nutzen für den Patienten das Risiko systemischer Kortikoidnebenwirkungen übersteigt. Auch bei der Kombination von Fluticasonpropionat mit anderen starken CYP3A-Inhibitoren besteht ein erhöhtes Risiko für systemische Nebenwirkungen (siehe Abschnitt 4.5).
Umstellung von Patienten, die mit oralen Kortikosteroiden behandelt werden: Nebennierenrindenfunktion und adrenale Reserve bleiben unter Behandlung mit Fluticasonpropionat in den empfohlenen Dosierungen in der Regel im Normbereich. Die Wirkung der Fluticasonpropionat-Inhalationen sollte den Bedarf an oralen Kortikoiden minimieren, aber dennoch bleibt das Risiko von Nebenwirkungen bei Patienten, die zuvor oder intermittierend orale Steroide erhalten haben, noch eine Zeit lang bestehen. Die Einschränkung der Nebennierenrindenfunktion kann so ausgeprägt sein, dass vor elektiven operativen Eingriffen die Konsultation eines Spezialisten sinnvoll ist. In Notfallsituationen (internistisch oder chirurgisch) und absehbaren Situationen, die voraussichtlich Stress erzeugen, ist immer an die Möglichkeit einer residualen Beeinträchtigung der Nebennierenrindenfunktion zu denken und eine entsprechende Kortikosteroidtherapie zu erwägen (siehe Abschnitt 4.9).
Wegen der Möglichkeit einer Nebennierenrindeninsuffizienz sind die Patienten bei und nach der Umstellung von einer oralen Steroidtherapie auf die Inhalationstherapie mit Fluticasonpropionat mit besonderer Sorgfalt zu behandeln; die adrenale Funktion sollte regelmäßig kontrolliert werden.
Nach Beginn der Inhalationsbehandlung mit Fluticasonpropionat sollte das Absetzen der systemischen Therapie schrittweise erfolgen. Die Patienten sollten einen Kortison-Pass mit sich führen, in dem darauf hingewiesen wird, dass in Stresssituationen eine Substitution erforderlich werden kann.
Bei kortikoidpflichtigen Patienten sollte Fluticasonpropionat zunächst 10 Tage lang zusammen mit dem oralen Kortikoid verabreicht werden. Danach wird das systemische Kortikoid schrittweise (2,5 mg Prednisolon oder äquivalent pro Monat) bis zur niedrigstmöglichen Dosis ausgeschlichen.
Manche Patienten klagen während der Absetzphase über unspezifische Beschwerden, obwohl die Lungenfunktion unverändert bleibt oder sich sogar bessert. Sie sollten ermutigt werden, die Umstellung von der systemischen auf die Inhalationstherapie mit Fluticasonpropionat fortzuführen, sofern keine objektiven Zeichen einer Nebennierenrindeninsuffizienz bestehen.
Durch die Umstellung von der systemischen auf die Inhalationsbehandlung können gelegentlich Allergiekrankheiten (z. B. allergische Rhinitis oder Ekzem) demaskiert werden, die zuvor durch die systemische Therapie supprimiert waren. Diese Allergien sollten symptomatisch mit Antihistaminika und/oder topischen Arzneimitteln einschließlich topischer Steroide behandelt werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Normalerweise werden nach inhalativer Anwendung aufgrund des ausgeprägten First-PassMetabolismus und die hohe systemische Clearance durch Cytochrom P450-3A4 in Darm und Leber nur geringe Plasmakonzentrationen von Fluticasonpropionat aufgebaut. Daher sind klinisch relevante Wechselwirkungen durch Fluticasonpropionat nicht zu erwarten.
Eine Wechselwirkungsstudie mit gesunden Probanden zeigte, dass bei Anwendung von intranasalem Fluticasonpropionat gemeinsam mit dem starken Cytochrom-P450-3A4-Inhibitor Ritonavir in einer Dosis von zweimal täglich 100 mg die Plasmakonzentrationen von Fluticasonpropionat mehrere hundertfach ansteigen und die Serumcortisolspiegel dadurch deutlich abnehmen. Entsprechende Daten für inhalatives Fluticasonpropionat liegen nicht vor, ein deutlicher Anstieg der Fluticasonpropionat-Plasmaspiegel ist jedoch zu erwarten. Einige Fälle von Cushing-Syndrom und adrenaler Suppression wurden gemeldet. Die Kombination von Fluticasonpropionat mit Ritonavir ist zu vermeiden, sofern der zu erwartende Nutzen nicht das erhöhte Risiko der systemischen Kortikoidwirkungen übersteigt. In einer kleinen Studie an gesunden Probanden nahm die Fluticasonpropionat-Exposition nach einer Einzelinhalation um 150% zu, wenn gleichzeitig der etwas weniger potente CYP3A-Inhibitor Ketoconazol verabreicht wurde. Die Reduktion des Plasmakortisolspiegels war dabei ausgeprägter als unter Fluticasonpropionat allein. Auch bei Komedikation mit anderen potenten CYP3A-Inhibitoren wie Itraconazol, Clarithromycin, Telithromycin, Atazanavir, Indinavir, Nelfinavir oder Saquinavir erhöht sich wahrscheinlich die systemische Fluticasonpropionat-Exposition sowie das Risiko systemischer Nebenwirkungen. Es wird zur Vorsicht geraten; die Langzeittherapie mit diesen Kombinationen ist nach Möglichkeit zu vermeiden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität:
Es liegen keine klinischen Daten zum Einfluss von Fluticasonpropionat auf die Fertilität vor. In Untersuchungen zur Toxizität nach wiederholter Gabe, Reproduktionsstudien und teratologischen Studien wurden keine neuen Wirkungen auf die Fertilität festgestellt. Als Vorsichtsmaßnahme ist es vorzuziehen, die Anwendung von Fluticasonpropionat zu vermeiden, wenn eine Schwangerschaft geplant ist.
Schwangerschaft:
Die Sicherheit der Anwendung von Fluticasonpropionat während der Schwangerschaft beim Menschen ist bisher nur unzureichend belegt. Daten aus einer begrenzten Zahl (200) exponierter Schwangerschaften deuten nicht auf unerwünschte Wirkungen des FluticasonDosieraerosols auf die Schwangerschaft oder die Gesundheit des Fetus/Neugeborenen hin. Weitere relevante epidemiologische Daten stehen bisher nicht zur Verfügung (siehe Abschnitt 5.3). Da der Fluticason-HFA-Inhalator den Wirkstoff inhalativ direkt in die Lungen abgibt, wird die hohe Exposition vermieden, die bei systemischer Anwendung von Kortikosteroiden auftritt.
Eine Anwendung von Fluticasonpropionat während der Schwangerschaft sollte nur dann in Betracht gezogen werden, wenn der zu erwartende Nutzen für die Mutter größer ist als jedes mögliche Risiko für den Fetus.
Stillzeit
Bisher wurde nicht untersucht, ob Fluticasonpropionat beim Menschen in die Muttermilch übergeht. Die subkutane Injektion von Fluticasonpropionat bei säugenden Laborratten führte zu messbaren Plasmaspiegeln und zum Nachweis von Fluticasonpropionat in der Muttermilch. Beim Menschen sind die Plasmaspiegel bei einer Inhalationstherapie in den empfohlenen Dosierungen jedoch wahrscheinlich niedrig. Wenn Fluticasonpropionat von stillenden Müttern verwendet wird, sind die therapeutischen Vorteile gegen die potenziellen Gefahren für Mutter und Kind abzuwägen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Beeinträchtigungen durch Fluticasonpropionat sind nicht zu erwarten.
4.8 Nebenwirkungen
Nachfolgend sind die Nebenwirkungen nach Systemorganklassen und Häufigkeit aufgelistet. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (>1/10), Häufig (>1/100 bis <1/10), Gelegentlich (>1/1.000 bis <1/100), Selten (>1/10.000 bis <1/1.000), Sehr selten (<1/10.000 einschließlich Einzelfallberichte) und Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Sehr häufige, häufige und gelegentliche Nebenwirkungen wurden im Allgemeinen aus den Daten der klinischen Prüfungen abgeleitet. Seltene und sehr seltene Nebenwirkungen wurden im Allgemeinen aufgrund spontan erfasster Meldungen festgestellt.
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Candidose der Mund- und Rachenschleimhaut |
Sehr häufig |
|
Erkrankungen des Immunsystems |
Arzneimittelüberempfindlichkeit mit folgenden Reaktionen: | |
|
Allergische Hauterscheinungen |
Gelegentlich | |
|
Angioödem (überwiegend faziales und oropharyngeales Ödem) |
Sehr selten | |
|
Respiratorische Symptome (Dyspnoe und/oder Bronchospasmus) |
Sehr selten | |
|
Anaphylaktische Reaktion |
Sehr selten | |
|
Endokrine Erkrankungen |
Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Abnahme der Knochenmineraldichte, Katarakt, Glaukom |
Sehr selten |
|
Stoffwechsel- und Ernährungsstörungen |
Hyperglykämie (siehe Abschnitt 4.4) |
Sehr selten |
|
Psychiatrische Erkrankungen |
Angstgefühle, Schlafstörungen, Verhaltensänderungen einschließlich Hyperaktivität und Reizbarkeit (überwiegend bei Kindern) |
Sehr selten |
|
Depression, Aggression (überwiegend bei Kindern) |
Nicht bekannt | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Heiserkeit/Dysphonie |
Häufig |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hämatome |
Häufig |
Bei einigen Patienten treten Heiserkeit und Candidose der Mund- und Rachenschleimhaut (Soor) auf. Für diese Patienten kann es hilfreich sein, nach Anwendung des Inhalators den Mund mit Wasser auszuspülen. Bei symptomatischen Candidosen empfiehlt sich eine antimykotische Lokalbehandlung unter Fortsetzung der Inhalationsbehandlung mit Fluticasonpropionat.
Mögliche systemische Wirkungen sind Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung, Abnahme der Knochenmineraldichte, Katarakt, Glaukom (siehe Abschnitt 4.4).
Wie bei fast allen Inhalationstherapien kann ein paradoxer Bronchospasmus auftreten (siehe Abschnitt 4.4).
Akut: Bei Anwendung des Arzneimittels in höheren als den zugelassenen Dosen kann eine vorübergehende Suppression der Nebennierenrindenfunktion eintreten. Dies erfordert keine Notfallmaßnahmen. Bei den betroffenen Patienten sollte die Inhalationsbehandlung mit Fluticasonpropionat in einer zur Asthmakontrolle ausreichenden Dosierung fortgesetzt werden. Die adrenale Funktion erholt sich innerhalb einiger Tage; dies kann durch Messung des Plasmakortisolspiegels verifiziert werden.
Chronisch: Wenn höhere als die zugelassenen Dosierungen über einen längeren Zeitraum angewendet werden, kann eine relevante Nebennierenrindensuppression eintreten. Sehr selten wurden akute adrenale Krisen bei Kindern beschrieben, die höhere als die zugelassenen Dosen (meist 1.000 ^g/Tag und mehr) über einen längeren Zeitraum (mehrere Monate oder Jahre) inhaliert hatten. Beobachtet wurden unter anderem Hypoglykämien mit nachfolgender Bewusstseinstrübung und/oder Konvulsionen. Risikosituationen für eine Addisonkrise sind Traumen, Operationen, Infektionen oder eine rasche Dosisreduktion. Eine Kontrolle der adrenalen Reserve kann angezeigt sein. Die Inhalationsbehandlung mit Fluticasonpropionat sollte in einer zur Asthmakontrolle ausreichenden Dosis fortgesetzt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere inhalative Mittel bei obstruktiven Atemwegserkrankungen, Glucocorticoide ATC-Code: R03BA05
Fluticasonpropionat ist ein Glukokortikoid mit antiphlogistischer Wirkung. Bei inhalativer Anwendung in der empfohlenen Dosierung entwickelt Fluticasonpropionat eine ausgeprägte glukokortikoide antientzündliche Wirkung in der Lunge. Dadurch werden Asthmasymptome und Exazerbationen reduziert; Häufigkeit und Schwere von Nebenwirkungen sind dabei geringer als unter systemischer Anwendung von Kortikosteroiden. Die Behandlung mit Fluticasonpropionat ist prophylaktischer Natur. Die volle Wirkung wird nach 4 bis 7 Behandlungstagen erreicht. Die meisten Aerosolpartikel sind kleiner als 5 Mikrometer.
5.2 Pharmakokinetische Eigenschaften
Resorption
Bei gesunden Probanden beträgt die durchschnittliche systemische Bioverfügbarkeit bei Anwendung des Fluticason-HFA-Inhalators je nach dem verwendeten Inhalationsgerät 5-11% der nominalen Dosis. Bei Patienten mit Asthma (FEV1 < 75% des Sollwerts) ist die absolute mittlere systemische Bioverfügbarkeit geringer als bei gesunden Probanden. Die systemische Resorption geschieht vorwiegend in der Lunge und es wurde gezeigt, dass sie über einen Dosisbereich von 500 bis 2000 Mikrogramm linear verläuft. Fluticasonpropionat wird initial rasch und dann über einen längeren Zeitraum langsam resorbiert.
Die absolute orale Bioverfügbarkeit ist aufgrund einer Kombination aus unvollständiger gastrointestinaler Resorption und weitgehendem First-Pass-Metabolismus vernachlässigbar (<1%).
Verteilung
Nach intravenöser Gabe verteilt sich Fluticasonpropionat weitläufig im Körper. Die Plasmaclearance ist hoch (ca. 1150 ml/min) und das Verteilungsvolumen im Steady State ist groß (ca. 300 l). Fluticasonpropionat wird zu 91% an Plasmaproteine gebunden.
Biotransformation
Fluticason wird durch das Enzym CYP3A4 vorwiegend zu einem inaktiven Carboxylsäuremetaboliten metabolisiert.
Elimination
87-100% einer oralen Dosis werden im Stuhl ausgeschieden, bis zu 75% in Form der Ausgangssubstanz. Daneben wurden weitere Metaboliten mit unbekannter Struktur im Stuhl gefunden. Die terminale Halbwertszeit beträgt etwa 8 Stunden.
5.3 Präklinische Daten zur Sicherheit
Kortikoidgaben an trächtige Tiere können Abnormitäten der fetalen Entwicklung einschließlich Gaumenspalten und intrauteriner Wachstumsverzögerung verursachen. Ein sehr geringes Risiko hierfür kann daher auch für den menschlichen Fetus bestehen. Dabei ist allerdings zu beachten, dass die fetalen Veränderungen bei Tieren nach relativ hoher systemischer Exposition beobachtet wurden.
Toxikologisch zeigten sich nur die Klasseneffekte, die für potente Kortikosteroide typisch sind und diese nur in Dosierungen, die weit höher als die für die therapeutische Anwendung empfohlenen Dosierungen lagen. In Untersuchungen zur Toxizität nach wiederholter Gabe, Reproduktionsstudien und teratologischen Studien wurden keine neuen Wirkungen oder Einflüsse auf die Fertilität festgestellt. Fluticasonpropionat hat in vitro und in vivo keine mutagenen Wirkungen und zeigte an Nagetieren kein tumorigenes Potenzial. In Tiermodellen ist es weder reizend noch sensibilisierend.
Bei täglicher Exposition eines breiten Spektrums von Tierarten über zwei Jahre zeigte das FCKW-freie Treibgas Norfluran selbst bei sehr hohen, d. h. weit über den voraussichtlich von Patienten aufgenommenen liegenden Dampfkonzentrationen keine toxischen Wirkungen. Durch die Verwendung von Norfluran als Treibmittel verändert sich das Toxizitätsprofil von Fluticasonpropionat nicht im Vergleich zu dem bei Verwendung des herkömmlichen FCKW-Treibmittels.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Norfluran
6.2 Inkompatibilitäten
Nicht zutreffend.
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die Flüssigkeit im Behälter steht unter Druck. Vor Temperaturen über 50°C schützen. Behälter nicht durchstechen. Nicht im Kühlschrank lagern oder einfrieren. Vor Frost und direkter Sonneneinstrahlung schützen.
Bei Arzneimitteln, die aus Druckbehältern verabreicht werden, kann die Wirkung abgeschwächt sein, wenn der Behälter kalt ist.
Behälter nicht öffnen, zerbrechen oder ins Feuer werfen, auch wenn er scheinbar leer ist. Schutzkappe nach der Inhalation fest auf das Mundstück aufsetzen und einrasten lassen.
6.5 Art und Inhalt des Behältnisses
Inhalator, bestehend aus einem Druckbehälter aus einer Aluminiumlegierung mit einem Dosierventil, einem Auslöser und einer Staubschutzkappe. Jeder Druckbehälter enthält 120 Sprühstöße zu je 250 Mikrogramm Fluticason-17-propionat.
Packungsgrößen
1 bzw. 2 (Bündelpackung 2x1) Druckbehälter mit je 120 Sprühstößen Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Das Aerosol wird durch den Mund in die Lunge inhaliert. Der Patient schüttelt den Inhalator, atmet anschließend tief aus, nimmt das Mundstück in den Mund und umschließt es mit den Lippen. Durch Druck auf den Auslöser wird das Aerosol freigesetzt; dies muss gleichzeitig mit der Einatmung geschehen.
Jede Packung enthält eine Packungsbeilage mit genauer Anleitung zur Anwendung.
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
87903.00.00 9. DATUM DER ERTEILUNG DER ZULASSUNG 10. STAND DER INFORMATION
Oktober 2013