Forair 12 Mikrogramm Druckgasinhalation, Lösung
S. 1
1. BEZEICHNUNG DES ARZNEIMITTELS
Forair® 12 Mikrogramm Druckgasinhalation, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Formoterolfumaratdihydrat
Jeder Sprühstoß enthält 12 Mikrogramm Formoterolfumaratdihydrat. Dies entspricht einer über das Mundstück abgegebenen Menge von 10,1 Mikrogramm.
Sonstige Bestandteile: Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Druckgasinhalation, Lösung.
4. KLINISCHE ANGABEN Anwendungsgebiete
Zur symptomatischen Langzeitbehandlung des persistierenden, mittelschweren bis schweren Asthma bronchiale bei Patienten, die eine regelmäßige
bronchialerweiternde Therapie benötigen, in Verbindung mit einer
entzündungshemmenden Dauertherapie (inhalative und/oder orale Glukokortikoide). Die Behandlung mit Glukokortikoiden ist regelmäßig weiterzuführen.
Forair® ist ebenfalls angezeigt zur Erleichterung der bronchialobstruktiven Symptome bei Patienten mit chronisch-obstruktiver Atemwegserkrankung (COPD).
Dosierung, Art und Dauer der Anwendung
Die Dosierung richtet sich nach Art und Schwere der Erkrankung.
Für Erwachsene, einschließlich ältere Patienten, sowie Jugendliche ab 12 Jahren gelten folgende Empfehlungen:
Asthma bronchiale
Erwachsene und Jugendliche ab 12 Jahren:
In der Regel morgens und abends je 1 Sprühstoß (entspricht 24 Mikrogramm Formoterolfumaratdihydrat pro Tag). In schweren Fällen maximal bis zu 2 Sprühstöße morgens und abends (entspricht 48 Mikrogramm
Formoterolfumaratdihydrat pro Tag).
Die maximale Tagesdosis beträgt 4 Sprühstöße (entspricht 48 Mikrogramm Formoterolfumaratdihydrat).
Zur Erleichterung der Symptome können, falls erforderlich, zusätzliche Inhalationen, die über die reguläre Erhaltungstherapie hinausgehen, bis zu einer maximalen Tagesdosis von 6 Inhalationen (Erhaltungsdosis plus eventuell zusätzlich erforderliche Dosis) angewendet werden. Als Einzeldosis dürfen nicht mehr als 3 Inhalationen nacheinander appliziert werden.
Kinder im Alter von 5 bis 11 Jahren:
Die Sicherheit und Wirksamkeit von Forair® bei Kindern im Alter von 5 bis 11 Jahren ist noch nicht nachgewiesen, weshalb Forair® bis zum Vorliegen
umfangreicher Erfahrungen bei Kindern im Alter von 5 bis 11 Jahren nicht angewendet werden sollte.
Forair® ist nicht für die Linderung akuter Asthmaanfälle gedacht.
Im Falle eines akuten Anfalls ist ein schnell wirkender ß2-Agonist einzusetzen.
Eine höhere Dosierung lässt im Allgemeinen keinen zusätzlichen Nutzen erwarten, die Wahrscheinlichkeit des Auftretens auch schwerwiegender Nebenwirkungen kann aber erhöht werden.
Forair® führt wegen seiner 12-stündigen Wirkungsdauer normalerweise bei
zweimal täglicher Dosierung zu einer ausreichenden Kontrolle der
Asthmasymptome während des Tages und der Nacht.
Forair® kann jedoch eine notwendige Basistherapie der Grunderkrankung nicht ersetzen. Die Dauerbehandlung mit ß-Sympathomimetika sollte von einer entzündungshemmenden Dauertherapie mit Glukokortikoiden zur Inhalation und/oder oralen Glukokortikoiden begleitet werden. Eine zu Beginn der Behandlung mit Forair® bereits bestehende Basistherapie mit Steroiden (oral oder zur Inhalation) muss in jedem Fall fortgesetzt werden.
Chronisch-obstruktive Atemwegserkrankung (COPD)
Erwachsene ab 18 Jahren:
In der Regel 1 Sprühstoß zweimal täglich (ein Sprühstoß morgens und einer abends, 24 Mikrogramm Formoterolfumaratdihydrat pro Tag).
Für den regelmäßigen Gebrauch sollte die Tagesdosis zwei Sprühstöße nicht überschreiten. Zur Erleichterung der Symptome können, falls erforderlich, zusätzliche Inhalationen, die über die reguläre Therapie hinausgehen, bis zu einer maximalen Tagesdosis von 4 Sprühstößen (reguläre plus erforderliche Dosis) angewendet werden. Als Einzeldosis sollten nicht mehr als 2 Sprühstöße inhaliert werden.
Bei an COPD erkrankten Patienten unter 18 Jahren ist dieses Arzneimittel nicht angezeigt.
Patienten sollten das Druckbehältnis nicht länger als 3 Monate nach dem Datum der Abgabe durch den Apotheker verwenden (siehe Abschnitt 6.4).
Trotz des raschen Wirkungseintritts von Forair® ist dieser langwirksame inhalative Bronchodilatator für die bronchodilatatorische Erhaltungstherapie vorgesehen.
Wenn die Symptome persistieren oder schlimmer werden oder wenn mit der empfohlenen Forair®-Dosis keine Symptomkontrolle (Aufrechterhaltung einer wirksamen Linderung) erreicht werden kann, dann ist dies in der Regel ein Hinweis auf eine Verschlimmerung der Grunderkrankung.
Nieren- und Leberfunktionsstörungen
Prinzipiell besteht kein Grund für eine Anpassung der Forair®-Dosis bei Patienten mit Nieren- oder Leberfunktionsstörungen. Es liegen jedoch keine klinischen Daten vor, die eine Anwendung bei diesen Patientengruppen stützen.
Anleitung zur Anwendung von Forair® :
Bei neuen oder gebrauchten Druckbehältnissen, die 3 oder mehr Tage nicht
verwendet wurden, sollte vor dem Gebrauch ein Sprühstoß in die Luft abgegeben
werden, um eine einwandfreie Funktion zu gewährleisten.
Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen. Die Inhalation nicht
überhastet vornehmen.
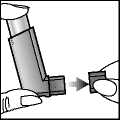
1. Die Schutzkappe vom Mundstück entfernen.
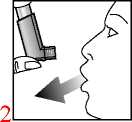
2. Langsam und so tief wie möglich ausatmen.
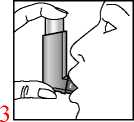
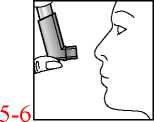
3. Das Druckbehältnis, unabhängig von der Körperposition, in der inhaliert wird, mit dem Behälterboden nach oben halten. Das Mundstück vorsichtig zwischen den Zähnen platzieren und mit den Lippen umschließen. Den Kopf leicht zurückneigen.
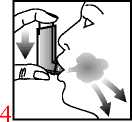
4. Langsam und tief durch den Mund einatmen und gleichzeitig auf den oberen Teil des Inhalators drücken, um einen Sprühstoß freizusetzen.
5. Den Atem so lange wie ohne Anstrengung möglich anhalten und anschließend den Inhalator aus dem Mund nehmen.
6. Falls ein weiterer Sprühstoß inhaliert werden soll, den Inhalator etwa eine halbe Minute in aufrechter Position halten und anschließend die Schritte 2 bis 5 wiederholen.
7. Nach Gebrauch die Schutzkappe wieder aufsetzen.
1
7
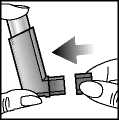
Falls unbeabsichtigt ein Teil des Gases vom oberen Teil des Inhalators oder seitlich aus dem Mund entweicht, sollte ein weiterer Sprühstoß inhaliert werden.
Für Patienten mit schwächerem Händedruck kann es leichter sein, den Inhalator mit beiden Händen zu halten. Dazu wird der Inhalator mit beiden Zeigefingern von oben und beiden Daumen von unten fixiert.
Pflege des Mundstücks:
Um eine störungsfreie Funktion des Druckbehältnisses zu gewährleisten, sollte das Mundstück regelmäßig (3- bis 4-mal pro Woche) gereinigt werden. Ablagerungen können mit lauwarmem Wasser entfernt werden, nachdem das Druckbehältnis abgezogen wurde. Anschließend das Mundstück gut abtrocknen, das Druckbehältnis einsetzen und die Schutzkappe aufstecken.
Hinweis:
Um eine falsche Anwendung zu vermeiden, ist eine gründliche Einweisung des Patienten in den korrekten Gebrauch vorzunehmen.
Die Anwendung eines Inhalationshilfsmittels (Spacer) wird normalerweise für Patienten empfohlen, die Schwierigkeiten dabei haben, Atmung und Drücken des Inhalators zu koordinieren; es liegen jedoch keine klinischen Daten für Forair® mit Spacern vor.
Gegenanzeigen
Bekannte Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile des Arzneimittels.
Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Forair® sollte nicht als Initialtherapie zur Asthmabehandlung eingesetzt werden und ist dafür auch nicht ausreichend.
Asthmapatienten, die eine Therapie mit langwirksamen ß2-Agonisten benötigen, sollten zur optimalen Erhaltung der antiinflammatorischen Wirkung auch eine Kortikoidsteroidtherapie erhalten. Die Patienten müssen angewiesen werden, ihre antiinflammatorische Therapie nach dem Beginn der Anwendung von Formoterol fortzuführen, selbst, wenn ihre Symptome abnehmen. Sollten weiterhin Symptome bestehen oder sollte die Behandlung mit ß2-Agonisten intensiviert werden müssen, so weist dieses auf eine Verschlechterung der Grunderkrankung hin und erfordert eine Neueinstellung der Erhaltungstherapie.Obwohl Forair® als Zusatztherapie eingesetzt werden kann, wenn inhalative Kortikosteroide zur adäquaten Kontrolle der Asthmasymptome nicht ausreichen, sollte der Therapiebeginn mit Forair® nicht während einer akuten schweren Exazerbation oder wenn sich das Asthma signifikant verschlechtert oder akut verschlimmert erfolgen.
Während der Behandlung mit Forair® können schwere Asthma-assoziierte unerwünschte Ereignisse und Exazerbationen auftreten. Patienten sollten aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat einzuholen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese nach Therapiebeginn mit Forair® verschlimmern.
Forair® sollte genau entsprechend den Dosierungsrichtlinien (siehe Abschnitt 4.2) angewendet werden. Sobald eine Kontrolle der Asthmasymptome erreicht ist, kann eine schrittweise Reduzierung der Dosis von Forair® in Betracht gezogen werden. In diesem Fall ist eine regelmäßige Kontrolle der Patienten wichtig. Es sollte die niedrigste wirksame Dosis von Forair® eingesetzt werden. Die maximale Tagesdosis sollte nicht überschritten werden.
Eine plötzliche und zunehmende Verschlechterung der Asthmabeschwerden kann lebensbedrohlich sein und verlangt unverzüglich ärztliche Hilfe. Eine erhebliche Überschreitung der verordneten Einzeldosen, aber auch der Tagesdosis, kann gefährlich sein aufgrund der Wirkungen auf das Herz (Herzrhythmusstörungen, Blutdruckanstieg) in Verbindung mit Veränderungen der Salzkonzentrationen in Körperflüssigkeiten (Elektrolytverschiebungen) und muss deshalb vermieden werden.
Es ist wiederholt über ein erhöhtes Risiko für schwere Komplikationen und Todesfälle bei der Behandlung des Asthma bronchiale mit ß2-Sympathomimetika zur Inhalation berichtet worden, ohne dass die ursächlichen Zusammenhänge bisher hinreichend geklärt werden konnten.
Begleiterkrankungen
Forair® sollte nur mit Vorsicht und bei strenger Indikationsstellung angewendet werden bei
- AV-Block III. Grades,
- idiopathisch-subvalvulärer Aortenstenose,
- hypertroph-obstruktiver Kardiomyopathie,
- verlängertem QTc-Intervall (angeboren oder arzneimittelinduziert mit QTc > 0,44 Sekunden),
- Thyreotoxikose,
- schweren Herzerkrankungen, insbesondere frischem Herzinfarkt, koronarer Herzkrankheit, dekompensierter Herzinsuffizienz,
- schwerer Hypertonie,
- Hyperthyreose,
- schwer kontrollierbarem Diabetes mellitus,
- Phäochromozytom
- Aneurysmen oder anderen schweren kardiovaskulären Funktionsstörungen, wie ischämische Herzerkrankungen, Tachyarrhythmien oder schwere Herzfehler und okklusiven Gefäßerkrankungen, insbesondere Arteriosklerose
Bei Patienten mit tachykarden Rhythmusstörungen (beschleunigter und/oder unregelmäßiger Herzschlag) darf die Anwendung von Forair® nur unter besonderen Vorsichtsmaßnahmen (z. B. Überwachung) erfolgen.
Formoterol kann eine Verlängerung des QTc-Intervalls hervorrufen. Vorsicht ist geboten bei der Behandlung von Patienten mit verlängertem QTc-Intervall (angeboren oder arzneimittelinduziert (QTc > 0,44 Sekunden) und bei Patienten, die gleichzeitig mit Arzneimitteln behandelt werden, die das QTc-Intervall beeinflussen (siehe Abschnitt 4.5).
Bei der Inhalation von Formoterol in hohen Dosen kann der Blutzuckerspiegel ansteigen. Bei Diabetikern sollten daher engmaschige Blutzuckerkontrollen durchgeführt werden. Wenn eine Narkose unter Verwendung von halogenierten Anästhetika geplant ist, sollte darauf geachtet werden, dass Forair® innerhalb von mindestens 12 Stunden vor Narkosebeginn nicht mehr angewendet wird.
Paradoxer Bronchospasmus
Wie bei jeder Inhalationstherapie sollte das Risiko eines paradoxen Bronchospasmuses bedacht werden. Falls dieser auftritt, sollte das Arzneimittel sofort abgesetzt und eine alternative Therapie begonnen werden (siehe Abschnitt 4.8).
Hypokaliämie
Aus der Therapie mit ß2-Agonisten können potentiell schwerwiegende Hypokaliämien resultieren. Besondere Vorsicht ist bei akutem schwerem Asthma geboten, da das assoziierte Risiko bei einer Hypoxie weiter steigen könnte. Der Hypokaliämieeffekt kann durch eine gleichzeitige Behandlung mit Xanthin-Derivaten, Steroiden und Diuretika verstärkt werden. Aus diesem Grund sollten die Serumkaliumspiegel überwacht werden.
Es gibt Hinweise darauf, dass unter einer Therapie mit Formoterol eine Senkung des Blutkaliumspiegels in größerem Ausmaß als unter einer Therapie mit kurzwirksamen ß2-Sympathomimetika (z. B. Salbutamol) auftreten kann. Daher ist insbesondere bei Patienten mit niedrigen Ausgangs-Kaliumwerten oder besonderen Risiken hinsichtlich einer Senkung des Blutkaliumspiegels dieser Wert regelmäßig zu kontrollieren, auch wenn unter einer bisherigen Therapie mit kurzwirksamen ß2-Sympathomimetika keine Senkung dieses Spiegels zu beobachten war. Gegebenenfalls ist Kalium zu substituieren.
Durch eine Senkung des Serumkaliumspiegels kommt es zu einer Wirkungsverstärkung von Digitalis-haltigen Arzneimitteln.
Die Anwendung von Forair® 12 Mikrogramm kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine speziellen Interaktionsstudien mit Formoterol durchgeführt. Es besteht das theoretische Risiko, dass eine gleichzeitige Behandlung mit Arzneistoffen, die das QTc-Intervall verlängern, pharmakodynamische Interaktionen mit Formoterol hervorrufen und das potentielle Risiko einer ventrikulären Arrhythmie erhöhen könnte. Beispiele solcher Arzneistoffe schließen Phenothiazine, bestimmte Antihistaminika (z.B. Terfenadin, Astemizol,
Mizolastine), bestimmte Antiarrhythmika (z.B. Chinidin, Disopyramid, Procainamid), Erythromycin und trizyklische Antidepressiva ein. Die gleichzeitige Behandlung mit anderen sympathomimetischen Substanzen, wie anderen ß2-Agonisten und Ephedrin, kann die möglichen Nebenwirkungen von Forair® verstärken und
möglicherweise eine Dosistitration erfordern. Die gleichzeitige Gabe von Formoterol und Theophyllin kann zu einer wechselseitigen Wirkungsverstärkung führen. Es besteht auch die Wahrscheinlichkeit einer Zunahme unerwünschter Wirkungen, wie z. B. Herzrhythmusstörungen. Auch Substanzen, die ihrerseits sympathomimetische Effekte verstärken, wie L-Dopa, L-Thyroxin, Oxytocin oder Alkohol, können die Herz-Kreislauf-Regulation im Zusammenwirken mit Forair® beeinflussen.
Die gleichzeitige Verabreichung von Xanthinderivaten, Steroiden oder Diuretika, wie Thiaziden und Schleifendiuretika, kann möglicherweise die seltene hypokaliämische Nebenwirkung von ß2-Sympathomimetika verstärken.
Die Hypokaliämie kann bei Patienten, die mit Digitalis behandelt werden, die Neigung zum Auftreten von kardialen Arrhythmien erhöhen (s. Abschnitt 4.4). ß-Rezeptoren-Blocker können die Wirkung von Forair® abschwächen bis vollständig hemmen. Forair® sollte daher - außer bei zwingender Indikation - nicht zusammen mit ß-Rezeptoren-Blockern (einschließlich Augentropfen) verabreicht werden. Bei gleichzeitiger Medikation kann ein Asthmaanfall ausgelöst werden.
Wegen einer möglichen Potenzierung sympathomimetischer Effekte ist die gleichzeitige Anwendung von Formoterol und Monoaminoxidase-Hemmstoffen (MAO-Inhibitoren, z. B. Tranylcypromin) oder trizyklischen Antidepressiva (z. B. Amitriptylin, Imipramin oder Doxepin) nicht angezeigt. Bei der Anwendung halogenierter Anästhetika (z. B. Halothan, Methoxyfluran oder Enfluran) muss bei Patienten, die mit Formoterol behandelt werden, mit einem erhöhten Risiko für schwere Herzrhythmusstörungen und Blutdrucksenkung gerechnet werden.
Der bronchodilatatorische Effekt von Formoterol kann durch anticholinerge Arzneistoffe verstärkt werden.
Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Es liegen keine ausreichenden Daten zur Anwendung von Formoterol bei Schwangeren vor. In tierexperimentellen Studien führte Formoterol zu Implantationsverlusten sowie vermindertem Überleben in der frühen Postnatal-Phase und vermindertem Geburtsgewicht. Diese Wirkungen traten bei systemischen Expositionen auf, die erheblich höher waren als die Exposition, die nach klinischer Anwendung von Formoterol erzielt wird. Die Behandlung mit Formoterol kann in allen Stadien der Schwangerschaft in Erwägung gezogen werden, wenn dies für die Asthmakontrolle notwendig ist und der erwartete Nutzen für die Mutter größer ist als jegmögliches Risiko für den Fetus. Das potenzielle Risiko für den Menschen ist nicht bekannt.
Stillzeit
Es ist nicht bekannt, ob Formoterol beim Menschen in die Muttermilch übergeht. Bei Ratten wurden kleine Mengen Formoterol in der Muttermilch gefunden. Die Gabe von Formoterol an stillende Frauen sollte nur dann in Erwägung gezogen werden, wenn der erwartete Nutzen für die Mutter größer ist als jegmögliches Risiko für das Kind.
Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Forair® hat keinen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
Nebenwirkungen
Die am häufigsten gemeldeten Nebenwirkungen der Therapie mit ß2-Agonisten, wie Tremor und Palpitationen sind in der Regel mild und verschwinden innerhalb von wenigen Behandlungstagen. Nebenwirkungen, die mit Formoterol in Verbindung gebracht werden, sind im Folgenden aufgeführt, geordnet nach Organsystem und Häufigkeit. Die Häufigkeit ist definiert als:
Sehr häufig (>1/10)
Häufig (>1/100 und <1/10)
Gelegentlich (>1/1.000 und <1/100)
Selten (>1/10.000 und <1/1.000)
Sehr selten (<1/10.000)
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombopenie |
sehr selten |
|
Störungen des Immunsystems |
Überempfindlichkeitsreaktionen, z.B. Angioödem, Bronchospasmus, Exanthem, Urticaria, Pruritus |
selten |
|
Stoffwechsel- und Ernährungsstörungen |
Hypokaliämie, Hyperglykämie |
gelegentlich |
|
Psychatrische Erkrankungen |
Unruhe, Ruhelosigkeit, Schlafstörungen |
gelegentlich |
|
Verhaltensstörungen, Halluzinationen |
sehr selten | |
|
Erkrankungen des Nervensystems |
Tremor, Kopfschmerzen |
häufig |
|
Schwindel, Störungen des Geschmacksempfindens |
gelegentlich | |
|
zentralnervös stimulierende Wirkungen |
sehr selten | |
|
Herzerkrankungen |
Palpitationen |
häufig |
|
Tachykardie |
gelegentlich | |
|
Herzrhythmusstörungen, wie Vorhofflimmern, supraventrikuläre Tachykardie, Extrasystolen, Angina pectoris |
selten | |
|
Verlängerung des QTc-Intervalls |
sehr selten | |
|
Gefäßerkrankungen |
Veränderungen im Blutdruck, starker Blutdruckabfall |
selten |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Husten |
häufig |
|
Rachenreizung |
gelegentlich | |
|
Paradoxer Bronchospasmus (s. Abschnitt 4.4) |
selten | |
|
Dyspnoe, Asthma-Exazerbation |
sehr selten | |
|
Erkrankungen des G astrointestinaltrakts |
Übelkeit |
gelegentlich |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hyperhidrose |
gelegentlich |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelkrämpfe, Myalgie |
gelegentlich |
|
Erkrankungen der Nieren und Harnwege |
Nephritis |
selten |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
periphere Ödeme |
sehr selten |
Übelkeit, Störungen des Geschmacksempfindens, Missempfindungen im Mund- und Rachenbereich, Hyperhidrose, Unruhe, Kopfschmerzen, Schwindel sowie
Muskelkrämpfe können sich bei Fortführung der Behandlung im Verlauf von ein bis zwei Wochen spontan zurückbilden.
Sporadisch ist über zentralnervös stimulierende Wirkungen nach Inhalation von ß2-Sympathomimetika berichtet worden, die sich in Übererregbarkeit äußerten. Diese Beobachtungen wurden überwiegend bei Kindern im Alter bis zu 12 Jahren gemacht.
Wie bei jeder inhalativen Therapie kann in sehr seltenen Fällen ein paradoxer Bronchospasmus auftreten. (siehe Abschnitt 4.4)
Durch Behandlungen mit ß2-Agonisten können die Konzentrationen von Insulin, freien Fettsäuren, Glycerol und Ketonkörper im Blut ansteigen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
Überdosierung
Es liegen begrenzte klinische Erfahrungen zur Behandlung einer Überdosierung vor. Eine Überdosierung mit Forair® wird in der Regel Wirkungen hervorrufen, wie sie typisch für ß2-Adrenozeptoragonisten sind:Kopfschmerzen, Tremor, Palpitationen. Berichtete Symptome von Einzelfällen sind Tachykardie, verlängertes QTc-Intervall, ventrikuläre Arrhythmien, metabolische Azidose, Hypokaliämie, Hyperglykämie, Übelkeit, Erbrechen und Schläfrigkeit..
Behandlung einer Überdosierung
Die Behandlung sollte unterstützend und symptomatisch erfolgen. Schwere Fälle sind in eine Klinik einzuweisen. Die Anwendung von ß-Adrenozeptorenblockern kann in Betracht gezogen werden, jedoch ist in diesem Fall extreme Vorsicht geboten, da die Anwendung von ß-Adrenozeptorenblockern Bronchospasmen auslösen kann. Der Serumkaliumspiegel sollte überwacht werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Inhalative Sympathomimetika, selektive ß2-Adrenozeptoragonisten
ATC-Code: R03 AC13
Formoterol ist ein überwiegend selektiver ß2-Stimulator. Formoterol wirkt bronchodilatatorisch bei Patienten mit reversiblen obstruktiven Atemwegserkrankungen. Der Wirkungseintritt erfolgt innerhalb von 1 bis 3 Minuten. Auch 12 Stunden nach Inhalation ist immer noch eine signifikante Bronchodilatation vorhanden.
Beim Menschen ist Formoterol zur Prophylaxe von Bronchospasmen wirksam, die durch Methacholin-Provokation hervorgerufen werden.
Pharmakokinetische Eigenschaften
Ebenso wie bei anderen inhalativ applizierten Substanzen werden 90 % der inhalierten Formoterol-Dosis verschluckt und im Gastrointestinaltrakt resorbiert. Deshalb können die pharmakokinetischen Charakteristika der oralen Formulierung auf die Inhalation mit einem Dosieraerosol übertragen werden.
Die Absorption verläuft rasch und zu einem hohen Ausmaß. Nach Inhalation einer therapeutischen Dosis (12 Mikrogramm) Forair® bei asthmatischen Patienten wird die maximale Plasmakonzentration etwa 15 Minuten nach der Inhalation beobachtet. Die Formoterol-Resorption nach der Inhalation von 12 bis 96 Mikrogramm Formoterolfumaratdihydrat verläuft linear.
Orale Dosen bis zu 300 Mikrogramm Formoterol werden im Gastrointestinaltrakt rasch resorbiert. Die maximale Plasmakonzentration der unveränderten Substanz wird nach 0,5 - 1 Stunde erreicht. Über 65 % einer oralen Dosis von 80 Mikrogramm werden resorbiert.
Innerhalb eines Dosierungsbereichs (orale Applikation) von 20 bis 300 Mikrogramm liegt Dosislinearität vor.
Wiederholte tägliche Verabreichung von 40 - 160 Mikrogramm/Tag führt aufgrund der kurzen Halbwertszeit nicht zu einer Akkumulation. Die Pharmakokinetik von Formoterol zeigt bei Frauen und Männern keine signifikanten Unterschiede.
Die Plasmaproteinbindung liegt bei 61 bis 64 % (34 % an Albumin), wobei es bei therapeutischen Dosen nicht zu einer Absättigung der Bindungsstellen kommt.
Formoterol wird primär über eine direkte Glukuronidierung metabolisiert und vollständig ausgeschieden. Eine weitere Metabolisierung ist die O-Demethylierung mit nachfolgender Glukuronidierung und konsekutiver vollständiger Ausscheidung.
Die Elimination von Formoterol scheint polyphasisch zu verlaufen, deshalb ist die beschriebene Halbwertszeit abhängig von den jeweils betrachteten Zeitintervallen. Auf der Basis von Plasma- oder Blutkonzentrationen 6, 8 oder 12 Stunden nach der oralen Applikation wurde eine Eliminationshalbwertszeit von 2 - 3 Stunden bestimmt. Aus der renalen Ausscheidungsrate zwischen 3 und 16 Stunden nach der Inhalation wurde eine Halbwertszeit von 5 Stunden berechnet.
Der Wirkstoff und die Metaboliten werden vollständig ausgeschieden, 2/3 einer oral applizierten Dosis mit dem Urin, 1/3 mit den Fäzes. Nach der Inhalation von Formoterol werden durchschnittlich 6 - 9 % der Substanz unverändert mit dem Urin ausgeschieden. Die renale Clearance von Formoterol beträgt 150 ml/min.
Präklinische Daten zur Sicherheit
Die Wirkungen von Formoterol bei Ratten und Hunden beschränkten sich vorwiegend auf das Herz-Kreislauf-System; es handelte sich um die bekannten
pharmakologischen Erscheinungen nach hohen Dosen von ß2-
Adrenozeptoragonisten.
Nach sehr hoher systemischer Exposition von Formoterol wurde bei männlichen Ratten eine leichte reduzierte Fertilität beobachtet.
Studien mit Formoterol zeigten in vivo und in vitro keine genotoxischen Effekte. Bei Ratten und Mäusen wurde ein leicht erhöhtes Auftreten von benignen Uterusleiomyomen beobachtet. Diese Wirkung gilt als ein Klasseneffekt bei Nagetieren nach hohen Dosen über einen längeren Zeitraum von ß2-Adrenozeptoragonisten.
6. PHARMAZEUTISCHE ANGABEN
Liste der sonstigen Bestandteile
Norfluran, Ethanol, Salzsäure
Inkompatibilitäten
Nicht zutreffend.
Dauer der Haltbarkeit
18 Monate (siehe auch Abschnitt 6.4).
Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Bis zur Abgabe an den Patienten:
Im Kühlschrank lagern (2 - 8 °C) (nicht länger als 15 Monate). Nach Abgabe:
Nicht über 30 °C lagern (nicht länger als 3 Monate).
Art und Inhalt des Behältnisses
1 Druckbehältnis aus Aluminium mit Kunststoffgehäuse inklusive Mundstück und Schutzkappe mit Lösung zur Druckgasinhalation.
Pro Druckbehältnis: 50, 100 bzw. 120 Sprühstöße.
2 Druckbehältnisse aus Aluminium mit Kunststoffgehäuse inklusive Mundstück und Schutzkappe mit Lösung zur Druckgasinhalation mit je 100 bzw. 120 Sprühstößen.
Klinikpackung:
1 Druckbehältnis aus Aluminium mit Kunststoffgehäuse inklusive Mundstück und Schutzkappe mit Lösung zur Druckgasinhalation mit 100 Sprühstößen.
Es werden möglicherweise nicht alle Packungen in den Verkehr gebracht.
Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Für Apotheken:
Bitte schreiben Sie das Datum der Abgabe an den Patienten auf die Packung. Es ist darauf zu achten, dass zwischen Abgabedatum und aufgedrucktem Verfalldatum ein Zeitraum von mindestens 3 Monaten liegt.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. INHABER DER ZULASSUNG
Chiesi GmbH Gasstraße 6 22761 Hamburg Telefon: 040 89724-0 Telefax: 040 89724-212 E-Mail: info.de@chiesi.com
8. ZULASSUNGSNUMMER
59068.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
24.11.2004/23.04.2012
10. STAND DER INFORMATION
April 2014
11.VERKAUFSABGRENZUNG
Verschreibungspflichtig