Formoterol Hexal Easyhaler 12 Mikrogramm/Dosis Pulver Zur Inhalation
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Formoterol HEXAL® Easyhaler® 12 Mikrogramm/Dosis Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine abgegebene Dosis enthält 12 Mikrogramm Formoterolfumarat-Dihydrat.
Eine mit dem Easyhaler®-Gerät abgegebene Dosis (aus dem Inhalator) enthält die gleiche Wirkstoffmenge wie die abgemessene Dosis (aus dem Reservoir).
Sonstiger Bestandteil mit bekannter Wirkung: 7,987 mg Lactose (als Lactose-Monohydrat) pro Dosis Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Inhalation
Weißes bis gelblich weißes Pulver
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Formoterol HEXAL Easyhaler® ist indiziert zur Behandlung von Asthma bei Patienten, die mit inhalativen Kortikosteroiden behandelt werden und die nach aktuellen Behandlungsrichtlinien auch einen langwirksamen Beta-2-Agonisten benötigen.
4.2 Dosierung und Art der Anwendung Dosierung
Erwachsene (einschließlich ältere Patienten) und Jugendliche Asthma bronchiale Regelmäßige Erhaltungstherapie:
1 Inhalation (12 Mikrogramm) 2-mal täglich. Bei schwereren Erkrankungen kann dieses Dosisschema auf
2 Inhalationen (24 Mikrogramm) 2-mal täglich erhöht werden (48 Mikrogramm Formoterolfumarat-Dihydrat pro Tag).
Die Tageshöchstdosis beträgt 4 Inhalationen (2 Inhalationen 2-mal täglich).
Wenn ein Patient Dosierungen oberhalb des empfohlenen Behandlungsschema an mehr als 2 Tagen pro Woche benötigen sollte, muss dies als nicht ausreichende Asthamkontrolle gewertet werden, und die Behandlung sollte neu bewertet werden.
Kinder und Jugendliche Kinder ab 6 Jahre
Asthma
Regelmäßige Erhaltungstherapie:
1 Inhalation (12 Mikrogramm) 2-mal täglich.
Die Tageshöchstdosis beträgt 24 Mikrogramm (1 Inhalation 2-mal täglich).
Kinder unter 6 Jahren
Formoterol HEXAL Easyhaler® soll bei Kindern unter 6 Jahren nicht angewendet werden.
Spezielle Patientengruppen
Niereninsuffizienz
Formoterol HEXAL Easyhaler® wurde nicht bei Patienten mit Nierenfunktionsstörungen untersucht
Leberinsuffizienz
Formoterol HEXAL Easyhaler® wurde nicht bei Patienten mit Leberfunktionsstörungen untersucht.. Ältere Patienten (über 65 Jahren)
Die Pharmakokinetik von Formoterol wurde nicht bei älteren Patienten untersucht (siehe Abschnitt 5.2 Pharmakokinetische Eigenschaften). Die verfügbaren Daten aus klinischen Studien mit älteren Patienten lassen nicht darauf schließen, dass eine andere Dosierung als bei anderen Erwachsenen (siehe Abschnitt 5.1 Pharmakodynamische Eigenschaften) zu empfehlen ist.
Die Wirkdauer von Formoterol liegt erwiesenermaßen bei etwa 12 Stunden. Bei der Behandlung sollte immer die niedrigste wirksame Dosis angestrebt werden.
Aktuelle Richtlinien zur Asthmabehandlung empfehlen, dass bei der Erhaltungstherapie mit Bronchodilatatoren langwirksame, inhalative Beta-2-Agonisten eingesetzt werden. Weiterhin wird empfohlen, für die Behandlung von akuten Asthmaanfällen kurzwirksame Beta-2-Agonisten einzusetzen.
In Übereinstimmung mit den aktuellen Richtlinien zur Asthmabehandlung kann das Behandlungsregime von Patienten um langwirksame Beta-2-Agonisten erweitert werden, wenn die Patienten hohe Dosen inhalativer Steroide nur unter Schwierigkeiten anwenden können. Patienten müssen darauf hingewiesen werden, dass die Steroidtherapie nach Einleiten der Behandlung mit Formoterol HEXAL Easyhaler® nicht beendet oder verändert werden darf.
Falls die Symptome anhalten bzw. eine Verschlechterung eintritt oder wenn die empfohlene Dosis von Formoterol HEXAL Easyhaler® keine ausreichende Symptomkontrolle bewirkt (Aufrechterhaltung einer effektiven Symptomverbesserung), so ist dies in der Regel ein Anzeichen für eine Verschlechterung der zugrunde liegenden Erkrankung.
Erfolgt eine Umstellung von einem anderen Inhalator auf Formoterol HEXAL Easyhaler® , so muss die Behandlung individuell angepasst werden. Der vorherige Wirkstoff, die Dosierung und die Art der Anwendung muss berücksichtigt werden.
Art der Anwendung
Zur Inhalation.
Um die richtige Anwendung des Arzneimittels zu gewährleisten, sollte der Arzt oder das medizinisches Fachpersonal dem Patienten die Handhabung des Inhalators zeigen.
Detaillierte Hinweise zur Handhabung sind in der Gebrauchsinformation enthalten.
Hinweise für die Handhabung
Der Easyhaler® ist ein durch den inspiratorischen Atemfluss gesteuerter Inhalator. Dies bedeutet, dass der Wirkstoff mit der eingeatmeten Luft in die Atemwege gelangt, wenn der Patient durch das Mundstück inhaliert.
Hinweis:
Es ist wichtig, dem Patienten zu zeigen, wie der Inhalator anzuwenden ist (für detaillierte Hinweise siehe Abschnitt 6.6 Hinweise für die Handhabung).
Formoterol HEXAL Easyhaler®
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Asthma-bedingte Todesfälle
Formoterol gehört zur Gruppe der langwirksamen Beta-2-Agonisten. In einer Studie mit Salmeterol, einem anderen langwirksamen Beta-2-Agonisten, wurde bei den mit Salmeterol behandelten Patienten eine höhere Todesrate aufgrund von Asthma beobachtet (13/13, 176) als in der Placebo-Gruppe (3/13, 179). Eine Studie zur Bestimmung, ob die Rate von Asthma-bedingten Todesfällen mit Formoterol erhöht ist, wurde bisher noch nicht durchgeführt.
Empfohlene Dosis
Die Dosis von Formoterol sollte auf die individuellen Bedürfnisse des Patienten abgestimmt werden und sollte die niedrigste Dosis sein, mit der das therapeutische Ziel erreicht werden kann. Die Dosis sollte nicht über die empfohlene Maximaldosis hinaus erhöht werden (siehe Abschnitt 4.2 „Dosierung, Art und Dauer der Anwendung“).
Formoterol sollte nicht zur Erstbehandlung (und ist dafür auch nicht ausreichend) von Asthma verwendet werden.
Begleitende anti-inflammatorische Therapie bei Asthma
Bei der Behandlung von Asthmatikern sollte Formoterol, ein lang wirksamer Beta-2-Agonist (LABA), nur als Zusatztherapie zu einem inhalativen Kortikosteroid (ICS) bei Patienten eingesetzt werden, die mit einem inhalativen Kortikosteroid alleine nicht ausreichend eingestellt werden können oder deren Krankheit von einem solchen Schweregrad ist, dass der Beginn der Behandlung sowohl mit einem inhalativen Kortikosteroid als auch mit einem LABA angezeigt ist.
Formoterol sollte nicht zusammen mit einem anderen LABA angewendet werden.
Eine bereits laufende anti-inflammatorische Therapie sollte vor Beginn der Therapie mit Formoterol auf ihre Angemessenheit hin überprüft werden. Die Patienten sind darauf hinzuweisen, dass die antiinflammatorische Therapie unverändert neben der Verwendung von Formoterol fortgesetzt werden sollte, auch wenn sich die Symptome verbessern.
Wenn die Asthma-Symptome unter Kontrolle sind, kann eine allmähliche Reduzierung der Dosis von Formoterol in Betracht gezogen werden. Eine regelmäßige Überwachung der Patienten ist dabei wichtig. Es sollte die niedrigste wirksame Dosis von Formoterol verwendet werden.
Asthma-Exazerbationen
Klinische Studien mit Formoterol zeigten eine höhere Inzidenz von schweren Asthma-Exazerbationen bei Patienten die Formoterol erhielten, als bei den Patienten, die Placebo erhielten, insbesondere bei Kindern zwischen 5 und 12 Jahren (siehe Abschnitt 4.8 „Nebenwirkungen“). Diese Studien lassen keine exakte Quantitätsbestimmung der Unterschiede bei schweren Asthma-Exazerbationsraten zwischen den Behandlungsgruppen zu.
Der Arzt sollte die Asthma-Therapie erneut beurteilen, wenn die Symptome weiter bestehen oder die Anzahl der benötigten Formoterol-Dosen zur Symptomkontrolle ansteigt, da dies in der Regel auf eine Verschlechterung der zugrunde liegenden Erkrankung hindeutet.
Formoterol darf nicht zur Linderung akuter Asthma-Symptome angewendet werden. Akute Asthmaanfälle sollten mit einem kurzwirksamen Beta-2-Agonisten behandelt werden. Die Patienten müssen informiert werden, dass sie umgehend eine ärztliche Behandlung benötigen, wenn sich ihr Asthma plötzlich verschlechtert oder allmählich verschlechtert.
Obwohl Formoterol als Zusatztherapie verwendet werden kann, wenn mit inhalativen Kortikosteroiden keine ausreichende Kontrolle der Asthma-Symptome erreicht wird, sollten Patienten nicht während einer akuten schweren Asthma-Exazerbation oder bei signifikanter oder akuter Verschlechterung ihres Asthmas mit der Anwendung von Formoterol beginnen.
Schwere asthmabezogene Nebenwirkungen und Exazerbationen können während der Behandlung mit Formoterol auftreten. Die Patienten sollten die Behandlung fortsetzen, aber ärztlichen Rat einholen, falls die Asthma-Symptome unkontrolliert bleiben oder sich nach Behandlungsbeginn mit Formoterol verschlechtern.
Begleitkrankheiten
Besondere Vorsicht und Überwachung - unter besonderer Beachtung der Dosisgrenzen - ist bei Patienten erforderlich, die Formoterol erhalten und von einer der folgenden Erkrankungen betroffen sind:
Schwere Hypertonie, ischämische Herzerkrankung, Arrhythmien (insbesondere AV-Block 3. Grades), schwere kardiale Dekompensation, schwere Herz-Kreislauf-Erkrankungen, schwere Herzinsuffizienz, idiopathische subvalvuläre Aortenstenose, hypertrophe obstruktive Kardiomyopathie, Thyreotoxikose, Phäochromozytom, Aneurysma, bekannte oder vermutete Verlängerung des QT-Intervalls (QTc > 0,44 s; siehe Abschnitt 4.5 „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“).
Da Beta-2-Stimulanzien eine hyperglykämische Wirkung besitzen, werden bei Diabetikern zusätzliche Blutzuckerkontrollen empfohlen.
Hypokaliämie
Beta-2-Agonisten, einschließlich Formoterol, können eine potentiell schwere Hypokaliämie verursachen. Eine Hypokaliämie kann die Anfälligkeit für kardiale Arrhythmien erhöhen. Besondere Vorsicht ist angebracht bei Patienten mit schwerem Asthma, da eine Hypokaliämie durch Hypoxie und Begleitmedikation mit Xanthin-Derivaten, Steroiden und Diuretika verstärkt werden kann (siehe Abschnitt 4.5 „Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen“). Es wird empfohlen, in solchen Fällen die Kaliumserumspiegel zu überwachen
Paradoxe Bronchospasmen
Wie auch bei anderen Inhalationstherapien sollte die Möglichkeit eines paradoxen Bronchospasmus bedacht werden. Wenn er auftritt, soll das Präparat sofort abgesetzt und eine alternative Therapie begonnen werden.
Pädiatrische Patientengruppe
Für Kinder von 6-12 Jahren wird die Behandlung mit einem Kombinationsprodukt, das ein ICS und einen LABA enthält, empfohlen. Ausnahme sind Fälle, bei denen ein separates ICS und LABA erforderlich ist (siehe Abschnitt 4.2 Dosierung und Art der Anwendung und 4.8 Nebenwirkungen).
Kinder bis zum Alter von 6 Jahren sollten nicht mit Formoterol HEXAL Easyhaler® behandelt werden, da für diese Altersgruppe keine ausreichenden Erfahrungen vorliegen.
Dieses Arzneimittel enthält Lactose-Monohydrat. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lapp-Lactase-Mangel oder Glukose-Galaktose-Malabsorption sollten dieses Arzneimittel nicht anwenden.
Die Anwendung von Formoterol HEXAL Easyhaler® kann bei Dopingkontrollen zu positiven Ergebnissen führen. Eine missbräuchliche Anwendung des Arzneimittels Formoterol HEXAL Easyhaler® zu Dopingzwecken kann die Gesundheit gefährden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es wurden keine Studien zur Erfassung von Wechselwirkungen durchgeführt.
Es besteht ein theoretisches Risiko, dass die gleichzeitige Behandlung mit anderen Arzneimitteln, die bekanntermaßen das QTc-Intervall verlängern können, Anlass zu einer pharmakodynamischen Interaktion mit Formoterol geben kann, und so das potenzielle Risiko für ventrikuläre Arrhythmien erhöht. Beispiele für solche Medikamente schließen bestimmte Antihistaminika (z. B. Terfenadin, Astemizol, Mizolastin, Phenothiazin), bestimmte Antiarrhythmika (z. B. Chinidin, Disopyramid, Procainamid), Erythromycin und trizyklische Antidepressiva ein (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Darüber hinaus können Levodopa, L-Thyroxin, Oxytocin und Alkohol die Herztoleranz gegenüber Beta-2-Agonisten beeinträchtigen.
Die gleichzeitige Gabe von anderen Sympathomimetika wie z. B. anderen Beta-2-Agonisten oder Ephidrin, kann die möglichen Nebenwirkungen von Formoterol HEXAL Easyhaler® verstärken und eine Dosistitration erforderlich machen.
Formoterol kann mit Monoaminoxidase-Hemmern interagieren und sollte bei Patienten, die mit MAOHemmern behandelt werden, nicht oder bis zu 14 Tage nach ihrem Absetzen nicht eingesetzt werden.
Bei Patienten, die gleichzeitig mit trizyklischen Antidepressiva behandelt werden, kann ein erhöhtes Risiko von Arrhythmien bestehen.
Die gleichzeitige Gabe von Formoterol und Kortikosteroiden kann zu einer Zunahme der bei diesen Arzneimitteln beobachteten hyperglykämischen Wirkung führen.
Die gleichzeitige Behandlung mit Xanthinderivaten, Steroiden oder kaliumausschwemmenden Diuretika, wie z. B. Thiazide und Schleifendiuretika, kann die mögliche hypokaliämische Wirkung von Beta-2-Agonisten verstärken. Eine Hypokaliämie kann die Neigung zu Arrhythmien bei Patienten, die mit Digitalis behandelt werden, erhöhen (siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Es besteht eine erhöhte Neigung zu Arrhythmien bei Patienten, die eine gleichzeitige Anästhesie mit halogenierten Kohlenwasserstoffen erhalten.
Betablocker können die Wirkung von Formoterol HEXAL Easyhaler® abschwächen oder antagonisieren. Daher sollte Formoterol HEXAL Easyhaler® nicht zusammen mit Betablockern (Augentropfen eingeschlossen) angewendet werden, es sei denn, es liegen zwingende Gründe für die Anwendung vor.
Die bronchodilatatorische Wirkung von Formoterol kann durch Anticholinergika verstärkt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Die klinischen Erfahrungen bei Schwangeren sind begrenzt. In tierexperimentellen Studien verursachte Formoterol eine verminderte Anzahl von Einnistungen (Implantationen) befruchteter Eizellen, eine herabgesetzte postnatale Überlebensrate sowie ein verringertes Geburtsgewicht. Diese Wirkungen traten erst bei systemischen Dosen auf, die wesentlich über der bei der klinischen Anwendung Formoterol HEXAL Easyhaler® ereichten Exposition lagen. In allen Phasen der Schwangerschaft kann Formoterol HEXAL Easyhaler® - falls erforderlich - zum Erhalt der Asthma-Kontrolle und, wenn der erwartete Nutzen für die Mutter größer ist als das mögliche Risiko für den Fötus, in Betracht gezogen werden. Das potentielle Risiko für den Menschen ist nicht bekannt.
Stillzeit
Es ist nicht bekannt, ob Formoterol beim Menschen in die Muttermilch übertritt. In der Muttermilch von Ratten wurden geringe Mengen Formoterol HEXAL Easyhaler® nachgewiesen. Die Anwendung von Formoterol bei stillenden Müttern sollte nur in Betracht gezogen werden, wenn der erwartete Nutzen für die Mutter größer ist als das mögliche Risiko für das Kind.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Formoterol hat keinen oder unerheblichen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Die am häufigsten berichteten Nebenwirkungen bei der Therapie mit Beta-2-Agonisten wie Tremor und Palpitationen sind normalerweise nur leicht ausgeprägt und verschwinden innerhalb von Tagen bei einer fortgesetzten Therapie.
Die Nebenwirkungen, die mit Formoterol in Verbindung gebracht wurden, sind nachstehend nach Systemorganklassen und Häufigkeit aufgelistet. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (>1/10); Häufig (>1/100 bis <1/10); Gelegentlich (>1/1.000 bis <1/100); Selten (>1/10.000 bis <1/1.000); Sehr selten (<1/10.000); Nicht bekannt (Häufigkeit aufgrund der verfügbaren Daten nicht abschätzbar).
|
Erkrankungen des Immunsystems | ||
|
Selten |
Überempfindlichkeitsreaktionen (einschließlich Hypotonie, Bronchospasmus, Urtikaria, Angioödem, Pruritus, Exanthem) | |
|
Sehr selten |
Ausschlag | |
|
Stoffwechsel- und Ernährungsstörungen | ||
|
Selten |
Hypokaliämie | |
|
Sehr selten |
Hyperglykämie | |
|
Psychiatrische Erkrankungen |
Gelegentlich |
Agitiertheit, Angstzustände, Nervosität, Schlaflosigkeit |
|
Erkrankungen des Nervensystems | ||
|
Häufig |
Kopfschmerzen, Tremor | |
|
Sehr selten |
Geschmacksstörungen, Schwindel | |
|
Herzerkrankungen | ||
|
Häufig |
Palpitationen | |
|
Gelegentlich |
Tachykardie | |
|
Selten |
Kardiale Arrhythmien, z. B. Vorhofflimmern, supraventrikuläre Tachykardie, Extrasystolen | |
|
Sehr selten |
Periphere Ödeme, Angina pectoris, Verlängerung des QTc-Intervals | |
|
Gelegentlich |
Tachyarrhythmien | |
|
Gefäßerkrankungen | ||
|
Sehr selten |
Schwankungen des Blutdrucks | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums | ||
|
Gelegentlich |
Bronchospasmus, einschließlich paradoxer Bronchospasmus, |
|
Reizungen im Rachen | ||
|
Gelegentlich |
Husten | |
|
Erkrankungen des Gastrointestinaltrakts | ||
|
Gelegentlich |
Trockener Mund | |
|
Selten |
Nausea | |
|
Skelettmuskulatur-, Bindegewebs-und Knochenerkrankungen | ||
|
Gelegentlich |
Muskelkrämpfe, Myalgie |
Wie bei allen Inhalationstherapien kann in sehr seltenen Fällen ein paradoxer Bronchospasmus auftreten (siehe Abschnitt 4.4).
Eine Behandlung mit Beta-2_Agonisten kann die Konzentrationen von Insulin, freien Fettsäuren, Glycerol und Ketonkörpern im Blut erhöhen.
Lactose-Monohydrat enthält geringe Mengen an Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome
Zur Behandlung einer Überdosierung liegt keine klinische Erfahrung vor. Eine Überdosierung von Formoterol HEXAL Easyhaler® verursacht vermutlich die für Beta-2-Agonisten charakteristischen unerwünschten Wirkungen wie Übelkeit, Erbrechen, Kopfschmerzen, Tremor, Benommenheit, Palpitationen, Tachykardie, ventrikuläre Arrhythmie, metabolische Azidose, Hypokaliämie und Hyperglykämie.
Behandlung
Es ist eine unterstützende und symptomatische Behandlung angezeigt. Schwere Fälle sollten im Krankenhaus behandelt werden.
Eine Anwendung kardioselektiver Betablocker kann in Betracht gezogen werden. In solchen Fällen ist jedoch extreme Vorsicht geboten, da Betablocker einen Bronchospasmus induzieren können.
Die Serumkalium-Konzentration sollte überwacht werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: selektive Beta-2-Adrenorezeptoragonisten ATC-Code: R03A C13
Wirkmechanismus
Formoterol ist ein hochwirksamer und selektiver Beta-2-Agonist. Bei Patienten mit reversibler Atemwegsobstruktion übt es eine bronchodilatatorische Wirkung aus. Die Wirkung setzt rasch ein (innerhalb von 1-3 Minuten) und ist auch 12 Stunden nach der Inhalation noch deutlich ausgeprägt.
Formoterol ist nachweislich effektiv bei der Vorbeugung belastungs- und metacholininduzierter Bronchospasmen beim Menschen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Wie von anderen inhalativen Arzneimitteln berichtet, werden wahrscheinlich ungefähr 80 % des aus dem Easyhaler® applizierten Formoterols geschluckt und dann im Gastrointestinaltrakt resorbiert. Daher stimmt die Pharmakokinetik von oral angewendetem Formoterol weitgehend mit der des Pulvers zur Inhalation überein. In therapeutischen Dosen inhaliertes Formoterol kann mit den gängigen Analysemethoden nicht im Plasma nachgewiesen werden.
Formoterol wird rasch und umfassend resorbiert: Bei Anwendung von höheren Dosen als der empfohlenen therapeutischen Dosis (120 Mikrogramm pro Einzeldosis) werden 5 Minuten nach der Inhalation Formoterol-Spitzenkonzentrationen im Plasma beobachtet, während mindestens 65 % einer radioaktiv markierten oralen Dosis von 80 Mikrogramm resorbiert werden. Orale Dosen von bis zu 300 Mikrogramm werden leicht resorbiert und die Spitzenkonzentration von unverändertem Formoterol wird nach 0,5-1 Stunde erreicht. Bei COPD-Patienten, die über 12 Wochen 2-mal täglich mit Formoterolfumarat 12 oder 24 Mikrogramm behandelt wurden, lagen die Plasmakonzentrationen von Formoterol 10 Minuten, 2 Stunden und 6 Stunden nach der Inhalation zwischen 11,5 und 25,7 pmol/l bzw. 23,3 und 50,3 pmol/l.
Die Pharmakokinetik von Formoterol erscheint bei Anwendung der untersuchten oralen Dosen von 20300 Mikrogramm linear. Die Mehrfachgabe täglicher oraler Dosen von 40-160 Mikrogramm verursachte keine bedeutende Akkumulation des Arzneimittels. Die maximale Ausscheidungsrate nach Inhalation einer Dosis von 12-96 Mikrogramm wird 1-2 Stunden nach Aufnahme erreicht.
Nach Gabe von 2-mal täglich 12 Mikrogramm oder 24 Mikrogramm Formoterol-Pulver über 12 Wochen kam es bei erwachsenen Patienten zu einer Zunahme der Harnausscheidung von unverändertem Formoterol um 63-73 % und bei Kindern um 18-84 %, was nach Mehrfachdosierung auf eine mäßige und selbstbegrenzende Akkumulation von Formoterol im Plasma hinweist.
Studien zur Bestimmung der kumulativen Ausscheidung von Formoterol und/oder von dessen (R,R)- und (S,S)-Enantiomeren im Urin bei der Inhalation als Pulver (12-96 Mikrogramm) oder Aerosol (12-96 Mikrogramm) haben ergeben, dass die Resorption mit ansteigender Dosis linear zunimmt.
Verteilung
Formoterol wird zu 61-64 % an Plasmaproteine gebunden (34 % hauptsächlich an Albumin). In dem durch therapeutische Dosen erreichten Konzentrationsbereich kommt es nicht zur Sättigung der Bindungsstellen.
Biotransformation
Formoterol wird hauptsächlich durch Metabolisierung eliminiert, wobei der vorwiegende Metabolisierungsweg die direkte Glucuronidierung darstellt. Ein weiterer Metabolisierungsweg ist die ODemethylierung gefolgt von weiterer Glucuronidierung. Da die Metabolisierung durch Isoenzyme von Cytochrom P450 (2D6, 2C19, 2C9 und 2A6) katalysiert wird, ist das Risiko metabolischer
Arzneimittelwechselwirkungen gering. Die Kinetik von Formoterol ist nach Einzel- und Mehrfachgabe vergleichbar, was einen Hinweis darstellt, dass keine Autoinduktion oder Hemmung der Metabolisierung von Formoterol stattfindet.
Elimination
Die Elimination von Formoterol aus dem Blutkreislauf scheint mehrphasig zu verlaufen; die offensichtliche Halbwertszeit hängt vom untersuchten Zeitintervall ab. Auf Grundlage der 6, 8 bzw. 12 Stunden nach oraler Anwendung im Plasma oder Blut gemessenen Konzentrationen wurde die Eliminationshalbwertszeit mit etwa 2-3 Stunden veranschlagt. Bei den 3-16 Stunden nach Inhalation gemessenen Ausscheidungsraten im Urin wurde für Formoterol eine Halbwertszeit von rund 5 Stunden ermittelt.
Nach der Inhalation deuten die Plasmakinetik von Formoterol und die Harnausscheidungsrate bei gesunden Probanden auf eine zweiphasige Elimination mit einer terminalen Eliminationshalbwertszeit der (R,R)- und (S,S)-Enantiomere von 13,9 bzw. 12,3 Stunden.
Ca. 6,4-8 % der Dosis wurden im Urin als unverändertes Formoterol mit (R,R)- und (S,S)-Enantiomeren von 40 % bzw. 60 % wiedergefunden.
Nach einer oralen Einzeldosis von 3H-Formoterol wurden 59-62 % der Dosis im Urin und 32-34 % in den Fäzes wiedergefunden. Die renale Clearance von Formoterol liegt bei 150 ml/min.
Bei erwachsenen Asthmatikern wurden nach Mehrfachdosen von 12 und 24 Mikrogramm ca. 10 % und 15-18 % der Dosis als unverändertes bzw. konjugiertes Formoterol im Urin wiedergefunden. Bei Kindern wurden nach Mehrfachdosen von 12 und 24 Mikrogramm ca. 6 % und 6,5-9 % der Dosis als unverändertes bzw. konjugiertes Formoterol im Urin wiedergefunden. Wie bei gesunden Probanden trugen die (R,R)- und (S,S)-Enantiomere zu ca. 40 % bzw. 60 % des im Urin von Erwachsenen ausgeschiedenen unveränderten Arzneimittels bei; nach wiederholter Dosierung gab es keine relative Akkumulation des einen Enantiomers über das andere.
Spezielle Patientengruppen
Geschlechtsspezifische Unterschiede
Die Pharmakokinetik von Formoterol unterscheidet sich auch mit Vernachlässigung des Körpergewichtes nicht signifikant zwischen Männern und Frauen.
Ältere Patienten
Die Pharmakokinetik von Formoterol wurde nicht bei älteren Patienten untersucht.
Kinder und Jugendliche
Nach Inhalation von 12 oder 24 Mikrogramm Formoterol 2-mal täglich über 12 Wochen stieg die urinäre Ausscheidung von unverändertem Formoterol, im Vergleich zu den gemessenen Mengen nach der ersten Dosis, um 18-84 % bei Kindern von 5 bis 12 Jahren an.
Die Akkumulation bei Kindern von Formoterol hat die Werte der Erwachsenen von 63 und 73 % (siehe oben) nicht überschritten. In den untersuchten Kindern wurden etwa 6 % der Dosis im Urin als unverändertes Formoterol wieder ausgeschieden.
Patienten mit Leber-/Nierenfunktionsstörungen
Die Pharmakokinetik von Formoterol wurde bei Patienten mit Leber-oder Nierenfunktionsstörungen nicht untersucht.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur chronischen Toxizität, Gentoxizität, Kanzerogenität und zur Reproduktionstoxizität ließen die nicht-klinischen Forschungsdaten im therapeutischen Dosisbereich keine besonderen Gefahren für den Menschen erkennen.
Formoterol wurde wegen seiner Auswirkungen auf die Fruchtbarkeit und auf die allgemeine Reproduktionsleistung bei geschlechtsreifen männlichen und weiblichen Ratten untersucht. Es wurden keine Beeinträchtigung der Fruchtbarkeit oder der Wirkung auf die frühe embryonale Entwicklung bei der
Verabreichung von oralen Dosen bis zu 60 mg/kg/Tag (etwa 12.000-fachen der maximalen empfohlenen Tagesdosis Pulver zur Inhalation in Mensch auf Basis von mg/m2) bei Ratten beobachtet. Bei Ratten und Mäusen wurde eine leichte Zunahme der Häufigkeit von Leiomyomen des Uterus beobachtet. Diese Wirkung wird als Klassenwirkung betrachtet, welche bei Nagetieren nach langer Exposition mit hohen Dosen von Beta-2-Rezeptor-Agonisten beobachtet wird.
6. PHARMAZEUTISCHE ANGABEN
6.1 Sonstige Bestandteile
Lactose-Monohydrat
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
2 Jahre
Nach dem Öffnen des Laminatbeutels 4 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nach dem Öffnen des Laminatbeutels Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Der Mehrfachdosis-Pulverinhalator besteht aus 7 Plastikteilen und einer Feder aus Edelstahl. Die Plastikmaterialien sind: Polybutylenterephthalat, LDPE, Polycarbonat, Styrolbutadien und Polypropylen. Der Inhalator ist in einem Laminatbeutel versiegelt und in einer Pappschachtel mit oder ohne Schutzbox verpackt.
Packungsgrößen
• 120 Einzeldosen
• 120 Einzeldosen + Schutzbox
• 2-mal 120 Einzeldosen (Die Schutzbox ist separat erhältlich)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
A. Vorbereitung des Inhalators
Der Inhalator ist in einem Laminatbeutel verpackt, um das Pulver trocken zu halten.
Nehmen Sie den Inhalator nur aus dem Laminatbeutel, wenn Sie vorhaben ihn zu verwenden.
Stellen Sie folgende Teile vor sich hin (Abbildung 1):
• Inhalator mit Schutzkappe
• Schutzbox
Schutzbox
Der Easyhaler kann mit oder ohne Schutzbox verwendet werden.
Falls Sie keine Schutzbox verwenden, gehen Sie zu Schritt B „Inhalation des Arzneimittels“.
Falls Sie die Schutzbox verwenden:
Öffnen Sie die Schutzbox. Stellen Sie sicher, dass das Mundstück durch die Kappe gesichert ist; sie verhindert eine unbeabsichtigte Betätigung des Inhalators.
Legen Sie den Inhalator wieder in die Schutzbox (Abbildung 2).
Wenn Sie den Inhalator nicht sofort verwenden möchten, schließen Sie die Schutzbox.
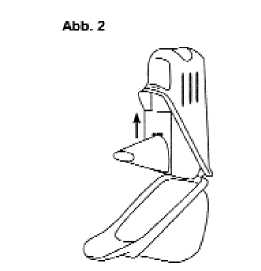
B. Inhalation des Arzneimittels
Die Abbildungen 3a-7a zeigen die Anwendung des Easyhalers mit Schutzbox, die Abbildungen 3b-7b zeigen die Anwendung ohne Schutzbox.
Falls Sie die Schutzbox verwenden, öffnen Sie diese.
1) Entfernen Sie die Schutzkappe des Mundstücks.
2) Schütteln Sie den Inhalator 3-5-mal kräftig hoch und runter (Abbildung 3a bzw. 3b).
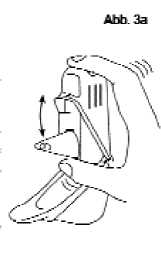
Damit wird sichergestellt, dass sich das Pulver richtig löst und die richtige Dosis abgegeben wird. Halten Sie den Inhalator während des Schüttelns senkrecht.
Während des Schüttelns den Inhalator nicht betätigen.
3) Betätigen
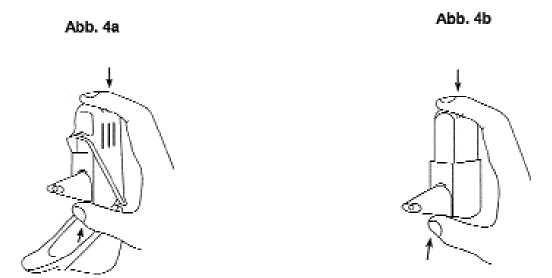
Halten Sie den Inhalator senkrecht zwischen Daumen und Zeigefinger (Abbildung 4a bzw. 4b).
Betätigen Sie den Inhalator, indem Sie ein einziges Mal drücken, bis Sie ein Klicken hören. Entlassen Sie dann den Inhalator wieder in die ursprüngliche Position. Das Pulver gelangt in den Inhalationskanal des Inhalators.
Hinweis
Wenn Sie den Inhalator versehentlich oder mehr als einmal betätigen: Entleeren Sie das Mundstück, indem Sie es auf Ihre Handfläche oder eine Tischplatte klopfen (Abbildung 6a bzw. 6b). Wiederholen Sie anschließend die Schritte 2 und 3.
4) Inhalieren Sie das Arzneimittel wie folgt:
• Atmen Sie zuerst normal aus.
• Führen Sie dann das Mundstück in Ihrem Mund zwischen Ihre Zähne, und umschließen Sie es fest mit Ihren Lippen.
Atmen Sie durch den Mund kräftig und tief ein (Abbildung 5a bzw. 5b).
Nehmen Sie das Mundstück aus dem Mund.
Halten Sie 5-10 Sekunden lang den Atem an und atmen Sie anschließend normal weiter. Falls Ihnen mehrere Dosen verordnet wurden, wiederholen Sie die Schritte 2) Schütteln,
3) Betätigen, 4) Inhalieren.
Hinweis
Atmen Sie nicht in den Inhalator aus, da die Feuchtigkeit Ihres Atems das Produkt schädigt.
5) Setzen Sie die Schutzkappe des Mundstücks wieder auf.
C. Reinigung
Reinigen Sie das Mundstück nach Notwendigkeit, aber mindestens einmal pro Woche mit einem trockenen Tuch.
Verwenden Sie für die Reinigung kein Wasser!
D. Ersetzen Ihres Inhalators
Abb. 7a
ft
' Zählwerk
Der Inhalator verfügt über einen Dosiszähler, der die Anzahl an übrigen Dosen anzeigt (Abbildung 7a bzw. 7b).
Der Zähler bewegt sich nach jeder fünften Betätigung. Die Zähleranzeige erscheint rot, wenn noch 20 Dosen übrig sind. Wenn der Zähler 0 anzeigt, ist normalerweise noch etwas Pulver übrig. Der Inhalator muss jetzt jedoch ersetzt werden, um eine genaue Dosierung zu gewährleisten.
• Bewahren Sie die Schutzbox für Ihren neuen Inhalator auf.
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0
Telefax: (08024) 908-1290 E-Mail: service@hexal.com
8. ZULASSUNGSNUMMER
62556.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
27.09.2005
10. STAND DER INFORMATION
Januar 2014
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
Zusätzlich Angaben der Hexal AG zur Bioverfügbarkeit von Formoterol HEXAL Easyhaler® 12
Mikrogramm/Dosis
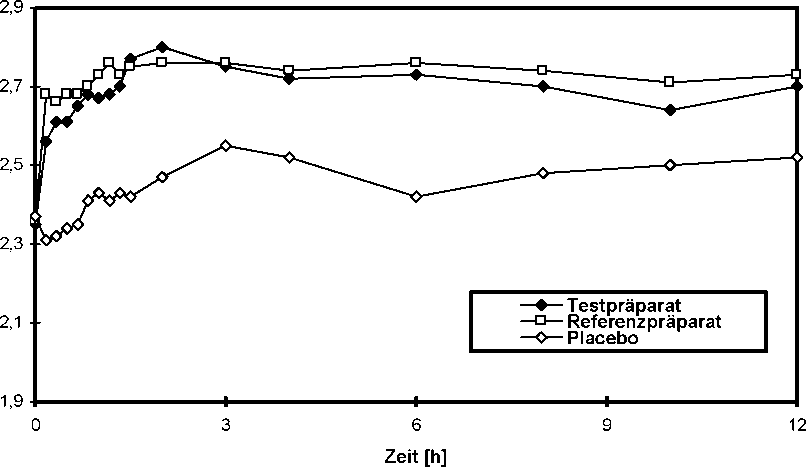
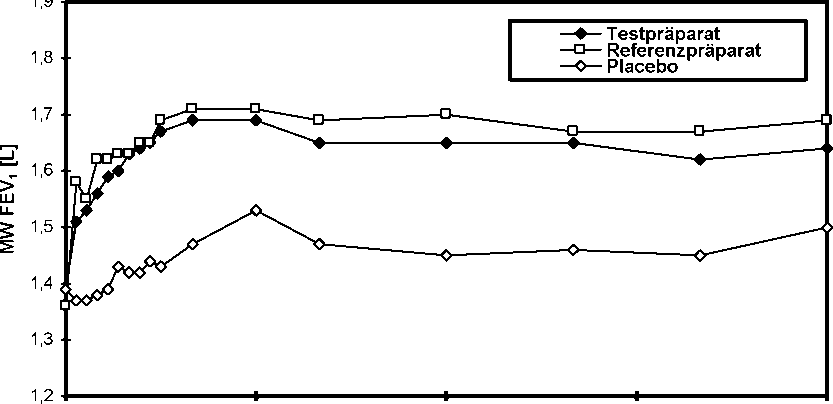
Eine im Jahr 2004 durchgeführte spirometrische Untersuchung zur therapeutischen Äquivalenz bezüglich FEV1 (doppelblind, doppel-dummy, placebokontrolliert, cross-over, randomisiert) an 44 Patienten (8 Frauen und 36 Männer) mit COPD ergab nach Einmalgabe im Vergleich zum Referenzpräparat:
FEVi-Parameter
Referenzpräparat 1212,40 ± 243,09
1,76 ± 0,35 300,30 ± 246,29
Testpräparat
AUC0-12 [L*min] 1186,84 ± 259,33
Fläche unter der
Flussvolumenkurve
Emax [L] 1,73 ± 0,39
maximaler Effekt
tmax [min] 265,02 ± 240,61
Zeit bis zum maximalen Effekt
Angabe der Werte als arithmetische Mittelwerte und Streubreite (Standardabweichung)
Flussvolumenkurve bis 12 Stunden nach Applikation von Formoterol HEXAL Easyhaler® 12 Mikrogramm/Dosis im Vergleich zum Referenzpräparat und zu Placebo für FEV1 (arithmetische Mittelwerte):
0
3
6
Zeit [h]
9
12
Flussvolumenkurve bis 12 Stunden nach Applikation von Formoterol HEXAL Easyhaler® 12 Mikrogramm/Dosis im Vergleich zum Referenzpräparat und zu Placebo für FVC (arithmetische Mittelwerte):
MW FVC [L]