Fsme-Immun Erwachsene
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
FSME-IMMUN Erwachsene
Suspension zur Injektion in einer Fertigspritze
(Inaktivierter, Ganzvirus-)Frühsommer-Meningoenzephalitis (FSME)-Impfstoff
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Dosis (0,5ml) enthält:
Frühsommer-Meningoenzephalitis- Virus1, 2 (inaktiviert) (Stamm Neudörfl) 2,4 pg
1 adsorbiert an hydratisiertes Aluminiumhydroxid (0,35mg Al3+)
2 hergestellt in Hühnerembryonal-Fibroblastenzellen (CEF-Zellen)
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Suspension zur Injektion in einer Fertigspritze.
Nach dem Aufschütteln ist der Impfstoff eine weißliche, opaleszente Suspension.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
FSME-IMMUN Erwachsene dient bei Personen ab dem Alter von 16 Jahren und älter zur aktiven (prophylaktischen) Immunisierung gegen die Frühsommer-Meningoenzephalitis (FSME).
Hinsichtlich der Notwendigkeit, des Zeitpunktes und der Intervalle der Impfung wird auf die offizielle Impfempfehlung verwiesen.
4.2 Dosierung und Art der Anwendung Dosierung
Grundimmunisierung
Das Grundimmunisierungsschema ist für alle Personen ab dem Alter von 16 Jahren gleich und besteht aus 3 Teilimpfungen von FSME-IMMUN Erwachsene. Die erste und die zweite Dosis sollten im Abstand von 1 bis 3 Monaten verabreicht werden.
Wird eine Schnellimmunisierung benötigt, kann die zweite Dosis zwei Wochen nach der ersten verabreicht werden. Nach den ersten beiden Dosen wird ein ausreichender Impfschutz für die aktuelle Zeckensaison erwartet (siehe Abschnitt 5.1). Die dritte Dosis sollte innerhalb von 5 bis 12 Monaten nach der zweiten Impfung gegeben werden.
Nach der dritten Dosis hält der Impfschutz für mindestens 3 Jahre an.
Da der Impfschutz möglichst schon zu Beginn der saisonalen Zeckenaktivität im Frühjahr bestehen soll, liegt der bevorzugte Zeitpunkt für die erste und zweite Teilimpfung in den Wintermonaten.
Die Grundimmunisierung sollte idealerweise mit der dritten Teilimpfung noch in derselben Zeckensaison abgeschlossen werden, spätestens jedoch vor dem Start der nächsten Zeckensaison.
|
Grundimmunisierung |
Dosis |
Normales Impfschema |
Schnellimmunisierung |
|
1. Dosis |
0,5 ml |
beliebiger Zeitpunkt |
beliebiger Zeitpunkt |
|
2. Dosis |
0,5 ml |
1 bis 3 Monate nach der 1. Impfung |
14 Tage nach der 1. Impfung |
|
3. Dosis |
0,5 ml |
5 bis 12 Monate nach der 2. Impfung |
5 bis 12 Monate nach der 2. Impfung |
Auffrischimpfungen
Personen im Alter von 16 bis 60 Jahren Die erste Auffrischimpfung sollte 3 Jahre nach der dritten Dosis erfolgen (siehe Abschnitt 5.1). Die weiteren Auffrischimpfungen sollten alle 5 Jahre nach der letzten Auffrischimpfung verabreicht werden.
Personen über 60 Jahre
Im Allgemeinen sollten bei Personen über 60 Jahre die Abstände zwischen den Auffrischimpfungen 3 Jahre nicht überschreiten.
|
Auffrischimpfungen >16 bis <60 Jahre |
Dosis |
Zeitpunkt |
|
1. Auffrischimpfung |
0,5ml |
3 Jahre nach der 3. Impfung |
|
Weitere Auffrischimpfungen |
0,5ml |
alle 5 Jahre |
|
Auffrischimpfungen >60 Jahre |
Dosis |
Zeitpunkt |
|
alle Auffrischimpfungen |
0,5ml |
alle 3 Jahre |
Bei einer Ausdehnung der Impfabstände zwischen den einzelnen Dosen (Grundimmunisierung und Auffrischimpfungen) kann die Schutzwirkung der geimpften Personen im Zeitraum zwischen den Impfzeitpunkten unzureichend sein (siehe Abschnitt 5.1).
Personen mit geschwächter Immunabwehr (einschließlich Personen unter immunsuppressiver Therapie)
Es liegen keine spezifischen klinischen Daten vor, die Basis einer Dosierungsempfehlung sein könnten. Aber es kann die Bestimmung der Antikörperkonzentration vier Wochen nach der zweiten Teilimpfung in Betracht gezogen werden. Falls ein schützender Antikörperspiegel nicht erreicht wurde, kann die Verabreichung einer zusätzlichen Dosis in Erwägung gezogen werden. Das gilt auch für alle weiteren Auffrischimpfungen.
Art der Anwendung
Der Impfstoff sollte als intramuskuläre Injektion in den Oberarm (M. deltoideus) verabreicht werden. Eine versehentliche intravaskuläre Verabreichung ist zu vermeiden (siehe Abschnitt 4.4).
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff, einen der sonstigen Bestandteile oder einen der Produktionsrückstände (Formaldehyd, Neomycin, Gentamycin, Protaminsulfat). Es sollten neben Neomycin und Gentamycin
weitere Kreuzallergien mit anderen Aminoglykosiden in Betracht gezogen werden.
Eine schwere Überempfindlichkeit gegen Eiprotein, Hühnereiweiß (anaphylaktische Reaktion nach oraler Aufnahme von Eiprotein) und Latex (z. B. eine anaphylaktische Reaktion) kann bei sensibilisierten Personen
schwere allergische Reaktionen hervorrufen (siehe auch Abschnitt 4.4).
Bei moderaten oder schweren akuten Erkrankungen (mit oder ohne Fieber) soll die FSME-Impfung verschoben werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen injizierbaren Impfstoffen müssen für den Fall einer seltenen anaphylaktischen Reaktion nach der Impfung geeignete medizinische Behandlungs- und Überwachungsmöglichkeiten bereit stehen.
Eine nicht-schwerwiegende Allergie gegen Eiprotein stellt in der Regel keine Gegenanzeige für eine Impfung mit FSME-IMMUN Erwachsene dar. Trotzdem sollen diese Personen nur unter geeigneter medizinischer Überwachung und der Möglichkeit einer Notfalltherapie von Überempfindlichkeitsreaktionen geimpft werden.
Das Behältnis dieses Arzneimittels enthält Gummi aus Latex, was zu schweren allergischen Reaktionen bei Personen führen kann, die auf Latex allergisch sind.
Eine Dosis enthält weniger als 1mmol Kalium und Natrium, d. h. das Arzneimittel ist praktisch „frei von Kalium und Natrium“.
Eine intravasale Anwendung ist unbedingt zu vermeiden, weil in diesem Falle schwere Überempfindlichkeitsreaktionen, einschließlich Schock, auftreten können.
Bei Personen, die eine immunsuppressive Therapie erhalten, wird möglichweise keine schützende Immunantwort erreicht. Werden serologische Tests zur Bestimmung der Notwendigkeit einer Auffrischimpfung für erforderlich erachtet, wird empfohlen diese Tests in einem erfahrenen, qualifizierten Labor vornehmen zu lassen. Wegen der Kreuzreaktionen mit präexistierenden Antikörpern, die aus natürlicher Exposition stammen können, oder die durch frühere Impfungen gegen andere Flaviviren (wie z. B. Japanisches Enzephalitis-, Gelbfieber-, Dengue- Virus) bedingt sein können, kann es zu falsch-positiven Resultaten kommen.
Bei bekannter oder vermuteter Autoimmunerkrankung eines Impflings muss das Risiko einer möglichen FSME-Infektion gegen das Risiko einer ungünstigen Beeinflussung der Autoimmunerkrankung durch die Impfung mit FSME-IMMUN Erwachsene abgewogen werden.
Die Impfindikation ist bei Personen mit bestehenden zerebralen Erkrankungen wie aktiven demyelinisierenden Erkrankungen oder schwer einstellbarer Epilepsie besonders sorgfältig zu stellen. Es liegen keine Daten zur Prophylaxe mit FSME-IMMUN Erwachsene nach einem Zeckenbiss vor.
Wie bei allen Impfstoffen kann FSMEIMMUN Erwachsene möglicherweise nicht alle Impflinge vollständig gegen eine FSME-Infektion schützen. Nähere Angaben zur Impfung von Personen mit einem geschwächtem
Immunsystem und Personen, die eine immunsuppressive Therapie erhalten, siehe Abschnitt 4.2.
Durch Zeckenbisse können auch andere Infektionen als FSME übertragen werden, inklusive bestimmter Pathogene, die manchmal ein klinisches Bild hervorrufen können, das einer FrühsommerMeningoenzephalitis ähnelt. FSME-Impfstoffe schützen nicht gegen Borrelieninfektionen. Daher sollte jeder Impfling beim Auftreten klinischer Zeichen und Symptome einer eventuellen FSME-Infektion sorgfältig auf die Möglichkeit, anderer Ursachen hin untersucht werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Es liegen keine Studien zu Wechselwirkungen mit anderen Impfstoffen vor. Die gleichzeitige Verabreichung von FSME-IMMUN Erwachsene mit anderen Impfstoffen sollte nur gemäß den offiziellen Empfehlungen erfolgen. Bei gleichzeitiger Gabe anderer injizierbarer Impfstoffe sind verschiedene Applikationsorte, vorzugsweise unterschiedliche Gliedmaßen, zu wählen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine Daten zur Behandlung von Schwangeren mit FSME-IMMUN Erwachsene vor.
Stillzeit
Es ist nicht bekannt, ob FSME-IMMUN Erwachsene in die Muttermilch übertritt.
Deshalb darf FSME-IMMUN Erwachsene Schwangeren und Stillenden nur nach sorgfältiger Nutzen/Risiko-Abwägung verabreicht werden, wenn eine dringende Notwendigkeit für einen Schutz gegen eine FSME-Infektion besteht.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es ist unwahrscheinlich, dass FSMEIMMUN Erwachsene die Verkehrstüchtigkeit oder das Bedienen von Maschinen beeinträchtigt. Trotzdem sollte daran gedacht werden, dass Sehstörungen oder Schwindel auftreten können.
4.8 Nebenwirkungen
Die errechneten Häufigkeiten basieren auf einer Datenanalyse von insgesamt 7 klinischen Prüfungen mit FSME-IMMUN Erwachsene. Es wurden die Nebenwirkungen nach drei Impfungen im Alter von 16 bis 65 Jahren (3.512 Personen nach der ersten Impfung, 3.477 Personen nach der zweiten Impfung und 3.472 Personen nach der dritten Impfung) ausgewertet. Die Nebenwirkungen, die im folgenden Abschnitt aufgeführt werden, sind gemäß dem empfohlenen System zur Klassifizierung der Häufigkeiten angegeben:
|
Sehr häufig |
(>1/10) |
|
Häufig |
(>1/100 bis <1/10) |
|
Gelegentlich |
(>1/1.000 bis <1/100) |
|
Selten |
(>1/10.000 bis <1/1.000) |
|
Sehr selten |
(<1/10.000) |
|
Systemorganklassen |
Häufigkeit | |
|
Erkrankungen des Blutes und des Lymphsystems |
Gelegentlich |
Lymphadenopathie |
|
Erkrankungen des Immunsystems |
Selten |
Überempfindlichkeit |
|
Erkrankungen des Nervensystems |
Häufig |
Kopfschmerz |
|
Gelegentlich |
Schläfrigkeit | |
|
Erkrankungen des Ohrs und des Labyrinths |
Selten |
Schwindel |
|
Erkrankungen des Gastrointestinaltrakts |
Häufig |
Übelkeit |
|
Gelegentlich |
Erbrechen | |
|
Selten |
Durchfall, Bauchschmerzen | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Häufig |
Myalgie, Arthralgie |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr häufig |
Reaktionen an der Injektionsstelle: z. B. Schmerzen |
|
Häufig |
Müdigkeit, Krankheitsgefühl | |
|
Gelegentlich |
Pyrexie, Blutungen an der Injektionsstelle | |
|
Selten |
Reaktionen an der Injektionsstelle wie: Rötung, Verhärtung, Schwellung, Juckreiz, Missempfindungen, Wärmegefühl | |
Nebenwirkungen nach der Markteinführung
Über die folgenden, weiteren Nebenwirkungen wurde nach Markteinführung berichtet.
Siehe Tabelle
|
Systemorganklassen |
Häufigkeit* |
|
Selten | |
|
Infektionen und parasitäre Erkrankungen |
Herpes zoster (ausgebrochen bei präexponierten Patienten) |
|
Erkrankungen des Immunsystems |
Auftreten oder Verschlimmerung von Autoimmunerkrankungen (z. B. Multipler Sklerose), anaphylaktische Reaktion |
|
Erkrankungen des Nervensystems |
Demyelinisierende Erkrankungen (akute disseminierte Enzephalomyelitis, Guillain-Barre-Syndrom, Myelitis, Myelitis transversa), Enzephalitis, Krämpfe, aseptische Meningitis,Meningismus, Störungen der Sinnesempfindungen und Bewegungsstörung (Gesichtslähmung, Lähmung/Parese, Neuritis, Dysästhesie, Hypästhesie, Parästhesie), Neuralgie, Sehnerventzündung, |
|
Augenerkrankungen |
Sehverschlechterungen, Lichtscheu, Augenschmerzen |
|
Erkrankungen des Ohrs und des Labyrinths |
Tinnitus |
|
Herzerkrankungen |
Tachykardie |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Dyspnoe |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Urtikaria, Hautausschlag (erythematös, makulo-papulös), Juckreiz, Dermatitis, Erythem, Hyperhidrosis |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Rückenschmerzen, Gelenkschwellung, Nackenschmerzen, muskuloskelettale Steifigkeit (einschließlich Nackensteifheit), Schmerzen in den Extremitäten |
|
Erkrankungen und Beschwerden am Verabreichungsort |
Gangstörung, Schüttelfrost, grippeähnliche Symptome, Asthenie, Ödeme, Bewegungseinschränkung eines Gelenkes an der Injektionsstelle wie Gelenkschmerz, Knötchen und Entzündung |
* Der obere Grenzwert des 95% Konfidenzintervalls der Häufigkeiten ist mit 3/n berechnet. Dabei repräsentiert „n“ die Anzahl der Personen, die in allen klinischen Prüfungen mit FSMEIMMUN Erwachsene behandelt wurden. Daher stellt die errechnete Häufigkeit „selten“ die theoretische, maximale Häufigkeit dieser Ereignisse dar.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut,
Paul-Ehrlich-Straße 51 - 59,
63225 Langen,
Telefon: +49 6 10 37 70,
Telefax: +49 61 03 77 12 34,
Website:www.pei.de
anzuzeigen.
4.9 Überdosierung
Es gibt keine Erfahrung zur Überdosierung. Aufgrund der Darreichungsform des Impfstoffs ist eine versehentliche Überdosierung an Volumen unwahrscheinlich. Werden Dosen in kürzerem zeitlichen Abstand als empfohlen oder mehr Dosen als gewünscht verabreicht, können Nebenwirkungen auftreten.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Frühsommer- Meningoenzephalitis-Impfstoff,
ATC Code: J07BA01
Die pharmakodynamische Wirkung des Produkts besteht darin, ausreichend hohe FSME-Antikörpertiter aufzubauen, die einen Schutz gegen das FSME-Virus gewährleisten.
Die Schutzrate des früheren und heutigen FSME-Impfstoffs wurde anhand einer Dauerüberwachung ermittelt, in die seit 1984 die gesamte österreichische Bevölkerung einbezogen wurde. In dieser Überwachung wurde eine Schutzrate von über 90% nach der zweiten Teilimpfung und über 97%nach Abschluss des Grundimmunisierungsschemas (3 Teilimpfungen) berechnet.
Auf der Basis einer Dauerüberwachung der gesamten österreichischen Bevölkerung aus den Jahren 2000 bis 2006 wurde eine Schutzrate von 99% errechnet, die keinen statistisch signifikanten Unterschied zwischen den Altersgruppen aller korrekt geimpften Personen ergab.
Die Schutzrate ist nach den ersten zwei Impfungen, d. h. vor der Vervollständigung des Grundimmunisierungsschemas durch die dritte, reguläre Impfung sowohl bei den normalen Impfabständen als auch bei der Schnellimmunisierung mindestens gleich hoch. Sie ist aber signifikant niedriger bei denjenigen Patienten, die in irregulären Abständen geimpft wurden.
In klinischen Studien mit FSME-IMMUN Erwachsene wurde die Seropositivität als ein ELISA-Wert von >126 VIEU/ml oder eine NT Titer-Konzentration von >10 definiert. Die gesammelten Serokonversionsraten wurden durch ELISA und dem Neutralisationstest 21 Tage nach der zweiten und dritten Impfung bestimmt und sind in den Tabellen 1 und 2 dargestellt.
Die höchsten Serokonversionsraten, bestimmt mittels ELISA und Neutralisationstiter, wurden in beiden Altersgruppen nach der dritten Dosis erreicht. Deshalb ist die Vollendung des kompletten Grundimmunisierungsschemas notwendig, um bei möglichst allen Personen eine Schutzwirkung zu erhalten.
Die Schnellimmunisierung mit FSMEIMMUN Erwachsene ergab frühestens 14 Tage nach der zweiten Impfung (89,3 %) und 7 Tage nach der dritten Impfung hohe Serokonversionsraten ermittelt mit dem NT.
Die Ergebnisse einer Folgestudie, die die Persistenz der FSME-Antikörper untersuchte, unterstützen die Notwendigkeit einer ersten Auffrischimpfung spätestens drei Jahre nach der Grundimmunisierung. Bei Erwachsenen bis zum Alter von 50Jahren blieben die Serokonversionsraten, bestimmt mittels NT, bis zu 5 Jahre nach der ersten Auffrischimpfung hoch (94,3%). Bei Personen im Alter von 50 - 60 Jahren waren die Werte nur geringfügig niedriger (>90,2%), was einen 5-jährigen Abstand der Auffrischimpfungen bei Personen unterhalb von 60 Jahren unterstützt.
Die FSME-Impfung erzeugt statistisch äquivalente Titer an neutralisierenden Antikörpern gegen europäische, sibirische und fernöstliche FSME-Virusstämme. In einer veröffentlichten klinischen Prüfung wurden beträchtliche neutralisierende Antikörper auch gegen das Virus des Hämorrhagischen Omsk-Fiebers durch Kreuzreaktion induziert, wenn auch mit niedrigeren Antikörper-Titern.
Tabelle 1:
Konventionelles Impfschema, gesammelte Serokonversionsratenl, bestimmt mittels ELISA und NT in Personengruppen von 16 - 65 Jahren
|
ELISA2 |
NT2 | |||
|
Dosis |
2. Impfung |
3. Impfung |
2. Impfung |
3. Impfung |
|
Serokonversionsrate1, % (n/N) |
87,5 (420/480) |
98,7 (825/836) |
94,8 (330/348) |
99,4 (714/718) |
Tabelle 2:
Schnellimmunisierung, gesammelte Serokonversionsraten1, bestimmt mittels ELISA und NT
|
ELISA2 |
NT2 | |||
|
Dosen |
2. Teilimpfung |
3. Teilimpfung |
2. Teilimpfung |
3. Teilimpfung |
|
Serokonversionsrate, Personengruppe von 16 - 49 Jahren,% (n/N) |
86,6 (168/194) |
99,4 (176/177) |
97,4 (189/194) |
100,0 (177/177) |
|
Serokonversionsrate, Personengruppe >50 Jahre,% (n/N) |
72,3 (125/173) |
96,3 (155/161) |
89,0 (154/173) |
98,8 (159/161) |
1 ermittelt 21 Tage nach jeder Dosis
2 Cut-Off der Serokonversion: ELISA-Wert >126 VIEU/ml; NT >1 : 10
5.2 Pharmakokinetische Eigenschaften
Nicht zutreffend.
5.3 Präklinische Daten zur Sicherheit
Nicht-klinische Daten auf der Basis von konventionellen Pharmakologie-Studien zeigen keine besonderen Gefahren für den Menschen auf.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Humanalbumin
Natriumchlorid
Di-Natriumhydrogenphosphat-Dihydrat Kaliumdihydrogenphosphat Wasser für Injektionszwecke Sucrose
hydratisiertes Aluminiumhydroxid
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien vorliegen, darf FSME-IMMUN Erwachsene nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
30 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2°C bis 8°C). Die Spritze im Umkarton aufbewahren, um das Produkt vor Licht zu schützen. Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
0,5ml Suspension in Fertigspritzen (Typ I Glas) mit oder ohne Kanüle. Die Fertigspritzen werden mit Gummistopfen (Halogenbutyl) verschlossen. Das Behältnis kann Latex enthalten (siehe Abschnitt 4.4). Packungsgrößen zu 1, 10 und 20 Stück. Die TipCap-Packung (Spritze ohne Kanüle) kann bis zu 2
Nadeln verschiedener Größe enthalten. Alle Nadeln sind steril und zum Einmalgebrauch gedacht. Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Hinweise für die Handhabung
Der Impfstoff soll vor der Anwendung Raumtemperatur erreichen.
Vor der Applikation ist die Impfstoffsuspension durch Aufschütteln gut durchzumischen. Nach dem Aufschütteln sollte FSMEIMMUN Erwachsene eine weißliche, durchsichtige, homogene Suspension sein. Der Impfstoffmuss visuell auf Fremdpartikel und/oder auf eine Veränderung des Aussehens überprüft werden. Sollte irgendeine Veränderung im Aussehen stattgefunden haben, darf der Impfstoff nicht verabreicht werden. Unverbrauchtes Produkt oder Abfallmaterialien sollten gemäß den lokalen Bestimmungen entsorgt werden.
Für die Fertigspritze mit Kanüle: Entfernen der Nadelschutzkappe:
1. Die Spritze an dem unteren Teil der Nadelschutzkappe, der am Glaskörper aufsitzt, festhalten.
2. Mit der anderen Hand den darüber liegenden Teil der Nadelschutzkappe zwischen Daumen und Zeigefinger nehmen und die beiden Teile gegeneinander verdrehen (Sollbruchstelle).
3. Die abgetrennte Nadelschutzkappe in Längsrichtung von der Nadel abziehen.
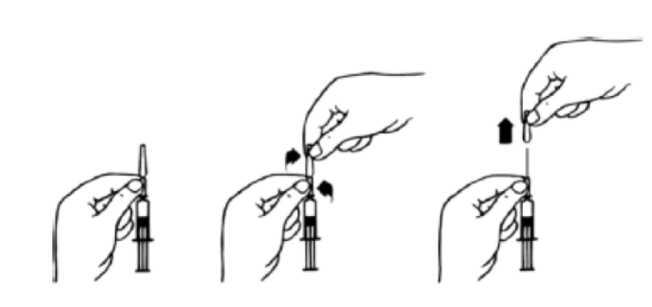
Nach Abnahme der Nadelschutzkappe ist FSME-IMMUN Erwachsene sofort zu verwenden.
Längeres, ungeschütztes Liegenlassen der Injektionsspritze kann zu Sterilitätsverlusten und/oder Verstopfung der Nadel führen. Daher soll die Nadelschutzkappe der Fertigspritze nur nach dem Aufschütteln, unmittelbar vor Gebrauch abgenommen werden.
Zusatzinformation für die Spritze ohne Kanüle
Nach Entfernen des Spritzenverschlusses soll die Nadel sofort aufgesetzt werden. Vor der Verabreichung die Nadelschutzkappe entfernen. Sobald die Nadel aufgesetzt wurde, muss der Impfstoff unmittelbar verabreicht werden.
Die Verabreichung des Präparates ist inklusive Chargennummer vom Arzt zu dokumentieren. Zu diesem Zweck befindet sich auf der Fertigspritze ein ablösbares Dokumentationsetikett.
7. INHABER DER ZULASSUNG
ACA Müller ADAG Pharma AG
Hauptstr. 99
78244 Gottmadingen
8. ZULASSUNGSNUMMER
PEI.H.11488.01.1
9. DATUM DER ERTEILUNG DER ZULASSUNG
10. STAND DER INFORMATION
April 2015
11. VERSCHREIBUNGSPFLICHT/ APOTHEKENPFLICHT
Verschreibungspflichtig
12. STOFF- ODER INDIKATIONSGRUPPE
Frühsommer-Meningoenzephalitis-Impfstoff, adsorbiert an Aluminiumhydroxid, für Personen ab dem Alter von 16 Jahren zur aktiven Immunisierung gegen FSME.
13. SONSTIGE HINWEISE
Alle Impfungen sollten vom Impfarzt in den Impfausweis eingetragen werden. Nur ein komplett durchgeführtes Impfprogramm führt zu einem optimalen Impfschutz.