Fulvestrant Teva 250 Mg Injektionslösung In Einer Fertigspritze
Gebrauchsinformation: Information für Anwender
Fulvestrant Teva 250 mg Injektionslösung in einer Fertigspritze
Fulvestrant
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Fulvestrant Teva und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Fulvestrant Teva beachten?
3. Wie ist Fulvestrant Teva anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Fulvestrant Teva aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Fulvestrant Teva und wofür wird es angewendet?
Fulvestrant Teva enthält den Wirkstoff Fulvestrant, der zu der Gruppe der Östrogen-Blocker gehört. Östrogene gehören zu den weiblichen Geschlechtshormonen und können in bestimmten Fällen am Wachstum von Brustkrebs beteiligt sein.
Fulvestrant Teva wird zur Behandlung von fortgeschrittenem oder metastasiertem Brustkrebs bei Frauen nach der Menopause angewendet.
2. Was sollten Sie vor der Anwendung von Fulvestrant Teva beachten?
Fulvestrant Teva darf NICHT angewendet werden, wenn Sie
- allergisch gegen Fulvestrant, raffiniertes Rizinusöl oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
- schwanger sind oder stillen (siehe Abschnitt „Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit“).
- schwerwiegende Leberprobleme haben.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Sie Fulvestrant Teva anwenden, wenn einer der folgenden Punkte auf Sie zutrifft:
- Nieren- oder Leberprobleme
- niedrige Anzahl an Blutplättchen (diese helfen bei der Blutgerinnung) oder Blutungsstörungen
- frühere Schwierigkeiten mit Blutgerinnseln
- Osteoporose (Abnahme der Knochendichte)
- Alkoholismus (siehe Abschnitt „Fulvestrant Teva enthält Ethanol 96 % (Alkohol)“).
Kinder und Jugendliche
Fulvestrant Teva ist NICHT angezeigt für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren.
Anwendung von Fulvestrant Teva zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt, Apotheker oder das medizinische Fachpersonal, wenn Sie andere Arzneimittel einnehmen, kürzlich andere Arzneimittel eingenommen haben oder beabsichtigen andere Arzneimittel einzunehmen.
Teilen Sie Ihrem Arzt vor allem mit, wenn Sie Antikoagulanzien einnehmen (Arzneimittel, die die Bildung von Blutgerinnseln verhindern).
Schwangerschaft, Stillzeit und Fortpflanzungsfähigkeit
Sie DÜRFEN Fulvestrant Teva NICHT anwenden, wenn Sie schwanger sind. Wenn Sie schwanger werden könnten, sollten Sie während der Behandlung mit Fulvestrant Teva eine wirksame Verhütungsmethode anwenden.
Sie DÜRFEN NICHT stillen, während Sie mit Fulvestrant Teva behandelt werden.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es ist nicht zu erwarten, dass Fulvestrant Teva Ihre Verkehrstüchtigkeit oder Ihre Fähigkeit zum Bedienen von Maschinen beeinträchtigt. Wenn Sie sich nach einer Behandlung mit Fulvestrant Teva jedoch müde fühlen, DÜRFEN Sie sich NICHT an das Steuer eines Fahrzeugs setzen oder eine Maschine bedienen.
Auswirkungen bei Fehlgebrauch zu Dopingzwecken
Die Anwendung von Fulvestrant Teva kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Fulvestrant Teva enthält Ethanol 96 % (Alkohol), d. h. bis zu 1.000 mg pro Dosis, entsprechend 20 ml Bier oder 8 ml Wein pro Dosis.
Ein gesundheitliches Risiko besteht u.a. bei Leberkranken, Alkoholkranken, Epileptikern, Patienten mit organischen Erkrankungen des Gehirns, Schwangeren, Stillenden und Kindern.
Fulvestrant Teva enthält Benzylalkohol. Die Menge an Benzylalkohol pro Dosis beträgt 500 mg pro 5 ml (100 mg pro ml). Dies kann allergische Reaktionen auslösen.
Fulvestrant Teva enthält raffiniertes Rizinusöl, welches schwere allergische Reaktionen hervorrufen kann.
3. Wie ist Fulvestrant Teva anzuwenden?
Die empfohlene Dosis beträgt 500 mg Fulvestrant (zwei 250 mg/5 ml Injektionen) einmal monatlich, wobei 2 Wochen nach der ersten Dosis eine zusätzliche 500 mg Dosis gegeben wird.
Ihr Arzt oder das medizinische Fachpersonal wird Ihnen Fulvestrant Teva langsam als intramuskuläre Injektion in Ihr Gesäß verabreichen, eine Injektion in jede Gesäßhälfte.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Informieren sie UMGEHEND Ihren Arzt, Apotheker oder das medizinische Fachpersonal, wenn Sie eine der folgenden Nebenwirkungen bemerken:
• allergische (Überempfindlichkeits-) Reaktionen, darunter Schwellungen von Gesicht, Lippen, Zunge und/oder Rachen
• Thromboembolien (erhöhtes Risiko für Blutgerinnsel)*
• Entzündung der Leber (Hepatitis)
• Leberversagen.
Dies sind ernst zu nehmende Nebenwirkungen. Es kann sein, dass Sie umgehend eine medizinische Behandlung benötigen.
Informieren Sie Ihren Arzt, Apotheker oder das medizinische Fachpersonal, wenn Sie eine der folgenden Nebenwirkungen bemerken:
Sehr häufig: kann mehr als 1 von 10 Behandelten betreffen
• Reaktionen an der Injektionsstelle, wie z. B. Schmerzen und/oder Entzündung
• unnormale Leberenzymwerte (im Bluttest)*
• Übelkeit (Gefühl, krank zu sein)
• Schwäche, Müdigkeit*.
Häufig: kann bis zu 1 von 10 Behandelten betreffen
• Kopfschmerzen
• Hitzewallungen
• Erbrechen (Übelkeit), Durchfall oder Appetitlosigkeit*
• Hautausschlag
• Infektionen des Harntrakts
• Rückenschmerzen*
• erhöhtes Bilirubin (Gallenfarbstoff, der von der Leber produziert wird)
Gelegentlich: kann bis zu 1 von 100 Behandelten betreffen
• verminderte Anzahl an Blutplättchen (Thrombozytopenie)
• vaginale Blutungen, dicker, weißlicher Ausfluss und Candidose (Pilzinfektion)
• blaue Flecken und Bluten an der Injektionsstelle
• erhöhtes Gamma-GT, ein in einem Bluttest nachgewiesenes Leberenzym
• Schließt Nebenwirkungen ein, bei denen die genaue Rolle von Fulvestrant Teva wegen der Grunderkrankung nicht bewertet werden kann.
Selten können Überempfindlichkeitsreaktionen durch Benzylalkohol auftreten.
Raffiniertes Rizinusöl kann schwere allergische Reaktionen hervorrufen.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Fulvestrant Teva aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und Umkarton nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Sie dürfen dieses Arzneimittel nicht verwenden, wenn Sie Partikel oder Verfärbungen vor der Anwendung bemerken.
Bewahren Sie die Fertigspritze in der Originalverpackung auf, um den Inhalt vor Licht zu schützen.
Kühl lagern und transportieren (2 °C-8 °C).
Temperaturabweichungen, die außerhalb des Bereiches von 2 °C-8 °C liegen, sollten begrenzt werden. Dies beinhaltet, dass die Lagerung bei Temperaturen über 25 °C vermieden wird und dass ein Zeitraum von 28 Tagen nicht überschritten wird, bei dem die durchschnittliche Lagerungstemperatur des Arzneimittels unter 25 °C (aber über 2 °C -8 °C) beträgt. Nach Temperaturabweichungen sollte das Arzneimittel sofort wieder in die empfohlenen Lagerungsbedingungen gebracht werden (kühl lagern und transportieren bei 2 °C-8 °C). Temperaturabweichungen haben einen additiven Effekt auf die Qualität des Arzneimittels, und der Zeitraum von 28 Tagen darf über die Dauer der Haltbarkeit von Fulvestrant Teva, die 2 Jahre beträgt, nicht überschritten werden. Das Aussetzen bei Temperaturen unter 2 °C beeinträchtigt das Arzneimittel nicht, vorausgesetzt es wird nicht unter -20 °C gelagert.
Das medizinische Fachpersonal ist für die korrekte Lagerung, Anwendung und Entsorgung von Fulvestrant Teva verantwortlich.
6. Inhalt der Packung und weitere Informationen Was Fulvestrant Teva enthält
- Der Wirkstoff ist Fulvestrant. Jede Fertigspritze enthält 250 mg Fulvestrant. Jeder ml der Lösung enthält 50 mg Fulvestrant.
- Die sonstigen Bestandteile sind: Ethanol (96 %), Benzylalkohol, Benzylbenzoat und raffiniertes Rizinusöl. Enthält 100 mg Benzylalkohol pro ml Injektionslösung.
Wie Fulvestrant Teva aussieht und Inhalt der Packung
Fulvestrant Teva ist eine klare, farblose bis gelbliche, viskose Lösung in einer Fertigspritze, die mit einem Originalitätsverschluss versehen ist und 5 ml Injektionslösung enthält. Für die empfohlene monatliche 500 mg Dosis müssen zwei Spritzen verabreicht werden.
Von Fulvestrant Teva gibt es 2 Packungen:
1 Packung, die 1 Glas-Fertigspritze und 1 Injektionsnadel mit Sicherheitssystem zur Verbindung mit dem Zylinder enthält.
1 Packung, die 2 Glas-Fertigspritzen und 2 Injektionsnadeln mit Sicherheitssystem zur Verbindung mit jedem Zylinder enthält.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer
ratiopharm GmbH Graf-Arco-Str. 3 89079 Ulm
Mitvertreiber:
TEVA GmbH
Graf-Arco-Str. 3 89079 Ulm
Hersteller
PLIVA HRVATSKA d.o.o.
-PLIVA CROATIA Ltd-Prilaz baruna Filipovica 25 HR-10000 ZAGREB KROATIEN
oder
TEVA Pharmaceutical Works Private Limited Company
- Teva Gyogyszergyar Zrt. -
Pallagi ut 13
4042 DEBRECEN
UNGARN
oder
Teva Operations Poland Sp. z o.o.
UL. Emilii Plater 53 00-113 WARSZAWA POLEN
Dieses Arzneimittel ist in den Mitgliedsstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
|
Belgien: |
Fulvestrant Teva 250 mg oplossing voor injectie/solution injectable/ Injektionslösung |
|
Bulgarien: |
OyaBecTpaHT TeBa 250 mg H^e^HOHeH pa3TBop b npegBapurenHO Hammem cnpnH^BKa |
|
Dänemark: |
Fulvestrant Teva |
|
Deutschland: |
Fulvestrant Teva 250 mg Injektionslösung in einer Fertigspritze |
|
Estland: |
Fulvestrant Teva |
|
Finnland: |
Fulvestrant Teva 250 mg injektioneste, liuos, esitäytetty ruisku |
|
Frankreich: |
Fulvestrant Teva 250 mg solution injectable en seringue preremplie |
|
Irland: |
Fulvestrant Teva 250mg Solution for injection in Pre-filled Syringe |
|
Island: |
Fulvestrant Teva 250 mg stungulyf, lausn i afylltri sprautu |
|
Italien: |
Fulvestrant Teva |
|
Kroatien: |
Fulvestrant Pliva 250 mg otopina za injekciju u napunjenoj strcaljki |
|
Lettland: |
Fulvestrant Teva 250 mg skidums injekcijäm pilnslirce |
|
Litauen: |
Fulvestrant Teva 250 mg injekcinis tirpalas uzpildytame svirkste |
|
Luxemburg: |
Fulvestrant Teva 250 mg oplossing voor injectie/solution injectable/ Injektionslösung |
|
Malta: |
Fulvestrant Teva 250mg Solution for injection in Pre-filled Syringe |
|
Niederlande: |
Fulvestrant Teva 250 mg, oplossing voor injectie voorgevulde spuit |
|
Österreich: |
Fulvestrant ratiopharm 250 mg Injektionslösung |
|
Polen: |
Fulvestrant Teva |
Fulvestrant Teva
Portugal:
Rumänien:
Schweden:
Slowakei:
Slowenien:
Spanien:
Tschechische Republik: Ungarn:
Vereinigtes Königreich:
Fulvestrant Teva 250 mg solufie injectabilä in seringä
preumplutä
Fulvestrant Teva
Fulvestrant Teva 250mg, injekcny roztok naplneny v injekcnej striekacke
Fulvestrant Teva 250 mg raztopina za injiciranje v napolnjeni injekcijski brizgi
Fulvestrant Teva 250 mg Solucion inyectable EFG Fulvestrant Teva 250 mg, injekcm roztok v predplnene injekcm stnkacce
Fulvestrant Teva 250 mg/5 ml oldatos injekcio elöretöltött fecskendöben
Fulvestrant Teva 250mg solution for injection in pre-filled syringe
Diese Packungsbeilage wurde zuletzt überarbeitet im April 2016.
Versionscode: Z01
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
Fulvestrant Teva 500 mg (2 x 250 mg Injektionslösung in einer Fertigspritze) wird mit Hilfe von zwei Fertigspritzen angewendet.
Anwendungshinweise
Warnhinweis - Die Sicherheitsnadel DARF vor der Anwendung NICHT autoklaviert werden. Die Hände MÜSSEN während der Anwendung und Entsorgung immer hinter der Nadel bleiben.
Bei jeder der beiden Spritzen:
Abbildung 1
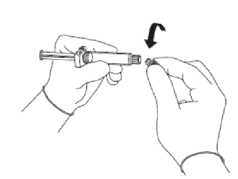
• Nehmen Sie den Glaszylinder der Spritze aus der Verpackung und überprüfen Sie, dass dieser nicht beschädigt ist.
• Brechen Sie den Verschluss der durchsichtigen Plastikabdeckung auf dem
Luer-Lock-Verbindungsstück der Spritze ab, damit Sie den Verschluss mit der aufgesetzten Gummikappe entfernen können (siehe Abbildung 1).
Abbildung 2
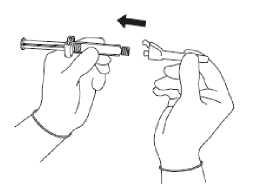
• Öffnen Sie die äußere Verpackung der Sicherheitsnadel. Verbinden Sie die Injektionsnadel mit dem Luer-Anschluss (siehe Abbildung 2).
• Schrauben Sie so lange, bis beide Teile fest miteinander verbunden sind.
Dabei schrauben Sie die Injektionsnadel auf das Luer-Verbindungsstück.
Abbildung 3
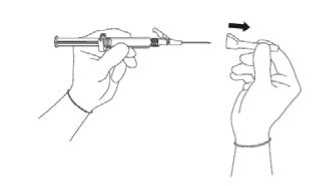
Abbildung 4
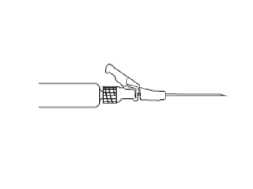
Abbildung 5
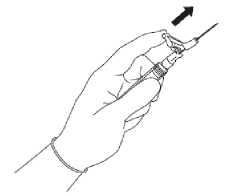
Ziehen Sie die Schutzabdeckung gerade von der Spritze ab, um eine Beschädigung der Nadelspitze zu vermeiden (siehe Abbildung 3).
Bringen Sie die gefüllte Spritze zur Applikationsstelle.
Parenterale Lösungen müssen vor der Applikation visuell auf Partikel und Farbveränderungen geprüft werden.
Entfernen Sie die überschüssige Luft aus der Spritze. Verabreichen Sie die Injektion langsam intramuskulär (1-2 Minuten/Injektion) in das Gesäß. Damit das Produkt möglichst anwenderfreundlich ist, liegt die Nadelöffnung oben, wenn der Hebelarm ebenfalls oben ist (siehe Abbildung 4).
• Nach der Injektion geben Sie dem
aktivierungsgesteuerten Hebelarm sofort mit einem Finger einen Stoß, um den Sicherheitsmechanismus der Nadel zu aktivieren (siehe Abbildung 5). HINWEIS: Halten Sie die Spritze beim Aktivieren von sich selbst und von anderen weg. Achten Sie auf den Klick und überzeugen Sie sich visuell davon, dass die Nadelspitze vollständig bedeckt ist.
Entsorgung
Die Fertigspritzen sind ausschließlich zur einmaligen Anwendung vorgesehen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7