Fyremadel 0,25 Mg/0,5 Ml Injektionslösung In Einer Fertigspritze
PACKUNGSBEILAGE
Gebrauchsinformation: Information für Anwender
Ganirelix SUN 0,25 mg/0,5 ml Injektionslösung in einer Fertigspritze
Ganirelix (als Acetat)
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt
4.
Was in dieser Packungsbeilage steht
1. Was ist Ganirelix SUN und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Ganirelix SUN beachten?
3. Wie ist Ganirelix SUN anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Ganirelix SUN aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Ganirelix SUN und wofür wird es angewendet?
Ganirelix SUN gehört zu einer Gruppe von Arzneimitteln, die „Gonadotropin-Releasing-Hormon-Antagonisten“ genannt werden, welche die Wirkungen des natürlichen Gonadotropin-Releasing-Hormons (GnRH) hemmen. GnRH reguliert die Ausschüttung der Gonadotropine (luteinisierendes Hormon (LH) und follikelstimulierendes Hormon (FSH)). Gonadotropine spielen eine wichtige Rolle in der menschlichen Fruchtbarkeit und Fortpflanzung. Bei Frauen ist FSH für das Wachstum und die Entwicklung der Eibläschen (Follikel) in den Eierstöcken verantwortlich. Follikel sind kleine runde Bläschen, die die Eizellen enthalten. LH wird für die Freisetzung der reifen Eizellen aus den Follikeln und Eierstöcken (Eisprung) benötigt. Ganirelix SUN verhindert die Wirkung von GnRH; hierdurch wird besonders die Freisetzung von LH gehemmt.
Ganirelix SUN wird angewendet
Bei Frauen, die sich einer künstlichen Befruchtung (assistierten Reproduktion) einschließlich der In-v/Yro-Befruchtung (IVF) und anderer Methoden unterziehen, kann es gelegentlich zu einem zu frühen Eisprung kommen, was eine erhebliche Abnahme der Wahrscheinlichkeit, schwanger zu werden, mit sich bringt. Ganirelix SUN wird verwendet, um den vorzeitigen LH-Anstieg und damit den zu frühen Eisprung zu verhindern.
In klinischen Studien wurde Ganirelix mit rekombinantem follikelstimulierendem Hormon (FSH) oder Corifollitropin alfa, einem Follikelstimulans mit langer Wirkdauer, angewendet.
2. Was sollten Sie vor der Anwendung von Ganirelix SUN beachten?
Ganirelix SUN darf nicht angewendet werden,
- wenn Sie allergisch gegen Ganirelix oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind;
- wenn Sie überempfindlich gegenüber Gonadotropin-Releasing-Hormon (GnRH) oder einem GnRH-Analogon sind;
- wenn Sie an einer mittelschweren oder schweren Nieren- oder Lebererkrankung leiden;
- wenn Sie schwanger sind oder stillen.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder Apotheker, bevor Sie Ganirelix SUN anwenden:
- sofern Sie zurzeit eine akute Allergie haben, teilen Sie dies bitte Ihrem Arzt mit. Er wird dann in Abhängigkeit der Schwere der Allergie entscheiden, ob zusätzliche Kontrollen während der Behandlung notwendig sind. Allergische Reaktionen wurden bereits mit der ersten Dosis berichtet.
- während und nach der hormonellen Stimulation der Eierstöcke kann ein Überstimulationssyndrom der Eierstöcke auftreten; dies hängt mit dem Stimulationsverfahren durch Gonadotropine zusammen. Bitte beachten Sie diesbezüglich die Packungsbeilage des Ihnen verordneten Gonadotropin-haltigen Arzneimittels.
- Das Auftreten von angeborenen Missbildungen nach der Anwendung einer assistierten Reproduktionstechnik könnte geringfügig höher sein als bei einer normalen Empfängnis. Es wird vermutet, dass diese geringfügige Erhöhung zurückzuführen ist auf die Eigenschaften der Patienten, die sich einer Fertilitätsbehandlung unterziehen (z. B. Alter der Frau, Eigenschaften der Spermien) sowie auf das häufigere Auftreten von Mehrlingsschwangerschaften nach Anwendung assistierter Reproduktionstechniken. Die Häufigkeit von angeborenen Missbildungen nach der Anwendung einer assistierten Reproduktionstechnik mit Ganirelix SUN unterscheidet sich nicht von der nach der Anwendung anderer GnRH-Analoga im Rahmen einer assistierten Reproduktionstechnik.
- Es besteht ein leicht erhöhtes Risiko für eine Bauchhöhlenschwangerschaft bei Frauen mit geschädigten Eileitern.
- Die Unbedenklichkeit und Wirksamkeit von Ganirelix SUN wurde nicht bei Frauen mit einem Körpergewicht von weniger als 50 kg oder mehr als 90 kg untersucht. Fragen Sie Ihren Arzt nach weiteren Informationen.
Kinder und Jugendliche
Es gibt keine relevante Anwendung von Ganirelix SUN bei Kindern.
Anwendung von Ganirelix SUN zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen andere Arzneimittel anzuwenden.
Schwangerschaft, Stillzeit und Zeugungs-/Gebärfähigkeit
Ganirelix SUN ist für den Einsatz während einer kontrollierten ovariellen Stimulation zur künstlichen Befruchtung (assistierten Reproduktion (ART)) bestimmt. Wenden Sie Ganirelix SUN nicht während der Schwangerschaft und Stillzeit an.
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Ganirelix SUN enthält Natrium
Ganirelix SUN enthält Natrium, aber weniger als 1 mmol (23 mg) Natrium pro Injektion, d. h., es ist nahezu „natriumfrei“.
3. Wie ist Ganirelix SUN anzuwenden?
Ganirelix SUN wird im Rahmen der assistierten Reproduktionsmedizin (ART) eingesetzt, einschließlich In-vitro-Fertilisation (IVF).
Sie werden sich die Injektionen selbst geben und so wird Ihr Arzt erklären, was Sie zu tun haben. Wenden Sie Ganirelix SUN immer genau nach Anweisung des Arztes an. Bitte fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht ganz sicher sind.
Grad 1
Die Stimulation der Follikel mit follikelstimulierendem Hormon (FSH) oder Corifollitropin kann an Tag 2 oder 3 der Periode beginnen.
Grad 2
Ganirelix SUN (0,25 mg) sollte 1-mal täglich direkt unter die Haut injiziert werden, beginnend am 5. oder 6. Tag der Stimulation. Unter Berücksichtigung Ihrer ovariellen Reaktion kann der Arzt entscheiden, an einem anderen Tag der FSH-Behandlung zu beginnen.
Ganirelix SUN sollte nicht mit FSH gemischt werden, beide Zubereitungen sollten jedoch annähernd zur selben Zeit, jedoch nicht an derselben Stelle verabreicht werden.
Die tägliche Behandlung mit Ganirelix SUN sollte bis zu dem Tag fortgesetzt werden, an dem ausreichend Follikel entsprechender Größe vorhanden sind.
Grad 3
Die endgültige Reifung der Eizellen in den Follikeln kann durch die Gabe von humanem Choriongonadotropin (hCG) eingeleitet werden. Die Zeitspanne zwischen zwei Ganirelix SUN-Injektionen und zwischen der letzten Ganirelix SUN-Injektion und der hCG-Injektion sollte 30 Stunden nicht überschreiten, da es sonst zu einem vorzeitigen Eisprung (Freisetzen der Eizellen) kommen kann. Deshalb sollte bei morgendlicher Injektion von Ganirelix SUN die Ganirelix SUN-Behandlung während der gesamten Gonadotropin-Behandlungsperiode, einschließlich des Tags der Ovulationsauslösung, fortgeführt werden. Bei der Injektion von Ganirelix SUN am Nachmittag sollte die letzte Ganirelix SUN-Injektion am Nachmittag vor dem Tag der Ovulationsauslösung gegeben werden.
Hinweise zur Handhabung
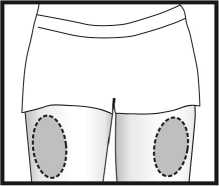
Injektionsstelle
Ganirelix SUN liegt in Fertigspritzen mit einer Einmaldosis vor und sollte langsam direkt unter die Haut injiziert werden, bevorzugt in den Oberschenkel. Kontrollieren Sie die Lösung vor Gebrauch. Verwenden Sie sie nicht, wenn die Lösung Teilchen enthält oder nicht klar ist. Wenn Sie die Injektionen selbst oder durch Ihren Partner verabreichen, folgen Sie den nachstehenden Anweisungen genau. Mischen Sie Ganirelix SUN nicht mit anderen Arzneimitteln.
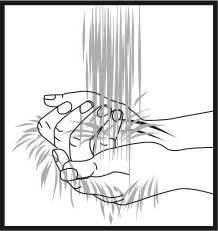
Vorbereitung der Injektionsstelle
Waschen Sie Ihre Hände gründlich mit Seife und Wasser. Wischen Sie die Injektionsstelle mit einem Desinfektionsmittel (z. B. Alkohol) ab, um Bakterien von der Hautoberfläche zu entfernen. Der Desinfektionsbereich sollte etwa 5 cm um die vorgesehene Einstichstelle betragen. Lassen Sie das Desinfektionsmittel mindestens 1 Minute lang trocknen, bevor Sie fortfahren.
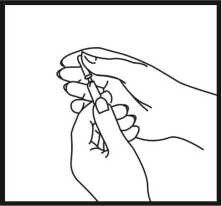
Nadeleinstich
Entfernen Sie die Nadelhülle. Nehmen Sie eine große Hautfläche zwischen Daumen und Finger. Die Nadel soll in einem 45°-Winkel zur Hautoberfläche in die eingeklemmte Haut eingestochen werden. Die Injektionsstelle sollte bei jeder Injektion gewechselt werden.
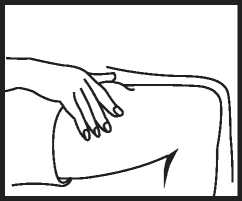
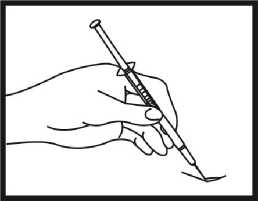
Überprüfung der Nadelposition
Ziehen Sie den Kolben leicht zurück, um zu überprüfen, ob die Nadel richtig positioniert ist. Wird dabei Blut in die Spritze aufgezogen, so wurde ein Blutgefäß verletzt. In diesem Fall injizieren Sie Ganirelix SUN nicht, sondern ziehen die Spritze heraus und drücken mit einem Desinfektionstupfer auf die Injektionsstelle; die Blutung sollte innerhalb von 1 oder 2 Minuten zum Stillstand kommen.
Verwenden Sie diese Spritze nicht mehr und entsorgen Sie diese ordnungsgemäß. Beginnen Sie mit einer neuen Spritze.
Injektion der Lösung
Sobald die Nadel richtig positioniert ist, drücken Sie den Kolben langsam und gleichmäßig herunter. Dadurch wird die Lösung korrekt injiziert und die Haut nicht verletzt.
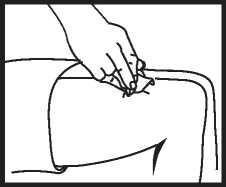
Entfernen der Spritze
Ziehen Sie die Spritze rasch heraus und drücken Sie einen Desinfektionstupfer auf die Injektionsstelle. Benutzen Sie die Fertigspritze nur einmal.
Wenn Sie eine größere Menge von Ganirelix SUN angewendet haben, als Sie sollten
Setzen Sie sich mit Ihrem Arzt in Verbindung.
Wenn Sie die Anwendung von Ganirelix SUN vergessen haben
Wenn Sie feststellen, dass Sie eine Dosis vergessen haben, holen Sie dies umgehend nach. Wenden Sie nicht die doppelte Dosis an, wenn Sie die vorherige Anwendung vergessen haben.
Sollte dies mehr als 6 Stunden zurückliegen, so dass die Zeitspanne zwischen zwei Injektionen mehr als 30 Stunden beträgt, dann holen Sie dies so bald wie möglich nach und fragen Sie Ihren Arzt hinsichtlich weiterer Ratschläge.
Wenn Sie die Anwendung von Ganirelix SUN abbrechen
Brechen Sie die Anwendung von Ganirelix SUN nicht ab, es sei denn Ihr Arzt hat Ihnen dazu geraten, da dies den Behandlungserfolg beeinträchtigen kann.
Wenn Sie weitere Fragen zur Anwendung des Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Häufig (kann bis zu 1 von 10 Behandelten betreffen)
- örtliche Hautreaktionen an der Injektionsstelle (vorwiegend Rötung mit oder ohne Schwellung). Diese lokale Reaktion klingt üblicherweise innerhalb von 4 Stunden nach Anwendung ab.
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen)
- Kopfschmerzen
- Übelkeit
- Unwohlsein (allgemeines Gefühl von Krankheit, Unwohlsein).
Sehr selten (kann bis zu 1 von 10.000 Behandelten betreffen)
- wurden umfassendere allergische Reaktionen bereits mit der ersten Dosis beobachtet.
Darüber hinaus werden Nebenwirkungen beobachtet, die bekanntermaßen bei der kontrollierten ovariellen Überstimulation auftreten z. B:
- Bauchschmerzen
- ovarielles Überstimulationssyndrom (OHSS). (OHSS passiert, wenn Ihre Eierstöcke auf die
Fruchtbarkeitmedikamente, die Sie einnehmen, überreagieren.)
- ektopische Schwangerschaft (wenn sich das Ungeborene außerhalb der Gebärmutter entwickelt)
- Fehlgeburt (lesen Sie die Packungsbeilage des FSH-haltigen Arzneimittels, mit dem Sie behandelt werden).
Eine Verschlechterung eines schon bestehenden Ekzems wurde bei einer Patientin nach der ersten Ganirelix-Dosis beobachtet.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungbeilage angegeben sind.
Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Ganirelix SUN aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
6
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett nach „Verw. bis“ und auf dem Umkarton nach „Verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des angegebenen Monats.
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Prüfen Sie die Injektionsspritze vor der Anwendung. Verwenden Sie nur Injektionsspritzen aus unbeschädigten Packungen mit klarer, partikelfreier Lösung.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was Ganirelix SUN enthält
- Der Wirkstoff ist: Ganirelix. Jede Fertigspritze enthält 0,25 mg Ganirelix (als Acetat) in 0,5 ml wässriger Lösung
- Die sonstigen Bestandteile sind: Essigsäure 99% (E260), Mannitol (Ph.Eur.) (E421) und Wasser für Injektionszwecke. Der pH-Wert (ein Messwert des Säuregehaltes) kann mit Natriumhydroxid und Essigsäure 99% eingestellt worden sein.
Wie Ganirelix SUN aussieht und Inhalt der Packung
Ganirelix SUN ist eine klare und farblose wässrige Lösung zur Injektion. Die Lösung ist gebrauchsfertig und zur subkutanen Anwendung bestimmt.
Ganirelix SUN-Packungen enthalten 1 bzw. 5 Fertigspritzen mit Injektionsnadeln (27 G).
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller
Pharmazeutischer Unternehmer
SUN Pharmaceuticals Germany GmbH
Kandelstraße 7
79199 Kirchzarten
Deutschland
Hersteller
Sun Pharmaceutical Industries Europe B.V.
Polarisavenue 87 2132 JH Hoofddorp Niederlande
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Dänemark:
Finnland:
Frankreich:
Deutschland:
Italien:
Niederlande:
Norwegen:
Österreich:
Spanien:
Ganirelix SUN 0,25 mg/0,5 ml injektionsv^ske, oplosning, i fyldt injektionssprojte
Ganireliksi SUN 0,25 mg/0,5 ml injektioneste, liuos esitäytetty ruisku Ganirelix SUN 0,25 mg/0,5 ml solution injectable en seringue pre-remplie Ganirelix SUN 0,25 mg/0,5 ml Injektionslösung in einer Fertigspritze Ganirelix SUN 0,25 mg/0,5 ml soluzione iniettabile in siringa preriempita Ganirelix SUN 0,25 mg/0,5 ml oplossing voor injectie in voorgevulde spuit Ganirelix SUN 0,25 mg/0,5 ml injeksjonsv^ske, opplosning, i ferdigfylt sprayte
Ganirelix SUN 0,25 mg/0,5 ml Injektionslösung in einer Fertigspritze Ganirelix SUN 0,25 mg/0,5 ml solucion inyectable en jeringa precargada EFG
Schweden: Ganirelix SUN 0,25 mg/0,5 ml injektionsvätska, lösning, förfylld spruta
Vereinigtes Königreich: Ganirelix SUN 0.25 mg/0.5 ml solution for injection in pre-filled syringe
Diese Packungsbeilage wurde zuletzt überarbeitet im Dezember 2014.
8