Gastrozepin 50Mg
F achinform ation
Boehringer n| \v Ingelheim
1. BEZEICHNUNG DES ARZNEIMITTELS
Gastrozepin® 50 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Tablette enthält 52,12 mg Pirenzepindihydrochlorid 1 H2O (entsprechend 50 mg Pirenzepindihydrochlorid)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Die Bruchkerbe dient nur zum Teilen der Tablette, um das Schlucken zu erleichtern, und nicht zum Teilen in gleiche Dosen.
|
4. |
KLINISCHE ANGABEN |
|
4.1 |
Anwendungsgebiete |
|
• |
Ulcus duodeni |
|
• |
Ulcus ventriculi |
|
Hinweise: | |
Die Behandlung mit Gastrozepin 50 mg kann Beschwerden, die bei einem Magenkarzinom auftreten, verschleiern und dadurch die Feststellung dieser Erkrankung verzögern. Daher sollte besonders vor der Behandlung von Magenulcera durch geeignete Maßnahmen untersucht werden, ob eine maligne Erkrankung vorliegt.
Bei Patienten mit Ulcus duodeni oder Ulcus ventriculi sollte eine Untersuchung auf Helicobacter pylori und im Falle des Nachweises dieses Bakteriums, wo immer möglich, eine anerkannte Eradikationstherapie vorgenommen werden, da in der Regel bei erfolgreicher Anwendung einer derartigen Therapie auch das Ulcus abheilt.
4.2 Dosierung und Art der Anwendung
Es werden folgende Dosierungen empfohlen:
Bei Magen- und Zwölffingerdarmgeschwüren:
2-mal täglich (morgens und abends) je 1 Tablette Gastrozepin 50 mg, entsprechend 2-mal täglich je 50 mg Pirenzepindihydrochlorid.
Bei schweren und komplizierten Magen- und Zwölffingerdarmgeschwüren kann die tägliche Dosis auf 3-mal 1 Tablette Gastrozepin 50 mg, entsprechend 3-mal 50 mg Pirenzepindihydrochlorid, erhöht werden.
Art und Dauer der Anwendung
Die Tabletten sind unzerkaut mit etwas Flüssigkeit jeweils etwa eine halbe Stunde vor den Mahlzeiten (morgens und abends, ggf. bei schweren und komplizierten Magen- und Zwölffingerdarmgeschwüren zusätzlich mittags) einzunehmen.
Unter der Behandlung gutartiger Magen- und Zwölffingerdarmgeschwüre kann bereits Beschwerdefreiheit eintreten, bevor diese Ulcera abgeheilt sind. Ziel der Behandlung ist jedoch die Abheilung der gutartigen Magen- und Zwölffingerdarmgeschwüre. Dafür kann eine Behandlungsdauer von 4 bis 8 Wochen erforderlich sein. Wenn das Ulcus nach 4 Wochen Behandlung noch nicht vollständig abgeheilt ist, sollte die Behandlung für weitere 4 Wochen fortgesetzt werden.
Über die Dauer der Anwendung von Gastrozepin 50 mg entscheidet der behandelnde Arzt.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Pirenzepindihydrochlorid (Gastrozepin 50 mg) bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen.
4.3 Gegenanzeigen
Gastrozepin 50 mg darf nicht angewendet werden bei bekannter Überempfindlichkeit gegen den Wirkstoff Pirenzepin oder einen der sonstigen Bestandteile und bei Patienten mit einem paralytischen Ileus. Im Fall von seltenen angeborenen Unverträglichkeiten mit einem Inhaltsstoff ist der Gebrauch dieses Produktes kontraindiziert (siehe Kapitel 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Patienten mit stark eingeschränkter Nierenfunktion (ClKreatinin < 30 ml/min) ist auf das Auftreten von Nebenwirkungen zu achten und die Dosis gegebenenfalls zu verringern.
Bei Patienten mit Glaukom, Prostatahypertrophie oder Tachykardie sollte Pirenzepin mit Vorsicht angewendet werden. Beim Auftreten anticholinerger Nebenwirkungen wie Sehstörungen oder Harnverhalt ist die Behandlung mit Gastrozepin 50 mg zu beenden.
Bei Pirenzepin-Dosen von mehr als 100 mg täglich (mehr als 2 Tabletten täglich) ist auf Grund des anticholinergen Wirkmechanismus bei diesen Patienten besondere Vorsicht geboten.
Das Arzneimittel enthält 439 mg Lactose-Monohydrat pro maximaler Tagesdosis von 150 mg Pirenzepindihydrochlorid. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsoption sollten Gastrozepin 50 mg nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei gleichzeitiger Anwendung von Pirenzepin mit Histamin-H2-Rezeptorantagonisten kommt es durch eine synergistische Wirkung zu einer deutlichen Verstärkung der säuresekretions-hemmenden Wirkung.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft:
Über die Anwendung von Gastrozepin 50 mg bei Schwangeren liegen keine hinreichenden Daten vor. Tierexperimentelle Studien ergaben keine Hinweise auf direkte oder indirekte gesundheitsschädliche
Wirkungen in Bezug auf eine Reproduktionstoxizität (siehe Abschnitt 5.3). Als Vorsichtsmaßnahme ist jedoch die Anwendung von Gastrozepin 50 mg während der Schwangerschaft zu vermeiden.
Stillzeit:
Pirenzepindihydrochlorid tritt, wenn auch nur in geringen Mengen, in die Muttermilch über. Anticholinerge Effekte können daher beim Säugling auftreten. Als Vorsichtsmaßnahme ist die Anwendung von Gastrozepin 50 mg während der Stillzeit daher zu vermeiden.
Fertilität:
Tierexperimentelle Studien ergaben keine Hinweise auf eine direkte oder indirekte Schädigung der Fertilität. Daten am Menschen liegen nicht vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Patienten müssen darauf hingewiesen werden, dass dieses Arzneimittel häufig Nebenwirkungen verursachen kann, insbesondere Akkommodationsstörungen. Dadurch kann auch bei bestimmungsgemäßem Gebrauch die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen und zur Arbeit ohne sicheren Halt beeinträchtigt sein. Sofern Akkommodationsstörungen auftreten, sollten möglicherweise gefährliche Tätigkeiten wie die Teilnahme am Straßenverkehr oder das Bedienen von Maschinen unterbleiben.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Systemorganklassen |
Häufigkeit |
|
Erkrankungen des Immunsystems | |
|
anaphylaktische Reaktionen |
Nicht bekannt |
|
Überempfindlichkeitsreaktionen |
Nicht bekannt |
|
Erkrankungen des Nervensystems | |
|
Kopfschmerzen |
Häufig |
|
Augenerkrankungen | |
|
Akkommodationsstörungen |
Häufig |
|
Herzerkrankungen | |
|
Herzfrequenzänderungen, vor allem Tachykardien |
Nicht bekannt |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Mundtrockenheit |
Sehr häufig |
|
Diarrhö, Obstipation |
Häufig |
|
Erkrankungen der Haut und des Unterhautzellgewebes | |
|
Hautausschlag |
Häufig |
|
Erkrankungen der Nieren und Harnwege | |
|
Harnverhalt |
Gelegentlich |
|
Psychiatrische Erkrankungen | |
|
V erwirrtheitszustände |
Sehr selten |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Bei Überdosierung können anticholinerge (atropinartige) Symptome wie Sehstörungen, Tachykardie, Mundtrockenheit, Erwärmung, Trockenheit und Rötung der Haut, Harnverhalt, Ileus, Unruhe oder Somnolenz auftreten, die mit einem Parasympathomimetikum, z. B. Physostigmin, behandelt werden können. Für Anticholinergika allgemein werden bei Überdosierung Ileus, delirante Zustände, myoklonische Bewegungen und Choreoathetose diskutiert. Bei Patienten mit Glaukom kann lokal Pilocarpin gegeben werden. Im Falle eines akuten Glaukomanfalles sollte die Behandlung mit Pupillen verengenden Tropfen begonnen und sofort eine fachärztliche Weiterbehandlung veranlasst werden. Pirenzepin ist nur gering dialysierbar.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Anticholinergika ATC-Code: A02BX03
Pirenzepin ist ein Anticholinergikum, dessen pharmakologische Wirkung auf der kompetitiven Blockade von Muskarinrezeptoren (= M-Cholinozeptoren) beruht. Dosisabhängig reduziert Pirenzepin - vor allem über eine Herabsetzung der Sekretvolumina, weniger über eine Beeinflussung der H+ -Ionen-Konzentration - die experimentell stimulierte Magensäuresekretion durch kompetitive Blockade der Mj-Rezeptoren an autonomen Ganglienzellen und parakrinen Zellen des Magens. Dies ist die hauptsächliche Wirkung von Pirenzepin in therapeutischer Dosierung von 100 mg. D. h. in therapeutischer Dosierung von 100 mg besitzt Pirenzepin eine gewisse, aber nicht ausschließliche Selektivität für M1-Muskarinrezeptoren.
Im Gegensatz zu den klassischen Muskarinrezeptor-Antagonisten wie Atropin bindet Pirenzepin nicht mit gleich großer Affinität an die verschiedenen Muskarinrezeptoren: an den Rezeptoren des Herzens (M2-Rezeptoren) und der glatten Muskulatur (M3-Rezeptoren) ist die Affinität geringer als an denen der exokrinen Drüsen (M3-Rezeptoren) und denen des Cortex und der peripheren Ganglien (M1-Rezeptoren). Daher gilt Pirenzepin in niedriger Dosierung als selektiver M1-Muskarinrezeptor-Antagonist. Bei ansteigender Dosierung von Pirenzepin werden jedoch auch andere Muskarinrezeptoren besetzt und dadurch das Auftreten anticholinerger (atropinartiger) Nebenwirkungen verursacht.
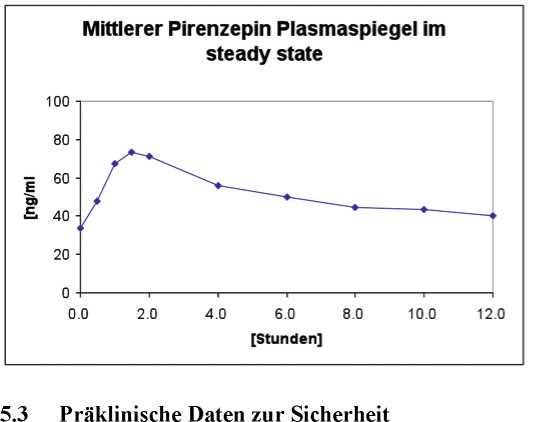
Pirenzepin wird nur teilweise aus dem Gastrointestinaltrakt resorbiert, die absolute Bioverfügbarkeit beträgt etwa 14 % nach oraler Applikation auf nüchternen Magen, bei vollem Magen ist die Resorption ca. 25 % geringer. Die relative Bioverfügbarkeit im Vergleich zu einer oral gegebenen Lösung liegt bei 99 %. Nach oraler Mehrfachgabe von 50 mg-Tabletten 2x täglich wurden nach ca. 1,3 Stunden maximale Plasmaspiegel von ca. 82 ng Pirenzepin/ml erreicht. Nach oraler Mehrfachgabe von 25 mg Pirenzepin werden auf Grund der Dosisproportionalität ca. 41 ng/ml erreicht.
Pirenzepin hat nur eine geringe Plasma-Protein-Bindung (ca. 12 %). Die Diffusion durch die Bluthirnschranke und Plazenta ist gering und nur minimale Mengen sind in der Muttermilch nachweisbar. Verteilungsvolumina von etwa 13 l im zentralen Kompartment bzw. ca. 140 l (Vss -Verteilungsvolumen im Steady State) wurden nach intravenöser Injektion errechnet.
Die Metabolisierung von Pirenzepin ist gering. Hauptmetabolit ist das pharmakologisch inaktive Desmethylpirenzepin, das beim Mensch aber weniger als 10 % der Gesamtradioaktivität widerspiegelt.
Nach parenteraler Gabe erfolgt die Ausscheidung zu gleichen Teilen über Faeces und Urin. Die Gesamt-Plasmaclearance beträgt 250 ml/min. Die renale Clearance beträgt die Hälfte davon, was etwa der glomerulären Filtrationsrate entspricht. Nach oraler Einnahme erfolgt die Elimination des Wirkstoffs innerhalb von 4 Tagen zu 90 % im Stuhl und zu 10 % im Urin. Der Unterschied zur parenteralen Gabe liegt in der geringen Resorption. Pirenzepin wird mit einer mittleren Halbwertszeit von 10 - 12 Stunden ausgeschieden.
Weder Leberinsuffizienz noch leichte oder mäßige Niereninsuffizienz beeinflussen die Pharmakokinetik von Pirenzepin maßgeblich. Bei deutlich eingeschränkter Niereninsuffizienz (ClKreatinin < 30 ml/min) treten deutlich im Steady state ca. 2fach höhere Plasmaspiegel auf.
Bioverfügbarkeit
Eine im Jahr 1989 durchgeführte Bioverfügbarkeitsuntersuchung an 12 Probanden mit Mehrfachgabe ergab folgende Ergebnisse:
Gastrozepin 50 mg Mehrfachgabe
maximale Plasmakonzentration (Cmax): 81.4 ± 32.0 ng/ml
Zeitpunkt der maximalen Plasmakonzentration
(tmax): 1.25 ± 0.45 h
Fläche unter der Konzentrations-Zeit-Kurve
(AUC): 621 ± 187 ng * h/ml
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe nach Mehrfachgabe in einem Konzentrations-Zeit-Diagramm:
Aus den Untersuchungen zur chronischen Toxizität liegen keine Erkenntnisse vor, die zu dem Verdacht führen, dass beim Menschen bisher unbekannte Nebenwirkungen auftreten könnten. Außerdem zeigte sich in In-vivo- und In-vitro-Studien kein Hinweis auf ein mutagenes oder kanzerogenes Potenzial.
Bei Mäusen, Kaninchen und Ratten war Pirenzepin auch bei hohen oralen Dosen nicht embryotoxisch oder teratogen. Bei der Ratte (oral gegeben, wurden nur ca. 11 % Pirenzepin resorbiert) war bis 1000 mg/kg/Tag bzw. 250 mg/kg/Tag die Fertilität bzw. die fetale und postnatale Entwicklung nicht beeinträchtigt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Hoch disperses Siliciumdioxid, Lactose-Monohydrat, Maisstärke, Magnesiumstearat (Ph.Eur)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses PVC/Aluminiumblister
OP mit 50 Tabletten
OP mit 100 Tabletten
Klinikpackung mit 500 (10 x 50) Tabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Boehringer Ingelheim Pharma GmbH & Co. KG
Binger Str. 173
55216 Ingelheim am Rhein
Telefon: 0 800/77 90 900
Telefax: 0 61 32/72 99 99
8. ZULASSUNGSNUMMER(N)
4809.00.01
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Zulassung: 05.10.1984
10. STAND DER INFORMATION
Juli 2013
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 7 von 7