Glianimon 5Mg
F achinform ation
(Zusammenfassung der Merkmale des Arzneimittels / SPC) Glianimon®
2 mg / 5 mg / 10 mg / Tropfen / 2 ml
1. BEZEICHNUNG DER ARZNEIMITTEL
Glianimon 2 mg Tabletten
Glianimon 5 mg Tabletten
Glianimon 10 mg Tabletten
Glianimon Tropfen 2 mg/ml Lösung zum Einnehmen
Glianimon 2 ml 1 mg/ml Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Glianimon 2 mg:
1 Tablette enthält 2 mg Benperidol.
Glianimon 5 mg:
1 Tablette enthält 5 mg Benperidol.
Glianimon 10 mg:
1 Tablette enthält 10 mg Benperidol.
Glianimon Tropfen:
1 ml Lösung zum Einnehmen enthält 2 mg Benperidol (Tropfflasche: 20 Tropfen = 1 ml). Glianimon 2 ml:
1 Ampulle zu 2 ml Injektionslösung enthält 2 mg Benperidol.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Glianimon 2 mg:
Tabletten
Rosa, runde Tabletten mit einer Bruchkerbe und der Markierung „GM“ auf einer Seite. Die Tablette kann in gleiche Hälften geteilt werden.
Glianimon 5 mg:
Tabletten
Gelbe, runde Tabletten mit einer Bruchkerbe und der Markierung „GM/5“ auf einer Seite.
Die Bruchkerbe dient nur zum Teilen der Tablette für ein erleichtertes Schlucken und nicht zum Aufteilen in gleiche Dosen.
Glianimon 10 mg:
Tabletten
Weiße, runde Tabletten mit einer Bruchkerbe und der Markierung „GM/10“ auf einer Seite.
Die Bruchkerbe dient nur zum Teilen der Tablette für ein erleichtertes Schlucken und nicht zum Aufteilen in gleiche Dosen.
Glianimon Tropfen:
Lösung zum Einnehmen Klare, farblose Lösung.
Glianimon 2 ml:
Injektionslösung Klare, farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Akute psychotische Syndrome mit Wahn, Halluzinationen, Denk-Störungen und Ich-Störungen; katatone Syndrome; delirante und andere exogen-psychotische Syndrome
- chronisch verlaufende endogene und exogene Psychosen (zur Symptomsuppression)
- maniforme Syndrome
- psychomotorische Erregungszustände
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung
Dosierung, Darreichungsform und Dauer der Anwendung müssen an Indikation, Schwere der Krankheit und individuelle Reaktionslage angepasst werden. Sobald der Krankheitsverlauf es zulässt, sollte auf orale Darreichungsformen übergegangen werden. Die Behandlungsdauer richtet sich nach dem Krankheitsbild und dem individuellen Verlauf. Dabei ist die niedrigste notwendige Erhaltungsdosis anzustreben. Über die Notwendigkeit einer Fortdauer der Behandlung ist laufend kritisch zu entscheiden.
Hinweis:
Bei gleichzeitiger Behandlung mit Lithium und Glianimon sollten beide Arzneimittel so niedrig wie möglich dosiert werden.
Die im Folgenden angeführten Tagesdosen dienen als Richtwerte. Die Tagesdosis kann auf 3 Einzeldosen verteilt werden, bei höheren Dosierungen auch auf häufigere Einzeldosen.
Bei ambulanter Therapie wird mit einer niedrigen Dosierung begonnen, die langsam gesteigert wird. Bei stationärer Behandlung kann mit höheren Anfangsdosen ein rascherer Wirkungseintritt erzielt werden.
Abrupte Dosisänderungen erhöhen das Nebenwirkungsrisiko. Nach einer längerfristigen Therapie muss der Dosisabbau in sehr kleinen Schritten über große Zeiträume erfolgen.
Die antipsychotische Wirkung erreicht manchmal erst nach ein- bis dreiwöchiger Behandlung ihr Maximum, während die psychomotorisch dämpfende Wirkung sofort eintritt.
Im Allgemeinen gelten folgende Dosierungsempfehlungen:
Bei akuten psychotischen und katatonen sowie deliranten und exogen-psychotischen Syndromen und maniformem Syndrom Beginn der Behandlung mit 2-6 mg Benperidol pro Tag; dies entspricht z. B. folgenden Dosierungen:
|
Arzneimittel |
Dosierung |
Benperidol-Menge pro Tag |
|
Glianimon Tropfen |
1-3 ml Lösung pro Tag (Pipettenflasche) |
2-6 mg |
|
20-60 Tropfen pro Tag (Tropfflasche) |
2-6 mg | |
|
Glianimon 2 mg |
1-3 Tabletten pro Tag |
2-6 mg |
|
Glianimon 5 mg |
max. 1 Tablette pro Tag |
5 mg |
|
Glianimon 2 ml |
1-3 Ampullen (2-6 ml Inj.-Lsg.) pro Tag |
2-6 mg |
Bei psychomotorischen Erregungszuständen Beginn der Behandlung mit 1-3 mg Benperidol täglich; dies entspricht z. B. folgenden Dosierungen:
|
Arzneimittel |
Dosierung |
Benperidol-Menge pro Tag |
|
Glianimon Tropfen |
0,5-1,5 ml Lösung pro Tag (Pipettenflasche) |
1-3 mg |
|
10-30 Tropfen pro Tag (Tropfflasche) |
1-3 mg | |
|
Glianimon 2 mg |
/-1/ Tabletten pro Tag |
1-3 mg |
|
Glianimon 2 ml |
/-1/ Ampullen (1-3 ml Inj.-Lsg.) pro Tag |
1-3 mg |
Die Tagesdosis kann auf höchstens 40 mg Benperidol gesteigert werden; z. B.: max. 8 Tabletten Glianimon 5 mg bzw. 4 Tabletten Glianimon 10 mg oder 20 Ampullen Glianimon 2 ml pro Tag. Nach Abklingen der akuten Symptome beträgt die Erhaltungsdosis 1-6 mg Benperidol täglich. In diesen Fällen empfehlen sich folgende Dosierungen:
|
Arzneimittel |
Dosierung |
Benperidol-Menge pro Tag |
|
Glianimon Tropfen |
0,5-3 ml Lösung pro Tag (Pipettenflasche) |
1-6 mg |
|
10-60 Tropfen pro Tag (Tropfflasche) |
1-6 mg | |
|
Glianimon 2 mg |
/-3 Tabletten pro Tag |
1-6 mg |
|
Glianimon 5 mg |
max. 1 Tablette pro Tag |
5 mg |
Bei therapieresistenten Fällen ist auch eine höhere Dosierung möglich.
Dosierung bei älteren Patienten
Bei älteren Patienten erzielen in der Regel niedrigere Tagesdosen bereits die gewünschte Wirkung (Beginn bei allen Indikationen mit 0,3-3 mg Benperidol täglich).
Art der Anwendung
Glianimon 2 mg / 5 mg /10 mg:
Die Tabletten werden während der Mahlzeit unzerkaut mit ausreichend Flüssigkeit eingenommen.
Glianimon Tropfen:
Die Tropfen werden während der Mahlzeit mit ausreichend Flüssigkeit eingenommen.
Glianimon 2 ml:
Die Injektionslösung ist nur zur intravenösen oder intramuskulären Anwendung bestimmt. Nach Anbruch Rest verwerfen.
Dauer der Anwendung
Die Dauer der Behandlung richtet sich nach dem Krankheitsverlauf.
4.3 Gegenanzeigen
Glianimon darf nicht angewendet werden bei:
- Überempfindlichkeit gegen den Wirkstoff Benperidol, andere Butyrophenone, Methyl-4-hydroxybenzoat (Paraben E 218), Propyl-4-hydroxybenzoat (Paraben E 216) oder einen der sonstigen Bestandteile
- Parkinson-Syndrom
- aus der Anamnese bekanntem malignem Neuroleptika-Syndrom nach Benperidol
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Glianimon darf nur unter besonderer Vorsicht angewendet werden bei:
- akuten Intoxikationen durch Alkohol, Opioide, Hypnotika oder zentraldämpfende Psychopharmaka
- Leberinsuffizienz
- prolaktinabhängigen Tumoren, z. B. Mammatumoren
- schwerer Hypotonie bzw. orthostatischer Dysregulation
- depressiver Erkrankung
- Erkrankungen des hämatopoetischen Systems
- hirnorganischen Erkrankungen und Epilepsie
- Hyperthyreose
- Hypokaliämie
- Bradykardie
- angeborenem langen QT-Syndrom oder anderen klinisch signifikanten kardialen Störungen (insbesondere Erregungsleitungsstörungen, Arrhythmien)
Zur Wirksamkeit und Verträglichkeit von Benperidol bei Kindern und Jugendlichen liegen keine ausreichenden Studien vor. Deshalb sollte Glianimon bei Kindern und Jugendlichen unter 18 Jahren nur unter besonderer Berücksichtigung des Nutzen-Risiko-Verhältnisses verordnet werden.
Besondere Vorsicht ist geboten bei Patienten mit neurologisch erkennbaren subkortikalen Hirnschäden und Neigung zu Krampfanfällen (anamnestisch, bei Alkoholentzug), da Benperidol die Schwelle für das Auftreten von Krampfanfällen senkt und Grand-mal-Anfälle auftreten können. Epileptiker sollten nur unter Beibehaltung der antikonvulsiven Therapie mit Glianimon behandelt werden.
Bei Patienten mit organischen Hirnschäden, arteriosklerotischen Hirngefäßerkrankungen und depressiver Erkrankung ist bei einer Therapie mit Glianimon besondere Vorsicht geboten.
Erhöhte Mortalität bei älteren Menschen mit Demenzerkrankungen
Die Daten zweier großer Anwendungsstudien zeigten, dass ältere Menschen mit DemenzErkrankungen, die mit konventionellen (typischen) Antipsychotika behandelt wurden, einem leicht erhöhten Mortalitätsrisiko im Vergleich zu nicht mit Antipsychotika Behandelten ausgesetzt sind. Anhand der vorliegenden Studiendaten kann eine genaue Höhe dieses Risikos nicht angegeben werden und die Ursache für die Risikoerhöhung ist nicht bekannt.
Glianimon ist nicht zur Behandlung von Verhaltensstörungen, die mit Demenz-Erkrankungen zusammenhängen, zugelassen.
Erhöhtes Risiko für das Auftreten von unerwünschten cerebrovaskulären Ereignissen
In randomisierten, placebokontrollierten klinischen Studien mit an Demenz erkrankten Patienten, die mit einigen atypischen Antipsychotika behandelt wurden, wurde ein etwa um das dreifache erhöhtes Risiko für unerwünschte cerebrovaskuläre Ereignisse beobachtet. Der Mechanismus, der zu dieser Risikoerhöhung führt, ist unbekannt. Es kann nicht ausgeschlossen werden, dass diese Wirkung auch bei der Anwendung anderer Antipsychotika oder bei anderen Patientengruppen auftritt. Glianimon sollte daher bei Patienten, die ein erhöhtes Schlaganfallrisiko haben, mit Vorsicht angewendet werden.
Thromboembolie-Risiko
Im Zusammenhang mit der Anwendung von Antipsychotika sind Fälle von venösen Thromboembolien (VTE) berichtet worden. Da Patienten, die mit Antipsychotika behandelt werden, häufig erworbene Risikofaktoren für VTE aufweisen, sollten alle möglichen Risikofaktoren für VTE vor und während der Behandlung mit Glianimon identifiziert und Präventivmaßnahmen ergriffen werden.
Obgleich die Prävalenz von Spätdyskinesien noch nicht hinreichend erforscht ist, scheint es so, dass ältere Patienten, insbesondere ältere Frauen, dafür besonders prädisponiert sind. Das Risiko der Spätdyskinesien und besonders das der Irreversibilität nimmt vermutlich mit der Therapiedauer und der Höhe der neuroleptischen Dosierung zu. Allerdings kann sich eine Spätdyskinesie auch schon nach kurzer Behandlungsdauer und niedriger Dosierung entwickeln. Die neuroleptische Behandlung selbst kann die Symptome einer beginnenden Spätdyskinesie zunächst maskieren. Nach Absetzen der Medikation tritt diese dann sichtbar in Erscheinung.
Bei Auftreten von hohem Fieber und Muskelstarre ist an ein malignes Neuroleptika-Syndrom zu denken welches nicht selten als Katatonie fehldiagnostiziert wird. Da hier eine erneute Neuroleptikum-Gabe lebensbedrohliche Konsequenzen haben kann, ist die Differentialdiagnose von entscheidender Bedeutung (Medikamentenanamnese, Prüfung auf Rigor, Fieber sowie CK-Anstieg in Blut und Harn).
Da Thyroxin die Nebenwirkungsrate steigern kann, sollten Patienten mit Hyperthyreose nur bei gleichzeitiger adäquater Therapie mit Glianimon behandelt werden.
Blutbild und Leberfunktion sowie die Kreislaufsituation sind während der Therapie in regelmäßigen Abständen zu überwachen. Ein Ausgangs-EEG und -EKG sollte für spätere Verlaufskontrollen vorliegen.
Glianimon Tropfen enthalten 1,5 Vol.-% Alkohol.
Glianimon 2 ml
Bei Behandlung mit Antikoagulanzien (blutgerinnungshemmende Arzneimittel) oder schweren Blutgerinnungsstörungen darf Glianimon 2 ml nicht intramuskulär injiziert werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Eine Beeinflussung der Wirkung folgender Wirkstoffe bzw. Wirkstoffgruppen ist bei gleichzeitiger Behandlung mit Benperidol möglich:
- zentraldämpfende Pharmaka (Schlafmittel, Schmerzmittel, andere Psychopharmaka, Antihistaminika): verstärkte Sedierung oder Atemdepression
- Lithium: selten kann es zu neurotoxischen Syndromen mit Bewusstseinsstörungen und Körpertemperaturerhöhung kommen. In diesen Fällen sollte die Behandlung beendet werden. Außerdem kann die gleichzeitige Einnahme von Lithium vermehrt zu extrapyramidalmotorischen Störungen, Müdigkeit, Zittern und Mundtrockenheit führen.
- Polypeptid-Antibiotika (z. B. Capreomycin, Colistin, Polymyxin B): eine durch diese Arzneimittel hervorgerufene Atemdepression kann durch Benperidol verstärkt werden.
- blutdrucksenkenden Medikamente: Wirkungsverstärkung
- Disulfiram: bei gleichzeitigem Alkoholgenuss Wirkungsabschwächung
- Dopaminagonisten (z. B. Levodopa): Wirkungsabschwächung
- Gonadorelin: Wirkungsabschwächung aufgrund der durch Benperidol hervorgerufenen Prolaktinerhöhung
- Dopamin: verminderte periphere Vasokonstriktion hoher Dopamindosen durch Wirkung an den alpha-Adrenorezeptoren
- Adrenalin: Auftreten einer paradoxen Hypotension (Ausbleiben der blutdrucksteigernden Wirkung) durch die Wirkung an den alpha-Adrenorezeptoren
Eine Abschwächung der Wirkung von Benperidol aufgrund der Erniedrigung der Plasmakonzentration von Benperidol ist bei gleichzeitiger Behandlung mit folgenden Wirkstoffen bzw. Wirkstoffgruppen möglich:
- Antiepileptika (z. B. Carbamazepin, Phenobarbital, Phenytoin)
- Rifampicin
Eine gegenseitige Wirkungsbeeinflussung ist in Kombination mit folgenden Wirkstoffen bzw. Wirkstoffgruppen möglich:
- andere Dopaminantagonisten (z. B. Metoclopramid): Verstärkung der extrapyramidalmotorischen Wirkungen
- Methyldopa: verstärkte zentralnervöse Effekte
- zentrale Stimulanzien vom Amphetamintyp: gegenseitige Wirkungsabschwächung
- Anticholinergika (wie z. B. Atropin, Benzatropin, Trihexyphenidyl): Wirkungsverstärkung. Zudem kann durch verminderte gastrointestinale Resorption die Benperidol-Wirkung abgeschwächt werden
Die gleichzeitige Anwendung von Arzneimitteln, die ebenfalls das QT-Intervall verlängern können (z. B. Antiarrhythmika Klasse IA oder III, Antibiotika, Malaria-Mittel, Antihistaminika, Antidepressiva) oder zu einer Hypokaliämie führen (z. B. bestimmte Diuretika), sollte vermieden werden.
Die Einnahme von Alkohol während einer Behandlung mit Benperidol kann zu einer Verstärkung der Alkoholwirkung und zu Blutdrucksenkung führen.
Die gleichzeitige Einnahme von Tee oder Kaffee kann zu einer Abschwächung der Benperidol-Wirkung führen.
Durch Rauchen kann die Plasmakonzentration von Benperidol aufgrund von Enzyminduktion erniedrigt werden. Es ist nicht bekannt, ob dies zu einer bedeutsamen Abschwächung der Benperidol-Wirkung führt.
4.6 Schwangerschaft und Stillzeit
Der Eintritt einer Schwangerschaft während der Behandlung mit Glianimon sollte nach Möglichkeit vermieden werden. Daher sollte vor Beginn der Behandlung ein Schwangerschaftstest vorgenommen werden. Während der Behandlung sind geeignete schwangerschaftsverhütende Maßnahmen durchzuführen.
Sollte eine Behandlung während der Schwangerschaft erforderlich werden, müssen Nutzen und Risiko sorgfältig gegeneinander abgewogen werden, da zur Anwendung von Benperidol in der Schwangerschaft keine Untersuchungen vorliegen. Tierexperimentelle Studien mit vergleichbaren Medikamenten haben Hinweise auf Fruchtschädigungen ergeben (siehe auch Abschnitt 5.3).
Neugeborene, die während des dritten Trimenons der Schwangerschaft gegenüber Antipsychotika (einschließlich Benperidol) exponiert sind, sind durch Nebenwirkungen einschließlich extrapyramidaler Symptome und/oder Entzugserscheinungen gefährdet, deren Schwere und Dauer nach der Entbindung variieren können.
Es gab Berichte über Agitiertheit, erhöhten oder erniedrigten Muskeltonus, Tremor, Somnolenz, Atemnot oder Störungen bei der Nahrungsaufnahme. Dementsprechend sollten Neugeborene sorgfältig überwacht werden.
Benperidol, der Wirkstoff in Glianimon, geht wie andere Neuroleptika der Butyrophenongruppe in die Muttermilch über. Bei gestillten Kindern, deren Mütter Butyrophenone erhalten hatten, wurden extrapyramidale Symptome beobachtet. Daher sollte unter einer Glianimon-Behandlung nicht gestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Diese Arzneimittel können auch bei bestimmungsgemäßem Gebrauch, besonders in den ersten Tagen der Behandlung, das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
Daher sollten das Führen von Fahrzeugen, die Bedienung von Maschinen oder sonstige gefahrvolle Tätigkeiten während der ersten Phase der Behandlung unterbleiben. Die Entscheidung in jedem Einzelfall trifft der behandelnde Arzt unter Berücksichtigung der individuellen Reaktion und der jeweiligen Dosierung.
4.8 Nebenwirkungen
Die folgenden unerwünschten Wirkungen wurden nach Gabe von Glianimon berichtet.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Extrapyramidalmotorische Symptome Sehr häufig:
Frühdyskinesien (vor allem in den ersten Tagen und Wochen), Parkinson-Syndrom und Akathisie (im Allgemeinen weniger früh)
Beim Auftreten von Frühdyskinesien oder Parkinson-Syndromen ist eine Dosisreduktion bzw. eine Behandlung mit einem anticholinergen Antiparkinsonmittel erforderlich. Diese Medikation sollte jedoch nur im Bedarfsfall und nicht routinemäßig durchgeführt werden. Falls eine AntiparkinsonMedikation erforderlich ist, deren Exkretion schneller erfolgt als diejenige von Benperidol, kann es zur Vermeidung des Auftretens oder der Verschlechterung extrapyramidalmotorischer Symptome notwendig sein, diese Antiparkinson-Medikation auch nach dem Absetzen von Benperidol weiterzuführen. Auf den möglichen Anstieg des Augeninnendrucks bei gleichzeitigem Verabreichen von Benperidol und anticholinergen Medikamenten inklusive Antiparkinson-Medikamenten ist zu achten.
Die Behandlung der Akathisie ist schwierig. Zunächst kann eine Dosisreduktion versucht werden, bei Erfolglosigkeit kann ein Therapieversuch mit Sedativa, Hypnotika oder Beta-Rezeptorenblockern durchgeführt werden.
Nach zumeist längerer und hochdosierter Therapie oder nach Abbrechen der Therapie kann es zur Manifestation von Spätdyskinesien kommen (anhaltende, vielfach irreversible hyperkinetische Syndrome mit abnormen unwillkürlichen Bewegungen vor allem im Bereich von Kiefer- und Gesichtsmuskulatur, aber auch athetoide und ballistische Bewegungen der Extremitäten). Eine gesicherte Therapie dieser Symptome ist derzeit nicht bekannt.
Auf erste dyskinetische Anzeichen, vorwiegend im lingualen und digitalen Bereich, ist unbedingt zu achten und die Beendigung der Neuroleptikatherapie in Erwägung zu ziehen.
Bei langandauemder Behandlung mit Benperidol können Spätdyskinesien maskiert werden und dann erst nach Beendigung der Behandlung in Erscheinung treten (siehe auch Abschnitt 4.4).
Schwangerschaft, Wochenbett undperinatale Erkrankungen Nicht bekannt:
Arzneimittelentzugssyndrom des Neugeborenen (siehe Abschnitt 4.6)
Malignes Neuroleptika-Syndrom
Unter der Behandlung mit Neuroleptika kann es zu einem lebensbedrohlichen malignen NeuroleptikaSyndrom kommen (Fieber über 40°C, Muskelstarre, vegetative Entgleisung mit Herzjagen und Bluthochdruck, Bewusstseinstrübung bis zum Koma), das ein sofortiges Absetzen der Medikation erfordert. Die Häufigkeit dieses Syndroms wird mit 0,07-2,2% angegeben. In einem solchen Fall sind intensivmedizinische Maßnahmen erforderlich.
Andere ZNS-Effekte Gelegentlich:
Schwindel, Lethargie, Kopfschmerzen, depressive Verstimmungen (insbesondere bei Langzeittherapie), Erregungszustände, delirante Symptome
Kardiovaskuläres System Häufig:
Hypotonie bzw. orthostatische Dysregulation, reflektorische Beschleunigung der Herzfrequenz (insbesondere zu Beginn der Behandlung)
Unter der Behandlung mit Neuroleptika kann es zu einer Verlängerung des QT-Intervalls und/oder ventrikulären Arrythmien kommen.
Leber- und Gallenwege Gelegentlich:
passagere Erhöhungen der Leberenzymaktivitäten Sehr selten:
cholestatische Hepatose
Endokrinium
Unter der Behandlung mit Neuroleptika kann es zur Gewichtszunahme und Erhöhung des Blutzuckerspiegels kommen. In seltenen Fällen wurde das Auftreten eines Diabetes mellitus beobachtet.
Als Folge einer Hyperprolaktinämie kann es zu Amenorrhoe, Galaktorrhoe, Brustvergrößerung, Abnahme von Libido und zu Potenzstörungen kommen.
Blut und Blutgefäße Gelegentlich:
Blutbildungsstörungen in Form einer Leukopenie Nicht bekannt:
Fälle von Thromboembolien (einschließlich Fällen von Lungenembolie und Fällen von tiefer Venenthrombose)
Überempfindlichkeitsreaktionen
Gelegentlich:
allergische Hautreaktionen (z. B. Juckreiz)
Sonstige Nebenwirkungen Sehr häufig:
Müdigkeit
Glianimon Tropfen
Methyl-4-hydroxybenzoat und Propyl-4-hydroxybenzoat (Parabene E 218 und E 216) können Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Wegen der großen therapeutischen Breite treten Intoxikationen im Allgemeinen nur bei massiven Überdosierungen auf.
a) Symptome der Intoxikation
- schwere extrapyramidale Störungen: akute dyskinetische oder dystone Symptome, ZungenSchlund-Syndrom, Blickkrämpfe, laryngeale oder pharyngeale Spasmen
- Somnolenz bis Koma, mitunter Erregung und delirante Verwirrtheit
- seltener zerebrale Krampfanfälle
- Hyperthermie oder Hypothermie
- kardiovaskulär: Hypotension, aber auch Hypertension, Tachykardie oder Bradykardie, ventrikuläre Tachyarrhythmie möglicherweise begleitet von einer QT-Verlängerung, Herz- und Kreislaufversagen
- selten anticholinerge Effekte: verschwommenes Sehen, Glaukomanfall, Ausbleiben der Darmmotilität, Urinretention
- selten respiratorische Komplikationen: Zyanose, Atemdepression, Atemstillstand, Aspiration, Pneumonie
b) Therapiemaßnahmen bei Überdosierung
Die Therapie orientiert sich an der allgemeinen Vorgehensweise bei Überdosierungen, weist aber folgende Besonderheiten auf:
- Die Induktion von Erbrechen kann wegen der antiemetischen Wirkung von Benperidol erschwert sein. Eine Magenspülung erscheint nur in früh erkannten Fällen sinnvoll. Forcierte Diurese oder Dialyse sind wenig hilfreich. Grundsätzlich sollte immer an die Möglichkeit einer Mehrfachintoxikation gedacht werden.
- Bei schweren extrapyramidalen Symptomen sind Antiparkinsonmittel zu geben (z. B.
Biperiden i.v.). Eine Verkrampfung der Schlundmuskulatur kann die Intubation erschweren; in diesem Fall kann ein Muskelrelaxans, z. B. Suxamethonium angewendet werden.
- Bei Hypotonie sind wegen der paradoxen Verstärkung keine adrenalinartig wirkenden Kreislaufmittel, sondern noradrenalinartig wirkende Mittel angezeigt (z. B. NoradrenalinDauertropfinfusion oder Angiotensinamid).
- Bei wiederholten epileptischen Anfällen werden Antikonvulsiva (ggf. Diazepam) gegeben, aber nur, wenn die Voraussetzungen für künstliche Beatmung gegeben sind (cave Atemdepression!).
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Butyrophenon-Derivate, ATC-Code: N05AD07
Wie in Tierversuchen gezeigt wurde, ist Benperidol ein spezifischer Dopaminantagonist, der vornehmlich auf die D2-Rezeptoren wirkt.
Hierdurch werden bei Versuchstieren Apomorphin-induzierte Stereotypien sowie Apomorphininduziertes Erbrechen gehemmt, Katalepsien ausgelöst und der bedingte Fluchtreflex unterdrückt; außerdem kommt es zu einer Prolaktinerhöhung. Bei chronischer Gabe kann es zu einer
Überempfindlichkeit von Dopaminrezeptoren in bestimmten Gehimregionen kommen. Für verschiedene Teilwirkungen kann Toleranz entwickelt werden. Eine Abschwächung der antipsychotischen Wirkung bei chronischer Anwendung ist nicht bekannt.
Weniger ausgeprägt als die dopamin-antagonistische Wirkung ist die Wirkung auf Serotoninrezeptoren. Nur in hohen Dosen kann Benperidol auch auf die alpha-Adreno- und Histaminrezeptoren wirken. Der anticholinerge Effekt von Benperidol ist sehr gering.
Das klinische Wirkprofil ist charakterisiert durch antipsychotische Wirkungen (Reduktion von Wahn, Halluzinationen, Ich-Störungen sowie Denk-Störungen, Dämpfung psychomotorischer und katatoner Erregung, affektiver Gespanntheit sowie manischer Verstimmung und Antriebssteigerung). Außerdem wirkt Benperidol sedierend, wobei der Grad der Sedierung mit der Dosierung korreliert.
5.2 Pharmakokinetische Eigenschaften
Benperidol wird in der Regel rasch resorbiert und unterliegt einem hohen First-pass-Effekt. Es können bei oraler Gabe maximale Plasmakonzentrationen um etwa 2 ng/ml je mg verabreichtem Benperidol erwartet werden. Die Kinetik ist bei wiederholter Applikation bis zu 40 mg Benperidol pro Tag linear. Eine Kumulation wird nicht beobachtet.
Die Substanz wird umfangreich biotransformiert, man findet nur etwa 1% der Dosis als unverändertes Benperidol im Urin. Über die beim Menschen auftretenden Metaboliten ist nur wenig bekannt. Die durchschnittlichen Werte für die Plasmahalbwertszeit t1/2ß liegen bei 7,65 h.
Bioverfügbarkeit
Eine im Jahr 1989/90 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (randomisiert, cross-over) an 12 Patienten (23-49 Jahre) ergab nach einmaliger Gabe von Tabletten im Vergleich zur Einnahme von Lösung und im Vergleich zur i.v.-Injektion als Referenzpräparate (entsprechend jeweils 6 mg Benperidol) folgende Werte:
|
Tabletten |
Lösung (oral) |
Injektionslösung (i.v.) | ||
|
C max |
[ng/ml] |
7,95 ± 2,99 |
11,58 ± 6,16 |
127,6 ± 84,18 |
|
tmax |
[h] |
3,15 ± 1,63 |
1,19 ± 0,96 |
0,033 ± 0,0* |
|
AUCo-oo |
[h*ng/ml] |
63,86 ± 31,70 |
79,10 ± 27,86 |
165,55 ± 54,90 |
Angabe der Werte als Mittelwerte und Streubreite (SD); *erster Messzeitpunkt nach Bolusinjektion
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
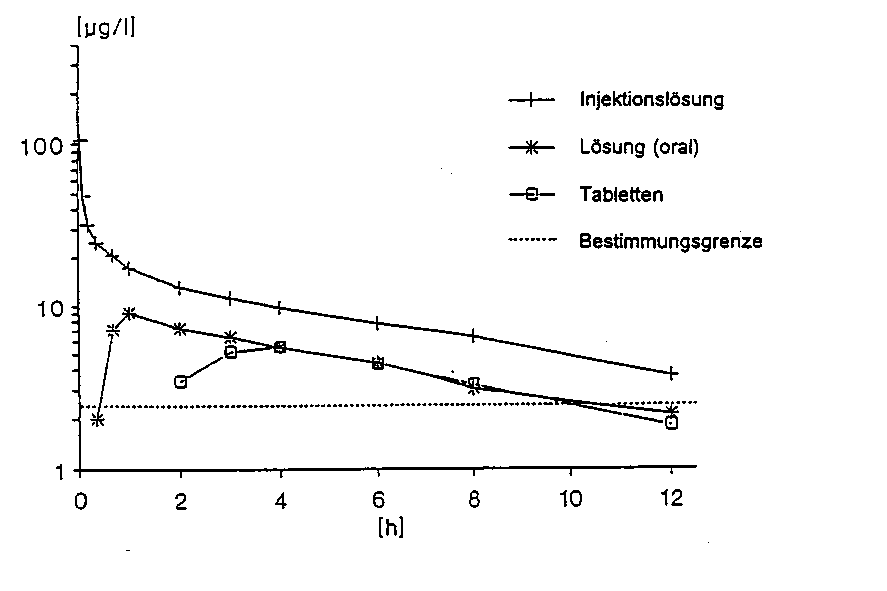
Das Diagramm zeigt den Konzentrations-Zeit-Verlauf im Plasma nach Einmalapplikation von Tabletten im Vergleich mit Lösung und Injektionslösung (i.v.) als Referenzpräparat (entsprechend jeweils 6 mg Benperidol).
Die absolute Bioverfügbarkeit der festen oralen Darreichungsform von Benperidol beträgt etwa 30-40%; die relative Bioverfügbarkeit im Verhältnis zur wässrigen Lösung beträgt etwa 80%.
5.3 Präklinische Daten zur Sicherheit
Untersuchungen zur akuten Toxizität wurden an Mäusen, Ratten und Kaninchen durchgeführt. Toxische Symptome waren vor allem Emesis, Tremor, Ataxie, Miosis, verminderte Motilität, Lakrimation, Piloerektion, Bradypnoe, Zyanose, Krämpfe und vermindertes Körpergewicht.
Die chronische Toxizität wurde im Fütterungsversuch an Ratten über 21 Monate (ca. 0,05 bis 0,5 mg/kg KG täglich) und an Hunden über 6 Monate (0,5 bis 2,5 mg /kg KG täglich) geprüft. Es ergaben sich keine Hinweise auf Organtoxizität.
Für strukturverwandte Butyrophenone (Haloperidol, Droperidol) ist bekannt, dass sie in vitro im nano-bis mikromolaren Konzentrationsbereich exprimierte HERG-Kanäle blockieren. Diese Kanäle sind für die Repolarisation im Herz verantwortlich. Die Substanzen haben daher das Potential, bestimmte Formen von ventrikulären Herzrhythmusstörungen (QT-Intervallverlängerung, Torsades de Pointes) auszulösen. Für Benperidol gibt es bisher keine Untersuchungen dazu. Eine vergleichbare Wirkung, insbesondere nach hochdosierter Gabe, kann nicht ausgeschlossen werden (siehe auch Abschnitte 4.4, 4.5 und 4.8).
Benperidol wurde nur unzureichend bezüglich mutagener Wirkungen geprüft. Bisherige in vitro- und in vivo-Tests verliefen negativ. Zu chemisch nahe verwandten Stoffen liegen Hinweise auf eine Chromosomen-brechende Aktivität vor.
Untersuchungen zum tumorerzeugenden Potential wurden an Ratten über 2 Jahre (Fütterungsversuch) mit den Dosierungen 0,5; 1,0 und 5,0 mg/kg/Tag durchgeführt. Beobachtet wurden ein dosisabhängiger Anstieg von Mamma-Tumoren (Adenome, Fibroadenome, Adenokarzinome), zystische Veränderungen und azinöse Hyperplasien der Brustdrüsen, Hyperplasie der Adenohypophyse und Mineralisation in den kortikomedullären Nierentubuli. Die Befunde wurden auf eine extensive pharmakodynamische Wirkung zurückgeführt.
Benperidol ist unzureichend auf reproduktionstoxikologische Eigenschaften geprüft. Embryo-fetotoxische Effekte wurden in Tierstudien bei der niedrigsten Dosis von 0,25 mg/kg/Tag beobachtet. Die Verabreichung während der Peri- und Postnatalperiode führte zu einer erhöhten Sterblichkeit der Jungtiere während der Geburt und der ersten Lebenstage. Ausreichende Untersuchungen über fertilitätsmindernde Eigenschaften wurden nicht durchgeführt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Glianimon 2 mg:
Calciumhydrogenphosphat-Dihydrat, Gelatine, Magnesiumstearat (Ph. Eur.), Maisstärke, Natriumdodecylsulfat, hochdisperses Siliciumdioxid, Eisen(III)-oxid (rotes Eisenoxid, E 172).
Glianimon 5 mg:
Calciumhydrogenphosphat-Dihydrat, Gelatine, Magnesiumstearat (Ph. Eur.), Maisstärke, Natriumdodecylsulfat, hochdisperses Siliciumdioxid, Eisen(III)-hydroxid-oxid (gelbes Eisenoxid,
E 172).
Glianimon 10 mg:
Calciumhydrogenphosphat-Dihydrat, Gelatine, Magnesiumstearat (Ph. Eur.), Maisstärke, Natriumdodecylsulfat, hochdisperses Siliciumdioxid.
Glianimon Tropfen:
Ethanol 96%, Weinsäure (Ph. Eur.), Methyl-4-hydroxybenzoat (Ph. Eur.) (Paraben E 218), Propyl-4-hydroxybenzoat (Ph. Eur.) (Paraben E 216), gereinigtes Wasser.
Glianimon 2 ml:
Weinsäure (Ph. Eur.), Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Glianimon 2 mg: 4 Jahre
Glianimon 5 mg: 4 Jahre
Glianimon 10 mg: 4 Jahre
Glianimon Tropfen: 3 Jahre
Nach Anbruch des Behältnisses nicht länger als 3 Monate verwenden.
Glianimon 2 ml: 5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Glianimon 2 mg / 5 mg /10 mg:
Die Blisterpackungen im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Glianimon Tropfen:
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
Nach Anbruch der Tropf- bzw. Pipettenflasche kann Glianimon Tropfen bei Raumtemperatur aufbewahrt werden.
Glianimon 2 ml:
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt der Behältnisse
Glianimon 2 mg / 5 mg /10 mg:
Umkarton mit Blisterpackungen aus Polypropylen (farblos oder weiß-opak)/Aluminium Packungen mit 50 Tabletten (N2)
Glianimon Tropfen:
Tropfflasche
Umkarton mit braunen 30 ml Glasflaschen (Glastyp 3) mit farblosem Vertikaltropfer aus Polyethylen und weiß-opakem Schraubdeckel aus Polypropylen Packung mit 30 ml Lösung zum Einnehmen (N1)
Klinikpackung mit 30 ml Lösung zum Einnehmen Pipettenflasche
Umkarton mit braunen 100 ml Glasflaschen (Glastyp 3) mit Glaspipetteneinheit mit Schraubdeckel
aus Polypropylen und Gumminippel
Packung mit 100 ml Lösung zum Einnehmen (N3)
Klinikpackung mit 100 ml Lösung zum Einnehmen
Glianimon 2 ml:
Umkarton mit braunen 2 ml Glasampullen (Glastyp 1)
Packung mit 5 Ampullen zu je 2 ml Injektionslösung (N1)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNGEN
DESITIN ARZNEIMITTEL GMBH Weg beim Jäger 214, 22335 Hamburg Telefon: (040) 5 91 01 525 Telefax: (040) 5 91 01 377
8. ZULASSUNGSNUMMERN
6016426.00. 02
27351.00. 01 27351.01.01
6016426.00. 00
6016426.00. 01
Glianimon 2 mg: Glianimon 5 mg: Glianimon 10 mg: Glianimon Tropfen: Glianimon 2 ml:
9. DATUM DER ERTEILUNG DER ZULASSUNGEN/VERLÄNGERUNG DER ZULASSUNGEN
|
Erteilung der Zulassung |
Letzte Verlängerung der Zulassung | |
|
Glianimon 2 mg |
02.08.1999 |
07.07.2014 |
|
Glianimon 5 mg |
11.12.1995 |
02.12.2003 |
|
Glianimon 10 mg |
11.12.1995 |
02.12.2003 |
|
Glianimon Tropfen |
02.08.1999 |
07.07.2014 |
|
Glianimon 2 ml |
02.08.1999 |
07.07.2014 |
10. STAND DER INFORMATION
{MM.JJJJ}
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
Seite 14 von 14