Infectobicillin Saft 750
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels)
1. BEZEICHNUNG DES ARZNEIMITTELS
INFECTOBICILLIN® Saft 750
750.000 Einheiten/5 ml Suspension zum Einnehmen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Phenoxymethylpenicillin-Benzathin (= Penicillin V-Benzathin)
1 Messlöffel bzw. 5 ml Suspension enthalten 594,3 mg Phenoxymethylpenicillin-Benzathin entsprechend
750.000 Einheiten.
Sonstige Bestandteile mit bekannter Wirkung:
Methyl-4-hydroxybenzoat (Ph. Eur.), Propyl-4-hydroxybenzoat (Ph. Eur.), Sorbitol (Ph. Eur.), (3-sn-Phosphatidyl)cholin aus Sojabohnen
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Suspension zum Einnehmen Orangegelbe Suspension
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
INFECTOBICILLIN wird angewendet bei Neugeborenen, Kindern aller Altersklassen, Jugendlichen und Erwachsenen zur Behandlung folgender leichter bis mittelschwerer Infektionen, die durch beta-hämolysierende Streptokokken der Gruppe A (Streptococcus pyogenes) bedingt sind:
- Tonsillitis
- Pharyngitis
- Scharlach und Scharlachprophylaxe
- Erysipel
Die offiziellen Richtlinien für den angemessenen Gebrauch von antibakteriellen Wirkstoffen sind bei der Anwendung von INFECTOBICILLIN zu berücksichtigen.
4.2 Dosierung und Art der Anwendung
Die antibakterielle Aktivität des Phenoxymethylpenicillins wird sowohl auf der Basis von Einheiten als auch auf der Basis der Masse (Gewichts-Basis) festgelegt. Dabei gilt folgende Beziehung:
1 mg Phenoxymethylpenicillin (freie Säure) entspricht 1.695 Einheiten und 1 mg Phenoxymethylpenicillin-Benzathin entspricht 1.262 Einheiten.
750.000 Einheiten entsprechen ungefähr 442 mg Phenoxymethylpenicillin bzw. 594,3 mg Phenoxymethylpenicillin-Benzathin.
Dosierung
Phenoxymethylpenicillin hat einen breiten Dosierungsspielraum, wobei sich die Art der Anwendung, die Höhe der Dosis und das Dosierungsintervall nach Art und Empfindlichkeit des Erregers, der Schwere der Infektion und dem Zustand des Patienten richten.
Im Allgemeinen beträgt die Tagesdosis für Neugeborene 15.000 bis 20.000 Einheiten/kg KG. Für Säuglinge und Kinder bis 12 Jahre beträgt die Tagesdosis 50.000 Einheiten/kg KG. Falls Erwachsene oder ältere Kinder Phenoxymethylpenicillin-Saft nehmen müssen, so beträgt die empfohlene Tagesdosis ebenfalls 50.000 Einheiten/kg KG.
Die folgende Tabelle gibt einen Anhaltspunkt für die Dosierung:
|
Alter |
Dosierung |
Tagesgesamtdosis |
|
Säuglinge (bis 12 Monate) |
2 x tägl. 1,25 ml (1/4 Messlöffel) |
375.000 Einheiten |
|
Kleinkinder (1-6 Jahre) |
2 x tägl. 2,5 ml (1/2 Messlöffel) |
750.000 Einheiten |
|
Schulkinder (6-12 Jahre) |
2 x tägl. 5 ml (1 Messlöffel) |
1.500.000 Einheiten |
|
Jugendliche (über 12 Jahre) und Erwachsene |
2 x tägl. 5-10 ml (1-2 Messlöffel) |
1.500.000 Einheiten bis 3.000.000 Einheiten |
1.000.000 Einheiten entsprechen 792,4 mg Phenoxymethylpenicillin-Benzathin.
Bei mittelschweren Fällen bzw. bei minderempfindlichen Erregern oder ungünstig gelegenem Infektionsort kann die Tagesdosis auf das Doppelte gesteigert werden. Eine weitere Erhöhung der Dosis kann im Einzelfall sinnvoll sein, jedoch ist in solchen Fällen in der Regel der Einsatz eines anderen Antibiotikums oder die Verwendung einer intravenösen Darreichungsform einer weiteren Erhöhung der Dosis von INFECTOBICILLIN vorzuziehen.
Dosierung bei eingeschränkter Nierenfunktion:
Bis zu einer Kreatinin-Clearance von 30-15 ml/min ist es beim empfohlenen Dosierungsintervall von 12 Stunden im Allgemeinen nicht erforderlich, die Dosis von Phenoxymethylpenicillin zu verringern.
Art der Anwendung
INFECTOBICILLIN kann vor, während oder nach einer Mahlzeit eingenommen werden.
Vor jedem Gebrauch die Flasche gut schütteln.
Der Packung liegt ein entsprechend markierter Messlöffel bei. Bis zum oberen Rand gefüllt enthält er 5 ml. Dies entspricht 750.000 Einheiten Phenoxymethylpenicillin-Benzathin.
Dauer der Anwendung
Die Therapiedauer soll mindestens 10 Tage betragen, um Spätkomplikationen (rheumatisches Fieber, Glomerulonephritis) vorzubeugen.
4.3 Gegenanzeigen
INFECTOBICILLIN darf nicht angewendet werden bei Patienten mit Überempfindlichkeit gegen Penicillin, Soja, Erdnuss, Methyl- bzw. Propyl-4-hydroxybenzoat oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile. Eine Kreuzallergie mit anderen ß-Laktam-Antibiotika kann bestehen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Anaphylaktische Reaktionen
Bei anaphylaktischen Reaktionen muss die Behandlung mit INFECTOBICILLIN sofort abgebrochen werden und die üblichen Sofortmaßnahmen (z. B. die Gabe von Antihistaminika, Kortikosteroiden, Sympathomimetika und ggf. Durchführung einer Beatmung) müssen eingeleitet werden.
Pseudomembranöse Enterokolitis
Hier ist eine Beendigung der Therapie mit INFECTOBICILLIN in Abhängigkeit von der Indikation zu erwägen und ggf. sofort eine angemessene Behandlung einzuleiten (z. B. Einnahme von speziellen Antibiotika/Chemotherapeutika, deren Wirksamkeit klinisch erwiesen ist). Arzneimittel, die die Peristaltik hemmen, sind kontraindiziert.
Bei Patienten mit allergischer Reaktionsbereitschaft (z. B. Heuschnupfen, Asthma bronchiale) ist das Risiko für schwerwiegendere Überempfindlichkeitsreaktionen erhöht, weshalb INFECTOBICILLIN in solchen Fällen mit besonderer Vorsicht angewandt werden sollte.
Bei Patienten mit schweren Magen-Darmstörungen mit Erbrechen und Durchfallen sollte von der Behandlung mit Phenoxymethylpenicillin abgesehen werden, da eine ausreichende Resorption nicht gewährleistet ist. (Hier empfiehlt sich eine parenterale Therapie, z. B. mit Benzylpenicillin oder einem anderen geeigneten Antibiotikum.)
Langfristige und wiederholte Anwendung von INFECTOBICILLIN kann zu Superinfektionen mit resistenten Keimen oder mit Sprosspilzen führen.
Zahnverfärbungen, die durch die Einnahme von INFECTOBICILLIN entstehen können, sind normalerweise durch intensive Mundhygiene während der Behandlung zu vermeiden.
Patienten mit der seltenen hereditären Fructose-Intoleranz sollten INFECTOBICILLIN nicht einnehmen.
Einfluss auf Laboruntersuchungen:
Unter einer Therapie mit INFECTOBICILLIN können nichtenzymatische Methoden zur Harnzuckerbestimmung ein positives Resultat ergeben. Ebenso kann der Urobilinogen-Nachweis gestört werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
INFECTOBICILLIN sollte nicht mit bakteriostatisch wirkenden Chemotherapeutika/Antibiotika (z. B. Tetracycline, Erythromycin, Sulfonamide oder Chloramphenicol) kombiniert werden, da ein antagonistischer Effekt möglich ist.
Die gleichzeitige Gabe von Probenecid führt als Folge einer Hemmung der renalen Ausscheidung zu höheren und längeranhaltenden Phenoxymethylpenicillin-Konzentrationen im Serum und in der Galle. Auch Indometacin, Phenylbutazon, Salicylate und Sulfinpyrazon führen zu erhöhten und verlängerten Serumspiegeln.
Die Resorption oral applizierter Penicilline kann bei unmittelbar vorausgegangener oder andauernder Darmsterilisation mit nicht resorbierbaren Aminoglykosiden (z. B. Neomycin) reduziert sein.
Bei gleichzeitiger Einnahme von INFECTOBICILLIN und oralen Kontrazeptiva kann eine Wirksamkeitsminderung der hormonellen Kontrazeptiva nicht ausgeschlossen werden. Es empfiehlt sich deshalb, zusätzlich nicht-hormonale empfängnisverhütende Maßnahmen anzuwenden.
Phenoxymethylpenicillin kann die Ausscheidung von Methotrexat vermindern und dadurch zu höheren Methotrexat-Plasmaspiegeln und gesteigerter Methotrexat-Toxizität führen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Phenoxymethylpenicillin ist plazentagängig. Daten über eine große Anzahl von exponierten Schwangeren lassen nicht auf Nebenwirkungen von Phenoxymethylpenicillin auf die Schwangerschaft oder auf die Gesundheit des Fötus bzw. Neugeborenen schließen. In tierexperimentellen Studien wurden keine reproduktionstoxischen Effekte beobachtet (siehe Abschnitt 5.3).
Falls notwendig, kann eine Anwendung von INFECTOBICILLIN während der Schwangerschaft in Betracht gezogen werden.
Stillzeit
Phenoxymethylpenicillin wird in die Muttermilch ausgeschieden. Die maximalen Milchspiegel betragen etwa 50 % der maximalen Serumspiegel. Beim gestillten Säugling ist die Möglichkeit einer Sensibilisierung bzw. Beeinflussung der physiologischen Darmflora mit Auftreten von Durchfall oder Sprosspilzbesiedlung zu beachten.
Fertilität
Die bisherigen umfangreichen klinischen Erfahrungen ergaben keine Hinweise auf fertilitätshemmende Effekte. Systematische Daten zum möglichen Einfluss von Phenoxymethylpenicillin auf die Fertilität des Menschen liegen jedoch nicht vor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
INFECTOBICILLIN hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Allerdings können die möglichen Nebenwirkungen zu einer entsprechenden Beeinträchtigung führen.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Die häufigsten Nebenwirkungen sind gastrointestinale Beschwerden, Appetitlosigkeit, allergische Hautreaktionen wie Urtikaria, Exantheme und Juckreiz sowie Schleimhautentzündungen.
Sehr selten können anaphylaktische Reaktionen, allergisches angioneurotisches Ödem, pseudomembranöse Enterokolitis oder Blutbildveränderungen auftreten.
Tabellarische Auflistung der Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (<1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die nachfolgenden Angaben beruhen auf Studienergebnissen sowie auf Einzelfallberichten aus Spontanmeldungen und der Literatur.
|
Systemorganklasse |
Häufigkeit |
Nebenwirkung |
|
Infektionen und parasitäre Erkrankungen |
Häufigkeit nicht bekannt |
Superinfektion mit resistenten Keimen oder Sprosspilzen (s. auch Abschnitt 4.4) |
|
Erkrankungen des Blutes und des Lymphsystems |
Sehr selten |
Granulozytopenie Agranulozytose Thrombozytopenie Panzytopenie hämolytische Anämie Eosinophilie |
|
Erkrankungen des Immunsystems |
Sehr selten |
anaphylaktischer Schock mit Blutdruckabfall (s. auch Abschnitt 4.4) Serumkrankheit |
|
Stoffwechsel- und Ernährungsstörungen |
Häufig |
Appetitlosigkeit |
|
Erkrankungen des Nervensystems |
Sehr selten |
Geschmacksstörungen, aseptische Meningitis |
|
Herzerkrankungen |
Sehr selten |
Tachykardie |
|
Erkrankungen der Atemwege, des Brustraums und |
Sehr selten |
Luftnot, Bronchospasmus Larynxödem |
|
Systemorganklasse |
Häufigkeit |
Nebenwirkung |
|
Mediastinums | ||
|
Erkrankungen des Gastrointestinaltrakts |
Häufig |
Übelkeit Erbrechen Magendrücken Bauchschmerzen Flatulenz weiche Stühle Durchfall |
|
Selten |
reversible Zahnverfärbung schwarze Haarzunge | |
|
Sehr selten |
Pseudomembranöse Enterokolitis (s. auch Abschnitt 4.4) trockener Mund | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Häufig |
Exantheme Erytheme Urtikaria Juckreiz Schleimhautentzündungen (besonders Glossitis, Stomatitis) |
|
Sehr selten |
Allergisches angioneurotisches Ödem allergische Vaskulitis Stevens-Johnson-Syndrom Lyell-Syndrom | |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Sehr selten |
Arthralgie |
|
Erkrankungen der Nieren und Harnwege |
Sehr selten |
Interstitielle Nephritis |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Sehr selten |
Arzneimittelfieber |
(3-sn-Phosphatidyl)cholin aus Sojabohnen kann sehr selten allergische Reaktionen hervorrufen.
Methyl- bzw. Propyl-4-hydroxybenzoat kann Überempfindlichkeitsreaktionen, auch Spätreaktionen, hervorrufen.
Kinder und Jugendliche
Es gibt keine Hinweise, dass sich das Sicherheitsprofil von INFECTOBICILLIN bei Kindern und Jugendlichen von dem bei Erwachsenen unterscheidet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: http://www.bfarm.de, anzuzeigen.
4.9 Überdosierung
Die Toxizität von Phenoxymethylpenicillin ist äußerst gering, die therapeutische Breite ist außerordentlich groß. Wie bei anderen Penicillinen ist die einmalige orale Aufnahme des Mehrfachen der therapeutischen Dosen von Phenoxymethylpenicillin nicht akut toxisch. Bei oraler Verabreichung ist es praktisch unmöglich, Konzentrationen zu erreichen, die zur Auslösung neurotoxischer Symptome führen.
Notfallmaßnahmen:
Spezielle Maßnahmen bei Überdosierung, außer dem Absetzen des Medikamentes, sind nicht erforderlich.
Eine Elimination von Phenoxymethylpenicillin kann mittels Hämodialyse erzielt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe
Antibiotika zur systemischen Anwendung, Betalactam-Antibiotika, Penicilline, Beta-Lactamase-sensitive Penicilline.
ATC-Code
J01CE10
Wirkmechanismus
Der Wirkungsmechanismus von Phenoxymethylpenicillin beruht auf einer Hemmung der bakteriellen Zellwandsynthese (in der Wachstumsphase) durch Blockade der Penicillin-bindenden Proteine (PBPs) wie z. B. der Transpeptidasen. Hieraus resultiert eine bakterizide Wirkung.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
Die Wirksamkeit hängt im Wesentlichen von der Zeitdauer ab, während der der Wirkstoffspiegel oberhalb der MHK des Erregers liegt.
Resistenzmechanismen
INFECTOBICILLIN ist zur Behandlung von Infektionen mit beta-hämolysierenden Streptokokken der Gruppe A (Streptococcus pyogenes) zugelassen. Weltweit wurden bisher keine resistenten Stämme gefunden.
Eine Resistenz gegenüber Phenoxymethylpenicillin kann prinzipiell auf folgenden Mechanismen beruhen:
- Inaktivierung durch Betalaktamasen: Phenoxymethylpenicillin ist nicht Betalaktamase-fest und wirkt daher nicht gegen Betalaktamase-bildende Bakterien (z. B. Staphylokokken oder Gonokokken).
- Reduzierte Affinität von PBPs gegenüber Phenoxymethylpenicillin: Die erworbene Resistenz bei Pneumokokken und einigen anderen Streptokokken gegenüber Phenoxymethylpenicillin beruht auf Modifikationen vorhandener PBPs als Folge einer Mutation. Für die Resistenz bei Methicillin (Oxacillin)-resistenten Staphylokokken hingegen ist die Bildung eines zusätzlichen PBPs mit verminderter Affinität gegenüber Phenoxymethylpenicillin verantwortlich.
- Unzureichende Penetration von Phenoxymethylpenicillin durch die äußere Zellwand kann bei Gram-negativen Bakterien dazu führen, dass die PBPs nicht ausreichend gehemmt werden.
- Durch Effluxpumpen kann Phenoxymethylpenicillin aktiv aus der Zelle transportiert werden.
Eine partielle oder vollständige Kreuzresistenz von Phenoxymethylpenicillin besteht mit anderen Penicillinen und Cephalosporinen.
Grenzwerte
Die Testung auf Empfindlichkeit gegenüber Phenoxymethylpenicillin erfolgt mit Hilfe von Benzylpenicillin unter Benutzung der üblichen Verdünnungsreihe. Folgende minimale Hemmkonzentrationen für sensible und resistente Keime wurden festgelegt:
EUCAST (European Committee on Antimicrobial Susceptibility Testing) Grenzwerte
|
Erreger |
Sensibel |
Resistent |
|
Streptokokken der Gruppe A (Streptococcus pyogenes) |
< 0,25 mg/l |
> 0,25 mg/l |
Prävalenz der erworbenen Resistenz in Deutschland
Bisher wurden weltweit keine resistenten Stämme von Streptokokken der Gruppe A (Streptococcus pyogenes) gefunden. Die Prävalenz der erworbenen Resistenz einzelner Spezies kann örtlich und im Verlauf der Zeit jedoch variieren. Deshalb sind - insbesondere für die adäquate Behandlung schwerer Infektionen - lokale Informationen über die Resistenzsituation erforderlich. Falls auf Grund der lokalen Resistenzsituation die Wirksamkeit von Phenoxymethylpenicillin in Frage gestellt ist, sollte eine Therapieberatung durch Experten angestrebt werden. Insbesondere bei schwerwiegenden Infektionen oder bei Therapieversagen ist eine mikrobiologische Diagnose mit dem Nachweis des Erregers und dessen Empfindlichkeit gegenüber Phenoxymethylpenicillin anzustreben.
5.2 Pharmakokinetische Eigenschaften
Resorption
Phenoxymethylpenicillin wird nach oraler Gabe vorwiegend im Duodenum resorbiert. Die Resorptionsquoten betragen 50-60 %. Maximale Serumspiegel nach Gabe von Phenoxymethylpenicillin-Benzathin werden nach 1-2 Stunden erreicht (Phenoxymethylpenicillin-Kalium: 30-60 Minuten).
Verteilung
Phenoxymethylpenicillin ist gut gewebegängig, und in verschiedenen Organen und Körperflüssigkeiten werden therapeutisch wirksame Konzentrationen erreicht. Die Liquorgängigkeit von Phenoxymethylpenicillin ist auch bei entzündeten Meningen gering.
Die Serumproteinbindung von Phenoxymethylpenicillin liegt bei 75 ± 14 % und ist damit höher als die des Benzylpenicillin mit 48 %. Das scheinbare Verteilungsvolumen beträgt 15,3 ± 1,17 l.
Plazentagängigkeit/Übergang in die Muttermilch
29 Schwangere erhielten Phenoxymethylpenicillin unter der Geburt. Die fetalen Blutspiegel betrugen 44 % der Konzentrationen im mütterlichen Blut. Im Fruchtwasser wurden 58 % der mütterlichen Serumkonzentrationen erreicht. Nach einmaliger Einnahme von Phenoxymethylpenicillin lag der Quotient aus Milchkonzentrationen und korrespondierenden Serumkonzentrationen zwischen 0,05 und
1.02 mit einem Mittelwert von 0,15. Etwa 0,2 % der Dosis, die eine stillende Mutter einnimmt, gelangen durch das Stillen in den kindlichen Organismus.
Elimination
Etwa 34 ± 20 % einer Dosis werden in Form von inaktiven Umwandlungsprodukten (z. B. Penicilloinsäure) im Urin aufgefunden. Die Exkretion von unverändertem Phenoxymethylpenicillin und seinen Umwandlungsprodukten erfolgt fast ausschließlich über die Nieren. Phenoxymethylpenicillin wird durch glomeruläre Filtration und tubuläre Sekretion ausgeschieden. Innerhalb von 12 Stunden werden 29 bis 43 % der verabreichten Dosis in unveränderter mikrobiologisch aktiver Form im Urin wiedergefunden. Innerhalb von 24 Stunden wird praktisch die gesamte resorbierte Menge in Form der Muttersubstanz und der Umwandlungsprodukte mit dem Urin ausgeschieden.
Die Serumhalbwertszeit beträgt nach Gabe von Phenoxymethylpenicillin-Benzathin 2,5 Stunden (Phenoxymethylpenicillin-Kalium 30-45 Minuten). Aufgrund der verlängerten Halbwertszeit ist Phenoxymethylpenicillin-Benzathin für eine 2 x tägliche Dosierung geeignet.
Bei Neugeborenen und Patienten mit eingeschränkter Nierenfunktion ist die Ausscheidung verzögert. Für die totale Clearance von Phenoxymethylpenicillin wurde nach i. v.-Gabe ein Wert von ca. 800 ml/min ermittelt und in einer anderen Untersuchung ein niedrigerer Wert von 476 ± 236 ml/min.
In einer Bioverfügbarkeitsstudie an 12 Kindern wurde INFECTOBICILLIN mit einem Referenzpräparat (Phenoxymethylpenicillin-Kalium) verglichen.
In Abbildung 1 sind die Mittelwertskurven als Plasma-Konzentrations-Zeit-Verläufe nach der Applikation von jeweils 12.500 Einheiten/kg KG dargestellt.
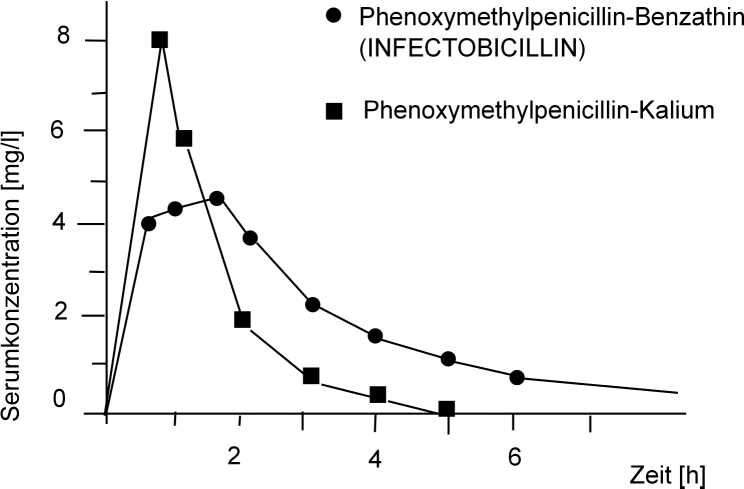
Abb. 1: Serumspiegel von Penicillin V nach Gabe von 12.500 Einheiten/kg KG als
Phenoxymethylpenicillin-Benzathin bzw. Phenoxymethylpenicillin-Kalium bei 12 Kindern
Im Einzelnen wurden folgende pharmakokinetische Parameter ermittelt:
|
tmax |
AUC | ||
|
(h) |
(h x mg/l) |
(h) | |
|
INFECTOBICILLIN Saft 750 = Phenoxymethylpenicillin-Benzathin |
1,23 |
4,5 |
2,3 |
|
Referenz-Präparat = Phenoxymethylpenicillin-Kalium |
0,38 |
4,8 |
0,75 |
Abbildung 2 zeigt die Plasmakonzentrations-Zeit-Kurve von INFECTOBICILLIN bei 12 Kindern nach Nüchterneinnahme und nach Gabe nach einer Mahlzeit. Die Resorption wird durch Nahrung praktisch nicht beeinflusst.
Phenoxymethylpenicilhn-Benzathin (INFECTOBICILLIN)
nüchtern nach Mah zeit
Zeit h
Abb. 2: Serumspiegel von Phenoxymethylpenicillin-Benzathin bei Kindern nüchtern und bei
Einnahme mit einer Mahlzeit (12.500 Einheiten/kg KG)
Insgesamt zeigt INFECTOBICILLIN im Vergleich zu einem herkömmlichen Präparat mit Phenoxymethylpenicillin-Kalium bei gleich guter Bioverfügbarkeit eine langsamere Resorption und erheblich verzögerte Elimination des Wirkstoffes Phenoxymethylpenicillin.
Durch die 3-fach längere Halbwertszeit ist daher INFECTOBICILLIN für die 2 x tägliche Gabe geeignet.
Pharmakokinetische/pharmakodynamische Zusammenhänge Siehe Abschnitt 5.1.
5.3 Präklinische Daten zur Sicherheit
Aus den Untersuchungen zur chronischen Toxizität liegen keine Erkenntnisse vor, die zu dem Verdacht führen, dass beim Menschen bisher unbekannte Nebenwirkungen auftreten könnten.
Bisherige Genotoxizitätsuntersuchungen von Phenoxymethylpenicillin ergaben keine Hinweise auf klinisch relevante Effekte. Langzeituntersuchungen an Ratten und Mäusen ergaben keine Anhaltspunkte für ein tumorigenes Potential.
Untersuchungen an verschiedenen Tierspezies haben keine Hinweise auf eine teratogene Wirkung von Phenoxymethylpenicillin ergeben.
In tierexperimentellen Untersuchungen (Maus) wurde kein Einfluss von Phenoxymethylpenicillin auf die Spermienmorphologie und kein signifikanter Effekt auf die Schwangerschaftshäufigkeit beobachtet.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Simeticon Saccharin-Natrium Citronensäure-Monohydrat Carmellose-Natrium (Ph. Eur.) Natriumcyclamat
Attapulgit
Natriumcitrat (Ph. Eur.)
(3-sn-Phosphatidyl)cholin aus Sojabohnen Eisen(III)-hydroxid-oxid Methyl-4-hydroxybenzoat (Ph. Eur.)
Propyl-4-hydroxybenzoat (Ph. Eur.)
Sorbitol (Ph. Eur.)
Aromastoffe Gereinigtes Wasser.
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
2 Jahre.
Haltbarkeit nach Anbruch: 14 Tage.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Im Kühlschrank lagern (2-8 °C).
Die angebrochene Flasche ebenfalls im Kühlschrank aufbewahren (2-8 °C).
Die Flasche im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
6.5 Art und Inhalt des Behältnisses
Braunglasflaschen mit Kunststoffverschluss zu 50 ml und 100 ml.
Messlöffel mit Füllmarken bei 1,25 ml, 2,5 ml und 5,0 ml.
INFECTOBICILLIN ist in Packungen mit 50 ml, 100 ml und 2 x 100 ml erhältlich.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
INFECTOPHARM Arzneimittel und Consilium GmbH
Von-Humboldt-Str. 1
64646 Heppenheim
Tel. 0 62 52/95 70 00
Fax 0 62 52/95 88 44
E-Mail: kontakt@infectopharm.com
Internet: www.infectopharm.com
8. ZULASSUNGSNUMMER(N)
6727357.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
23.09.1999/07.04.2011
10. STAND DER INFORMATION
November 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
11