Influsplit Ssw
FACHINFORMATION
FACHINFORMATION

Influsplit SSW® 2014/2015
April 2014
1. BEZEICHNUNG DES ARZNEIMITTELS
Influsplit SSW® 2014/2015
Injektionssuspension in einer Fertigspritze Influenza-Spaltimpfstoff (inaktiviert)
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Impfdosis (0,5 ml) enthält:
Wirkstoffe:
Gereinigte und durch Formaldehyd und Natriumdesoxycholat inaktivierte InfluenzaVirus Spaltantigene der folgenden Stämme*:
A/California/7/2009 (H1N1)pdm09-entsprechender verwendeter Stamm: NIB-74xp, abgeleitet von: A/Christchurch/16/2010
15 Mikrogramm HA**
A/Texas/50/2012 (H3N2)-davon abgeleiteter verwendeter Stamm: NYMC X-223A
15 Mikrogramm HA**
B/Massachusetts/02/2012-davon abgeleiteter verwendeter Stamm: NYMC BX-51B
15 Mikrogramm HA**
* vermehrt in embryonierten Hühnereiern von gesunden Hühnerherden ** Hämagglutinin
Dieser Impfstoff entspricht den Empfehlungen der WHO (Weltgesundheitsorganisation) für die nördliche Hemisphäre und der EU-Entscheidung für die Saison 2014/2015.
Sonstige Bestandteile:
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Influsplit SSW® kann Spuren von Eiern (wie Ovalbumin, Hühnerproteine), Formaldehyd, Gentamicinsulfat und Natriumdesoxycholat enthalten, die im Herstellungsprozess verwendet werden (siehe Abschnitt 4.3)
3. DARREICHUNGSFORM
Injektionssuspension in einer Fertigspritze. Influsplit SSW® ist farblos bis leicht opaleszierend.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Die Impfung dient der Vorbeugung der echten Virusgrippe (Influenza), besonders bei Personen mit erhöhtem Risiko für influenzabedingte Komplikationen.
Influsplit SSW® ist empfohlen für Erwachsene und Kinder ab 6 Monaten.
Der Einsatz von Influsplit SSW® sollte auf Grundlage der jeweils aktuellen STIKO-Empfehlungen (STIKO = Ständige Impfkommission am Robert-Koch-Institut) erfolgen. Diese sind auf den Internetseiten des Robert-Koch-Institutes einzusehen: www.rki.de.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene: 0,5 ml
Kinder:
Kinder im Alter von 36 Monaten und älter: 0,5 ml
Kinder im Alter von 6 Monaten bis 35 Monaten: Klinische Daten sind begrenzt vorhanden: 0,25 ml. Eine detaillierte Anleitung zur Verabreichung einer Dosis von 0,25 ml, siehe Abschnitt 6.6.
Kinder bis zum vollendeten 9. Lebensjahr, die noch nie gegen Grippe geimpft wurden, sollten nach einem Zeitraum von mindestens 4 Wochen eine zweite Dosis bekommen.
Kinder jünger als 6 Monate: Die Sicherheit und Wirksamkeit von Influsplit SSW® bei Kindern unter 6 Monaten ist nicht bewiesen. Es sind keine Daten verfügbar.
Art der Anwendung
Influsplit SSW® wird intramuskulär, gegebenenfalls tief subkutan verabreicht.
Notwendige Vorsichtsmaßnahmen zur Vorbereitung der Impfung sind zu treffen.
Hinweise zur Handhabung vor der Applikation des Impfstoffs, siehe Abschnitt 6.6.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe, gegen einen der Hilfsstoffe oder gegen sonstige in Spuren vorhandene Bestandteile wie vom Ei (Ovalbumin, Hühnerprotein), Formaldehyd, Gentamicinsulfat und Na-triumdesoxycholat.
Bei fieberhaften Erkrankungen und akuten Infektionen sollte die Impfung auf einen späteren Zeitpunkt verschoben werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Wie bei allen injizierbaren Impfstoffen sollten für den seltenen Fall einer anaphylaktischen Reaktion nach der Gabe des Impfstoffes entsprechende Möglichkeiten der medizinischen Behandlung und Überwachung stets sofort verfügbar sein (Adrenalin, Kortikosteroide, Antihistaminika).
Influsplit SSW® darf auf keinen Fall intravasal verabreicht werden.
Der Impferfolg kann bei Patienten mit endogener oder iatrogener Immunsuppression möglicherweise eingeschränkt sein.
Besonders bei Jugendlichen kann es als psychogene Reaktion auf die Nadelinjektion nach oder sogar vor einer Impfung zu einer Synkope (Ohnmacht) kommen. Diese kann während der Erholungsphase von verschiedenen neurologischen Symptomen wie vorübergehende Sehstörung, Parästhesie und tonisch-klonische Bewegungen der Gliedmaßen begleitet sein. Es ist wichtig, Maßnahmen zu ergreifen, um Verletzungen durch die Ohnmacht zu verhindern.
Zu Interferenzen mit serologischen Tests, siehe Abschnitt 4.5
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Ein zeitlicher Abstand zu anderen Impfungen muss nicht eingehalten werden. Bei gleichzeitiger Verabreichung eines anderen Impfstoffes sollten verschiedene Injektionsstellen (kontralateral) gewählt werden. Bei simultaner Gabe können Nebenwirkungen verstärkt werden.
Die Immunantwort bei Patienten mit endogener oder iatrogener Immunsuppression (krankheits- oder medikamentös bedingte Immunschwäche) kann unzureichend sein.
Nach der Grippeschutzimpfung wurden falsch positive Ergebnisse bei serologischen Tests beobachtet, die mittels ELISAMethode Antikörper gegen HIV1, Hepatitis C und insbesondere HTLV1 nachweisen. Die Western Blot-Technik widerlegt die falsch positiven ELISA Testergebnisse. Die vorübergehend falsch positiven Ergebnisse könnten auf die IgM-Immunantwort aufgrund der Impfung zurückzuführen sein.
4.6 Fertilität, Schwangerschaft und Stillzeit
Inaktivierte Influenza Impfstoffe können in allen Phasen der Schwangerschaft gegeben werden. Verglichen mit dem 1. Trimester sind für das 2. und 3. Trimester mehr Daten über die Sicherheit von Grippeimpfungen verfügbar. Auf jeden Fall zeigen die Daten nach weltweiter Anwendung von Influenza Impfstoffen keine gesundheitsgefährdenden Einflüsse auf die Schwangere oder das Baby.
Stillen
Der Impfstoff (Influsplit SSW®) kann während der Stillzeit verabreicht werden.
Fertilität
Daten bezogen auf den Einfluß auf Fertilität sind nicht verfügbar.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Der Impfstoff hat keine oder unwesentliche Auswirkungen auf die Verkehrstüchtigkeit und das Bedienen von Maschinen.
4.8 Nebenwirkungen
UNERWÜNSCHTE EREIGNISSE, BEOBACHTET IN KLINISCHEN PRÜFUNGEN: Die Sicherheit trivalenter inaktivierter Influenza-Impfstoffe wird anhand der Daten aus offenen, nicht-kontrollierten Studien beurteilt, die jährlich nach der Änderung der Stammzusammensetzung des Impfstoffes durchgeführt werden, und an denen mindestens 50 Erwachsene im Alter zwischen 18 - 60 Jahren und mindestens 50 Personen im Alter von 61 Jahren und älter, teilnehmen. Dabei werden Reaktogenität und Sicherheit während der ersten 3 Tage nach der Impfung beobachtet.
Die folgenden unerwünschten Ereignisse wurden während der klinischen Prüfungen berichtet, wobei die Häufigkeiten wie folgt angegeben werden:
sehr häufig (> 1/10), häufig (> 1/100, < 1/10), gelegentlich (> 1/1,000, < 1/100)
Siehe Tabelle auf Seite 2 oben
Pädiatrische Bevölkerungsgruppe:
In drei klinischen Studien wurde gesunden Kindern im Alter von 6 Monaten bis 17 Jahren (mehr als 3500 Kinder) Influsplit SSW®
Influsplit SSW® 2014/2015

Tabellarische Auflistung der Nebenwirkungen:
|
Organklasse |
Sehr häufig > 1/10 |
Häufig > 1/100, < 1/10 |
Gelegentlich > 1/1,000, < 1/100 |
|
Störungen des Nervensystems |
Kopfschmerzen* | ||
|
Haut- und subkutane Gewebestörungen |
Schweißausbruch* | ||
|
Skelettmuskel-, Bindegewebs- und Knochenerkrankungen |
Muskelschmerzen, Gelenkschmerzen* | ||
|
Allgemeine Reaktionen und lokale Reaktionen an der Injektionsstelle |
Fieber, Unwohlsein, Schüttelfrost, Erschöpfung. Lokale Reaktionen: Rötung, Schwellung, Schmerz, Hautblutung, Verhärtung* |
* Diese Reaktionen klingen gewöhnlich nach 1 - 2 Tagen ohne Behandlung folgenlos ab.
verabreicht. Die folgenden Nebenwirkungen wurden auch in dieser Bevölkerungsgruppe berichtet.
Siehe Tabelle unten
UNERWÜNSCHTE EREIGNISSE, BERICHTET NACH BREITER ANWENDUNG: Unerwünschte Ereignisse, die nach breiter Anwendung von trivalenten inaktivierten Influenza-Impfstoffen berichtet wurden, sind neben den Reaktionen, die auch in Klinischen Prüfungen beobachtet wurden, folgende:
Störungen des Blut- und Lymphsystems: Vorübergehende Thrombozytopenie, vorübergehende Lymphadenopathie
Störungen des Immunsystems:
Allergische Reaktionen (einschließlich Konjunktivitis), die in seltenen Fällen zum Schock führen, Angioödem
Störungen des Nervensystems:
Neuralgie, Parästhesie, Fieberkrämpfe, neurologische Störungen wie z. B. Enzephalomyelitis, Neuritis und Guillain Barre Syndrom
Gefäßstörungen:
Vaskulitis, in sehr seltenen Fällen verbunden mit vorübergehender Beeinträchtigung der Niere
Haut- und subkutane Gewebsstörungen: Generalisierte Hautreaktionen, einschließlich Pruritus, Urtikaria oder unspezifischer Hautausschlag
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer
Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Ver-hältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, Paul-Ehrlich-Institut, Paul-Ehrlich-Straße 51 - 59, 63225 Langen, Telefon: +49 6 10 37 70, Telefax: +49 61 03 77 12 34, Website: www.pei.de, anzuzeigen.
4.9 Überdosierung
Eine unerwünschte Wirkung durch Überdosierung ist unwahrscheinlich.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: InfluenzaImpfstoff
ATC-Code: J07BB02
Die schützende Antikörperkonzentration wird nach etwa 2 - 3 Wochen erreicht. Die Dauer des Impfschutzes gegen die im Impfstoff enthaltenen Stämme oder diesen Stämmen ähnliche Varianten ist unterschiedlich, beträgt aber gewöhnlich 6 - 12 Monate.
5.2 Pharmakokinetische Eigenschaften
Für Impfstoffe nicht zutreffend
5.3 Präklinische Daten zur Sicherheit
Für Impfstoffe nicht zutreffend
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid, Natriummonohydrogenphosphat x 12H2O, Kaliumdihydrogen-phosphat, Kaliumchlorid, Magnesiumchlorid x 6H2O, RRR-a-Tocopherolhydro-
gensuccinat, Polysorbat 80 (Tween 80), Octoxinol 10 (Triton X-100) sowie Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Da keine Daten aus Kompatibilitätsstudien vorliegen, darf der Impfstoff nicht mit anderen Arzneimitteln gemischt werden.
6.3 Dauer der Haltbarkeit
1 Jahr.
Das Verfallsdatum des Impfstoffes ist auf dem Etikett und der Verpackung angegeben.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Der Impfstoff ist im Kühlschrank bei +2 °C bis +8 °C zu lagern und darf nicht eingefroren werden. Um den Impfstoff vor Lichteinflüssen zu schützen, ist er in der Originalverpackung aufzubewahren.
6.5 Art und Inhalt des Behältnisses
0,5 ml Injektionssuspension in Fertigspritze (Glasart Typ I) mit einem Kolbenstopfen (grauer Butylkautschuk) mit oder ohne Nadel - Packungsgrößen zu 1, 10 oder 20.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht
|
Organklasse |
Sehr häufig > 1/10 |
Häufig > 1/100, < 1/10 |
Gelegentlich > 1/1,000, < 1/100 |
|
Stoffwechsel- und Ernährungsstörungen |
Appetitlosigkeit2 | ||
|
Psychiatrische Störungen |
Reizbarkeit2 | ||
|
Störungen des Nervensystems |
Benommenheit2, Kopfschmerzen3 | ||
|
Magen-Darm-Störungen |
Magen-Darm-Beschwerden3 | ||
|
Skelettmuskel-, Bindegewebs- und Knochenerkrankungen |
Gelenkschmerzen3, Muskelschmerzen3 | ||
|
Allgemeine Reaktionen und lokale Reaktionen an der Injektionsstelle |
Fieber2, Erschöpfung3. Lokale Reaktionen: Rötung1, Schwellung1, Schmerz1 |
Fieber3, Schüttelfrost3 |
1 berichtet bei Kindern im Alter von 6 Monaten bis 17 Jahren
2 berichtet bei Kindern im Alter von 6 Monaten bis < 6 Jahren
3 berichtet bei Kindern im Alter von 6 Jahren bis 17 Jahren
Influsplit SSW® 2014/2015

6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise für die Handhabung
Der Impfstoff sollte bei der Verabreichung Zimmertemperatur haben. Vor Gebrauch ist die Spritze mit dem Impfstoff zu schütteln. Überprüfen Sie den Impfstoff optisch vor der Anwendung.
Wenn eine Dosis von 0,5 ml appliziert werden soll, ist der gesamte Inhalt der Spritze zu verabreichen.
Anleitung für die Verabreichung von 0,25 ml des Impfstoffes für die Anwendung bei Kindern im Alter von 6 bis 35 Monaten:
Wenn eine Dosis von 0,25 ml appliziert werden soll, ist die Spritze in aufrechter Position zu halten und die Hälfte des Volumens abzuspritzen. Dazu wird der Stopfen bis zur Markierung auf der Spritze gedrückt. Bei Spritzen ohne Markierung kann Abbildung 1 als Dosierungshilfe benutzt werden. Man legt den oberen Rand der Spritze an die obere Pfeilspitze an und drückt den Stopfen bis zur unteren Pfeilspitze. Es verbleiben 0,25 ml Impfstoff in der Spritze (siehe Abbildung 1). Dann ist nach Möglichkeit die Kanüle zu wechseln, um das Impfen mit nasser Kanüle zu vermeiden.
Der verbleibende Impfstoff von 0,25 ml ist zu verabreichen.
Abbildung 1
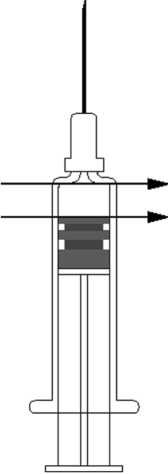
Anleitung für die Verabreichung des Impfstoffes in einer Fertigspritze ohne Nadel: Um die Kanüle/Nadel an der Spritze anzubringen, folgen Sie der Anleitung unten. Allerdings kann sich die mitgelieferte Spritze von der in der Anleitung beschriebenen Spritze etwas unterscheiden (d.h. ohne Schraubgewinde). In diesem Fall muss die Kanüle/Nadel ohne zu schrauben angebracht werden.
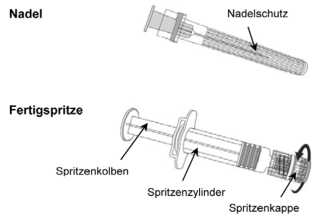
1. Halten Sie den Spritzenzylinder in einer Hand (vermeiden Sie, die Spritze am Kolben zu halten), drehen Sie die Spritzenkappe entgegen dem Uhrzeigersinn ab.
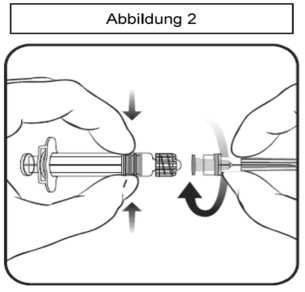
2. Um die Nadel an der Spritze anzubringen, drehen Sie die Nadel im Uhrzeigersinn in die Spritze bis sie fest sitzt (siehe Abbildung 2).
3. Entfernen Sie den Nadelschutz, der gelegentlich ein wenig fest sitzen kann.
4. Verabreichen Sie den Impfstoff.
Nicht verwendeter Impfstoff oder Abfallmaterial ist gemäß den lokalen Vorschriften zu entsorgen.
7. INHABER DER ZULASSUNG
GlaxoSmithKline GmbH & Co. KG 80700 München Service Tel.: 0800 1 22 33 55 Service Fax: 0800 1 22 33 66 e-mail: produkt.info@gsk.com
8. ZULASSUNGSNUMMER(N)
PEI.H.00084.01.1
9. DATUM DER ERTEILUNG DER ZU-LASSUNG/VERLÄNGERUNG DER ZULASSUNG
04.07.1991/30.12.2007
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
12. HINWEISE
Gemäß § 22 Infektionsschutzgesetz müssen alle Schutzimpfungen vom Impfarzt mit dem Impfdatum, Handelsnamen, der ChargenBezeichnung sowie der Angabe der Krank-
heit, gegen die geimpft wurde, in einen Impfausweis eingetragen werden.
Häufig unterbleiben indizierte Impfungen, weil bestimmte Situationen irrtümlicherweise als Impfhindernisse angesehen werden. Einzelheiten hierzu finden Sie in den jeweils aktuellen STIKO-Empfehlungen (Ständige Impfkommission am Robert-Koch-Institut, aktuell abrufbar über www.rki.de).
Zentrale Anforderung an: Rote Liste Service GmbH Fachinfo-Service Mainzer Landstraße 55 60329 Frankfurt
3