Instanyl 100 Mikrogramm Nasenspray, Lösung Im Einzeldosisbehältnis - Op6(6X0,1Ml)(Edb)
1. BEZEICHNUNG DES ARZNEIMITTELS
Instanyl 50 Mikrogramm Nasenspray, Lösung im Einzeldosisbehältnis Instanyl 100 Mikrogramm, Nasenspray, Lösung im Einzeldosisbehältnis Instanyl 200 Mikrogramm, Nasenspray, Lösung im Einzeldosisbehältnis
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Instanyl 50 Mikrogramm
Jedes Spraybehältnis enthält eine Dosis (100 Mikroliter) Fentanylcitrat entsprechend 50 Mikrogramm Fentanyl
Instanyl 100 Mikrogramm
Jedes Spraybehältnis enthält eine Dosis (100 Mikroliter) Fentanylcitrat entsprechend 100 Mikrogramm Fentanyl
Instanyl 200 Mikrogramm
Jedes Spraybehältnis enthält eine Dosis (100 Mikroliter) Fentanylcitrat entsprechend 200 Mikrogramm Fentanyl
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Nasenspray, Lösung (Nasenspray) Klare, farblose Lösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Instanyl ist für die Behandlung von Durchbruchschmerzen bei Erwachsenen bestimmt, die bereits eine Opioid-Basistherapie gegen ihre chronischen Tumorschmerzen erhalten. Durchbruchschmerzen sind eine vorübergehende Exazerbation von Schmerzen, die vor dem Hintergrund anderweitig kontrollierter Dauerschmerzen auftritt.
Zu den Patienten, die eine Opioid-Basistherapie erhalten, werden diejenigen gezählt, die mindestens 60 mg orales Morphium täglich, mindestens 25 Mikrogramm transdermales Fentanyl pro Stunde, mindestens 30 mg Oxycodon täglich, mindestens 8 mg orales Hydromorphon täglich oder eine äquianalgetische Dosis eines anderen Opioids über eine Woche oder länger erhalten.
4.2 Dosierung und Art der Anwendung
Die Behandlung ist von einem Arzt einzuleiten und zu überwachen, der Erfahrung mit einer OpioidTherapie bei Tumorpatienten hat. Der Arzt muss das Missbrauchspotenzial von Fentanyl bedenken.
Dosierung
Patienten sollten auf eine individuell wirksame Dosis eingestellt werden, die eine ausreichende Schmerzlinderung bei tolerablen Nebenwirkungen bietet. Die Patienten sollten während dieser Dosiseinstellung sorgfältig überwacht werden.
Zur Einstellung auf eine höhere Dosis sollte Kontakt mit medizinischem Fachpersonal aufgenommen werden.
In klinischen Studien war die wirksame Dosis von Instanyl zur Therapie von Durchbruchschmerzen unabhängig von der Tagesdosis der Opioid-Basistherapie (siehe Abschnitt 5.1).
Maximale Tagesdosis: Behandlung von bis zu vier Durchbruchschmerz-Episoden, jeweils mit nicht mehr als 2 Dosen in einem Abstand von mindestens 10 Minuten.
Der Patient sollte während der Dosiseinstellung als auch während der Erhaltungstherapie mindestens 4 Stunden warten bevor eine weitere Durchbruchschmerz-Episode mit Instanyl behandelt wird.
Dosistitration
Bevor der Patient auf Instanyl eingestellt wird, sollte sicher gestellt sein, dass die vorbestehenden chronischen Schmerzen durch eine adäquate Opioid-Basistherapie kontrolliert sind und dass nicht mehr als vier Durchbruchschmerz-Episoden pro Tag auftreten.
Titrationsschritte
Die Anfangsdosis von Instanyl sollte 50 Mikrogramm, appliziert in ein Nasenloch, betragen. Diese wird nach Bedarf schrittweise durch eine der verfügbaren Wirkstärken (50, 100 und 200 Mikrogramm) auftitriert. Wenn nach dem ersten Sprühstoß keine hinreichende Analgesie erreicht wird, kann frühestens nach 10 Minuten eine zweite Dosis derselben Wirkstärke appliziert werden. Jeder Titrationsschritt (Dosis einer Wirkstärke) sollte üblicherweise über mehrere DurchbruchschmerzEpisoden bewertet werden.
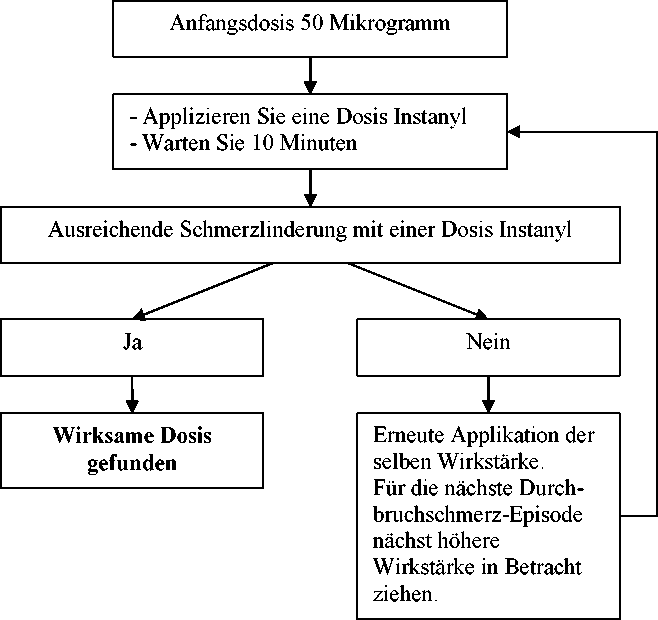
Erhaltungstherapie
Sobald die individuelle Dosis gemäß den oben beschriebenen Titrationsschritten ermittelt worden ist, sollte diese Wirkstärke von Instanyl vom Patienten beibehalten werden. Wenn die Schmerzen nur unzureichend gelindert werden, kann der Patient frühestens nach 10 Minuten eine zusätzliche Dosis der gleichen Stärke applizieren.
Dosisanpassung
Generell gilt, dass die Erhaltungsdosis von Instanyl dann erhöht werden sollte, wenn ein Patient über mehrere aufeinanderfolgende Durchbruchschmerz-Episoden hinweg mehr als eine Dosis pro Episode benötigt.
Wenn bei einem Patienten mehr als vier Durchbruchschmerz-Episoden pro 24 Stunden auftreten, kann eine Dosisanpassung der Opioid-Basistherapie erforderlich werden.
Wenn intolerable oder persistierende Nebenwirkungen auftreten, sollte die Wirkstärke reduziert oder die Behandlung mit Instanyl durch andere Analgetika ersetzt werden.
Therapiebeendigung
Instanyl sollte sofort abgesetzt werden, wenn der Patient nicht mehr unter DurchbruchschmerzEpisoden leidet. Die Opioid-Basistherapie zur Behandlung der chronischen Schmerzen sollte entsprechend der Verordnung beibehalten werden.
Wenn bei einem Patienten das vollständige Absetzen der Opioid-Therapie erforderlich ist, sollten die Opioide unter engmaschiger ärztlicher Kontrolle schrittweise reduziert werden, um mögliche Entzugserscheinungen zu vermeiden.
Besondere Patientengruppen
Ältere Patienten
Zur Anwendung von Instanyl liegen für Patienten über 65 Jahren nur begrenzte Daten zur Pharmakokinetik, Wirksamkeit und Sicherheit vor. Ältere Patienten können eine reduzierte Clearance, eine verlängerte Halbwertzeit und eine höhere Empfindlichkeit gegenüber Fentanyl aufweisen als jüngere Patienten. Die Behandlung von älteren, kachektischen oder geschwächten Patienten ist daher mit erhöhter Vorsicht vorzunehmen.
In klinischen Studien war die individuell wirksame Dosis für ältere Patienten tendenziell niedriger als für Patienten unter 65 Jahren. Die Einstellung von älteren Patienten auf Instanyl sollte mit besonderer Vorsicht erfolgen.
Eingeschränkte Leberfunktion
Instanyl sollte bei Patienten mit mäßiger bis schwerer Leberfunktionsstörung mit Vorsicht angewendet werden (siehe Abschnitt 4.4).
Eingeschränkte Nierenfunktion
Instanyl sollte bei Patienten mit mäßiger bis schwerer Nierenfunktionsstörung mit Vorsicht angewendet werden (siehe Abschnitt 4.4).
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit von Instanyl bei Kindern und Jugendlichen unter 18 Jahren ist bis jetzt noch nicht erwiesen.
Es liegen keine Daten vor.
Art der Anwendung
Instanyl ist zur nasalen Anwendung bestimmt.
Es wird empfohlen, dass sich der Kopf des Patienten während der Anwendung von Instanyl in einer aufrechten Haltung befindet.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Patienten ohne Opioid-Basistherapie, da ein erhöhtes Risiko für eine Atemdepression besteht. Behandlung akuter Schmerzen, welche keine Durchbruchschmerzen darstellen.
Schwere Atemdepression oder schwere obstruktive Lungenerkrankungen.
Vorausgegangene Strahlentherapie im Gesichtsbereich.
Wiederholte Episoden von Epistaxis (siehe Abschnitt 4.4).
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Atemdepression
Unter Fentanyl kann es zu einer klinisch relevanten Atemdepression kommen. Daher müssen die Patienten auf solche Reaktionen hin beobachtet werden.
Schmerzpatienten, die eine regelmäßige Opioid-Therapie erhalten, entwickeln eine Toleranz gegenüber Atemdepression, daher ist das Risiko einer Atemdepression bei diesen Patienten reduziert. Die gleichzeitige Anwendung von ZNS-dämpfenden Arzneimitteln kann das Risiko einer Atemdepression erhöhen (siehe Abschnitt 4.5).
Chronische Lungenerkrankungen
Bei Patienten mit chronisch obstruktiven Lungenerkrankungen kann Fentanyl häufiger schwere Nebenwirkungen hervorrufen. Bei solchen Patienten können Opioide den Austausch der Atemluft vermindern und den Atemwegswiderstand erhöhen.
Eingeschränkte Nieren- oder Leberfunktion
Fentanyl sollte bei Patienten mit mäßiger bis schwerer Beeinträchtigung der Leber- oder Nierenfunktion mit Vorsicht angewendet werden. Der Einfluss einer eingeschränkten Leber- und Nierenfunktion auf die Pharmakokinetik von Instanyl wurde nicht untersucht. Es konnte jedoch gezeigt werden, dass die Clearance von Fentanyl nach intravenöser Anwendung bei Vorliegen einer beeinträchtigten Leber- und Nierenfunktion aufgrund der Veränderungen von metabolischer Clearance und Plasmaproteinen anders verläuft.
Erhöhter intrakranieller Druck
Fentanyl sollte bei Patienten mit Anzeichen von erhöhtem intrakraniellem Druck, Bewusstseinsstörungen oder Koma mit Vorsicht angewendet werden.
Instanyl sollte bei Patienten mit Hirntumor oder einer Kopfverletzung mit Vorsicht angewendet werden.
Herzerkrankungen
Fentanyl kann eine Bradykardie hervorrufen. Bei der Anwendung von Fentanyl bei Patienten mit früherer oder vorbestehender Bradyarrhythmie ist Vorsicht geboten. Opioide können Hypotonie verursachen, besonders bei Patienten mit Hypovolämie. Daher sollte Instanyl bei Patienten mit Hypotonie und/oder Hypovolämie mit Vorsicht angewendet werden.
Serotonin-Syndrom
Vorsicht ist geboten, wenn Instanyl gleichzeitig mit Arzneimitteln verabreicht wird, die das serotonerge Neurotransmitter-System beeinflussen.
Bei gleichzeitiger Verwendung von serotonergen Arzneimitteln wie selektiven Serotonin-Wiederaufnahme-Hemmern (SSRIs) und
Serotonin-Noradrenalin-Wiederaufnahme-Hemmern (SNRIs) sowie von Arzneimitteln, die den Serotoninstoffwechsel beeinträchtigen [einschließlich Monoaminooxidase (MAO)-Hemmern], kann sich ein möglicherweise lebensbedrohliches Serotonin-Syndrom ausbilden. Dieses kann auch innerhalb der empfohlenen Dosierung auftreten.
Das Serotonin-Syndrom kann Veränderungen der psychischen Verfassung (z. B. Agitiertheit, Halluzinationen, Koma), autonome Instabilität (z. B. Tachykardie, labiler Blutdruck, Hyperthermie), neuromuskuläre Auffälligkeiten (z. B. Hyperreflexie, Koordinationsmangel, Rigidität) und/oder gastrointestinale Symptome (z. B. Übelkeit, Erbrechen, Diarrhö) einschließen.
Bei Verdacht auf ein Serotonin-Syndrom ist die Behandlung mit Instanyl abzubrechen.
Nasale Beschwerden
Wenn der Patient unter der Anwendung von Instanyl unter wiederholten Episoden von Epistaxis oder nasalen Beschwerden leidet, sollte eine alternative Darreichungsform zur Behandlung des Durchbruchschmerzes in Betracht gezogen werden.
Erkältung
Unter der Vorraussetzung, dass zuvor keine Behandlung mit nasalen vasokonstriktorischen Mitteln erfolgt ist, ist die Aufnahme von Fentanyl bei erkälteten Patienten vergleichbar mit der bei gesunden Probanden. Für die gleichzeitige Anwendung von nasalen vasokonstriktorischen Mitteln siehe Abschnitt 4.5.
Missbrauchspotenzial und Abhängigkeit
Unter der wiederholten Anwendung von Opioiden wie Fentanyl kann sich eine Toleranz und physische und/oder psychische Abhängigkeit entwickeln. Allerdings ist eine iatrogen hervorgerufene Sucht infolge Anwendung von Opioiden zur Behandlung von Tumorschmerzen selten.
Entzugserscheinungen
Durch die Anwendung von Substanzen mit opioid-antagonistischer Wirkung, z. B. Naloxon, oder von partiellen Opioid-Agonisten/Antagonisten (z. B. Pentazocin, Butorphanol, Buprenorphin, Nalbuphin) können Entzugserscheinungen ausgelöst werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Verabreichung von Fentanyl zusammen mit einem serotonergen Arzneimittel wie einem selektiven Serotonin-Wiederaufnahme-Hemmer (SSRI), einem Serotonin-Noradrenalin-Wiederaufnahme-Hemmer (SNRI) oder einem Monoaminooxidase (MAO)-Hemmer kann das Risiko für ein möglicherweise lebensbedrohliches Serotonin-Syndrom erhöhen.
Die Anwendung von Instanyl wird bei Patienten, die in den letzten 14 Tagen MonoaminoxidaseHemmer (MAOH) erhalten haben, nicht empfohlen, da für Opioid-Analgetika eine starke und unvorhersehbare Potenzierung der Wirkstärke durch MAO-Hemmer berichtet wurde.
Fentanyl wird hauptsächlich über das humane Cytochrom P450 3A4 Isoenzym-System (CYP3A4) metabolisiert. Daher können potenziell Wechselwirkungen auftreten, wenn Instanyl zusammen mit Arzneimitteln angewendet wird, die die Aktivität von CYP3A4 beeinflussen. Die gleichzeitige Anwendung von Arzneimitteln, die die CYP3A4-Aktivität induzieren, kann die Wirksamkeit von Instanyl herabsetzen. Die gleichzeitige Anwendung von Instanyl mit starken CYP3A4-Inhibitoren (z. B. Ritonavir, Ketoconazol, Itraconazol, Troleandomycin, Clarithromycin und Nelfinavir) oder moderaten CYP3A4-Inhibitoren (z. B. Amprenavir, Aprepitant, Diltiazem, Erythromycin, Fluconazol, Fosamprenavir, und Verapamil) kann erhöhte Plasmakonzentrationen von Fentanyl zur Folge haben, was möglicherweise zu schweren Arzneimittelnebenwirkungen einschließlich einer tödlichen Atemdepression führen kann.
Patienten, die Instanyl zusammen mit moderaten oder starken CYP3A4-Inhibitoren erhalten, sollten über einen längeren Zeitraum sorgfältig überwacht werden. Eine Dosiserhöhung sollte mit Vorsicht vorgenommen werden.
In einer pharmakokinetischen Interaktionsstudie zeigte sich, dass die maximale Plasmakonzentration von nasal angewendetem Fentanyl bei gleichzeitiger Anwendung von Oxymetazolin um ca. 50 % reduziert wurde, während sich die Zeitspanne zur Erreichung von Cmax (Tmax) verdoppelte. Dies kann die Wirksamkeit von Instanyl verringern. Es wird empfohlen, die gleichzeitige Behandlung mit nasal anzuwendenden Arzneimitteln mit abschwellender Wirkung zu vermeiden (siehe Abschnitt 5.2).
Die gleichzeitige Anwendung anderer ZNS-dämpfender Arzneimittel, einschließlich anderer Opioide, Sedativa oder Hypnotika, Allgemeinanästhetika, Phenothiazine, Tranquilizer,
Skelettmuskelrelaxanzien, sedierender Antihistaminika und Alkohol kann zusätzlich sedierende Wirkungen hervorrufen.
Die gleichzeitige Anwendung von partiellen Opioid-Agonisten/Antagonisten (z. B. Buprenorphin, Nalbuphin, Pentazocin) wird nicht empfohlen. Diese weisen eine hohe Affinität zu Opioid-Rezeptoren mit relativ niedriger intrinsischer Aktivität auf. Daher antagonisieren sie die analgetische Wirkung von Fentanyl teilweise und können Entzugserscheinungen bei opioidabhängigen Patienten auslösen.
Die gleichzeitige Anwendung von Instanyl mit anderen nasal verabreichten Arzneimitteln (andere als Oxymetazolin) ist in klinischen Studien nicht untersucht worden. Es wird empfohlen, für die gleichzeitige Behandlung anderer Erkrankungen, die durch nasale Anwendung behandelt werden können, alternative Darreichungsformen in Betracht zu ziehen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Es liegen keine hinreichenden Daten für die Anwendung von Fentanyl bei Schwangeren vor. Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3). Das potenzielle Risiko für den Menschen ist nicht bekannt. Instanyl darf während der Schwangerschaft nicht angewendet werden, es sei denn, dies ist eindeutig erforderlich.
Nach einer Langzeitbehandlung kann Fentanyl beim Neugeborenen Entzugserscheinungen hervorrufen.
Es wird empfohlen, Fentanyl nicht während der Wehen und Geburt (einschließlich Kaiserschnitt) anzuwenden, da Fentanyl die Plazenta passiert und beim Fetus eine Atemdepression hervorrufen kann. Wenn Instanyl dennoch angewendet wird, sollte ein Antidot für das Kind unmittelbar bereitgehalten werden.
Stillzeit
Fentanyl geht in die Muttermilch über und kann beim gestillten Kind eine Sedierung und Atemdepression hervorrufen. Fentanyl soll von stillenden Frauen nicht angewendet werden. Mit dem Stillen soll erst wieder begonnen werden, wenn die letzte Anwendung von Fentanyl mindestens 5 Tage zurückliegt.
Fertilität
Für den Menschen liegen keine Daten bezüglich Fertilität vor. In Tierstudien wurde die männliche und weibliche Fertilität durch sedative Dosen beeinträchtigt (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt. Allerdings ist bekannt, dass Opioid-Analgetika die geistigen und/oder körperlichen Fähigkeiten, die zum Führen von Fahrzeugen oder Bedienen von Maschinen notwendig sind, beeinträchtigen. Die Patienten sollten angewiesen werden, kein Fahrzeug zu führen oder Maschinen zu bedienen, wenn sie an Schläfrigkeit, Schwindel, Sehstörungen oder anderen Nebenwirkungen leiden, die ihre Fähigkeit zum Führen von Fahrzeugen und Bedienen von Maschinen beeinträchtigen können.
4.8 Nebenwirkungen
Zusammenfassung des Sicherheitsprofils
Unter der Anwendung von Instanyl sind die für Opioide typischen Nebenwirkungen zu erwarten. Häufig verschwinden bei fortgesetzter Anwendung des Arzneimittels die meisten dieser Nebenwirkungen oder nehmen an Intensität ab. Die schwerwiegendsten Nebenwirkungen sind Atemdepression (die möglicherweise zu einer Apnoe oder einem Atemstillstand führen kann),
Kreislaufabfall, Hypotonie und Schock. Alle Patienten müssen engmaschig auf diese Nebenwirkungen hin überwacht werden.
Ziel der klinischen Studien zu Instanyl war es, die Sicherheit und Wirksamkeit in der Behandlung von Durchbruchschmerzen zu untersuchen. Dabei erhielten alle Patienten als Basismedikation gegen ihre Dauerschmerzen Opioide wie retardiertes Morphin oder transdermales Fentanyl. Daher ist es nicht möglich, die alleinigen Effekte von Instanyl definitiv abzugrenzen.
Die Nebenwirkungen, für die zumindest ein möglicher Zusammenhang zur Behandlung mit Instanyl im Rahmen der klinischen Studien angenommen wird, sind in der unten stehenden Tabelle aufgeführt.
Tabellarische Liste der Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10); häufig (> 1/100 bis < 1/10); gelegentlich (> 1/1.000 bis < 1/100); selten (> 1/10.000 bis < 1/1.000); sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Innerhalb jeder Häufigkeitsgruppe werden die Nebenwirkungen nach abnehmendem Schweregrad angegeben.
Die folgenden Nebenwirkungen wurden bei der Therapie mit Instanyl und/oder anderen Fentanyl-haltigen Präparaten während klinischer Studien und seit der Markteinführung beobachtet.
|
Systemorganklassen |
Häufig |
Gelegentlich |
Nicht bekannt |
|
Psychiatrische Erkrankungen |
Abhängigkeit, Schlaflosigkeit |
Halluzinationen | |
|
Erkrankungen des Nervensystems |
Somnolenz, Schwindel, Kopfschmerzen |
Sedierung, Myoklonien, Parästhesie, Dysästhesie, Geschmacksstörung |
Konvulsionen |
|
Erkrankungen des Ohrs und des Labyrinths |
Schwindel |
Reisekrankheit | |
|
Herzerkrankungen |
Hypotonie | ||
|
Gefäßerkrankungen |
Flush, Hitzewallungen | ||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Rachenreizung |
Atemdepression, Epistaxis, nasales Ulcus, Rhinorrhö |
Perforation der Nasenscheidewand |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Erbrechen |
Obstipation, Stomatitis, Mundtrockenheit |
Diarrhoe |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Hyperhydrosis |
Hautschmerzen, Pruritus | |
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Pyrexie |
Fatigue, Unwohlsein, periphere Ödeme, Entzugssyndrom* | |
|
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen |
Sturz |
*Bei transmukosalem Fentanyl wurden Opiatentzugserscheinungen wie Übelkeit, Erbrechen, Diarrhoe, Angstzustände, Schüttelfrost, Tremor und Schwitzen beobachtet.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome
Es ist zu erwarten, dass die Symptome einer Fentanyl-Überdosierung eine Verstärkung seiner pharmakologischen Wirkungen darstellen, wie z. B. Lethargie, Koma und schwere Atemdepression. Andere Symptome können Hypothermie, verminderter Muskeltonus, Bradykardie und Hypotonie sein. Anzeichen von Toxizität sind tiefe Sedierung, Ataxie, Miosis, Krämpfe und Atemdepression, die das Hauptsymptom darstellt.
Behandlung
Die Behandlung einer Atemdepression erfordert sofortige Gegenmaßnahmen einschließlich einer physischen oder verbalen Stimulierung des Patienten. Im Anschluss an diese Maßnahmen kann ein Opioid-Antagonist wie z. B. Naloxon verabreicht werden. Eine Atemdepression in Folge einer Überdosierung kann länger anhalten als die Wirkungsdauer des Opioid-Antagonisten. Die Halbwertszeit des Antagonisten kann kurz sein, daher kann eine wiederholte Gabe oder eine kontinuierliche Infusion erforderlich sein. Die Aufhebung der narkotischen Wirkung kann akute Schmerzen und die vermehrte Ausschüttung von Katecholaminen zur Folge haben.
Wenn der klinische Zustand es erfordert, sollte ein Atemwegszugang angelegt und aufrecht erhalten werden, beispielsweise mit einem oropharyngalen oder einem endotrachealen Tubus. Wenn notwendig, sollte Sauerstoff verabreicht und eine assistierte oder kontrollierte Beatmung durchgeführt werden. Eine adäquate Körpertemperatur und eine ausreichende Flüssigkeitszufuhr sollten sichergestellt sein.
Wenn schwere oder anhaltende Hypotonie auftritt, sollte eine Hypovolämie in Betracht gezogen und mit einer geeigneten parenteralen Flüssigkeitstherapie behandelt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Analgetika, Opioide, ATC-Code: N02AB03 Wirkmechanismus
Fentanyl ist ein Opioid-Analgetikum, das als reiner Agonist vorwiegend mit dem p-Opioid-Rezeptor interagiert bei niedriger Affinität zu den S- und K-Opioid-Rezeptoren. Seine primäre therapeutische Wirkung ist die Analgesie. Die sekundären pharmakologischen Wirkungen sind Atemdepression, Bradykardie, Hypothermie, Obstipation, Miosis, physische Abhängigkeit und Euphorie.
Klinische Sicherheit und Wirksamkeit
Die Wirksamkeit und Sicherheit von Instanyl (50, 100 und 200 Mikrogramm) wurde in zwei randomisierten, doppelblinden, cross-over, placebokontrollierten pivotalen Studien an 279 opioid-toleranten erwachsenen Tumorpatienten (Alter zwischen 32 und 86 Jahren) mit
Durchbruchschmerzen untersucht. Die Patienten hatten unter ihrer Opioid-Basistherapie im Durchschnitt 1 - 4 Durchbruchschmerz-Episoden täglich. Die Patienten, die in die zweite pivotale Studie eingeschlossen waren, hatten zuvor bereits an der pharmakokinetischen Studie zu Instanyl oder an der ersten pivotalen Studie teilgenommen.
Die klinischen Studien belegen die Wirksamkeit und Sicherheit von Instanyl. Es konnte keine klare Korrelation zwischen der Höhe der Opioid-Basismedikation und den Instanyl Dosierungen nachgewiesen werden. Allerdings haben in der zweiten pivotalen Studie die Patienten, die eine niedrige Opioid-Basismedikation erhielten, mit einer entsprechend niedrigeren Stärke von Instanyl tendenziell eine wirksamere Schmerzlinderung erreicht als Patienten mit einer höheren OpioidBasismedikation. Das zeigte sich am deutlichsten bei Patienten, die mit 50 Mikrogramm Instanyl ausreichend therapiert waren.
In klinischen Studien mit Tumorpatienten waren die am häufigsten verwendeten Wirkstärken 100 und 200 Mikrogramm.
Alle drei Wirkstärken von Instanyl zeigten nach 10 Minuten eine statistisch signifikant (p < 0,001) höhere Differenz in der Schmerzintensität (PID10) im Vergleich zu Placebo. Außerdem war Instanyl 10, 20, 40 und 60 Minuten nach Applikation dem Placebo hinsichtlich der Linderung von Durchbruchschmerzen signifikant überlegen. Die Ergebnisse der Summe der
Schmerzintensitätsdifferenzen nach 60 Minuten (SPID0-60) zeigten, dass alle Wirkstärken von Instanyl signifikant höhere mittlere SPID0-60-Werte im Vergleich zum Placebo aufwiesen (p < 0,001), was eine bessere Schmerzlinderung durch Instanyl über 60 Minuten im Vergleich zu Placebo zeigt.
Die Sicherheit und Wirksamkeit von Instanyl wurde bei Patienten, die das Arzneimittel beim Auftreten einer Durchbruchschmerz-Episode eingenommen haben, untersucht. Instanyl sollte nicht präventiv angewendet werden.
Die klinische Erfahrung mit Instanyl bei Patienten mit einer Opioid-Basistherapie äquivalent zu > 500 mg/Tag Morphin oder > 200 Mikrogramm/Stunde transdermales Fentanyl ist begrenzt.
Die Anwendung von Instanyl in einer Dosierung über 400 Mikrogramm wurde in klinischen Studien nicht untersucht.
5.2 Pharmakokinetische Eigenschaften
Resorption
Fentanyl ist stark lipophil. Fentanyl weist eine 3-Kompartiment-Verteilungskinetik auf. Tierexperimentelle Daten zeigen, dass Fentanyl nach Resorption schnell in Hirn, Herz, Lungen,
Nieren und Milz verteilt und dann langsam in Muskeln und Fett umverteilt wird. Die Plasmaproteinbindung von Fentanyl beträgt ca. 80 %. Die absolute Bioverfügbarkeit von Instanyl liegt bei 89 %.
Klinische Daten zeigen, dass Fentanyl sehr schnell durch die Nasenschleimhaut resorbiert wird. Nach Applikation von Instanyl in Einzeldosen von 50 bis 200 Mikrogramm Fentanyl pro Dosis wird bei opioidtoleranten Tumorpatienten die maximale Plasmakonzentration (Cmax) von 0,35 bis 1,2 ng/ml schnell erreicht. Die korrelierende mittlere Tmax beträgt 12 - 15 Minuten. In einer Studie zur Untersuchung der Dosisproportionalität wurden jedoch auch höhere Tmax-Werte bei gesunden Probanden beobachtet.
Verteilung
Nach intravenöser Anwendung von Fentanyl beträgt die initiale Verteilungshalbwertszeit ca.
6 Minuten, eine vergleichbare Halbwertszeit wird nach nasaler Applikation von Instanyl beobachtet. Bei Tumorpatienten beträgt die Eliminationshalbwertszeit für Instanyl nach nasaler Anwendung ca.
3 - 4 Stunden.
BiotransformationFentanyl wird hauptsächlich in der Leber über CYP3A4 metabolisiert. Der Hauptmetabolit Norfentanyl ist inaktiv.
Elimination
Etwa 75 % des Fentanyls werden, meist in Form von inaktiven Metaboliten, über den Urin ausgeschieden. Weniger als 10 % werden unverändert als aktive Substanz ausgeschieden. Ungefähr 9 % der Dosis werden primär als Metaboliten in den Fäces gefunden.
Linearität
Fentanyl weist eine lineare Kinetik auf. Dosislinearität von 50 Mikrogramm bis 400 Mikrogramm Instanyl konnte bei gesunden Probanden gezeigt werden.
Eine Interaktionsstudie wurde mit einem nasalen Vasokonstriktor (Oxymetazolin) durchgeführt. Patienten mit allergischer Rhinitis erhielten ein oxymetazolinhaltiges Nasenspray 1 Stunde vor Instanylgabe. Mit und ohne Oxymetazolin wurden vergleichbare Bioverfügbarkeiten (AUC) von Fentanyl erzielt. Nach Anwendung von Oxymetazolin nahm die Cmax von Fentanyl ab und die Tmax stieg um den Faktor 2 an. Unter der Vorraussetzung, dass zuvor keine Behandlung mit nasalen vasokonstriktorischen Mitteln erfolgt ist, ist die Aufnahme von Fentanyl bei Patienten mit allergischer Rhinitis vergleichbar mit der bei gesunden Probanden. Die gleichzeitige Anwendung von nasalen vasokonstriktorischen Mitteln sollte vermieden werden (siehe Abschnitt 4.5).
Bioäquivalenz
Eine pharmakokinetische Studie hat gezeigt, dass Instanyl Einzeldosis- und MehrfachdosisNasenspray bioäquivalent sind.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität und Kanzerogenität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
In einer Studie zur Fertilität und frühen embryonalen Entwicklung an Ratten wurde bei hohen Dosierungen (300 gg/kg/Tag, s.c.) eine Auswirkung auf die männlichen Tiere beobachtet, die konsistent mit der sedierenden Wirkungen von Fentanyl in Tierversuchen ist. Des Weiteren ergaben Studien an weiblichen Ratten eine reduzierte Fertilität und gesteigerte embryonale Mortalität. Neuere Studien zeigten, dass die embryotoxischen Effekte indirekt auf eine maternale Toxizität und nicht auf direkte Effekte der Wirksubstanz auf den sich entwickelnden Embryo zurückzuführen sind. In einer Studie zur prä- und postnatalen Entwicklung wurde die Überlebensrate der Nachkommen bei Dosen, die das mütterliche Gewicht geringfügig herabsetzten, signifikant reduziert. Dieser Effekt könnte entweder auf ein verändertes mütterliches Pflegeverhalten oder einen direkten Effekt von Fentanyl auf die Jungtiere zurückzuführen sein. Wirkungen auf die körperliche Entwicklung und das Verhalten der Nachkommen wurden nicht beobachtet. Teratogene Wirkungen wurden nicht gezeigt.
Studien zur lokalen Verträglichkeit von Instanyl an Minischweinen haben gezeigt, dass die Anwendung von Instanyl gut vertragen wird.
Kanzerogenitätsstudien mit Fentanyl ergaben keine Hinweise auf ein krebsauslösendes Potential (26-wöchiger alternativer Haut-Bioassay an transgenen Tg.AC Mäusen; 2-jährige Studie an Ratten mit subkutaner Applikation). Bei der Untersuchung von Hirnschnitten aus der Kanzerogenitätsstudie an Ratten wurden bei Tieren, die hohe Dosen Fentanylcitrat erhalten hatten, Hirnläsionen festgestellt. Die Bedeutung dieser Befunde für den Menschen ist nicht bekannt.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Natriumdihydrogenphosphat-Dihydrat
Natriummonohydrogenphosphat-Dihydrat (Ph. Eur.)
Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Instanyl 50 Mikrogramm 23 Monate
Instanyl 100 und 200 Mikrogramm 42 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30 °C lagern.
6.5 Art und Inhalt des Behältnisses
Einzeldosisbehältnis bestehend aus einer Durchstechflasche (klares Glas Typ 1), integriert in ein Polypropylen-Spraybehältnis, verpackt in einer kindergesicherten Blisterpackung.
Instanyl 50 Mikrogramm/Dosis: orangene Etikettierung Instanyl 100 Mikrogramm/Dosis: violette Etikettierung Instanyl 200 Mikrogramm/Dosis: grün-blaue Etikettierung
Packungsgrößen: 2, 6, 8 and 10 Einzeldosisbehältnisse
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Jedes Einzeldosisbehältnis enthält nur eine Dosis. Das Einzeldosisbehältnis darf vor dem Gebrauch nicht getestet werden.
Wegen des möglichen Missbrauchs von Fentanyl müssen nicht verwendete Einzeldosisbehältnisse systematisch und auf geeignete Weise in der kindergesicherten Blisterpackung entsprechend den nationalen Anforderungen beseitigt oder in der Apotheke zurückgegeben werden.
7. INHABER DER ZULASSUNG
Takeda Pharma A/S Dybendal Alle 10 2630 Taastrup Dänemark
8. ZULASSUNGSNUMMER(N)
EU/1/09/531/010-013
EU/1/09/531/014-017
EU/1/09/531/018-021
Instanyl 50 Mikrogramm Instanyl 100 Mikrogramm Instanyl 200 Mikrogramm
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 20. Juli 2009
Datum der letzten Verlängerung der Zulassung: 23. April 2014
10. STAND DER INFORMATION
März 2015
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig Betäubungsmittel
KONTAKTADRESSE IN DEUTSCHLAND
Takeda GmbH Byk-Gulden-Str. 2 78467 Konstanz Telefon: 0800 8253325 Telefax: 0800 8253329 E-Mail: medinfo@takeda.de
Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu verfügbar.