Ipratropiumbromid 125 Mikrogramm / 1 Ml Stulln
Fachinformation
1. Bezeichnung des Arzneimittels
®
Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln , Lösung für einen Vernebler
2. Qualitative und quantitative Zusammensetzung
Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln ® :
1 ml Lösung für einen Vernebler enthält 125 Mikrogramm (= 0,125 mg) wasserfreies Ipratropiumbromid.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform Lösung für einen Vernebler
Klare, farblose Lösung mit einem pH-Wert von 3,0 - 4,0 und einer Osmolalität von 270 - 330 mOsm/kg.
4. Klinische Angaben
4.1 Anwendungsgebiete
Zur Verhütung und Behandlung von Atemnot bei
• chronisch obstruktiver Lungenerkrankung (COPD)
• leichtem bis mittelschwerem Asthma bronchiale im Erwachsenen- und Kindesalter als Ergänzung zu b2-Mimetika im akuten Asthmaanfall.
4.2 Dosierung, Art und Dauer der Anwendung Zur Inhalation mit einem Vernebler
Diese Lösung ist gebrauchsfertig, d. h. eine Verdünnung ist nicht erforderlich. Die Lösung in den Einzeldosisbehältnissen ist ausschließlich zum Inhalieren mit geeigneten Inhalationsgeräten bestimmt und darf nicht eingenommen oder parenteral angewendet werden. Die Anwendung sollte möglichst im Sitzen oder Stehen erfolgen. Erläuterung zur Handhabung siehe unter Art der Anwendung.
Ipratropiumbromid Stulln® sollte verwendet werden, wenn die optimale Dosis dem gesamten Inhalt eines 1 ml Einzeldosisbehältnisses entspricht.
Dosierung
Die Dosierung sollte den persönlichen Bedürfnissen des Patienten angepasst werden. Folgende Dosierungen werden empfohlen:
Erwachsene und Jugendliche über 12 Jahre:
Die empfohlene Dosis für die Behandlung einer akuten Blockade der Atemwege beträgt 500 Mikrogramm Ipratropiumbromid (entsprechend 2 Einzeldosisbehält-nisse mit 125 Mikrogramm/1 ml mit einem Füllvolumen von 2,0 ml); die Anwendung erfolgt solange, bis sich der Zustand des Patienten stabilisiert hat. Der Abstand zwischen zwei Dosen wird von Ihrem Arzt festgelegt.
Zur Behandlung akuter Bronchospasmen können wiederholte Gaben bis zur Besserung der Atemnot verabreicht werden. Der zeitliche Abstand zwischen den Dosen muss vom Arzt festgelegt werden.
Kinder von 6 bis 12 Jahren:
Die inhalative Einzeldosis liegt bei 250 Mikrogramm Ipratropiumbromid (entsprechend 1 Einzeldosisbehältnissen). Zur Behandlung akuter Bronchospasmen können wiederholte Gaben bis zur Besserung der Atemnot verabreicht werden. Der zeitliche Abstand zwischen den Dosen muss vom Arzt festgelegt werden.
Kinder unter 6 Jahren
Da für die Anwendung dieses Arzneimittels bei Kindern nur begrenzte Informationen vorliegen, sollte die folgende Dosierung nur unter regelmäßiger medizinischer Überwachung gegeben werden:
Die inhalative Einzeldosis liegt bei 125 - 250 Mikrogramm Ipratropiumbromid (entsprechend % Einzeldosisbehältnis mit einem Füllvolumen von 2,0ml bzw. entsprechend 1 Einzeldosisbehältnis mit einem Füllvolumen von 2,0ml) bis zu einer täglichen Gesamtdosis von 1 mg (entsprechend 4 Einzeldosisbehältnisse mit 125 Mikrogramm/1 ml mit einem Füllvolumen von 2,0 ml), welche nur zur Behandlung eines plötzlich auftretenden Asthmaanfalls gegeben werden sollte..
Zur Behandlung akuter Bronchospasmen können wiederholte Gaben, jedoch nicht öfter als alle 6 Stunden, bis zur Besserung der Atemnot verabreicht werden. Der zeitliche Abstand zwischen den Dosen muss vom Arzt festgelegt werden
Zur Dauerbehandlung
Erwachsene und Jugendliche über 12 Jahre
Die empfohlene Dosis beträgt 250 - 500 Mikrogramm Ipratropiumbromid (entsprechend 1 Einzeldosisbehältnis mit 125 Mikrogramm/1 ml mit einem Füllvolumen von 2,0 ml bis 2 Einzeldosisbehältnis mit 125 Mikrogramm/1ml mit einem Füllvolumen von 2,0 ml) 3-4-mal täglich.
Tagesdosen über 2 mg (4 x 500 Mikrogramm) Ipratropiumbromid sollten nur unter ärztlicher Kontrolle gegeben werden.
Für höhere Dosierungen steht Ipratropiumbromid 250 Mikrogramm / 1 ml Stulln® mit einem Füllvolumen von 1,0 und 2,0 ml zur Verfügung.
Kinder von 6 bis 12 Jahren
Da für die Anwendung dieses Arzneimittels bei Kindern nur begrenzte Informationen vorliegen, sollte die folgende Dosierung nur unter regelmäßiger medizinischer Überwachung gegeben werden:
Die inhalative Einzeldosis liegt bei 125 - 250 Mikrogramm (d.h. der Inhalt eines % Einzeldosisbehältnisses mit 125 Mikrogramm/1 ml mit einem Füllvolumen von 2,0 ml bis ein Einzeldosisbehältnis mit 125 Mikrogramm/1 ml mit einem Füllvolumen von 2,0 ml) 3-4-mal täglich. Bei Kindern unter 5 Jahren sollte Ipratropiumbromid Stulln® nicht öfter als alle 6 Stunden angewendet werden.
Hinweis
Die empfohlene Tagesdosis darf weder in der Akut- noch in der Erhaltungstherapie überschritten werden. Tagesdosen von mehr als 2 mg (8 Einzeldosisbehältnisse) bei Erwachsenen und Jugendlichen über 12 Jahre und von mehr als 1 mg (4 Einzeldosisbehältnisse) bei Kindern unter 12 Jahren sollten nur unter regelmäßiger medizinischer Überwachung angewendet werden.
Wichtiger Hinweis
Der Patient sollte während der Behandlung medizinisch überwacht werden. Kommt es trotz der verordneten Therapie zu keiner befriedigenden Besserung oder gar zu einer Verschlechterung des Leidens, ist ärztliche Beratung erforderlich, um die Therapie ggf. unter Hinzuziehung anderer Arzneimittel (Kortikoide, ß2-Sympathikomimetika, Theophyllin) neu festzulegen.
Im Fall einer akuten oder sich rasch verschlechternden Dyspnoe (Atemnot) ist sofort ein Arzt aufzusuchen.
Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® kann mit Düsen-, Ultraschall- oder Kompressorverneblern verabreicht werden (die optimale Fließgeschwindigkeit beträgt 6 - 8 Liter pro Minute). Die abgegebenen Dosen können je nach Verneblersystem unterschiedlich sein.
Die Lösung in den Einzeldosisbehältnissen ist gebrauchsfertig, d.h. eine Verdünnung ist nicht erforderlich. Die Lösung kann sowohl unverdünnt als auch verdünnt mit physiologischer Kochsalzlösung inhaliert werden. Die Menge an physiologischer Kochsalzlösung hängt vom Vernebler ab. Ipratropium Stulln® ist ausschließlich zum Inhalieren bestimmt und darf nicht eingenommen oder parenteral angewendet werden.
Wenn die erforderliche Menge für eine Einzeldosis der Abfüllgröße von Ipratropium Stulln® entspricht, kann jeweils der gesamte Inhalt des entsprechenden Einzeldosisbehältnisses inhaliert werden. Vorgehensweise:
1. Bereiten Sie den Vernebler entsprechend der Bedienungsanleitung gebrauchsfertig vor.
2. Entnehmen Sie den 5-er Streifen bestehend aus 5 Einzeldosisbehältnissen durch Aufreissen des Aluminiumbeutels
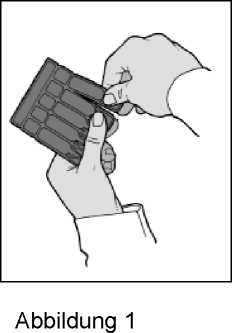
3. Trennen Sie ein Einzeldosisbehältnis vom Einzeldosisbehältnisstreifen ab (Abbildung 1).
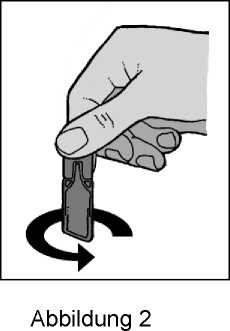
4. Öffnen Sie das Einzeldosisbehältnis durch Abdrehen des Verschlusses (Abbildung 2).
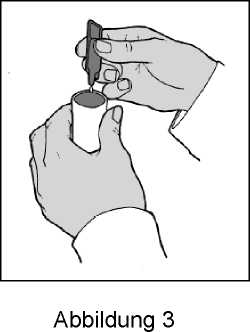
5. Befüllen Sie den Behälter des Verneblers (Abbildung 3).
6. Geben Sie gegebenenfalls physiologische Kochsalzlösung zu (geräteabhängig).
7. Setzen Sie den Vernebler entsprechend der Bedienungsanleitung wieder zusammen. Die Inhalation einer ganzen Dosis dauert für gewöhnlich zwischen 5 und 15 Minuten.
8. Verwerfen Sie nach der Anwendung die restliche Flüssigkeit im Behälter und reinigen sie den Vernebler entsprechend der Bedienungsanleitung .
Da die Einzeldosen keine Konservierungsstoffe enthalten, ist es wichtig, dass der Inhalt sofort nach dem Öffnen verbraucht und für jede Anwendung ein neues Einzeldosisbehältnis benutzt wird, um eine mikrobielle Kontamination zu vermeiden. Offene oder beschädigte Einzelbehältnisse müssen entsorgt werden (siehe Abschnitt 6.6).
Es muss sorgfältig darauf geachtet werden, dass die Lösung oder der Inhalationsnebel nicht in die Augen gelangt. Die vernebelte Lösung sollte durch ein Mundstück inhaliert werden. Wenn kein Mundstück verfügbar ist und eine Verneblungsmaske verwendet wird,muss auf deren korrekten Sitz geachtet werden. Patienten mit Neigung zu Glaukom sollen besonders darauf achten, dass ihre Augen während der Inhalation geschützt sind.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff Ipratropiumbromid, Atropin oder Atropinderivate oder einen der sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Anwendung bei Kindern Siehe Abschnitt 4.2
Verschlimmert sich die Atemnot während der Inhalation akut (paradoxe Bronchospastik), so muss die Behandlung sofort abgesetzt werden und der Behandlungsplan überprüft werden
Ipratropium sollte nicht für die Initialtherapie von akuten bronchospastischen Ereignissen verwendet werden, wenn ein schnelles Ansprechen erforderlich ist.
Ophthalmologische Komplikationen
In seltenen Fällen wurde über ophthalmologische Komplikationen (z.B. Mydriasis, Anstieg des Augeninnendrucks, Engwinkelglaukom und Augenschmerzen) berichtet, wenn Ipratropiumbromid als Aerosol alleine oder zusammen mit einem Beta2-
Sympathomimetikum in die Augen geriet.
Schmerzen in den Augen oder Schmerzhaftigkeit der Augen, unscharfes Sehen, die Wahrnehmung farbiger Ringe oder Abbilder in Kombination mit geröteten Augen durch Konjunktivitis oder Hornhautkongestion können Symptome eines akuten Engwinkelglaukoms sein. Wenn eines oder mehrere dieser Symptome auftreten, muss unverzüglich eine Behandlung mit pupillenverengenden Augentropfen begonnen und fachärztlicher Rat eingeholt werden.
Die Patienten sollten daher klare Anweisungen für die korrekte Anwendung von Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® erhalten. Es muss darauf geachtet werden, dass die Flüssigkeit oder der Sprühnebel nicht in die Augen gelangt. Die Anwendung der Inhalationsflüssigkeit durch ein Mundstück wird empfohlen. Falls kein Mundstück vorhanden ist und eine Verneblermaske benutzt wird, sollte diese richtig sitzen. Insbesondere Patienten mit einem erhöhten Glaukom-Risiko sollten angewiesen werden, ihre Augen zu schützen.
Zusätzliche Information
Besondere Vorsicht ist geboten, wenn Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® bei Patienten mit einer Prädisposition für Engwinkelglaukom, Prostatahyperplasie, Blasenauslass-obstruktion und Darmobstruktion angewendet wird.
Bei Patienten mit zystischer Fibrose besteht möglicherweise eine erhöhte Neigung zu gastrointestinalen Motilitätsstörungen.
Nach der Anwendung von Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® können plötzliche allergische Reaktionen, z.B. vereinzelte Fälle von Urtikaria, Angioödem, Hautausschlag, Broncho-spasmus und oropharyngeales Ödem auftreten.
Bei Patienten mit Herzerkrankungen ist Vorsicht geboten.
Wenn zur Kontrolle der Symptome einer Bronchokonstriktion (oder eines Bronchospasmus) höhere Dosen als die empfohlenen gegeben werden müssen, sollte der Therapieplan des Patienten überprüft werden.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Beta2-Sympathomimetika und Xanthinderivate (z.B. Theophyllin) können die bronchodilatatorischen Eigenschaften von Ipratropiumbromid erhöhen.
Nebenwirkungen anderer Anticholinergika könnten verstärkt werden.
Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® darf NICHT zusammen mit anderen Lösungen für einen Vernebler im selben Vernebler angewendet werden (siehe Abschnitt 6.2.).
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Für Ipratropiumbromid liegen keine klinischen Daten über eine Exposition während der Schwangerschaft vor.
Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Auswirkungen auf Schwangerschaft, embryonale/fetale Entwicklung, Geburt oder postnatale Entwicklung schließen.
Das potentielle Risiko für den Menschen ist nicht bekannt. Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® sollte daher nur bei eindeutiger Indikationsstellung angewendet werden.
Stillzeit
Es ist nicht bekannt, in welchem Ausmaß Ipratropiumbromid beim Menschen in die Muttermilch ausgeschieden wird. Aufgrund seiner pharmakokinetischen Eigenschaften ist es unwahrscheinlich, dass ein großer Anteil in die Muttermilch ausgeschieden wird. Die Anwendung von Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® in der Stillzeit ist zulässig, jedoch sollte Ipratropiumbromid 125 Mikrogramm / 1 ml Stulln® bei stillenden Müttern mit Vorsicht gegeben werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Ipratropiumbromid hat geringen Einfluss auf die Verkehrstüchtigkeit und das Bedienen von Maschinen. Beim Führen von Kraftfahrzeugen oder Bedienen von Maschinen sollte berücksichtigt werden, dass gelegentlich Schwindel auftreten kann.
4.8 Nebenwirkungen
Die Nebenwirkungen sind in nachstehender Tabelle aufgelistet, geordnet nach Organsystem und Häufigkeit gemäß der MedDRA-Definition.
Folgende Häufigkeiten werden zugrunde gelegt: Sehr häufig (>1/10), häufig (>1/100, <1/10), gelegentlich (>1/1.000, <1/100), selten (>1/10.000, <1/1.000), sehr selten (<1/10.000), nicht bekannt (auf Grundlage der verfügbaren Daten nicht abschätzbar).
|
Häufigkeit |
Systemorganklasse |
Symptome |
|
Häufig (> 1/100, < 1/10) |
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Husten, lokale Reizungen |
|
Erkrankungen des Gastrointestinaltrakts |
Mundtrockenheit, Geschmacksstörung, gastrointestinale Motilitätsstörungen, Übelkeit | |
|
Erkrankung des Nervensystems |
Kopfschmerzen, Schwindel | |
|
Herzerkrankungen |
Tachykardie, Palpitationen | |
|
Augenerkrankungen |
Engwinkelglaukom, verschwommenes Sehen, Mydriasis, Anstieg des Augeninnendrucks ggf. mit Augenschmerzen, sehen von Regenbogenfarben (-ringen), Bindehauthyperämie und Hornhautödem | |
|
Gelegentlich |
Erkrankungen des Gastrointestinaltrakts |
Verstopfung, Durchfall, Bauchschmerzen, Erbrechen, Stomatisis, Mund-Ödem |
|
(> 1/1.000, < 1/100) |
Erkrankungen der Haut und des Unterhautzellgewebes |
Hautausschlag, Pruritus, Angioödem |
|
Erkrankungen des Immunsystems |
anaphylaktische Reaktionen, Überempfindlichkeit | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Laryngospasmus, (paradoxer) Bronchospasmus, Rachenödem, trockener Rachen | |
|
Erkrankungen der Nieren und Harnwege |
Harnretention | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Allergische Reaktionen | |
|
Herzerkrankungen |
atriale Fibrillationen (Vorhofflimmern) | |
|
Augenerkrankungen |
Akkomodationsstörungen | |
|
Selten |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
(> 1/10.000, < 1/1.000) |
Erkrankungen des Gastrointestinaltrakts | |
|
Erkrankungen der Nieren und Harnwege | ||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Urtikaria |
|
Erkrankungen des Nervensystems | ||
|
Sehr selten |
Erkrankungen der Atemwege, des Brustraums und Mediastinums | |
|
(<1/10)000) |
Erkrankungen des Gastrointestinaltrakts |
Darmobstruktion |
|
Erkrankungen des Immunsystems |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Nach Überdosierung sind keine spezifischen Symptome beobachtet worden. In Anbetracht der großen therapeutischen Breite und der lokalen Anwendung sind bei einer Überdosierung von Ipratropiumbromid keine schwerwiegenden anticholinergen Symptome zu erwarten. Geringfügige systemische Manifestationen einer anticholinergen Wirkung wie Mundtrockenheit, Akkomodationsstörungen und Tachykardie können auftreten. Eine schwere Überdosierung ist durch Intoxikationssymptome gekennzeichnet, die jenen von Atropin ähneln, wie Tachykardie, Tachypnoe, hohes Fieber und ZNS-Effekte wie Unruhe, Verwirrtheit und Halluzinationen. Diese Symptome sollten symptomatisch behandelt werden. Bei unzulänglicher Atmung ist eine künstliche Beatmung erforderlich. Die Gabe von Physostigmin ist für gewöhnlich nicht empfehlenswert, da kardiotoxische Effekte und Konvulsionen verursacht werden können. Eine Anwendung darf nur erfolgen, wenn eine EKG-Überwachung durchgeführt wird und eine Beatmungsmöglichkeit zur Verfügung steht.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Mittel bei obstruktiven Atemwegserkrankungen, inhalativ, Anticholinergika
ATC-Code: R03BB01
Anticholinergika verhindern eine Erhöhung der intrazellulären Konzentration von zyklischem Guanosinmonophosphat (zyklisches GMP), die durch die Wechselwirkung von Acetylcholin mit den Muskarinrezeptoren der glatten Bronchialmuskulatur verursacht wird.
Die Erweiterung der Bronchien nach der Inhalation von Ipratropiumbromid ist ein ortsgebundener und lokaler und kein systemischer Effekt.
In einer kontrollierten 90-tägigen Studie an Patienten mit Bronchospasmen in Zusammenhang mit chronisch obstruktiver Lungenerkrankung (chronische Bronchitis und Emphysem) verbesserte sich die Lungenfunktion innerhalb von 15 Minuten beträchtlich
(Anstieg von FEV1 und FEF25-75% um mindestens 15%); Spitzenwerte wurden innerhalb von 1 bis 2 Stunden erreicht, die Wirkung hielt bis zu maximal 6 Stunden an.
Aufgrund der Ergebnisse präklinischer und klinischer Studien scheint Ipratropiumbromid keine Wirkung auf die Schleimhautsekretion, die mukoziliäre Clearance oder den Gasaustausch auszuüben.
Die bronchodilatatorische Wirkung von Ipratropiumbromid auf akuten Bronchospasmus bei Asthma wurde in Studien mit Erwachsenen beobachtet. In den meisten dieser Studien wurde Ipratropiumbromid in Kombination mit inhalativen Beta2-Sympathomimetika gegeben.
5.2 Pharmakokinetische Eigenschaften
Nach der Inhalation wird der Wirkstoff sehr rasch absorbiert. Die maximale Plasmakonzentration wird 10-20 Minuten nach der Inhalation erreicht. Die geschätzte Bioverfügbarkeit beträgt 7% der Dosis.
Die pharmakokinetischen Parameter für den Wirkstoff wurden auf Basis der Plasmaspiegel nach intravenöser Verabreichung berechnet. Die Plasmaspiegel von Ipratropiumbromid sanken schnell ab und zeigten einen biphasischen Verlauf. Die Halbwertszeit der terminalen Eliminationsphase betrug etwa 3,6 Stunden. Die mit Radiomarkierung ermittelte Eliminationshalbwertszeit des Arzneimittels und der Metaboliten betrug 1,6 Stunden. Die wichtigsten im Urin gefundenen Metaboliten werden nur in geringem Ausmaß an Muskarinrezeptoren gebunden. Die Gesamtclearance des Wirkstoffs beträgt 2,3 l/Minute. Die Clearance erfolgt zu etwa 40% renal (0,9 l/min) und zu 60% nicht-renal, d.h. hauptsächlich über die Leber. Das Distributionsvolumen (Vz) beträgt 338 l (entspricht +4,6 l/kg).
Nach intravenöser Verabreichung werden 46% der Dosis über die Nieren ausgeschieden, nach oraler Inhalation sind es 3%.
Die Plasmabindung von Ipratropiumbromid ist gering (weniger als 20%). Wie aufgrund der quaternären Ammoniumstruktur des Moleküls erwartet, passiert das Ipratropium-Ion die Blut-Hirn-Schranke nicht.
5.3 Präklinische Daten zur Sicherheit
Präklinische Effekte wurden nur nach Expositionen beobachtet, die ausreichend über der maximalen humantherapeutischen Exposition lagen. Die Relevanz für den Menschen wird als gering bewertet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid
Salzsäure (10 % ) zur pH-Einstellung Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Ipratropiumbromid Stulln® sollte NICHT zusammen mit anderen zum Vernebeln bestimmten Lösungen, die das Konservierungsmittel Benzalkoniumchlorid enthalten, in dem selben Vernebler gemischt werden. Es können sich Ausfällungen bilden.
6.3 Dauer der Haltbarkeit
2 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die Einzeldosisbehältnisse in der Originalverpackung aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht kühlen oder einfrieren.
Verwenden Sie den Inhalt eines Einzeldosisbehältnisses sofort nach dem Öffnen. Verwenden Sie nie ein Einzeldosisbehältnis, das bereits geöffnet war oder die eine verfärbte oder trübe Lösung enthält. Entsorgen Sie jedes teilweise verwendete, geöffnete oder beschädigte Einzeldosisbehältnis.
6.5 Art und Inhalt des Behältnisses
Ipratropiumbromid 125 Mikrogramm / 1 ml Lösung Stulln®, für einen Vernebler:
20 Einzeldosisbehältnisse mit je 2,0 ml Lösung für einen Vernebler 50 Einzeldosisbehältnisse mit je 2,0 ml Lösung für einen Vernebler 100 Einzeldosisbehältnisse mit je 2,0 ml Lösung für einen Vernebler
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Sobald eine Inhalation beendet ist, sollte die Lösung, die noch im Vernebler verblieben ist, verworfen werden und der Vernebler entsprechend den Anweisungen des Herstellers gereinigt werden.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu entsorgen.
7. Inhaber der Zulassung
Penta Arzneimittel GmbH Werksstrasse 3 92551 Stulln
Telefon +49 9435 30 71 38 Telefax +49 9435 30 71 39
8. Zulassungsnummer(n)
82005.00.00
9. Datum der Erteilung der Zulassung
17.07.2014
10. Stand der Information
11/2016
11. Verkaufsabgrenzung
Verschreibungspflichtig
Seite 10 von 10