Isicom 250 Mg/25 Mg
Wortlaut der für die Fachinformation vorgesehenen Angaben
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
isicom® 100 mg/25 mg isicom® 250 mg/25 mg Tabletten
Wirkstoffe: Levodopa und Carbidopa
2. Qualitative und quantitative Zusammensetzung
1 Tablette isicom® 100 mg/25 mg enhält 100 mg Levodopa und 26,99 mg Car-bidopa-Monohydrat entspr. 25 mg Carbidopa.
1 Tablette isicom® 250 mg/25 mg enhält 250 mg Levodopa und 26,99 mg Carbidopa-Monohydrat entspr. 25 mg Carbidopa.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Tabletten
isicom® 100 mg/25 mg
Weiße, quadratische Tablette mit abgerundeten Ecken und Randkerben. Oberseite flach mit abgeschrägten Kanten und Kreuzbruchkerbe, Unterseite gewölbt mit der Prägung “lcd 100”. Die Tablette kann in gleiche Teile gebrochen werden.
isicom® 250 mg/25 mg
Weiße, quadratische Tablette mit abgerundeten Ecken und Randkerben. Oberseite flach mit abgeschrägten Kanten und Kreuzbruchkerbe, Unterseite gewölbt mit der Prägung “lcd 250”. Die Tablette kann in gleiche Teile gebrochen werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
Dieses Arzneimittel ist ein Antiparkinsonmittel (Dopamin-Vorstufe mit Decarboxylasehemmer).
isicom® wird eingenommen zur Behandlung von Parkinson-Syndromen.
Hinweis isicom® ist nicht indiziert bei medikamentös induziertem Parkinson-Syndrom.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung
Die Dosierung richtet sich nach der Schwere der extrapyramidalen Symptomatik und der Verträglichkeit im Einzelfall. Hohe Einzeldosen sollten vermieden werden. Die Behandlung wird mit langsam ansteigender Dosierung durchgeführt.
Die Behandlung muss langsam einschleichend erfolgen, um das Ausmaß der Nebenwirkungen gering zu halten und einen möglichen Behandlungserfolg nicht zu gefährden.
isicom® 100 mg/25 mg
Tabletten 100 mg Levodopa und 25 mg Carbidopa
Bei bisher unbehandelten Patienten wird mit einer Tagesdosis von einer halben bis 1% Tabletten isicom® 100 mg/25 mg (50 bis 150 mg Levodopa in Kombination mit 12,5 bis
37.5 mg Carbidopa) begonnen.
Eine Dosissteigerung kann um eine Tablette isicom® 100 mg/25 mg (100 mg Levodopa und 25 mg Carbidopa) jeden 3. bis 7. Tag vorgenommen werden.
Tagesdosen von täglich bis zu 7 Tabletten isicom® 100 mg/25 mg (700 mg Levodopa und 175 mg Carbidopa) sollen in der Regel nicht überschritten werden.
isicom® 250 mg/25 mg
Tabletten 250 mg Levodopa und 25 mg Carbidopa
Bei bisher unbehandelten Patienten wird mit einer Tagesdosis von einer halben oder einer Tablette isicom® 250 mg/25 mg (125 bis 250 mg Levodopa in Kombination mit
12.5 bis 25 mg Carbidopa) begonnen.
Eine Dosissteigerung kann um eine halbe Tablette isicom® 250 mg/25 mg (125 mg Levodopa und 12,5 mg Carbidopa) jeden 3. bis 7. Tag vorgenommen werden.
Tagesdosen von täglich bis zu 4 Tabletten isicom® 250 mg/25 mg (1000 mg Levodopa und 100 mg Carbidopa) sollen in der Regel nicht überschritten werden.
Bei Nebenwirkungen wird die Dosissteigerung zunächst unterbrochen oder die Dosis vorübergehend gesenkt und die weitere Erhöhung langsamer vorgenommen. Bei stärkeren gastrointestinalen Beschwerden können Antiemetika wie Domperidon verabreicht werden.
Bei der Umstellung von einem reinen Levodopa-Präparat ist zu berücksichtigen, dass zur Erreichung vergleichbarer klinischer Effekte mit der Kombination Levodopa und Carbidopa nur etwa 20 % der bisherigen Levodopa-Dosis benötigt werden. Ein medikationsfreies Intervall von 12 Stunden ist einzuhalten.
Art und Dauer der Anwendung
isicom® 100 mg/25 mg/isicom® 250 mg/25 mg besitzen eine Kreuzkerbe und sind teilbar.
Die Tabletten werden am besten 30 Minuten vor oder 90 Minuten nach den Mahlzeiten unzerkaut mit einem Glas Wasser geschluckt. Anschließend etwas Gebäck essen. Vor der Einnahme sind große eiweißreiche Mahlzeiten zu vermeiden.
Alternativ, z.B. bei Schluckschwierigkeiten, kann man die Tabletten in einem Glas mit Wasser zerfallen lassen (Suspendieren), rührt mit einem Teelöffel die Suspension um und nimmt sie sofort ein.
Hinweis: Die Suspension ist sondengängig. Sollte diese Form der Einnahme nötig sein, so ist die Suspension unmittelbar vor der Verabreichung herzustellen und nach Verabreichung die Sonde gut nachzuspülen.
isicom® wird in der Regel über einen längeren Zeitraum eingenommen (Substitutionstherapie). Die Anwendung ist bei guter Verträglichkeit nicht begrenzt.
4.3 Gegenanzeigen
isicom® darf nicht gegeben werden
- bei bekannter Überempfindlichkeit gegenüber Levodopa oder Carbidopa oder sonstigen Bestandteilen der Arzneimittel (s. Abschnitt 6.1)
- Jugendlichen unter 18 Jahren, da über diese keine ausreichende klinisch-therapeutische Erfahrung vorliegt.
isicom® sollte nicht gegeben werden bei
- ausgeprägter Schilddrüsenüberfunktion, Tachykardie oder Phäochromozytom
- schweren Herz-, Leber-, Nieren- oder Bronchialerkrankungen
- schweren Störungen des hämopoetischen Systems
- - endogenen und exogenen Psychosen
- allen Krankheitszuständen, bei denen Sympathomimetika kontraindiziert sind
- Medikation mit nichtselektiven MAO-A-Hemmern (s. Abschnitt 4.5 "Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen")
- Engwinkelglaukom.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Nach langjähriger Behandlung mit Präparaten, die , wie isicom® 100 mg/25 mg/isicom® 250 mg/25 mg, Levodopa enthalten, kann ein plötzliches Absetzen zu einem malignen Levodopa-Entzugssymdrom (mit Hyperpyrexie, Muskelrigidität, ggf. psychischen Auffälligkeiten und einem Anstieg der Serumkreatin-Phosphokinase) oder einer akinetischen Krise führen. Beide Zustände sind lebensbedrohend. Aus therapeutischen Gründen indizierte Levodopa-Pausen dürfen daher nur in der Klinik durchgeführt werden.
Impulskontrollstörungen
Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten und / oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich isicom, behandelt werden, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen auftreten können, einschließlich pathologischer Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang. Die Überprüfung der Behandlung wird empfohlen, wenn solche Symptome auftreten.
Sonstige Hinweise
Die Ausscheidung der wirksamen Bestandteile von isicom® 100 mg/25 mg und isicom® 250 mg/25 mg mit dem Urin, Speichel und Schweiß kann Flecken in der Kleidung verursachen, die nach dem Antrocknen nicht mehr entfernt werden können, weshalb die Flecken in frischem Zustand ausgewaschen werden sollten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Patienten sollten vor der Behandlung mit isicom® befragt werden, welche anderen Arzneimittel - auch freiverkäufliche - von ihnen angewendet werden.
Die Wirkung von isicom® wird eingeschränkt durch Opioide, reserpinhaltige Antihypertensiva, Phenytoin, Papaverin und Neuroleptika.
Bei gleichzeitiger Gabe von Hemmstoffen der Monoaminooxydase A, wie z. B. Tranylcypromin, kann es - unter Umständen bis zu 2 Wochen nach Absetzen des MAO-Hemmstoffs - zu hypertensiven Krisen kommen. Die Gabe eines reinen MAO-B-Hemmers (Selegilin, bis 10 mg/Tag) kann die Antiparkinson-Wirkung des Levodopa verstärken, ohne gefährliche Interaktionen auszulösen.
Die gleichzeitige Einnahme von isicom® und Sympathomimetika kann deren Wirkung verstärken und eine Dosisreduktion der Sympathomimetika erfordern.
Es ist möglich, isicom® mit allen anderen Antiparkinsonmitteln zu kombinieren, wobei eine Dosisverminderung von isicom® oder der anderen Substanzen notwendig werden kann.
Die Wirkung von isicom® wird durch niedrige Dosen Vitamin B6 nicht beeinträchtigt.
Die gleichzeitige Einnahme einer proteinreichen Mahlzeit oder von Eisensulfat-haltigen Arzneimitteln kann zu einer geringeren Aufnahme von isicom® im Magen-Darm-Trakt führen.
Es können verschiedene labordiagnostische Messungen gestört sein:
- Bestimmung von Katecholaminen, Kreatinin, Harnsäure, Glukose, alkalischer Phosphatase, SGOT, SGPT, LDH und Bilirubin
- falsch-positiver Ketonnachweis bei Verwendung von Teststreifen (durch Kochen der Urinprobe wird diese Reaktion nicht verändert)
- falsch-negativer Harnzuckernachweis bei Verwendung der Glukose-Oxidase-Methode
- falsch-positiver Coombs-Test (zu einer hämolytischen Anämie kam es dabei nur äußerst selten).
Hinweis
Vor Narkosen mit Halothan oder anderen Substanzen, die das Herz gegenüber sympathomimetischen Aminen sensibilisieren, muss isicom® mindestens 8 Stunden vorher abgesetzt werden, sofern nicht gleichzeitig Opioide zur Anwendung kommen.
4.6 Schwangerschaft und Stillzeit
Es gibt keine Beobachtungen, die beim Menschen auf eine fruchtschädigende Wirkung der Kombination von Levodopa und Carbidopa hinweisen. Untersuchungen am Tier haben speziesabhängig unterschiedliche Ergebnisse erbracht.
Es ist im Einzelfall zu entscheiden, ob ein Absetzen der Therapie mit isicom® bei der Schwangeren verantwortet werden kann, weil es aufgrund der Schwere der unbehandelten Erkrankung möglicherweise zu einer ernsthaften Gefährdung der Patientin kommen kann.
Levodopa hemmt die Prolaktinausschüttung und somit die Laktation. Ist eine Behandlung mit isicom® während der Stillzeit erforderlich, muss abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Möglicherweise treten Nebenwirkungen wie z.B Kreislaufbeschwerden, Schwindel, Kopfschmerzen oder Verwirrtheitszustände auf, wodurch das Seh- und Reaktionsvermögen sowie die Urteilskraft vermindert werden.
isicom® kann deshalb auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr und zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol oder anderen zentral wirksamen Medikamenten. Deshalb sollten das Führen von Kraftfahrzeugen, die Bedienung von elektrischen oder motorgetriebenen Maschinen oder sonstige gefahrvolle Tätigkeiten zumindest während der ersten Tage der Behandlung unterbleiben.
Da isicom® auch bei bestimmungsgemäßem Gebrauch Müdigkeit und in sehr seltenen Fällen übermäßige Tagesmüdigkeit und plötzlich auftretende Schlafattacken (evtl. auch ohne vorherige Warnzeichen) verursachen kann, müssen Patienten darauf hingewiesen werden, im Straßenverkehr, beim Bedienen von Maschinen sowie bei Arbeiten ohne sicheren Halt besonders vorsichtig zu sein. Patienten, bei denen übermäßige Tagesmüdigkeit und Schlafattacken aufgetreten sind, dürfen kein Fahrzeug führen und keine Maschinen bedienen, durch die sie selbst oder andere dem Risiko schwerwiegender Verletzungen ausgesetzt sein könnten. In derartigen Fällen sollte auch eine Dosisreduktion oder eine Beendigung der Therapie erwogen werden.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Sehr häufige Nebenwirkungen sind
- Übelkeit, Erbrechen und Appetitlosigkeit, besonders zu Beginn der Behandlung;
- psychische Störungen wie innere Unruhe und Ängstlichkeit, Schlafstörungen wie auch Schläfrigkeit, insbesondere dann, wenn aus der Vorgeschichte bereits Hinweise auf solche Störungen vorliegen.
Häufige Nebenwirkungen sind
- Verschwommensehen, Benommenheit, Müdigkeit, metallischer Geschmack,
Schwindel, Fluktuationen der Beweglichkeit (End-of-dose-Akinese, On-off-Phänomen);
- exogen-psychotische Symptome wie Halluzinationen, Wahnideen und depressive Verstimmungen, die besonders nach länger dauernder Behandlung in den fortgeschrittenen Stadien der Erkrankung beobachtet werden. Es kommt dann auch zu cho-reoathetotischen und dystonen Hyperkinesen, die sich durch Dosisreduktion z. T. vermindern lassen.
Gelegentliche Nebenwirkungen sind hypotone orthostatische
Kreislaufregulationsstörungen, kardiale Arrhythmien, Hitzegefühl und Herzklopfen, Duodenalgeschwüre, Hypertonus, Phlebitis, Thoraxschmerzen, Dyspnoe, Parästhesien, Krämpfe sowie Flapping-Tremor.
In seltenen Fällen wurde Haarausfall beschrieben.
Bei Parkinson-Patienten wird in seltenen Fällen eine eigenmächtige, missbräuchliche Dosissteigerung beobachtet.
Sehr selten wurden hämolytische Anämien, gastrointestinale Blutungen, sklerodermieartige Hautveränderungen sowie übermäßige Tagesmüdigkeit und Schlafattacken beobachtet.
Die für den Behandlungsbeginn typischen Erscheinungen (Appetitminderung, Übelkeit, Erbrechen, Geschmacksstörungen) sind in der Regel durch Dosisreduktion, langsamere Steigerung der Dosis und ggf. durch ein Antiemetikum wie Domperidon zu beherrschen.
Impulskontrollstörungen
Pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich isicom, behandelt werden (siehe Abschnitt 4.4)
Hinweise zur Überwachung der Behandlung
In der Einstellungsphase sind häufigere Kontrollen der Leber- und Nierenfunktion sowie des Blutbildes zu empfehlen.
Bei Patienten mit Herzinfarktanamnese, Herzrhythmusstörungen oder koronaren Durchblutungsstörungen sollen regelmäßige Kreislauf- und EKG-Kontrollen vorgenommen werden. Patienten mit Magen-Darm-Ulcera in der Vorgeschichte sollten ebenfalls ärztlich besonders beobachtet werden. Bei Patienten mit Glaukom sind regelmäßige Kontrollen des intraokulären Druckes angezeigt.
Alle Patienten sollten sorgfältig auf psychische Veränderungen und Depressionen mit und ohne Suizidtendenz überwacht werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Die Symptome einer Überdosierung entsprechen einem verstärkten Nebenwirkungsprofil.
b) Therapiemaßnahmen bei Überdosierung
Bei akuter Überdosierung von isicom® sind neben einer sofortigen Magenspülung eine intensivmedizinische Überwachung und Stützmaßnahmen unter besonderer Beachtung der Herz- und Kreislauffunktionen erforderlich. Kardiale Arrhythmien können die Anwendung von Antiarrhythmika, wie z. B. Beta-Rezeptorenblockern, erforderlich machen. Ein spezifisches Antidot existiert nicht. Es liegen keine Dialyseerfahrungen vor.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Dopaminerge Mittel ATC-Code: N04BA02
Die Aminosäure Levodopa dient der Substitution des beim Parkinson-Syndrom bestehenden Dopamin-Mangels. Da wenigstens 95 % des oral verabreichten Levodopa bereits in extrazerebralen Organen (Darm, Leber, Niere, Herz, Magen) decarboxyliert werden, gelangen nur geringe Mengen ins Gehirn. Durch das extrazerebral gebildete Dopamin und die aus ihm entstehenden adrenergen Substanzen sind zahlreiche Nebenwirkungen gastrointestinaler und kardiovaskulärer Art bei der Monotherapie mit Levodopa bedingt.
Durch die gleichzeitige Gabe des Decarboxylasehemmers Carbidopa wird die Decarboxylierung von Levodopa in der Peripherie weitgehend verhindert. Dadurch kann die Dosis Levodopa, die zur Erreichung vergleichbarer klinischer Effekte notwendig ist, auf bis zu 20 % der bei der Monotherapie notwendigen Dosis gesenkt werden. Die gastrointestinalen und kardiovaskulären Nebenwirkungen werden damit weitgehend vermieden.
Bei einer Dosierung von 3 x 100 mg Carbidopa-Monohydrat pro Tag wurde eine deutliche Erhöhung der Prolaktinplasmakonzentration gemessen. Die Kombination von Levodopa und Carbidopa führte dagegen, wie die Monotherapie mit Levodopa, zu einer Abnahme der Prolaktinplasmakonzentration um etwa 40 %.
5.2 Pharmakokinetische Eigenschaften
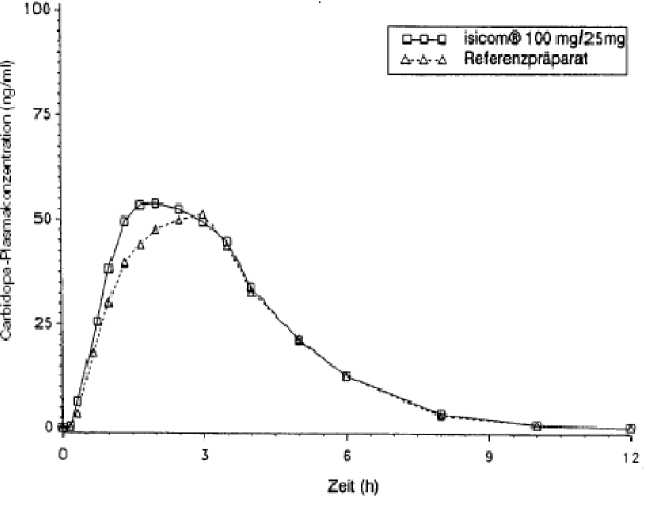
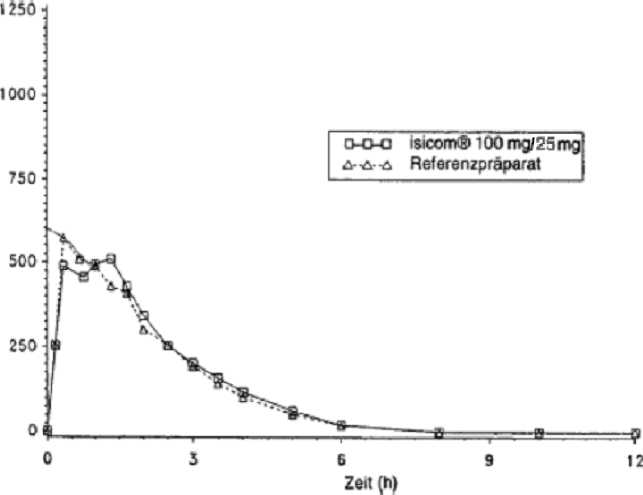
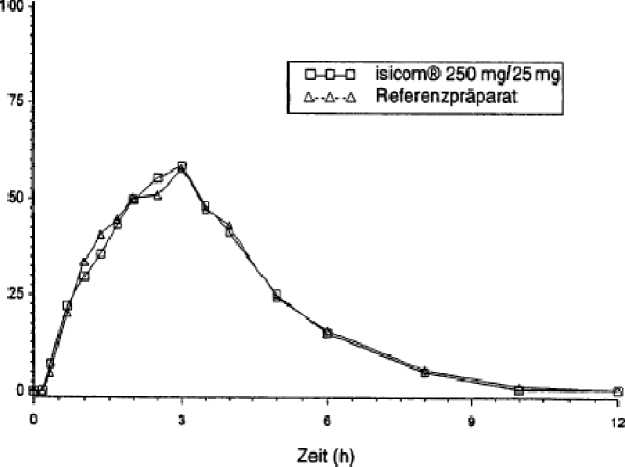
Die orale Gabe von 25 mg Carbidopa-Monohydrat in Kombination mit 100 mg bzw. 250 mg Levodopa führte nach 0,9 h bzw. 0,6 h zu maximalen Levodopa-Plasmakonzentrationen von 1091 ng/ml bzw. 1413 ng/ml. Die Bioverfügbarkeit von Carbidopa lag zwischen 58 % und 71 %. Maximale Carbidopa-Konzentrationen im Plasma, die nach
1,9 h bis 2,4 h erreicht wurden, betrugen 69,2 bis 93,6 ng/ml.
Die Plasmahalbwertszeit von Levodopa steigt mit zunehmender Carbidopadosis von 1,1 h bei 10 mg Carbidopa-Monohydrat/100 mg Levodopa auf 1,5 h bei 62,5 mg Carbidopa-Monohydrat/250 mg Levodopa. Die Plasmaclearance für Levodopa war bei Kombination mit Carbidopa nur etwa halb so groß wie bei der Monotherapie. Die Eiweißbindung von Carbidopa liegt bei 36 %. Es wurde eine Eliminationshalbwertzeit von 7,7 h bis 11,7 h gemessen.
Die Hemmung der peripheren Decarboxylasen führt, wenn man die Plasmakonzentration der Metabolite bei Mono-und Kombinationstherapie vergleicht, zu erhöhten Plasmakonzentrationen bei den Aminosäuren (Levodopa und sein 3-O-Methyl-Derivat) und zur Abnahme der Plasmakonzentration bei den Catecholaminen (Dopamin, Noradrenalin), der Homovanillinsäure und der 3,4-Dihydroxyphenylessigsäure. So konnte z. B. die maximale Dopaminkonzentration im Plasma durch Carbidopazusatz von 300 ng/ml auf unter 2,5 ng/ml gesenkt werden. 50 % bis 60 % der applizierten Carbidopa-Dosis wird renal ausgeschieden. Davon konnte etwa ein Drittel als unverändertes Carbidopa identifiziert werden. Als Metabolite fand man im Urin: 2-Methyl-3'-methoxy-4'-hydroxyphenyl-propionsäure, 2-Methyl-3',4' -dihydroxyphe-nyl-propionsäure, 3-Hydroxy-2-p tolyl-propionsäure und 3,4-Dihydroxyphenylmethylketon. Diese vier Metabolite traten überwiegend in konjugierter Form auf.
Auch die Metabolite des Levodopa werden hauptsächlich über die Nieren ausgeschieden. Bei gleichzeitiger Gabe von Carbidopa konnte im 48-h-Sammelharn eine deutliche Abnahme der Homovanillinsäure- und Dopaminmenge festgestellt werden.
Bioverfügbarkeit
Zwei im Jahr 1997 durchgeführte Bioverfügbarkeitsuntersuchungen an jeweils 24 Probanden ergaben im Vergleich zum Referenzpräparat:
|
Levodopa |
isicom® 100 mg/25 mg |
Referenzpräparat |
|
maximale Plasmakonzentration (Cmax)[ng/ml]: |
779±286 |
866 ±359 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax)[h]: |
1,01 ± 0,78 |
0,98 ± 0,67 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC)[ng/mlxh]: |
1504±294 |
1444 ± 306 |
|
Carbidopa |
isicom® 100 mg/25 mg |
Referenzpräparat |
|
maximale Plasmakonzentration (Cmax)[ng/ml]: |
68,6 ± 29,5 |
60,3 ± 27,8 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax)[h]: |
2,22 ± 0,90 |
2,54 ± 0,69 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC)[ng/mlxh]: |
238,7 ± 112,8 |
225,2 ± 114,0 |
|
Levodopa |
isicom® 250 mg/25 mg |
Referenzpräparat |
|
maximale Plasmakonzentration (Cmax)[ng/ml]: |
2363 ±1012 |
2399 ± 925 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax)[h]: |
1,12 ± 0,87 |
1,17 ± 0,72 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC)[ng/mlxh]: |
4340± 1111 |
4438 ±1016 |
|
Carbidopa |
isicom® 250 mg/25 mg |
Referenzpräparat |
|
maximale Plasmakonzentration (Cmax)[ng/ml]: |
63,7 ± 33,1 |
65,2 ± 38,9 |
|
Zeitpunkt der maximalen Plasmakonzentration (tmax)[h]: |
2,62 ± 0,67 |
2,85 ± 0,67 |
|
Fläche unter der Konzentrations-Zeit-Kurve (AUC)[ng/mlxh]: |
250,8 ± 129,5 |
253,4 ± 152,1 |
Angabe der Werte als Mittelwert und Streubreite
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
Carbidopa isicom 100 mg/25 mg
Gartid<pa-Plasmakonzeriraiion (ngjftil) H L9vodopa-Plasrnakon2i9iiliaibn(ng/itil)
irbidopa isicom 250 mg/25 mg
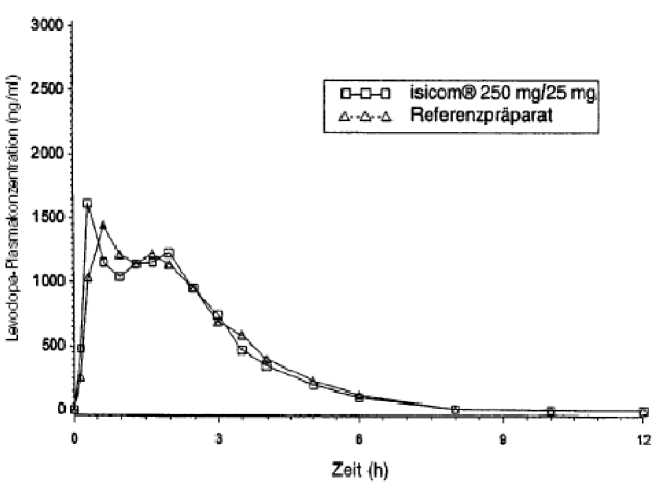
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Siehe Abschnitt 4.9 “Überdosierung”
b) Chronische Toxizität / Subchronische Toxizität Levodopa
Es liegen keine Untersuchungen zur chronischen Toxizität von Levodopa vor (vgl. aber Abschnitt 4.8 "Nebenwirkungen").
Carbidopa
Untersuchungen zur chronischen Toxizität von Carbidopa wurden an Affen, Ratten und Hunden durchgeführt. Die Untersuchungen an Affen über 1 Jahr ergaben keine Hinweise auf Arzneimittel-bedingte toxische Effekte. In Untersuchungen über 96 Wochen an der Ratte mit Dosen von 25 bis 135 mg/kg KG wurden lediglich bei einigen Tieren Schwächeerscheinungen beobachtet. In den Untersuchungen am Hund wurde ab einer Dosis von 15 mg/kg als Folge Pyridoxinmangel beobachtet.
Kombination von Levodopa und Carbidopa
Nach täglicher oraler Gabe von 10 mg + 20 mg, 10 mg + 50 mg und 10 mg + 100 mg Carbidopa + Levodopa pro Kilogramm Körpergewicht an Affen über 54 Wochen und Ratten über 106 Wochen zeigte sich, dass die physischen Hauptwirkungen auf die pharmakologische Aktivität der Substanzen zurückzuführen sind. Dosen von 10 mg Carbidopa + 20 mg Levodopa pro Kilogramm Körpergewicht täglich hatten keine sichtbaren physischen Effekte zur Folge.
c) Mutagenes und tumorerzeugendes Potential
Levodopa
Für Levodopa bestehen Hinweise auf eine mutagene Wirkung, die vorwiegend zytogenetischen Untersuchungen entstammen. Die Relevanz dieser Befunde ist aufgrund der nur unzureichend dokumentierten Untersuchungen nicht abgeklärt.
Langzeituntersuchungen auf ein tumorerzeugendes Potential von Levodopa liegen nicht vor. In Einzelfällen ist berichtet worden, dass beim Menschen unter Levodopa-Therapie Melanome reaktiviert wurden. Ein kausaler Zusammenhang zwischen Levodopa-Therapie und Melanomexazerbation konnte jedoch weder experimentell noch epidemiologisch nachgewiesen werden.
Carbidopa
Carbidopa wurde nur unzureichend bezüglich mutagener Wirkungen untersucht. Im mikrobiellen Mutagenitätstest erwies sich Carbidopa als nicht mutagen.
Kombination von Levodopa und Carbidopa
Aus den Untersuchungen zur chronischen Toxizität der Kombination konnte kein Hinweis auf ein tumorerzeugendes Potential abgeleitet werden.
d) Reproduktionstoxizität
Levodopa
Bei Kaninchen traten ab einer (maternal toxischen) Dosis von 75 mg/kg KG täglich embryoletale Effekte auf; oberhalb dieser Dosis wurden kardiovaskuläre Fehlbildungen und oberhalb einer Dosis von 125 mg/ kg KG täglich Rippenanomalien beobachtet. Teratogene Effekte bei Mäusen und Ratten sind auch bei höheren Dosen nicht beschrieben. Levodopa ist nicht hinsichtlich möglicher Störungen der Fertilität und der Peri-Postnatalentwicklung geprüft.
Carbidopa
Embryotoxizitätsstudien an Mäusen und Kaninchen ergaben keine Hinweise auf eine spezifische Schädigung von Embryonen. Die männliche Fertilität bei Ratten wurde nicht beeinträchtigt, bei weiblichen Tieren traten oberhalb einer täglichen Dosis von 60 mg/kg KG erhöhte Präimplantationsverluste von Embryonen und damit eine Verringerung der Wurfgröße auf. Dosen ab 30 mg/kg KG täglich führten zu Tragzeitverlängerungen.
Kombination von Levodopa und Carbidopa
Es liegen Embryotoxizitätsstudien an Mäusen und Kaninchen, eine Fertilitätsstudie sowie eine Peri-Postnatalstudie an Ratten vor. Die beobachteten Effekte weichen hinsichtlich embryo-fetotoxischer Eigenschaften nicht wesentlich von den bei den Einzelwirkstoffen aufgetretenen Befunden ab. Es wurden keine Fertilitätsstörungen bis zu einer Dosis von 10 mg Carbidopa+ 100 mg Levodopa pro Kilogramm Körpergewicht täglich beobachtet.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Calciumstearat (Ph. Eur.), Citronensäure-Monohydrat, Gelatine, mikrokristalline Cellulose, Poly(O-carboxymethyl)stärke-Natriumsalz, hochdisperses Siliciumdioxid.
6.2 Inkompatibilitäten
Bisher keine bekannt.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt für isicom® 100 mg/25 mg und für isicom® 250 mg/25 mg 3 Jahre.
Dieses Arzneimittel soll nach Ablauf des Verfalldatums nicht mehr angewendet werden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C aufbewahren.
6.5 Art und Inhalt des Behältnisses
isicom® 100 mg/25 mg PP/Aluminium-Bli sterpackung.
30 Tabletten 60 Tabletten 200 Tabletten
isicom® 250 mg/25 mg PP/Aluminium-Bli sterpackung.
30 Tabletten 60 Tabletten 100 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. Inhaber der Zulassung
DESITIN ARZNEIMITTEL GMBH Weg beim Jäger 214 22335 Hamburg Telefon:(040) 5 91 01-525 Telefax: (040) 5 91 01-377
8. Zulassungsnummern
isicom® 100 mg/25 mg 3004319.00.00
isicom® 250 mg/25 mg 3004319.01.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
isicom® 100 mg/25 mg 07.11.2003
isicom® 250 mg/25 mg 07.11.2003
10. Stand der Information
Februar 2013 Verkaufsabgrenzung
Verschreibungspflichtig
16