Jenaspiron 50Mg
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Jenaspiron® 50 mg Jenaspiron® 100 mg Tabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Eine Tablette Jenaspiron 50 mg enthält 50 mg Spironolacton.
Eine Tablette Jenaspiron 100 mg enthält 100 mg Spironolacton.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Tablette
Jenaspiron ist eine weiße runde Tablette mit Bruchkerbe.
Die Tablette kann in gleiche Dosen geteilt werden.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Primärer Hyperaldosteronismus, sofern nicht eine Operation angezeigt ist.
Ödeme und/oder Aszites bei Erkrankungen, die mit einem sekundären Hyperaldosteronismus einhergehen.
4.2 Dosierung und Art der Anwendung
Spironolacton steht in Form von Tabletten zu 50 mg und 100 mg zur Verfügung. Die Wahl der geeigneten Dosisstärke richtet sich nach der Höhe der Anfangsdosis und der Anzahl der über den Tag zu verteilenden Dosen.
Die Dosierung sollte individuell - in Abhängigkeit vom Schweregrad und dem Ausmaß der Erkrankung - festgelegt werden.
Kinder und Jugendliche
Aufgrund des hohen Wirkstoffgehaltes sind Jenaspiron Tabletten für die Anwendung bei Säuglingen ungeeignet.
Es stehen keine kontrollierten klinischen Studien zur Dosierung bei Neugeborenen und Kindern zur Verfügung. In medizinischen Leitlinien werden folgende Dosierungen empfohlen:
- Neugeborene: 1-2 mg/kg KG täglich, aufgeteilt in 1-2 Einzeldosen; bis zu 7 mg/kg KG täglich bei resistentem Aszites.
- Kinder ab 1 Monat bis 12 Jahre: 1-3 mg/kg KG täglich, aufgeteilt in 1-2 Einzeldosen; bis zu 9 mg/kg KG täglich bei resistentem Aszites.
- Jugendliche von 12 bis 18 Jahren: 50-100 mg täglich, aufgeteilt in 1-2 Einzeldosen; bis zu
9 mg/kg KG täglich (maximal 400 mg täglich) bei resistentem Aszites.
Erwachsene Jenaspiron 50 mg
Initial 1- bis 2-mal täglich 2 Tabletten Jenaspiron 50 mg (entsprechend 100 bis 200 mg Spironolacton täglich) über 3 bis 6 Tage.
Bei unzureichender Wirksamkeit kann die tägliche Dosis auf maximal 8 Tabletten Jenaspiron 50 mg (entsprechend 400 mg Spironolacton täglich) erhöht werden.
Als Erhaltungsdosis sind in der Regel 1 bis 2 Tabletten Jenaspiron 50 mg (entsprechend 50 mg bis 100 mg Spironolacton) bis maximal 2 bis 4 Tabletten Jenaspiron 50 mg (entsprechend 100 bis 200 mg Spironolacton) ausreichend.
Die Erhaltungsdosis kann je nach Bedarf täglich, jeden 2. oder jeden 3. Tag verabreicht werden. Jenaspiron 100 mg
Initial 1- bis 2-mal täglich 1 Tablette Jenaspiron 100 mg (entsprechend 100 bis 200 mg Spironolacton täglich) über 3 bis 6 Tage.
Bei unzureichender Wirksamkeit kann die tägliche Dosis auf maximal 4 Tabletten Jenaspiron 100 mg (entsprechend 400 mg Spironolacton täglich) erhöht werden.
Als Erhaltungsdosis sind in der Regel A bis 1 Tablette Jenaspiron 100 mg (entsprechend 50 bis 100 mg Spironolacton) bis maximal 1 bis 2 Tabletten Jenaspiron 100 mg (entsprechend 100 bis 200 mg Spironolacton) ausreichend.
Die Erhaltungsdosis kann je nach Bedarf täglich, jeden 2. oder jeden 3. Tag verabreicht werden.
Art der Anwendung
Die Tabletten sind unzerkaut mit ausreichend Flüssigkeit einzunehmen.
Über die Dauer der Behandlung entscheidet der behandelnde Arzt. Sie sollte auf einen möglichst kurzen Zeitraum begrenzt werden. Die Notwendigkeit einer Therapie über einen längeren Zeitraum sollte periodisch überprüft werden.
Kindern sollte Jenaspiron nicht länger als 30 Tage verabreicht werden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Anurie
- akutes Nierenversagen
- schwere Niereninsuffizienz (Creatinin-Clearance unter 30 ml/min pro 1,73 m2 Körperoberfläche bzw. bei einem Serum-Creatinin-Wert über 1,8 mg/dl)
- Hyperkaliämie
- Hyponatriämie
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Eine besonders sorgfältige ärztliche Überwachung ist erforderlich bei:
- Nierenfunktionseinschränkung leichteren Grades (Serum-Creatinin-Werte zwischen 1,2 und 1,8 mg/dl bzw. einer Creatinin-Clearance zwischen 60 ml/min und 30 ml/min)
- Patienten, die als Folge ihrer Grunderkrankung zu Azidose und/oder Hyperkaliämie neigen (z. B. Diabetes mellitus)
- Hypotonie
- Hypovolämie
Bei gleichzeitiger Anwendung von Spironolacton und kaliumsparenden Diuretika, Kaliumsubstituenten oder ACE-Hemmern kann es zu lebensgefährlichen Hyperkaliämien kommen.
Die Kombination der vorgenannten Arzneimittel mit Spironolacton wird daher im Allgemeinen nicht empfohlen.
Die Behandlung mit Jenaspiron erfordert eine regelmäßige Kontrolle von Serum-Natrium, SerumKalium, Serum-Creatinin und des Säure-Basen-Status.
Eine engmaschige Überwachung des Serum-Kaliumspiegels ist erforderlich bei eingeschränkter Nierenfunktion mit Serum-Creatinin-Werten zwischen 1,2 und 1,8 mg/dl bzw. einer Creatinin-Clearance unter 60 ml/min pro 1,73 m2 Körperoberfläche sowie bei Anwendung von Jenaspiron in Kombination mit anderen Arzneimitteln, die zu einem Anstieg des Kaliumspiegels führen können (siehe Abschnitt 4.5).
Spironolacton kann eine Störung diagnostischer Tests (z. B. Digoxin-RIA) verursachen. Auswirkungen bei Fehlgebrauch zu Dopingzwecken
Die Anwendung von Jenaspiron kann bei Dopingkontrollen zu positiven Ergebnissen führen.
Die gesundheitlichen Folgen der Anwendung von Jenaspiron als Dopingmittel können nicht abgesehen werden. Schwerwiegende Gesundheitsgefährdungen sind nicht auszuschließen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die Kombination von nicht-steroidalen antiphlogistisch wirkenden Substanzen mit Spironolacton kann zu Hyperkaliämien führen.
Bei Anwendung von Spironolacton in Kombination mit Kaliumsalzen (z. B. Kaliumchlorid), mit Substanzen, die die Kaliumausscheidung vermindern (kaliumsparende Diuretika wie Triamteren oder Amilorid) oder mit ACE-Hemmern kann es zu einem Anstieg des Serum-Kalium-Spiegels bis hin zu schweren, unter Umständen lebensgefährlichen Hyperkaliämien kommen (siehe Abschnitt 4.4).
Bei gleichzeitiger Anwendung von ACE-Hemmern, Furosemid und Spironolacton kann ein akutes Nierenversagen auftreten.
Spironolacton und Carbenoxolon können sich gegenseitig in ihrer Wirkung beeinträchtigen. Größere Mengen von Lakritze wirken in dieser Hinsicht wie Carbenoxolon.
Die gleichzeitige Gabe von nicht-steroidalen Antiphlogistika (z. B. Acetylsalicylsäure, Indometacin) kann die diuretische Wirkung von Spironolacton abschwächen.
Die gleichzeitige Anwendung von Digoxin und Spironolacton kann zu erhöhten Digoxin-Blutspiegeln führen.
Neomycin kann die Resorption von Spironolacton verzögern.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Jenaspiron sollte während der Schwangerschaft nicht angewendet werden, da antiandrogene Wirkungen beim Menschen nachgewiesen worden sind.
Untersuchungen am Tier haben eine Feminisierung der Genitalien männlicher Nachkommen sowie Hinweise auf endokrine Störungen bei weiblichen und männlichen Nachkommen ergeben.
Stillzeit
Zur Ausscheidung von Spironolacton in die Muttermilch liegen keine Daten vor. Der Hauptmetabolit Canrenoat ist nachgewiesen worden (Milch-Plasma-Konzentrationsverhältnis 0,7).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder zum Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße bei Behandlungsbeginn, Dosiserhöhung und Präparatewechsel sowie im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
|
Organsystem klassen (MedDRA) |
Sehr häufig (> 1/10) |
Häufig (> 1/100; < 1/10) |
Gelegentlich (> 1/1.000, < 1/100) |
Sehr selten (< 1/10.000) |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) |
|
Erkrankunge n des Blutes und des Lymphsyste ms |
Thrombozytopeni e durch Spironolactoninduzierte Antikörper, Eosinophilie bei Patienten mit Leberzirrhose, Agranulozytose | ||||
|
Endokrine Erkrankunge n |
bei Frauen Hirsutismus und Vertiefung der Stimmlage; bei Männern Erhöhung der Stimmlage | ||||
|
Stoffwechsel - und Ernährungsst örungen |
Erhöhung des HarnsäureSpiegels |
Hyponatriämie insbesondere nach ausgiebiger Wasserzufuhr; Elektrolytverände rungen, die sich als kardiale Arrhythmien, Müdigkeit, allg. Muskelschwäche, Muskelkrämpfe (z. B. Wadenkrämpfe) od. Schwindel bemerkbar machen; Induzierung od. Verschlechterung einer hyperchlorämisch metabolischen Azidose; reversibler Anstieg stickstoffhaltiger harnpflichtiger Stoffe |
|
Erkrankunge n des Nervensyste ms |
Kopfschmerzen, Schläfrigkeit, Ataxie, Verwirrtheitszust ände | ||||
|
Herzerkrank ungen |
Unerwünschtes Absinken des Blutdrucks, orthostatische Regulationsstöru ngen | ||||
|
Erkrankungen des Gastrointesti naltrakts |
Magen-DarmStörungen (Übelkeit, Erbrechen, Diarrhö, gastrointestinale Krämpfe), Blutungen der Magenschleimha ut und gastrointestinale Ulzera | ||||
|
Leber- und Gallenerkran kungen |
Hepatotoxizität mit Ansteigen der Leberenzyme und histologisch nachgewiesener Hepatitis | ||||
|
Erkrankunge n der Haut und des Unterhautzel lgewebes |
Alopezie, Hautrötung, Urtikaria, Erythema anulare, Lupuserythematodes-und Lichen-ruber-planus-ähnliche Hautveränderung en | ||||
|
Skelettmusk ulatur-, Bindegewebs - und Knochenerkr ankungen |
Osteomalazie | ||||
|
Erkrankunge n der Nieren und Harnwege |
insbes. bei Patienten mit eingeschränkter Nierenfunktion bedrohliche Hyperkaliämien, die zu Herzrhythmusstörungen und hyperkaliämische r Paralyse führen | ||||
|
Erkrankunge n der Geschlechtso rgange und der |
bei Männern: reversible Gynäkomastie; bei Frauen: Mastodynie, |
Impotenz |
|
Brustdrüse |
Zwischenblutung en, Amenorrhoe. Das Auftreten dieser Nebenwirkungen ist dosisabhängig. |
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risikos-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 53175 Bonn
Website: www.bfarm.de
4.9 Überdosierung
Symptome einer Überdosierung
Somnolenz und Verwirrtheitszustände treten vor allem als Folge von Elektrolytstörungen (Hyperkaliämie) auf. Reizbildungs- und Reizleitungsstörungen am Herzen (z. B. AV-Block, Vorhofflimmern, Kammerflimmern, Herzstillstand) sowie EKG-Veränderungen (hohe zeltförmige T-Zacken und zunehmende Verbreiterung des QRS-Komplexes) können auftreten.
Therapiemaßnahmen bei Überdosierung
Therapie der Hyperkaliämie
Bedrohliche Hyperkaliämien müssen unverzüglich einer Intensivbehandlung zugeführt werden.
- Normalisierung des Verhältnisses zwischen intra- und extrazellulärer Kaliumkonzentration: Natriumhydrogencarbonat erhöht über einen direkten Mechanismus die Kaliumaufnahme der Zelle: Infusion von 50 bis 100 ml einer 1molaren (8,4 %igen) Natriumhydrogencarbonat-Lösung i.v. (Wirkungseintritt: nach wenigen Minuten; Wirkungsdauer: mehrere Stunden).
Der Kaliumeinstrom in die Zelle wird besonders durch Glucose gefördert: z. B. 200 ml einer 25 %igen (1,4 mol/l) Glucose-Lösung und 25 I.E. Altinsulin (1 I.E. Altinsulin pro 2 g Glucose) i.v. innerhalb von 30 bis 60 Minuten infundieren (Wirkungsdauer: mehrere Stunden).
- Elimination eines ggf. vorhandenen Kaliumüberschusses:
Nach den oben erwähnten Notfallmaßnahmen sollte überschüssiges Kalium durch längerfristig wirkende Maßnahmen aus dem Körper eliminiert werden. Lässt sich die renale Ausscheidung nicht steigern (z. B. durch Injektion von Furosemid), sind extrarenale Eliminationswege zu wählen. Hier ist die orale Gabe von Kationen-Austauschharzen (z. B. Resonium A oder Calcium-Resonium) zu empfehlen: 1 g der Harze bindet ca. 1 mmol Kalium im Darmlumen. Das gebundene Kalium wird mit den Fäzes ausgeschieden.
Lässt sich mit den o. g. Maßnahmen keine Normalisierung der extrazellulären Kaliumkonzentration erreichen, ist eine Peritoneal- oder Hämodialyse unumgänglich.
Ein spezifisches Antidot ist nicht bekannt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
Pharmakotherapeutische Gruppe: Kaliumsparende Mittel; Aldosteron-Antagonisten, ATC-Code: C03DA01
Spironolacton blockiert kompetitiv die Bindung von Aldosteron an dessen zytoplasmatischen Rezeptor. Aldosteron kann dadurch nicht über seinen Rezeptor in den Zellkern eindringen, wodurch die Synthese der Aldosteron-induzierten Proteine unterbleibt.
Damit wird der wesentlichen Aldosteronwirkung, der Natriumreabsorption und Kaliumsekretion, entgegengewirkt.
Aldosteronrezeptoren werden renal sowie extrarenal, z. B. in den Speicheldrüsen und im Darm, gefunden.
Spironolacton entwickelt nur in Gegenwart von endogenem oder exogenem Aldosteron eigene Aktivität. Die Wirkung kann durch ansteigende Aldosteronspiegel aufgehoben werden.
Weder die Produktion noch die Ausscheidung von Aldosteron wird in therapeutischen Dosen verringert. Nur in extrem hoher Dosierung hemmt Spironolacton die Biosynthese des Aldosterons.
Spironolacton steigert die Natrium- und Chloridausscheidung sowie in geringem Maße die Calciumausscheidung; reduziert werden die Kalium- und Ammoniumausscheidung sowie die Azidität des Harns.
Spironolacton vermindert die renale Magnesiumausscheidung.
Bei alleiniger Anwendung hat Spironolacton nur eine geringe diuretische Wirkung. Durch zusätzliche Gabe von Thiaziden oder Schleifendiuretika kann die Natriurese weiter gesteigert werden.
Spironolacton kann über eine Senkung der glomerulären Filtrationsrate die Serumharnstoffkonzentrationen erhöhen.
Ein blutdrucksenkender Effekt bei Hypermineralocorticoid-Syndromen bzw. bei verschiedenen Erkrankungen mit primärem oder sekundärem Hyperaldosteronismus ist erwiesen.
Nach oraler Einzeldosis tritt die biochemische Wirkung über einen Aldosteronantagonismus nach 2 bis 4 Stunden ein, die maximale Wirkung wird nach 6 bis 8 Stunden erreicht und hält 16 bis 24 Stunden an.
Der klinische Wirkungseintritt erfolgt bei kontinuierlicher Verabreichung schrittweise mit einem Wirkungsmaximum nach 2 bis 3 Tagen oder später; ggf. kann der maximale diuretische Effekt auch erst nach 2 Wochen auftreten.
5.2 Pharmakokinetische Eigenschaften
Spironolacton wird nach oraler Gabe zu etwa 73 % resorbiert. Nach 1 bis 2 Stunden werden maximale Plasmakonzentrationen von Spironolacton und nach 3 Stunden maximale Plasmakonzentrationen des aktiven Metaboliten Canrenon gemessen.
Steady-state-Konzentrationen werden für Canrenon nach ungefähr 3 bis 8 Tagen nach täglicher Applikation von Spironolacton erreicht. Bei Patienten mit Leberzirrhose und Aszites werden diese erst nach 14 Tagen erreicht.
Die Plasmaproteinbindung von Spironolacton und seinen Metaboliten beträgt 98 %.
Spironolacton wird hauptsächlich in der Leber und in den Nieren metabolisiert. Zu 80 % entstehen Metaboliten mit erhaltener Schwefelgruppe: Thiomethylspironolacton IV (pharmakologisch aktiver Hauptmetabolit) und V, sowie deren sulfoxidierte Metaboliten, zu 20 % Amenone mit seinem
wichtigsten Vertreter Canrenon, dem Metabolit II.
Nach oraler Gabe von Spironolacton beträgt die Serum-Halbwertszeit für Spironolacton 1 bis 2 Stunden.
Die Eliminationshalbwertszeit des aktiven Metaboliten Canrenon wird mit 18 bis 23 Stunden angegeben.
Die Elimination von Spironolacton erfolgt über Nieren und Leber.
Nach einer oralen Einmaldosis von radioaktiv markiertem Spironolacton erscheinen innerhalb von 6 Tagen 47 bis 57 % im Urin und 35 bis 41 % im Stuhl. Der Anteil von unverändertem Spironolacton ist gering.
Bioverfügbarkeit
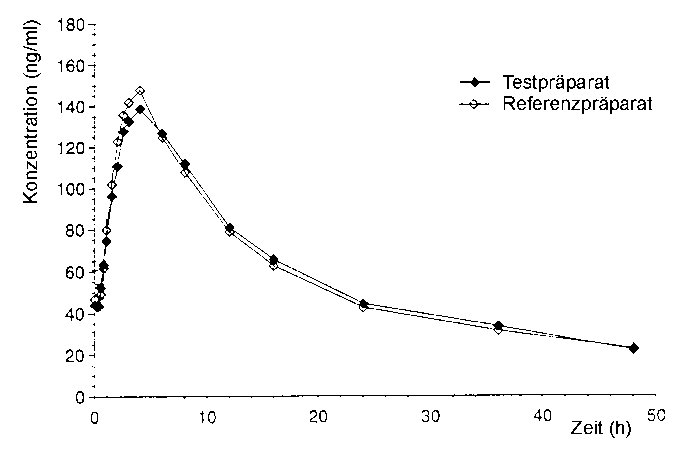
Eine im Jahr 1996 durchgeführte randomisierte Zwei-Wege-cross-over-Bioäquivalenzuntersuchung an 24 nüchternen Probanden ergab nach einer täglichen Einnahme von 100 mg Spironolacton (2 Tabletten Jenaspiron 50 mg) über 5 Tage (steady state) im Vergleich zum Referenzpräparat:
|
Testpräparat |
Referenzpräparat | |
|
maximale Plasmakonzentration |
152,5 |
154,7 |
|
(Css max[ng/ml]) |
±26,3 |
±31,4 |
|
Zeitpunkt der maximalen | ||
|
Plasmakonzentration |
3,667 |
3,208 |
|
(tss max [h]) |
±1,599 |
±0,736 |
|
Fläche unter der Konzentrations- | ||
|
Zeit-Kurve (AUCss 0^» |
2037,4 |
2028,8 |
|
[h x ng/ml]) |
±370,7 |
±323,1 |
Angabe der Canrenon-Werte am 5. Tag nach Erreichen des steady state als Mittelwerte und Streubreite.
Mittlerer Canrenon-Plasmaspiegelverlauf (5. Tag nach Erreichen des steady state) in einem Konzentrations-Zeit-Diagramm:
Subchronische/chronische Toxizität
Untersuchungen zur subchronischen und chronischen Toxizität wurden an verschiedenen Tierspezies (Ratte, Hund, Affe) durchgeführt. In der Untersuchung an der Ratte zeigte sich in der hohen Dosis ein vermehrtes Vorkommen von Schilddrüsen- und Hodenadenomen.
Mutagenes und tumorerzeugendes Potenzial
Spironolacton wurde ausführlich geprüft. Es ergab sich kein Hinweis auf eine mutagene Wirkung.
In einer Langzeituntersuchung an Ratten ergaben sich keine Hinweise auf ein tumorerzeugendes Potenzial von Spironolacton.
Reproduktionstoxizität
Feminisierende Wirkungen auf die äußeren Genitalien wurden bei den männlichen Nachkommen während der Trächtigkeit exponierter Ratten bei Tagesdosen von ca. 160 mg/kg KG beobachtet.
Endokrine Störungen bei beiden Geschlechtern (Veränderungen von Hormonkonzentrationen im Plasma) wurden schon bei ca. 80 mg/kg KG, Verminderung der Prostata-Gewichte bei männlichen Jungtieren bei 40 mg/kg KG gefunden.
Untersuchungen an Ratten und Mäusen haben keine Hinweise auf teratogene Wirkungen ergeben.
Für den Menschen liegen über die Sicherheit einer Anwendung während der Schwangerschaft keine ausreichenden Erfahrungen vor.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Maisstärke
Calciumhydrogenphosphat-Dihydrat Natriumdodecylsulfat Hochdisperses Siliciumdioxid Povidon K 25
Magnesiumstearat (Ph.Eur.)
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Blisterpackung mit Tabletten in Faltschachtel
Packung mit 20 Tabletten Packung mit 50 Tabletten Packung mit 100 Tabletten
Packung (Klinikpackung) mit 200 Tabletten
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
mibe GmbH Arzneimittel Münchener Straße 15 06796 Brehna Tel.: 034954/247-0 Fax: 034954/247-100
8. ZULASSUNGSNUMMERN
Jenaspiron 50 mg: 219.00.01
Jenaspiron 100 mg: 219.01.01
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Jenaspiron 50 mg: 08.05.1979/24.02.2004
Jenaspiron 100 mg: 07.05.1979/24.02.2004
10. STAND DER INFORMATION
02.2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig.
spcde-j enaspiron-201402 10