Jext 150 Mikrogramm Injektionslösung In Einem Fertigpen
SUMMARY OF PRODUCT CHARACTERISTICS Jext® 150 microgram
Jext® 150 Mikrogramm Injektionslösung in einem Fertigpen
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Ein Fertigpen gibt eine Dosis von 0,15 ml Injektionslösung mit 150 Mikrogramm Epinephrin (als Tartrat) ab.
1 ml Lösung enthält 1 mg Epinephrin (als Tartrat).
Sonstige Bestandteile: Natriummetabisulfit (E223) und Natriumchlorid.
Jext® enthält weniger als 1 mmol Natrium (23 mg) pro Dosis.
Für die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung in einem Fertigpen.
Klare und farblose Lösung.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Notfallbehandlung von schweren akuten allergischen Reaktionen (Anaphylaxie), verursacht durch Insektenstiche oder -bisse, Nahrungsmittel, Arzneimittel und andere Allergene sowie bei idiopathischer oder anstrengungsbedingter Anaphylaxie.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung:
Für Kinder mit einem Gewicht zwischen 15 kg und 30 kg ist die übliche Dosierung 150 Mikrogramm.
Bei Kindern, die weniger als 15 kg wiegen, kann eine Dosierung unter 150 Mikrogramm nicht mit ausreichender Genauigkeit gegeben werden. Daher wird die Anwendung nur empfohlen, wenn es sich um eine lebensbedrohliche Situation handelt und die Anwendung unter medizinischer Aufsicht erfolgt.
Kinder und Jugendliche mit einem Gewicht über 30 kg sollten Jext® 300 Mikrogramm verschrieben bekommen.
Eine erste Injektion sollte unverzüglich nach dem Auftreten von Symptomen einer Anaphylaxie gegeben werden.
Die wirksame Dosis liegt normalerweise in einem Bereich von 0,005 - 0,01 mg/kg Körpergewicht, es können aber in einigen Fällen auch höhere Dosierungen notwendig sein.
Bei Ausbleiben einer klinischen Verbesserung oder bei weiterer Verschlechterung kann
5 bis 15 Minuten nach der ersten Injektion eine zweite Injektion mit einem zusätzlichen Jext® gegeben werden.
Art der Anwendung:
Zur intramuskulären Anwendung.
Zum einmaligen Gebrauch.
Jext® wird in die Außenseite des Oberschenkels intramuskulär appliziert und kann durch die Kleidung oder direkt auf der Haut angewendet werden.
Die Applikationsstelle sollte nach der Injektion massiert werden, um die Aufnahme des Epinephrins zu verbessern.
Bitte lesen Sie Abschnitt 6.6 für ausführliche Hinweise zur Handhabung.
4.3 Gegenanzeigen
Es gibt keine absoluten Gegenanzeigen für die Anwendung von Jext® bei einem allergischen Notfall.
4.4 Besondere Hinweise und Vorsichtsmaßnahmen für die Anwendung
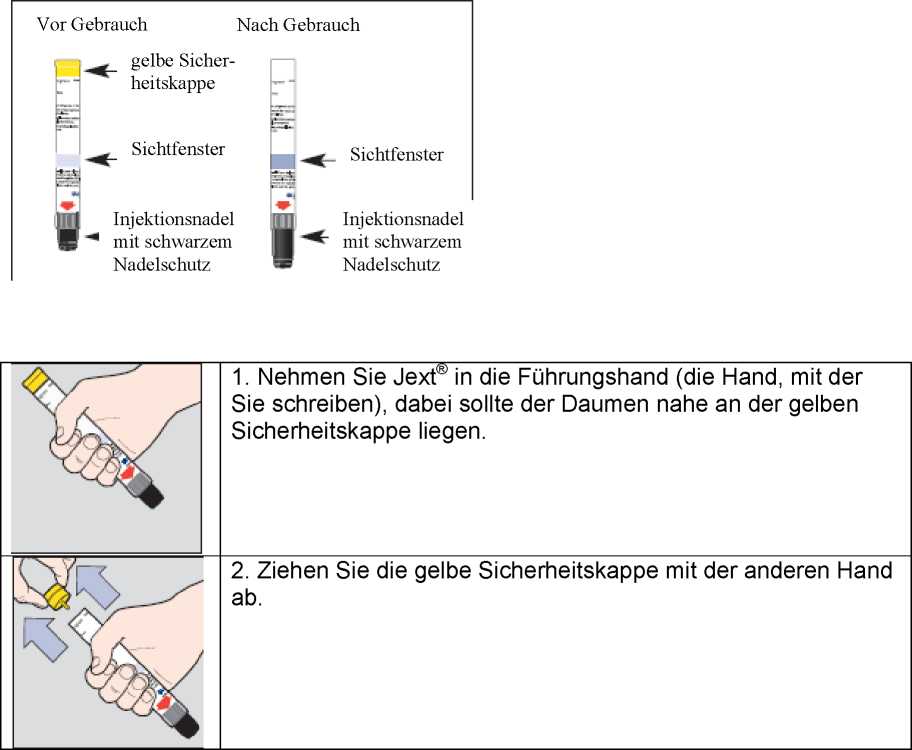
Ziehen Sie die gelbe Sicherheitskappe erst unmittelbar vor dem Gebrauch von Jext® ab.
Jext® sollte in die Außenseite des Oberschenkels verabreicht werden. Die Injektion wird sofort ausgelöst, wenn der schwarze Nadelschutz des automatischen Injektors (Autoinjektor) fest gegen die Haut oder eine andere Oberfläche (z.B. Kleidung) gepresst wird. Patienten sollten darauf hingewiesen werden, Jext® aufgrund des Risikos einer versehentlichen intravenösen Injektion nicht in das Gesäß zu injizieren.
Die Patienten sollten angewiesen werden, nach der ersten Jext®-Anwendung unverzüglich einen Notarzt zu rufen und den Begriff „Anaphylaxie“ zu nennen, damit die anaphylaktische Reaktion sorgfältig beobachtet werden kann und gegebenenfalls weiter behandelt wird.
Jext® enthält Natriummetabisulfit. Natriummetabisulfit kann in seltenen Fällen bei empfindlichen Personen, insbesondere bei Asthmatikern, schwere Überempfindlichkeitsreaktionen einschließlich anaphylaktischer Symptome und Bronchospasmus auslösen. Diese Patienten müssen sorgfältig aufgeklärt werden, in welchen Situationen Jext® angewendet werden soll.
Aufgrund eines erhöhten Nebenwirkungsriskos nach einer Epinephrinanwendung ist bei Patienten mit Herz-Kreislauf-Erkrankungen wie Angina pectoris, obstruktiver Kardiomyopathie, Herzrhythmusstörungen, Cor pulmonale, Atherosklerose und Bluthochdruck besondere Vorsicht geboten.
Besondere Vorsicht ist auch geboten bei Patienten mit Hyperthyreose, Phäochromozytom, Engwinkelglaukom, schwerer Nierenfunktionsstörung, Prostataadenom mit Restharnbildung, Hyperkalzämie, Hypokaliämie und Diabetes mellitus.
Vorsicht ist geboten bei älteren Patienten und schwangeren Patientinnen.
Eine periphere Ischämie infolge einer versehentlichen Injektion in Hände oder Füße kann zur Unterbrechung des Blutflusses in angrenzenden Arealen durch Vasokonstriktion führen.
Alle Patienten, die Jext® verschrieben bekommen, sollen umfassend informiert werden, damit sie die Indikation und die korrekte Art der Anwendung verstehen.
Es liegt häufig ein längerer Zeitraum zwischen einer Verschreibung von Jext® und einer allergischen Reaktion, die die Anwendung von Jext® erfordert. Patienten sollen angewiesen werden, Jext® regelmäßig zu überprüfen und sicherzustellen, dass Jext® direkt zum oder noch vor Ablauf des Verfalldatums ersetzt wird.
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Anwendung, d.h. es ist im Wesentlichen natriumfrei.
Die Anwendung von Jext® kann bei Dopingkontrollen zu positiven Ergebnissen führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bei Patienten, die proarrhythmisch wirkende Arzneimittel, einschließlich Digitalis und Chinidin, erhalten, ist Vorsicht geboten.
Die Wirkung von Epinephrin kann durch trizyklische Antidepressiva, Monoaminooxidase-Hemmer (MAO-Hemmer) und Catechol- o-Methyltransferase (COMT)-Inhibitoren verstärkt werden.
Epinephrin hemmt die Insulinsekretion und erhöht somit den Blutzuckerspiegel. Es ist möglich, dass Diabetiker, die Epinephrin erhalten, ihre Insulindosis oder die Dosis von oralen Antidiabetika erhöhen müssen.
Die Alpha- und Beta-stimulierende Wirkung kann sowohl durch gleichzeitig verabreichte Alpha- und Betablocker als auch durch Parasympathomimetika gehemmt werden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Es gibt nur begrenzt klinische Erfahrung mit der Anaphylaxiebehandlung während der Schwangerschaft. Epinephrin darf während der Schwangerschaft nur angewendet werden, wenn der mögliche Nutzen das potenzielle Risiko für das Ungeborene rechtfertigt.
Epinephrin ist nicht oral verfügbar. Von in die Muttermilch übergetretenem Epinephrin sind keine Wirkungen auf den gestillten Säugling zu erwarten.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Jext® hat keinen oder vernachlässigbaren Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen. Trotzdem wird den Patienten empfohlen, nach der Anwendung von Epinephrin kein Fahrzeug zu führen und keine Maschine zu bedienen, da sie durch die anaphylaktische Reaktion beeinträchtigt sind.
4.8 Nebenwirkungen
Nebenwirkungen, die durch die Alpha- und Beta-Rezeptoraktivität des Epinephrins bedingt sind, können sowohl das Herz-Kreislauf-System als auch das zentrale Nervensystem betreffen.
Die nachfolgende Tabelle basiert auf Erfahrungen nach Markteinführung mit der Anwendung von Epinephrin. Häufigkeiten können aus den verfügbaren Daten nicht abgeleitet werden.
|
Systemorganklassen |
Nebenwirkung |
|
Stoffwechsel- und Ernährungsstörungen |
Hyperglykämie, Hypokaliämie, metabolische Azidose |
|
Psychiatrische Erkrankungen |
Angst, Halluzinationen |
|
Erkrankungen des Nervensystems |
Kopfschmerzen, Schwindel, Tremor, Synkope |
|
Erkrankungen des Herzens |
Tachykardie, Arrhythmie, Herzklopfen, Angina pectoris, Stress-Kardiomyopathie |
|
Gefäßerkrankungen |
Hypertonie, Vasokonstriktion, periphere Ischämie |
|
Erkrankungen der Atemwege, des Brustraums und des Mediastinums |
Bronchospasmus |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Erbrechen |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Hyperhidrose, Asthenie |
Es gibt Berichte über periphere Ischämie durch eine versehentliche Injektion von Epinephrin in Hände oder Füße.
Jext® enthält Natriummetabisulfit, das in seltenen Fällen zu schweren Überempfindlichkeitsreaktionen einschließlich Anaphylaxie und Bronchospasmus führen kann (siehe Abschnitt 4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-
Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das nationale Meldesystem anzuzeigen:
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de
4.9 Überdosierung
Eine Überdosierung oder versehentliche intravaskuläre Injektion von Epinephrin kann aufgrund von Bluthochdruckspitzen zu zerebralen Blutungen und ventrikulären Arrhythmien führen. Es können myokardiale Ischämien und Nekrosen sowie Nierenfunktionsstörungen auftreten. Durch periphere Gefäßverengung bei gleichzeitiger kardialer Stimulation kann es zu einem akuten Lungenödem kommen, das zum Tod führen kann. Ein Lungenödem kann durch die Gabe eines Alpha-Rezeptorblockers wie Phentolamin behandelt werden. Bei Herzrhythmusstörungen können Betablocker angewendet werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Kardiostimulantien exkl. Herzglykoside, adrenerge und dopaminerge Mittel ATC-Code: C01CA24
Epinephrin ist ein Katecholamin, das das sympathische Nervensystem (Alpha- und BetaRezeptoren) stimuliert, wodurch Herzfrequenz, Herzleistung und Koronardurchblutung gesteigert werden. Die Wirkung von Epinephrin auf die Beta-Rezeptoren in der Bronchialmuskulatur führt zu einer Entspannung der Bronchialmuskulatur, wodurch Giemen und Dyspnoe gebessert werden.
5.2 Pharmakokinetische Eigenschaften
Epinephrin ist eine natürlich vorkommende Substanz, die vom Nebennierenmark als Reaktion auf körperliche Anstrengung oder Stress ausgeschüttet wird. Es wird rasch vom Körper, vor allem durch die Enzyme COMT und MAO, abgebaut. Die Leber ist reich an diesen Enzymen und ist ein wichtiges, wenn auch nicht entscheidendes Organ im Abbauprozess. Ein großer Teil der Epinephrindosis wird durch Exkretion von Metaboliten mit dem Urin ausgeschieden.
Die Halbwertszeit von Epinephrin im Plasma beträgt 2,5 Minuten. Allerdings kann durch lokale Blutgefäßverengung die Aufnahme verzögert werden, sodass der Effekt länger anhalten kann als die Halbwertszeit annehmen lässt. Die Applikationsstelle sollte nach der Injektion massiert werden, um die Absorption des Epinephrins zu verbessern.
Epinephrin wird seit vielen Jahren bei der Behandlung von allergischen Notfällen eingesetzt. Es sind keine relevanten präklinischen Daten verfügbar.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Natriumchlorid Natriummetabisulfit (E223)
Salzsäure (zur Einstellung des pH-Werts)
Wasser für Injektionszwecke
6.2 Inkompatibilitäten
Da keine Kompatibilitätsstudien durchgeführt wurden, sollte dieses Arzneimittel nicht mit anderen Arzneimitteln gemischt werden.
6.3 Haltbarkeit
18 Monate
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht einfrieren.
6.5 Art und Inhalt des Behältnisses
Fertigpen, bestehend aus einem automatischen Injektor und einer Patrone aus Typ 1-Glas. Die Patrone (Karpule) wird mit einem Latex-freien grauen Brombutylgummikolben und mit einem Latex-freien Brombutylgummistopfen, der sich in einer anodisierten Aluminiumkappe befindet, verschlossen.
Der automatische Injektor besteht aus Plastik.
Packungsgröße: 1 Fertigpen.
6.6 Besondere Vorsichtmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Jext® ist ein einfach zu handhabender Fertigpen zum einmaligen Gebrauch.
Der Fertigpen wird durch einfaches Anpressen des schwarzen Nadelschutzes an die äußere Seite des Oberschenkels angewendet. Der dadurch aktivierte Kolben drückt eine versteckte Nadel durch eine Membran in der schwarzen Spitze des Injektors in den Muskel und setzt so das Epinephrin frei. Die Applikation kann auch durch Kleidung erfolgen.
Jext® enthält 1,4 ml einer Lösung mit 1 mg Epinephrin pro ml und gibt bei der Anwendung einmal eine Dosis (0,15 ml) von 150 Mikrogramm Epinephrin ab. Nach der Anwendung von Jext® bleiben 1,25 ml Restflüssigkeit im Fertigpen zurück. Entsorgen Sie den benutzten Fertigpen ordnungsgemäß.
Im Sichtfenster des Pens kann manchmal eine kleine Luftblase sichtbar sein, die keinen Einfluss auf den Gebrauch oder die Wirksamkeit des Produkts hat.
Der verschreibende Arzt kann während der Schulung des Patienten einen Jext® -Simulator verwenden. Dies ist ein Fertigpen ohne Nadel und ohne Epinephrin, der auch für Patienten, Angehörige und Betreuer erhältlich ist, die die Anwendung zu Hause üben möchten.
Hinweis: Die gelbe Sicherheitskappe verhindert eine Aktivierung des Pens. Ziehen Sie die gelbe Sicherheitskappe erst unmittelbar vor dem Gebrauch von Jext® ab.
Der schwarze Nadelschutz des Injektors sollte von der Hand ferngehalten werden.
|
3. Halten Sie den schwarzen Nadelschutz in einem rechten Winkel (circa 90°) an die Außenseite des Oberschenkels. | ||
|
- /(löl Y' a VsEcy |
4. Drücken Sie den schwarzen Nadelschutz fest gegen die Außenseite des Oberschenkels, bis Sie ein Klicken hören. Das Klicken zeigt Ihnen, dass die Injektion begonnen hat. Drücken Sie Jext® weiter fest an. Halten Sie den Fertigpen für 10 Sekunden in dieser Position am Oberschenkel (zählen Sie langsam von 1 bis 10) und entfernen Sie den Pen dann. Der schwarze Nadelschutz fährt automatisch weiter aus und verdeckt die Nadel. | |
|
/ ) |
5. Massieren Sie den Bereich um die Injektionsstelle für 10 Sekunden. Rufen Sie sofort medizinische Hilfe. Rufen Sie den Notarzt und nennen Sie den Begriff „Anaphylaxie“. |
Nach Ablauf des Verfalldatums sollte das Arzneimittel nicht mehr verwendet und entsprechend den nationalen Anforderungen entsorgt werden.
Die Lösung sollte regelmäßig durch das Sichtfenster auf dem Fertigpen geprüft werden, um sicherzustellen, dass sie klar und farblos ist.
Durch Licht- oder Lufteinfluss kann sich die Lösung dunkel verfärben.
Wenn die Lösung verfärbt ist, einen Niederschlag enthält, spätestens aber kurz vor Ablauf der Haltbarkeit muss der Fertigpen entsorgt und durch einen Neuen ersetzt werden.
Das Verfalldatum ist auf dem Etikett angegeben. Jext® sollte nach Ablauf des Verfalldatums nicht mehr verwendet werden.
7. ZULASSUNGSINHABER
ALK-Abello A/S B0ge Alle 6-8 DK-2970 H0rsholm
Örtlicher Vertreter:
ALK-Abello Arzneimittel GmbH Griegstrasse 75 (Haus 25)
D-22763 Hamburg
80540.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
28/12/2010
10. STAND DER INFORMATION
11/2013
11. VERKAUFSABGRENZUNG
V erschreibungspflichtig
Page 10 of 10