Juliette
FACHINFORMATION
(Zusammenfassung der Merkmale des Arzneimittels)
Dieses Arzneimittel unterliegt einer zusätzlichen Überwachung. Dies ermöglicht eine schnelle Identifizierung neuer Erkenntnisse über die Sicherheit. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung zu melden. Hinweise zur Meldung von Nebenwirkungen, siehe Abschnitt 4.8.
1. BEZEICHNUNG DES ARZNEIMITTELS
Juliette® • überzogene Tabletten • 2 mg Cyproteronacetat / 0,035 mg Ethinylestradiol
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede überzogene Tablette enthält:
2 mg Cyproteronacetat und 0,035 mg Ethinylestradiol.
Sonstige Bestandteile mit bekannter Wirkung:
Jede überzogene Tablette enthält 31,115 mg Lactose-Monohydrat und 19,371 mg Sucrose. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Überzogene Tablette
Die Tabletten sind rund, beigefarben und ohne weitere Markierungen.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Behandlung mäßig schwerer bis schwerer Akne aufgrund von Androgenempfindlichkeit (mit oder ohne Seborrhö) und/oder Hirsutismus bei Frauen im gebärfähigen Alter.
Juliette sollte erst nach dem Versagen einer topischen Therapie oder systemischer Antibiotikabehandlungen zur Aknetherapie angewendet werden.
Da es sich bei Juliette gleichzeitig um ein hormonales Kontrazeptivum handelt, darf es nicht in Kombination mit anderen hormonalen Kontrazeptiva angewendet werden (siehe Abschnitt 4.3).
4.2 Dosierung und Art der Anwendung
Juliette unterdrückt die Ovulation und ist damit kontrazeptiv wirksam. Patientinnen, die Juliette anwenden, sollten deshalb nicht zusätzlich ein hormonelles Empfängnisverhütungsmittel anwenden, da dies zu einer Überdosierung mit Hormonen führt und für einen effektiven Konzeptionsschutz nicht erforderlich ist.
Dosierung
Erster Behandlungszyklus: Eine Tablette täglich über 21 Tage, beginnend am ersten Tag des Menstruationszyklus (der erste Tag der Menstruation zählt als Tag 1).
Nachfolgende Zyklen: Jeder weitere Einnahmezyklus wird nach einem therapiefreien Intervall von 7 Tagen begonnen, das dem vorherigen Einnahmezyklus folgt.
Wenn auch die kontrazeptive Wirkung von Juliette zum Einsatz kommen soll, müssen die oben angeführten Anweisungen unbedingt eingehalten werden. Tritt während der tablettenfreien Tage keine Blutung ein, muss die Möglichkeit einer Schwangerschaft vor Anbruch der nächsten Packung ausgeschlossen werden.
Beim Wechsel von einem oralen Kontrazeptivum sollten die nachfolgenden Anweisungen eingehalten werden, wenn die empfängnisverhütende Wirkung von Juliette gewährleistet sein soll:
Wechsel von einem kombinierten oralen Kontrazeptivum mit Tabletten für 21 Einnahmetage: Die erste Tablette Juliette sollte am ersten Tag unmittelbar nach Ende des Einnahmezyklus des vorhergehenden oralen Kontrazeptivums eingenommen werden. Zusätzliche kontrazeptive Maßnahmen sind nicht erforderlich.
Wechsel von einem kombinierten oralen Kontrazeptivum zur täglichen Einnahme (Tabletten für 28 Einnahmetage): Die Einnahme von Juliette sollte nach Einnahme der letzten wirkstoffhaltigen Tablette aus der Packung des oralen Kontrazeptivums zur täglichen Einnahme begonnen werden. Die erste Tablette Juliette wird am nächsten Tag eingenommen. Zusätzliche kontrazeptive Maßnahmen sind dann nicht erforderlich.
Wechsel von einem ausschließlich Gestagen enthaltenden oralen Kontrazeptivum („Minipille “): Die erste Tablette Juliette sollte am ersten Tag der Blutung genommen werden, selbst wenn bereits ein ausschließlich Gestagen enthaltendes orales Kontrazeptivum an diesem Tag eingenommen wurde. Zusätzliche kontrazeptive Maßnahmen sind dann nicht erforderlich. Die restlichen Tabletten des ausschließlich Gestagen enthaltenden oralen Kontrazeptivums sollten verworfen werden.
Anwendung nach Entbindung oder Abort: Nach einer Schwangerschaft kann mit der Einnahme von Juliette 21 Tage nach einer vaginalen Entbindung begonnen werden, vorausgesetzt, die Patientin ist vollständig genesen und es sind keine Wochenbett-Komplikationen aufgetreten. Zusätzliche kontrazeptive Maßnahmen sind während der ersten 7 Tage der Pilleneinnahme erforderlich. Da die erste Ovulation nach der Entbindung vor der ersten Blutung eintreten kann, sollte in der Zeit zwischen der Geburt und dem ersten Tabletten-Zyklus ein anderer Konzeptionsschutz angewendet werden. Nach einem Abort im ersten Trimester kann mit der Anwendung von Juliette sofort begonnen werden; in diesem Fall sind keine zusätzlichen kontrazeptiven Maßnahmen erforderlich.
Dauer der Anwendung
Die Zeit bis zur Linderung der Symptome beträgt mindestens drei Monate. Der behandelnde Arzt sollte regelmäßig überprüfen, ob weiterhin ein Bedarf für die Behandlung besteht.
Besondere Umstände, die eine zusätzliche Kontrazeption erfordern
Anwendungsfehler: Die Einnahme einer vergessenen Tablette sollte sobald wie möglich nachgeholt werden; ist dies innerhalb von 12 Stunden nach dem korrekten Einnahmezeitpunkt, bleibt der Konzeptionsschutz bestehen. Bei längeren Verzögerungen der Einnahme wird ein zusätzlicher Konzeptionsschutz benötigt. Es sollte nur die zuletzt vergessene Tablette genommen werden, jedoch nicht bereits schon vorher ausgelassene Tabletten. Die nächsten 7 Tage sollten zusätzlich zur Einnahme der folgenden 7 Tabletten nicht-hormonelle Methoden der Kontrazeption (mit Ausnahme der Kalender- oder Temperaturmethode) angewendet werden. Zudem sollte, wenn eine Tablette/mehrere Tabletten während der letzten 7 Tage einer Packung ausgelassen wurden, vor Anbruch der nächsten Packung keine Pause eingelegt werden. In diesem Fall sollte eine Entzugsblutung nicht vor dem Aufbrauchen der 2. Packung erwartet werden. Eine leichte Durchbruchblutung kann an den Tagen auftreten, an denen Tabletten eingenommen werden; dies ist jedoch klinisch nicht bedeutsam. Tritt bei einer Patientin während des tablettenfreien Intervalls nach dem Aufbrauchen der 2. Packung keine Entzugsblutung ein, muss vor Anbruch der nächsten Packung die Möglichkeit einer Schwangerschaft ausgeschlossen werden.
Gastrointestinale Beschwerden: Die Wirksamkeit oraler Kontrazeptiva kann durch Erbrechen oder Diarrhö wegen der Verhinderung einer vollständigen Resorption herabgesetzt sein. Die Einnahme der Tabletten sollte fortgesetzt werden. Während der Dauer der gastrointestinalen Beschwerden, sowie für 7 Tage danach sollten zusätzliche nicht-hormonelle Methoden der Kontrazeption (mit
Ausnahme der Kalender- oder Temperaturmethode) angewendet werden. Gehen diese 7 Tage über das Ende einer Packung hinaus, sollte die Einnahme aus der nächsten Packung ohne Unterbrechung beginnen. In diesem Fall ist eine Entzugsblutung nicht vor dem Aufbrauchen der 2. Packung zu erwarten. Tritt bei einer Patientin während des tablettenfreien Intervalls nach dem Aufbrauchen der
2. Packung keine Entzugsblutung ein, muss vor Beginn der Einnahme aus der nächsten Packung die Möglichkeit einer Schwangerschaft ausgeschlossen werden. Andere Methoden der Kontrazeption sollten in Erwägung gezogen werden, wenn zu erwarten ist, dass die gastrointestinalen Beschwerden länger andauern.
Art der Anwendung Zum Einnehmen.
4.3 Gegenanzeigen
• Gleichzeitige Anwendung eines anderen hormonalen Kontrazeptivums (siehe Abschnitt 4.1)
Präparate mit Estrogen/Gestagen-Kombinationen dürfen nicht beim Vorliegen einer der unten aufgeführten Zustände angewendet werden. Sollte eine der Zustände zum ersten Mal während der Einnahme auftreten, muss das Arzneimittel sofort abgesetzt werden.
• Bestehende oder vorausgegangene Venenthrombose (VTE) (z. B. tiefe Venentrombose, Lungenembolie), größere chirurgische Eingriffe mit längerfristiger Immobilisierung
• Bestehende oder vorausgegangene Arterienthrombose oder vorausgehende Erkrankungen (Schlaganfall (z. B transitorische ischämische Attacke, ischämischer Schlaganfall, hämorrhagischer Schlaganfall), Angina pectoris, Myokardinfarkt)
• Vererbte oder erworbene, für venöse oder arterielle Thromboembolien prädisponierende Zustände, z. B. Störungen der Blutgerinnung (wie Resistenz gegenüber aktiviertem Protein C (APC-Resistenz)), Herzklappenerkrankungen und Vorhofflimmern, bekannte thrombogene Mutationen (wie Antithrombin-III-Mangel, Protein-C-Mangel, Protein-S-Mangel, Hyperhomocysteinämie und Antiphospholipid-Antikörper (Anticardiolipin-Antikörper, Lupus-Antikoagulans))
• Vorhandensein schwerer und/oder mehrerer Risikofaktoren für eine Venen- oder Arterienthrombose (siehe Abschnitt 4.4) wie z.B.
o Schwerer Diabetes mellitus mit Gefäßveränderungen o Schwere oder unkontrollierte Hypertonie oder Hypertonie, einhergehend mit vaskulären Erkrankungen o Schwere Dyslipoproteinämie
• Migräne mit fokalen neurologischen Symptomen in der Anamnese
• Bestehende oder frühere schwere Lebererkrankung, z. B. aktive virale Hepatitis und schwere Zirrhose, solange sich die Leberfunktionswerte nicht normalisiert haben
• Bestehende Lebertumore oder Lebertumore in der Anamnese (benigne oder maligne)
• Bestehender Brustkrebs oder Brustkrebs in der Anamnese
• Bekannte oder vermutete Schwangerschaft (siehe Abschnitt 4.6)
• Stillzeit (siehe Abschnitt 4.6)
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
Relevante klinische Leitlinien zu KOK sollten ebenfalls beachtet werden.
Juliette soll nicht von Männern angewendet werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung Ärztliche Untersuchung
Die Untersuchung von Frauen vor Behandlungsbeginn mit oralen Kontrazeptiva (und danach in regelmäßigen Abständen) sollte eine persönliche Anamnese und eine Familienanamnese mit einschließen. Die körperliche Untersuchung sollte sich daran, ebenso wie an den Gegenanzeigen (Abschnitt 4.3) und Wamhinweisen (Abschnitt 4.4) für dieses Arzneimittel orientieren. Die Häufigkeit und Art dieser Untersuchungen sollte auf den entsprechenden Richtlinien basieren und an die Bedürfnisse der jeweiligen Frau angepasst werden. Sie sollten jedoch eine Blutdruckmessung und - falls es vom Arzt für erforderlich gehalten wird - eine Untersuchung der Brust, des Bauch- und Beckenraumes einschließlich Zervixzytologie mit einschließen.
Vor Beginn der Behandlung ist die Wahrscheinlichkeit einer Schwangerschaft auszuschließen.
Nicht abgeklärte vaginale Blutungen, bei denen der Verdacht auf eine zugrundeliegende Erkrankung vorliegt, sollten abgeklärt werden.
Warnhinweise:
Juliette besteht aus dem Gestagen Cyproteronacetat und dem Estrogen Ethinylestradiol und wird über 21 Tage eines monatlichen Zyklus verabreicht. Es hat eine ähnliche Zusammensetzung wie ein kombiniertes orales Kontrazeptivum (KOK).
Frauen sollten darauf hingewiesen werden, dass Juliette nicht vor HIV-Infektionen (AIDS) und anderen sexuell übertragbaren Krankheiten schützt.
Zustände, die eine strenge ärztliche Aufsicht erfordern
Liegt eine der nachstehend erwähnten Erkrankungen/Risikofaktoren vor, sollte der Nutzen der Anwendung von Juliette gegen die möglichen Risiken für die Frau abgewogen und mit dieser diskutiert werden, bevor sie sich dazu entschließt, Juliette anzuwenden. Bei einer Verschlimmerung/Exazerbation oder dem ersten Auftreten einer dieser Erkrankungen oder Risikofaktoren sollte die Frau sich an Ihren Arzt wenden. Der Arzt sollte dann entscheiden, ob die Anwendung von Juliette beendet werden sollte.
• Diabetes mellitus mit leichten Gefäßveränderungen, oder leichte Nephropathie, Retinopathie oder Neuropathie
• Hypertonie, die ausreichend kontrolliert wird, d. h. systolisch > 140 mmHg bis 159 mmHg oder diastolisch > 90mmHg bis 94mmHg (siehe auch Abschnitt 4.4 „Gründe für ein sofortiges Absetzen von Juliette “)
• Porphyrie
• klinisch relevante Depressionen
• Adipositas
• Migräne
• Herz-Kreislauf-Erkrankungen
• Chloasma
Patienten mit Depressionen oder einer der oben genannten Erkrankungen in der Anamnese sollten während der Behandlung mit Juliette überwacht werden.
Gründe für ein sofortiges Absetzen von Juliette
Bei Beendigung einer oralen Kontrazeption sollte - wenn notwendig - eine nicht-hormonelle Verhütung angewendet werden, um den Empfängnisschutz weiterhin zu gewährleisten.
1. migräneartige Kopfschmerzen, die erstmalig oder verstärkt auftreten oder ungewöhnlich häufig oder ungewohnt stark auftretende Kopfschmerzen.
2. akute Seh- oder Hörstörungen oder andere Wahrnehmungsstörungen.
3. erste Anzeichen einer Thrombose oder von Blutgerinnseln (z. B. ungewöhnliche Schmerzen oder Schwellungen in einem oder beiden Beinen, stechende Schmerzen beim Atmen oder Husten unklarer Ursache). Schmerzen und Engegefühl in der Brust.
4. Sechs Wochen vor einer geplanten größeren Operation (z. B. abdominal, orthopädisch), jegliche chirurgische Eingriffe an den Beinen, ärztliche Behandlung von Varizen oder längere Immobilisation, z. B. nach Unfällen oder einer Operation; mit der Einnahme darf nicht früher als zwei Wochen nach vollständiger Mobilisierung wieder begonnen werden; bei Notoperationen ist üblicherweise eine Thromboseprophylaxe indiziert, z. B. mit Heparin subkutan;
5. Auftreten von Gelbsucht, Hepatitis oder generalisiertem Pruritus.
6. stärkerer Blutdruckanstieg.
7. Einsetzen von schweren Depressionen.
8. starke Oberbauchschmerzen oder Lebervergrößerung.
9. deutliche Verschlechterung von Erkrankungen, die sich bekanntermaßen während der Anwendung von hormonellen Kontrazeptiva oder während einer Schwangerschaft verschlechtern (siehe Abschnitt 4.4 „Erkrankungen, die sich während der Schwangerschaft oder während einer früheren KOK-Behandlung verschlechtern“).
10. Schwangerschaft ist ein Grund für das sofortige Absetzen (siehe Abschnitt 4.6).
Kreislauferkrankungen
Frauen, die Juliette anwenden, sollten spezifisch darauf hingewiesen werden, sich bei möglichen Symptomen einer Thrombose an Ihren Arzt zu wenden. Bei einer vermuteten oder bestätigten Thrombose ist Juliette abzusetzen. Aufgrund der Teratogenität von Antikoagulanzien (Kumarine) sollten geeignete Verhütungsmethoden verwendet werden.
• Venöse Thromboembolien
Die Anwendung kombinierter oraler Kontrazeptiva (KOK) oder von Juliette birgt ein erhöhtes Risiko für das Auftreten venöser Thromboembolien (VTE), einschließlich tiefer venöser Thrombosen und Lungenembolien, im Vergleich zur Nichtanwendung von KOK. In sehr seltenen Fällen wurde bei Anwenderinnen hormonaler Kontrazeptiva vom Auftreten einer Thrombose in anderen Blutgefäßen, z. B. Arterien und Venen der Leber, des Mesenteriums, der Niere, des Gehirns oder der Netzhaut berichtet.
Das zusätzliche VTE-Risiko ist während des ersten Jahres einer erstmaligen Anwendung von Juliette durch eine Frau oder bei der erneuten Aufnahme oder einem Wechsel nach einer mindestens einen Monat langen pillenfreien Zeit am größten. Dieses erhöhte Risiko bei der Anwendung eines KOK ist niedriger als das VTE-Risiko bei einer Schwangerschaft, das auf 60 Fälle pro 100.000 Schwangerschaften geschätzt wird.
Die vollständige Genesung von einer solchen Erkrankung ist nicht immer möglich, in 1-2 % der Fälle führt eine VTE zum Tode.
Epidemiologische Studien haben gezeigt, dass die Inzidenz von VTE bei Anwenderinnen von Juliette 1,5- bis 2-mal so groß ist wie bei Anwenderinnen von Levonorgestrel-haltigen kombinierten oralen Kontrazeptiva (KOK) und möglicherweise ähnlich dem Risiko für Desogestrel-/Gestoden-/Drospirenon-haltige KOK.
Epidemiologische Studien haben gezeigt, dass die Inzidenz venöser Thromboembolien (VTE) bei Anwenderinnen oraler Kontrazeptiva mit niedrigem Estrogengehalt (< 50 pg Ethinylestradiol) bei bis zu 40 Fällen pro 100.000 Frauenjahre liegt. Im Vergleich dazu beträgt die Inzidenz unter den Nichtanwenderinnen 5 bis 10 Fälle pro 100.000 Frauenjahre.
In epidemiologischen Studien haben sich Anzeichen dafür ergeben, dass die Inzidenz von VTE bei der Anwendung von Juliette höher ist als bei der Anwendung von KOK mit geringem Estrogengehalt (< 50 pg Ethinylestradiol).
Zu den häufigen Anzeichen/Symptomen von arteriellen Thromboembolien und zerebrovaskulärem Insult zählen:
• ungewöhnliche, einseitige Schmerzen oder Schwellung eines Beins
• plötzlich einsetzende starke Schmerzen in der Brust, unabhängig davon, ob diese in den linken Arm ausstrahlen oder nicht
• plötzliche Atemnot
• plötzlich einsetzender Husten
• ungewöhnliche, schwere, länger anhaltende Kopfschmerzen
• plötzlicher partieller oder vollständiger Verlust des Sehvermögens
• Diplopie;
• schleppende Sprache oder Aphasie;
• Vertigo (Schwindel);
• Kollaps mit oder ohne fokalem Anfall;
• Schwäche oder sehr deutliches Taubheitsgefühl, die/das plötzlich eine Seite oder ein Teil des Körpers befällt;
• motorische Störungen.
• „akutes“ Abdomen.
Das Risiko für venöse thromboembolische Ereignisse steigt mit:
• zunehmendem Alter
• Rauchen (mit zunehmendem Tabakkonsum und Alter steigt das Risiko weiter an, insbesondere bei Frauen, die älter als 35 Jahre sind. Frauen, die älter als 35 Jahre sind, sollte dringend geraten werden, nicht zu rauchen, wenn sie Juliette anwenden wollen);
• Adipositas (Body-Mass-Index über 30 kg/m2)
• positive Familienanamnese (d. h. Auftreten von venösen oder arteriellen thromboembolischen Ereignissen bei einem Geschwister- oder Elternteil in relativ jungen Jahren). Wenn eine vererbte oder erworbene Prädisposition vermutet wird, sollte eine fachärztliche Abklärung erfolgen, bevor über die Anwendung von Juliette oder eines Kombinationspräparates zur hormonalen oralen Kontrazeption entschieden wird (siehe Abschnitt 4.4 für weitere Informationen über biochemische Faktoren unter „Andere Faktoren, die das Herz-Kreislauf-System betreffen“).
• längerfristiger Immobilisation (Bettlägerigkeit), einer großen Operation, einer Beinoperation oder einem schweren Trauma. In diesen Situationen wird empfohlen, das orale Kontrazeptivum oder Juliette abzusetzen (bei einer elektiven Operation mindestens
6 Wochen im voraus) und mit der Einnahme, erst wieder 2 Wochen nach vollständiger Mobilisierung zu beginnen. Wenn die Anwendung von Juliette nicht im Voraus abgesetzt wurde, ist eine Therapie mit einem Antithrombotikum in Erwägung zu ziehen.
Über die mögliche Bedeutung von Varizen und oberflächlicher Thrombophlebitis bei einer venösen Thromboembolie besteht kein Konsens.
Bei Behandlungs-Wiederaufnahme muss das erhöhte Risiko einer Thromboembolie im Wochenbett in Betracht gezogen werden (siehe Abschnitt 4.2 und für Informationen zu “Schwangerschaft und Stillzeit“ siehe Abschnitt 4.6)
• Arterielle thromboembolische Ereignisse
Epidemiologische Studien haben die Anwendung hormonaler Kontrazeptiva oder von Juliette außerdem mit einem erhöhten Risiko für Schlaganfall, transitorische ischämische Attacken und Myokardinfarkt in Verbindung gebracht, die sekundär nach arteriellen Thromboembolien auftreten. Das Risiko für arterielle thromboembolische Komplikationen oder einen zerebrovaskulären Insult steigt mit:
• Zunehmendem Alter
• Rauchen (mit zunehmendem Tabakkonsum und Alter steigt das Risiko weiter an, insbesondere bei Frauen, die älter als 35 Jahre sind. Frauen, die älter als 35 Jarhe sind, sollte dringen geraten werden, nicht zu rauchen, wenn sie Juliette anwenden wollen)
• positiver Familienanamnese (d. h. Auftreten von venösen oder arteriellen thromboembolischen Ereignissen bei einem Geschwister- oder Elternteil in relativ jungen Jahren). Wenn eine vererbte oder erworbene Prädisposition vermutet wird, sollte eine fachärztliche Abklärung erfolgen, bevor über die Anwendung eines Kombinationspräparates zur hormonalen oralen Kontrazeption oder über Juliette entschieden wird.
• Adipositas (Body-Mass-Index über 30 kg/m2)
• Dyslipoproteinämie (Fettstoffwechselstörungen)
• Hypertonie
• Herzklappenerkrankung
• Vorhofflimmern
• Migräne. Ein Anstieg der Häufigkeit oder der Schwere von Migräne (möglicherweise als Prodromalstadium eines zerebrovaskulären Ereignisses) unter KOK oder Juliette, kann ein Grund für das sofortige Absetzen eines KOK oder von Juliette sein.
Andere Faktoren, die das Herz-Kreislaufsystem betreffen
Es ist anzunehmen, dass unter den Anwenderinnen von Juliette, die das Arzneimittel zur Behandlung von schwerer Akne und mäßig schwerem Hirsutismus anwenden, auch Patientinnen sind, die ein erblich erhöhtes kardiovaskuläres Risiko tragen, wie es zum Beispiel mit einem polyzystischen Ovarialsyndrom assoziiert ist.
Andere Erkrankungen, die mit kardiovaskulären Störungen in Verbindung gebracht werden, sind u. a. Diabetes mellitus, systemischer Lupus erythematodes, hämolytisch-urämisches Syndrom, chronisch entzündliche Darmerkrankungen (z.B. Morbus Crohn oder Colitis ulcerosa) und Sichelzellenanämie.
Biochemische Faktoren, die Hinweise auf eine erbliche oder erworbene Prädisposition für venöse oder arterielle Thrombosen geben können, sind APC-Resistenz, Hyperhomozysteinämie, Antithrombin III-Mangel, Protein-C-Mangel, Protein-S-Mangel und Antiphospholipid-Antikörper (Antikardiolipin-Antikörper, Lupusantikoagulans).
Bei der Nutzen-Risiko-Bewertung sollte der Arzt berücksichtigen, dass die adäquate Behandlung einer Erkrankung das damit verbundene Risiko von Thrombosen verringert und dass das mit einer Schwangerschaft verbundene Risiko höher ist, als das Risiko, welches mit einer KOK- oder Juliette-Behandlung verbunden ist.
Tumore
Für Cyproteronacetat/Ethinylestradiol, wie für viele andere Steroide auch, wurde nachgewiesen, dass es bei Ratten nach Gabe sehr hoher Dosen und über den größten Teil der Lebensdauer der Tiere, ein vermehrtes Auftreten von Tumoren, einschließlich Karzinomen, der Leber hervorrief.
Die Relevanz dieser Ergebnisse für den Menschen ist nicht bekannt.
In zahlreichen epidemiologischen Studien wurde über die Risiken von Eierstock-, Endometrium-, Gebärmutterhals- und Brustkrebs bei Frauen unter kombinierter oraler Kontrazeptiva-Behandlung berichtet. Der Nachweis ist eindeutig, dass hochdosierte kombinierte orale Kontrazeptiva erheblichen Schutz sowohl gegen Eierstock-, als auch Gebärmutterkrebs bieten. Es ist jedoch nicht klar, ob niedrig dosierte KOK oder Juliette den gleichen wirksamen Schutz bieten.
• Brustkrebs
Eine Meta-Analyse von 54 epidemiologischen Studien zeigte ein geringfügig erhöhtes relatives Risiko (RR = 1,24) für die Diagnose Brustkrebs bei Frauen, die gegenwärtig kombinierte orale Kontrazeptiva (KOK) einnehmen. Das beobachtete erhöhte Risikoprofil kann auf eine frühzeitigere Diagnosestellung von Brustkrebs bei Anwenderinnen von KOK, die biologischen Wirkungen der KOK oder eine Kombination aus beidem zurückzuführen sein. Bei Frauen, die gegenwärtig kombinierte orale Kontrazeptiva einnehmen oder bei Frauen, die in den letzten 10 Jahren kombinierte orale Kontrazeptiva eingenommen haben, ist der zusätzlich diagnostizierte Brustkrebs mit größerer Wahrscheinlichkeit auf die Brust beschränkt, als der Brustkrebs, der bei Frauen diagnostiziert wird, die noch nie KOK angewandt haben.
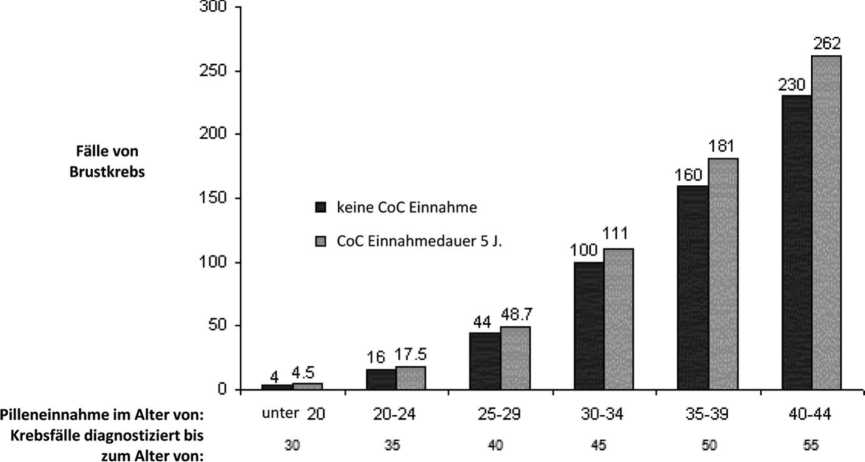
Brustkrebs tritt selten bei Frauen unter 40 Jahren auf, unabhängig davon, ob sie KOK einnehmen oder nicht. Mit dem Hintergrund, dass das Risiko mit zunehmenden Alter steigt, ist die Anzahl der zusätzlich diagnostizierten Brustkrebsfälle bei Anwenderinnen, die gegenwärtig oder in letzter Zeit KOK eingenommen haben, gering im Verhältnis zum Gesamtrisiko, an Brustkrebs zu erkranken (siehe Balkendiagramm).
Der bedeutendste Risikofaktor für Brustkrebs bei KOK-Anwenderinnen ist das Alter der Frauen beim Absetzen der KOK; je höher das Alter beim Absetzen ist, desto mehr Fälle von Brustkrebs werden diagnostiziert. Die Dauer der Anwendung ist weniger wichtig und das zusätzliche Risiko nimmt im Laufe von 10 Jahren nach Absetzen von KOK allmählich ab, so dass nach 10 Jahren kein zusätzliches Risiko mehr vorhanden zu sein scheint.
Das mögliche erhöhte Brustkrebsrisiko sollte mit der Anwenderin besprochen werden und gegen den Nutzen von KOK abgewogen werden, unter Berücksichtigung des Nachweises, dass sie einen wesentlichen Schutz gegen das Risiko der Entwicklung bestimmter anderer Krebsarten bieten (z. B. Eierstock- und Gebärmutterkrebs).
Geschätzte kumulative Anzahl von Brustkrebserkrankungen pro 10.000 Frauen, die während 5-jähriger Anwendung und bis zu 10 Jahre nach Absetzen der KOK diagnostiziert wurden, im Vergleich zu der Anzahl von Brustkrebserkrankungen, die bei 10.000 Frauen diagnostiziert wurden, die noch nie KOK angewendet haben
• Zervixkrebs
Der wichtigste Risikofaktor für Zervixkrebs ist die persistierende HPV-Infektion. Einige epidemiologische Studien haben gezeigt, dass die langfristige Anwendung kombinierter oraler Kontrazeptiva das Risiko weiter erhöhen kann. Es ist jedoch weiterhin strittig, inwieweit dieser Befund den Auswirkungen von z. B. Gebärmutterhalskrebs-Screening, unterschiedlichem Sexualverhalten, einschließlich der Verwendung von Barrieremethoden zur Empfängnisverhütung zuzuschreiben ist.
• Lebertumor
Nach der Anwendung von ähnlichen hormonellen Substanzen, wie sie auch in Juliette enthalten sind, hat man in seltenen Fällen benigne und in noch selteneren Fällen maligne Lebertumoren beobachtet, die in Einzelfallen zu lebensbedrohlichen intraabdominalen Blutungen führten. Bei einem Auftreten von starken Beschwerden im Oberbauch, einer Lebervergrößerung oder von Anzeichen für intraabdominale Blutungen sollte ein Lebertumor in die Differentialdiagnose einbezogen werden.
Sonstige Erkrankungen
Es kann nicht ausgeschlossen werden, dass sich gelegentlich bestimmte chronische Erkrankungen während der Einnahme von Juliette verschlechtern.
• Bekannte Hyperlipidämien
Frauen mit Hypertriglyzeridämie oder einer diesbezüglich vorliegenden Familienanamnese können ein erhöhtes Risiko für die Entwicklung einer Pankreatitis haben, wenn sie KOK oder Juliette einnehmen.
Frauen mit Hyperlipidämien haben ein erhöhtes Risiko für eine arterielle Verschlusskrankheit (siehe Abschnitt 4.4 „Durchblutungsstörungen“). Ein Routine-Screening von Frauen unter KOK-oder Juliette-Behandlung ist jedoch nicht angezeigt.
• Blutdruck
Bluthochdruck ist ein Risikofaktor für die Entwicklung eines Schlaganfalls und Mykardinfarkts (siehe Abschnitt 4.4 „Arterielle thromboembolische Ereignisse"). Obwohl bei vielen Frauen, die KOK, oder Estrogen/Gestagen-Kombinationen wie Juliette einnehmen, ein geringer Blutdruckanstieg berichtet wurde, sind klinisch relevante Blutdruckerhöhungen selten. Wenn sich jedoch eine anhaltende Hypertonie unter der Behandlung von Juliette entwickelt, muss eine antihypertensive Therapie in der Regel bei einem Blutdruckwert von 160/100 mmHg bei unkomplizierten Patienten, oder einem Blutdruckwert von 140/90 mmHg bei Patientinnen mit Endorganschäden, bekannter kardiovaskulärer Erkrankung, Diabetes oder bei Patientinnen mit erhöhten kardiovaskulären Risikofaktoren, eingeleitet werden. Die Entscheidung über eine Weiterbehandlung mit Juliette sollte bei niedrigeren Blutdruckwerten getroffen werden und möglicherweise ist eine alternative Verhütungsmethode ratsam.
• Erkrankungen, die sich während einer Schwangerschaft oder während einer früheren KOK- oder Juliette-Behandlung verschlechtern
Die folgenden Erkrankungen sollen Berichten zufolge sowohl in der Schwangerschaft als auch unter Anwendung eines KOKs oder von Estrogen/Gestagen-Kombinationen wie Juliette auftreten bzw. sich verschlechtern. Das Beenden der Einnahme von Juliette sollte in Erwägung gezogen werden, wenn eines der folgenden Ereignisse während der Einnahme auftritt:
• Gelbsucht und/oder cholestatischer Pruritus
• KOK oder Juliette können das Risiko für die Entstehung von Gallensteinen erhöhen und eine bereits bestehende Erkrankung verschlechtern
• systemischer Lupus erythematodes
• Herpes gestationis
• Otosklerose-bedingte Schwerhörigkeit
• Sichelzellenanämie
• Nierenfunktionsstörung
• hereditäres Angioödem
• jedes andere Ereignis, bei dem eine Frau individuell während der Schwangerschaft oder einer früheren KOK- oder Juliette-Behandlung eine Verschlechterung bemerkt.
• Leberfunktionsstörungen
Akute oder chronische Leberfunktionsstörungen können eine Unterbrechung der Anwendung des KOKs erforderlich machen, bis sich die Leberfunktionswerte wieder normalisiert haben.
• Diabetes (ohne Gefäßerkrankungen)
Insulinpflichtige Diabetiker ohne Gefäßerkrankungen können Juliette anwenden. Allerdings sollte daran gedacht werden, dass alle Diabetiker ein erhöhtes Risiko für arterielle Erkrankungen haben und dies sollte bei der Verschreibung von KOK oder Juliette berücksichtigt werden. Die Anwendung von Juliette bei Diabetikern mit bereits bestehenden Gefäßerkrankungen ist kontraindiziert (siehe Abschnitt 4.3).
Obwohl KOK oder Estrogen/Gestagen-Kombinationen wie Juliette eine Wirkung auf die periphere Insulinresistenz und Glukosetoleranz haben können, gibt es keine Belege für eine Notwendigkeit, das Therapieschema bei Diabetikern, die niedrig dosierte KOK anwenden (< 0,05 mg
Ethinylestradiol), zu ändern. Allerdings sollten Frauen mit Diabetes während der Einnahme von KOK oder Juliette sorgfältig überwacht werden.
• Chloasma
Chloasmen können gelegentlich auftreten, insbesondere bei Frauen mit Chloasma gravidarum in der Anamnese. Frauen mit dieser Veranlagung sollten sich daher während der Einnahme von Juliette nicht direkt der Sonne oder ultraviolettem Licht aussetzen.
• Veränderte Menstruationsblutung
Reduzierte Menstruationsblutung: Dies ist nicht ungewöhnlich und kann bei einigen Patientinnen auftreten. Tatsächlich kann dies von Vorteil sein, wenn vorher starke Perioden aufgetreten sind.
Ausbleibende Menstruation: Gelegentlich können Entzugsblutungen ganz ausbleiben. Wenn die Tabletten vorschriftsmäßig eingenommen wurden, ist eine Schwangerschaft unwahrscheinlich. Sollten während des tablettenfreien Intervalls keine Blutungen auftreten, muss eine Schwangerschaft ausgeschlossen werden, bevor die Einnahme mit der nächsten Packung begonnen wird.
Zwischenblutungen: Besonders während der ersten Einnahmemonate können unregelmäßige Blutungen (Schmier- oder Durchbruchblutungen) auftreten. Daher ist die Bewertung unregelmäßiger Blutungen erst nach einer Anpassungsphase von ca. drei Zyklen sinnvoll. Wenn Blutungsunregelmäßigkeiten persistieren oder nach zuvor regelmäßigen Zyklen auftreten, sollten nicht-hormonelle Ursachen in Betracht gezogen werden und geeignete diagnostische Maßnahmen ergriffen werden, um eine maligne Erkrankung oder eine Schwangerschaft auszuschließen.
Dies kann auch eine Kürettage einschließen.
Bei einigen Frauen kann nach Absetzen von Juliette eine Amenorrhö oder Oligomenorrhö auftreten, insbesondere wenn diese Krankheitsbilder vor Behandlungsbeginn vorlagen. Die Frauen sollten über diese Möglichkeit informiert werden.
Dauer der Anwendung
Die Zeit bis zur Linderung der Symptome beträgt mindestens drei Monate. Der behandelnde Arzt sollte regelmäßig überprüfen, ob weiterhin ein Bedarf für die Behandlung besteht (siehe Abschnitt 4.2).
• Dieses Arzneimittel enthält Lactose- und Sucrose
Patientinnen mit der seltenen hereditären Galaktose-Intoleranz, Lapp-Laktase-Mangel, FructoseIntoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel, sollten dieses Arzneimittel nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
• Wechselwirkungen Leberenzyminduktoren
Arzneimittel, die die Leberenzyme (insbesondere Cytochrom P450 3A4) induzieren, erhöhen den Metabolismus der kontrazeptiven Steroide und können daher zu Durchbruchblutungen und Schwangerschaft führen. Die nachfolgenden Arzneimittel zeigten klinisch wichtige Wechselwirkungen mit KOK und Estrogen/Gestagen-Kombinationen wie Juliette:
Antiretrovirale Wirkstoffe
• Ritonavir
• Nelfinavir
• Nevirapin
Antikonvulsiva
• Barbiturate (einschließlich Phenobarbital)
• Primidon
• Phenytoin
• Carbamazepin
• Oxcarbazepin
• Topiramat
Antibiotika/Antimykotika
• Griseofulvin
• Rifampacin
Pflanzliche Heilmittel
• Johanniskraut (Hypericum perforatum)
Vorgehensweise bei Wechselwirkungen mit Leberenzyminduktoren
Da Wechselwirkungen von Enzyminduktoren, einschließlich der Antibiotika Rifampicin und Griseofulvin, mit oralen Kontrazeptiva zu Durchbruchblutungen und/oder zu Verlust der kontrazeptiven Wirkung führen können, werden folgende Vorsichtsmaßnahmen empfohlen:
Frauen, die kurzzeitig mit Arzneimitteln irgendeiner der genannten Substanzklassen behandelt werden, sollten während dieser Zeit neben der KOK zusätzlich eine Barrieremethode anwenden, oder eine andere Methode der Empfängnisverhütung wählen. Bei mikrosomalen Enzyminduzierenden Arzneimitteln wie Rifampicin und Griseofulvin, sollte die Barrieremethode für die Dauer der Begleitmedikation und weitere 28 Tage darüber hinaus angewendet werden.
Bei Frauen, die längerfristig mit leberenzyminduzierenden Wirkstoffen behandelt werden, wird die Anwendung einer anderen Verhütungsmethode empfohlen.
Nicht-enzyminduzierende Antibiotika
Einige klinische Berichte deuten darauf hin, dass sich der enterohepatische Estrogen-Kreislauf verringern kann, wenn bestimmte Antibiotika gegeben werden, wodurch möglicherweise die Ethinylestradiol-Konzentrationen (z. B. Penicilline, Tetrazykline) reduziert werden.
Vorgehensweise bei Wechselwirkungen mit nicht-enzyminduzierenden Antibiotika
Da Wechselwirkungen von einigen Antibiotika mit oralen Kontrazeptiva zu Durchbruchblutungen und/oder zu Verlust der kontrazeptiven Wirkung führen können, werden folgende Vorsichtsmaßnahmen empfohlen:
Frauen, die kurzfristig mit Antibiotika (mit Ausnahme von Rifampicin und Griseofulvin) behandelt werden, sollten vorübergehend neben der KOK eine Barrieremethode anwenden, oder eine andere Methode der Empfängnisverhütung wählen. Bei Anwendung der Barrieremethode sollte diese bis einschließlich 7 Tage nach Ende der Antibiotika-Behandlung angewendet werden. Gehen diese 7 Tage über das Packungsende hinaus, sollte sofort mit der Einnahme aus der nächsten Packung des KOK begonnen werden. In diesem Fall ist eine Entzugsblutung nicht vor dem Aufbrauchen der zweiten Packung zu erwarten. Wenn sich während der Einnahmepause nach dem Aufbrauchen der zweiten Packung bei der Patientin keine Entzugsblutung einstellt, muss die Möglichkeit einer Schwangerschaft vor Anbruch der nächsten Packung ausgeschlossen werden.
Bei Einnahme von Arzneimitteln wie oralen Tetrazyklinen, ist eine zusätzliche nicht-hormonelle Methode zur Empfängnisverhütung (mit Ausnahme der Kalender- oder Temperaturmethode) ratsam, da bei gleichzeitiger Einnahme von Juliette ein extrem hohes Maß an Empfängnisschutz gewährleistet sein muss.
Auswirkungen auf andere Arzneimittel
Orale Kontrazeptiva und Estrogen/Gestagen-Kombinationen wie Juliette können den Stoffwechsel bestimmter anderer Wirkstoffe beeinflussen. Entsprechend können Plasma- und Gewebekonzentrationen ansteigen (z. B. Ciclosporin) oder sinken (z. B. Lamotrigin).
Hinweis: Die Fachinformationen gleichzeitig verabreichter Arzneimittel sollten auf mögliche Wechselwirkungen hin überprüft werden.
Laboruntersuchungen
Die Anwendung von oralen Kontrazeptiva kann die Ergebnisse bestimmter Labortests, einschließlich biochemischer Parameter der Leber-, Schilddrüsen-, Nebennieren- und Nierenfunktion sowie die Plasmaspiegel von Träger-Proteinen und Lipid-/Lipoprotein-Fraktionen, die Parameter des Kohlenhydratstoffwechsels sowie die Gerinnungs- und Fibrinolyseparameter beeinflussen. Daher sollte das Laborpersonal über die Einnahme oraler Kontrazeptiva informiert werden, wenn Laboruntersuchungen notwendig sind.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Juliette ist während der Schwangerschaft nicht indiziert. Falls unter der Einnahme von Juliette eine Schwangerschaft eintritt, ist das Arzneimittel abzusetzen.
Tierversuche zeigten, dass eine Feminisierung männlicher Foeten auftreten kann, wenn das Muttertier Cyproteronacetat während der Phase der Embryogenese, in der sich die externen Genitalien entwickeln, erhält. Obwohl diese Erkenntnisse für den Menschen nicht unbedingt relevant sind, muss die Möglichkeit in Betracht gezogen werden, dass die Einnahme von Juliette nach dem 45. Schwangerschaftstag eine Feminisierung männlicher Foeten bewirken könnte. Daraus folgt, dass eine Schwangerschaft eine absolute Kontraindikation für die Behandlung mit Juliette ist und vor Therapiebeginn ausgeschlossen werden muss.
Stillzeit
Die Einnahme von Juliette während der Stillzeit kann zu einer Verringerung der produzierten Milchmenge führen und ihre Zusammensetzung verändern. Winzige Mengen der Wirkstoffe werden mit der Milch ausgeschieden. Diese Mengen können die Säuglinge, vor allem in den ersten 6 Wochen, beeinträchtigen. Stillende Mütter sollten darauf hingewiesen werden, Juliette nicht einzunehmen, bis sie ihr Kind vollständig abgestillt haben.
4.7 Auswirkung auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Keine bekannt.
4.8 Nebenwirkungen
|
Systemorgan Klasse |
Nebenwirkungen, die in klinischen Prüfungen berichtet wurden |
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar) | ||
|
Häufig (> 1/100 bis < 1/10) |
Gelegentlich (> 1/1.000 bis < 1/100) |
Selten (> 1/10.000 bis < 1/1.000) | ||
|
Erkrankungen des |
Überempfind- |
V erschlimmerung | ||
|
Immunsystems |
lichkeits- reaktionen |
eines hereditären Angioödems | ||
|
Stoffwechsel- und Ernährungsstörungen |
Flüssigkeits retention |
Hypertriglyzerid- ämie | ||
|
Psychiatrische Erkrankungen |
Depressive Verstimmungen, Stimmungs schwankungen |
Verminderte Libido |
Gesteigerte Libido | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Migräne |
V erschlimmerung der Chorea | |
|
Augenerkran kungen |
Kontaktlinsen intoleranz | |||
|
Gefäßerkrankungen |
Thrombo embolie |
Blutdruckanstieg | ||
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit, Bauchschmerzen |
Erbrechen, Durchfall |
Morbus Crohn, Colitis ulcerosa | |
|
Leber- und Gallenerkrankungen |
Leberfunktions störungen | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Ausschlag, Urtikaria |
Erythema nodosum, Erythema multiforme |
Chloasma | |
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Brustschmerzen, Brustspannungen |
Hypertrophie der Brust |
Veränderung des Vaginalsekrets, Brustdrüsensekretion |
Abgeschwächte Menstruations blutungen Zwischen blutungen, Durchbruch blutungen, Entzugs blutungen, Post-Pill- Amenorrhoe |
|
Untersuchungen |
Gewichts zunahme |
Gewichts abnahme |
Nach Markteinführung wurde bei Patientinnen, die Juliette anwandten, über schwere Depressionen berichtet. Ein kausaler Zusammenhang zwischen klinischen Depressionen und Juliette wurde jedoch nicht bestätigt.
Bei allen Frauen, die Juliette anwenden, besteht ein erhöhtes Risiko für Thromboembolien (siehe Abschnitt 4.4).
Bei Anwenderinnen von KOK oder Juliette wurden die folgenden schwerwiegenden Nebenwirkungen berichtet, die in Abschnitt 4.4 erläutert werden:
• Venöse thromboembolische Erkrankungen
• Arterielle thromboembolische Erkrankungen
• Schlaganfälle (z. B. transitorische ischämische Attacke, ischämischer Schlaganfall, hämorrhagischer Schlaganfall)
• Hypertonie
• Lebertumore (benigne und maligne)
Bei Frauen mit hereditärem Angioödem können exogen zugeführte Estrogene Symptome eines Angioödems auslösen oder verschlimmern.
Die Diagnosehäufigkeit von Brustkrebs unter Anwenderinnen von OK ist geringfügig erhöht. Da bei Frauen unter 40 Jahren Brustkrebs selten auftritt, ist das zusätzliche Risiko im Verhältnis zum Gesamtrisiko, an Brustkrebs zu erkranken, gering. Die Kausalität mit der Anwendung von KOK oder Juliette ist nicht bekannt. Für weitere Informationen, siehe Abschnitte 4.3 und 4.4).
Erkrankungen, die sich während einer Schwangerschaft oder während einer früheren KOK-oder Juliette-Behandlung verschlechtern
Gelbsucht und/oder cholestatischer Pruritus; Bildung von Gallensteinen; systemischer Lupus erythematodes; Herpes gestationis; Otosklerose-bedingte Schwerhörigkeit; Sichelzellenanämie; renale Dysfunktion; hereditäres Angioödem; Porphyrie; Zervixkrebs.
Veränderungen in der Glukosetoleranz oder Wirkungen auf die periphere Insulinresistenz wurden bei Frauen, die KOK oder Juliette einnehmen, berichtet (siehe Abschnitt 4.4).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Eine Überdosierung kann zu Übelkeit, Erbrechen und - bei Frauen - zu einer Entzugsblutung führen.
Es gibt keine spezifischen Antidote, und die Behandlung sollte symptomatisch erfolgen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiandrogene und Estrogene, Cyproteron und Estrogen ATC-Code: G03HB01
Cyproteronacetat/Ethinylestradiol blockiert Androgen-Rezeptoren. Über einen negativen Feedback-Mechanismus des Hypothalamus-Hypophysen-Ovarial-Systems und durch die Hemmung Androgen-synthetisierender Enzyme reduziert es außerdem die Androgensynthese.
Obwohl Cyproteronacetat/Ethinylestradiol auch empfängnisverhütend wirkt, sollte es bei Frauen nicht ausschließlich zur Empfängnisverhütung angewendet werden, sondern sollte jenen Frauen vorbehalten sein, die aufgrund der beschriebenen androgen-abhängigen Krankheitsbilder behandelt werden müssen.
5.2 Pharmakokinetische Eigenschaften
Cyproteronacetat
Cyproteronacetat wird nach einer oralen Einnahme über einen weiten Dosisbereich vollständig resorbiert. Die Einnahme von Cyproteronacetat/Ethinylestradiol führt nach 1,6 Stunden zu einem maximalen Serumspiegel von 15 ng Cyproteronacetat/ml. Nachfolgend sinken die Serumkonzentrationen in zwei Phasen mit Halbwertszeiten von 0,8 Stunden und 2,3 Tagen ab. Die totale Clearance von Cyproteronacetat aus dem Serum beträgt 3,6 ml/min/kg. Cyproteronacetat wird über verschiedene Wege metabolisiert, unter anderem Hydroxylierung und Konjugation. Der Hauptmetabolit im menschlichen Plasma ist das 15 ß-Hydroxy-Derivat.
Ein Teil der verabreichten Dosis wurde unverändert über die Gallenflüssigkeit ausgeschieden. Der überwiegende Teil wird in Form von Metaboliten über die Niere und die Galle in einem Verhältnis von 3:7 mit einer Halbwertszeit von 1,9 Tagen ausgeschieden. Die Elimination der Metaboliten aus dem Plasma erfolgte mit einer ähnlichen Geschwindigkeit (Halbwertszeit von 1,7 Tagen). Cyproteronacetat wird nahezu ausschließlich an Plasmaalbumin gebunden. Nur etwa 3,5-4 % der Gesamtwirkstoffspiegel liegen in freier Form vor. Veränderungen des SexualhormonbindendenGlobulin-Spiegels (SHBG) haben wegen der unspezifischen Proteinbindung keinen Einfluss auf die Pharmakokinetik von Cyproteronacetat.
Aufgrund der langen terminalen Halbwertszeit der Elimination aus dem Plasma (Serum) und der täglichen Einnahme erfolgt innerhalb eines Behandlungszyklus eine Akkumulation von Cyproteronacetat. Mittlere maximale Serumspiegel nahmen von 15 ng/ml (Tag 1) auf 21 ng/ml bzw. 24 ng/ml am Ende des 1. bzw. 3. Behandlungszyklus zu. Die Fläche unter der KonzentrationsZeit-Kurve stieg um den Faktor 2,2 (Ende von Zyklus 1) bzw. 2,4 (Ende von Zyklus 3). Steady-State-Bedingungen wurden nach etwa 16 Tagen erreicht. Während einer Langzeitbehandlung kumuliert Cyproteronacetat im Laufe der Behandlungszyklen um etwa den Faktor 2.
Die absolute Bioverfügbarkeit von Cyproteronacetat ist nahezu vollständig (88 % einer Dosis). Die relative Bioverfügbarkeit von Cyproteronacetat aus Cyproteronacetat/Ethinylestradiol betrug 109 % im Vergleich mit einer wässrigen mikrokristallinen Suspension.
Ethinylestradiol
Oral verabreichtes Ethinylestradiol wird rasch und vollständig resorbiert. Nach Einnahme von Cyproteronacetat/Ethinylestradiol wurden nach 1,7 Stunden maximale Serumspiegel von ca. 80 pg/ml erreicht. Nachfolgend sinken die Ethinylestradiol-Plasmaspiegel in zwei Phasen mit Halbwertzeiten von 1-2 Stunden und ca. 20 Stunden ab. Aus analytischen Gründen können diese Parameter nur für höhere Dosierungen berechnet werden. Für Ethinylestradiol wurde ein scheinbares Verteilungsvolumen von ca. 5 l/kg und eine metabolische Clearance-Rate aus dem Plasma von ca. 5 ml/kg ermittelt.
Ethinylestradiol wird in hohem Ausmaß, aber nicht spezifisch, an Serumalbumin gebunden. Nur 2 % der Substanz liegen in freier Form vor. Während der Resorption und der ersten Leberpassage wird Ethinylestradiol metabolisiert, woraus sich eine verminderte absolute und variable orale Bioverfügbarkeit ergibt. Unveränderte Substanz wird nicht ausgeschieden. Die Metaboliten von Ethinylestradiol werden über die Niere und die Galle in einem Verhältnis von 4:6 mit einer Halbwertszeit von etwa einem Tag ausgeschieden.
Entsprechend der terminalen Halbwertszeit der Elimination aus dem Plasma und der täglichen Einnahme werden Steady-State-Plasmaspiegel nach 3-4 Tagen erreicht. Sie sind im Vergleich zur Einmalgabe 30-40 % höher. Die relative Bioverfügbarkeit (Referenz: wässrige mikrokristalline Suspension) von Ethinylestradiol war fast vollständig.
Die systemische Bioverfügbarkeit von Ethinylestradiol könnte durch andere Arzneistoffe in beiden Richtungen verändert werden. Es gibt jedoch keine Interaktion mit hohen Dosen von Vitamin C.
Bei Langzeitanwendung induziert Ethinylestradiol die hepatische Synthese von SHBG und Kortisol-bindendem Globulin (CBG). Das Ausmaß der SHBG-Induktion ist jedoch abhängig von der chemischen Struktur und der Dosis des gleichzeitig verabreichten Gestagens. Während der Behandlung mit Cyproteronacetat/Ethinylestradiol stiegen die SHBG-Konzentrationen im Serum von etwa 100 nmol/l auf 300 nmol/l und die Serumkonzentrationen von CBG von etwa 50 pg/ml auf 95 pg/ml.
5.3 Präklinische Daten zur Sicherheit
Es liegen keine präklinischen Daten zur Sicherheit vor, die für den verschreibenden Arzt relevant sein könnten und die nicht bereits in anderen relevanten Abschnitten dieser Fachinformation enthalten sind.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Tablettenkern:
Lactose -Monohydrat Maisstärke Povidon K25 Talkum
Magnesiumstearat (Ph. Eur.)
Tablettenüberzug:
Sucrose
Talkum
Povidon 700.000 Macrogol 6000 Calciumcarbonat Glycerol 85%
Titandioxid (E 171)
Eisen(III)-hydroxid-oxid (E 172)
Montanglycolwachs
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Blister im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Nicht über 25°C lagern.
6.5 Art und Inhalt des Behältnisses
21, 63 (3x21) oder 126 (6x21) überzogene Tabletten in PVC/AI Blisterstreifen (Kalenderpackung)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Mylan dura GmbH Postfach 10 06 35 64206 Darmstadt Telefon: (06151) 95 12-0 Telefax: (06151) 95 12-471 Email: info@mylan-dura.de www.mylan-dura.de 24-Std-Telefondienst für Notfälle: 06131-19240 (Giftnotrufzentrale Mainz)
8. ZULASSUNGSNUMMER
45792.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
17. September 1999 / 19. November 2013
10. STAND DER INFORMATION
Juni 2015
11. VERSCHREIBUNGSSTATUS V erschreibungspflichtig