Leptoprol 5 Mg Fertigspritze Mit Implantat
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
LEPTOPROL
5 mg Fertigspritze mit Implantat
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jedes Implantat enthält 5 mg Leuprorelin (als Leuprorelinacetat). Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Fertigspritze mit Implantat
Biologisch abbaubares, weißes bis leicht gelbliches zylinderförmiges Stäbchen (Länge: 10 mm) in einer Fertigspritze.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Palliative Behandlung von Patienten mit fortgeschrittenem hormonabhängigen Prostatakarzinom.
4.2 Dosierung und Art der Anwendung Dosierung
Die Indikationsstellung zur Behandlung und die längerfristige Therapiekontrolle sollte von in der Geschwulsttherapie erfahrenen Ärzten vorgenommen werden.
Die empfohlene Dosis beträgt 5 mg LEPTOPROL als Einzeldosis alle 3 Monate.
Wenn die Anwendung in Ausnahmefällen um bis zu 4 Wochen verschoben wird, dürfte bei den meisten Patienten die therapeutische Wirkung nicht beeinträchtigt sein (siehe Abschnitt 5.2).
Spezielle Patientengruppen
Für Patienten mit eingeschränkter Nieren- oder Leberfunktion, oder für ältere Patienten ist keine Dosisanpassung notwendig.
Pädiatrische Patienten
LEPTOPROL ist bei Kindern und Jugendlichen kontraindiziert, siehe Abschnitt 4.3.
Art der Anwendung
Ein Implantat wird subkutan in die vordere Bauchwand injiziert.
Vor der Injektion kann ein Lokalanästhetikum gegeben werden.
Es wird empfohlen, als Zusatztherapie etwa 5 Tage vor Beginn der Behandlung mit LEPTOPrOl mit der Gabe eines Antiandrogens zu beginnen (siehe Abschnitt 4.4).
Anwendungshinweise
1. Desinfizieren Sie die Injektionsstelle auf der vorderen Bauchwand unterhalb der Nabellinie.
2. Entnehmen Sie die Spritze aus dem Sterilbeutel und prüfen Sie, ob das Implantat im Depot sichtbar ist. Die Spritze dabei ggf. gegen das Licht halten oder leicht schütteln.
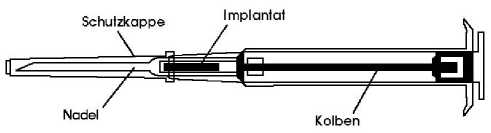
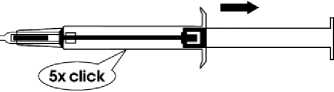
3. Ziehen Sie den Spritzenkolben vollständig bis zum Anschlag zurück. Dabei „clickt" es mehrmals. Entfernen Sie dann die Schutzkappe von der Nadel. Bitte beachten: Der Kolben lässt sich zur Injektion des Implantats nur dann nach vorne schieben, wenn er zuvor vollständig bis zum Anschlag zurückgezogen wurde!
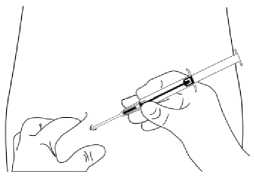
4. Halten Sie den Spritzenkörper mit einer Hand fest. Drücken Sie mit der anderen Hand die Haut des Patienten zusammen. Führen Sie die gesamte Nadel leicht schräg, fast parallel zur Haut mit der Nadelöffnung nach oben in das subkutane Gewebe der vorderen Bauchwand unterhalb der Nabellinie ein.
5. Ziehen Sie die Spritze ca. 1 cm vorsichtig zurück (Stichkanal für das Implantat). Schieben Sie nun den Kolben vollständig nach vorne, bis dieser hörbar („click“) einrastet, um das Implantat in den Stichkanal zu injizieren.
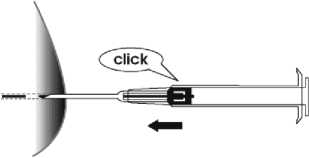
6. Ziehen Sie die Nadel heraus. Um sicherzustellen, dass das Implantat ordnungsgemäß injiziert wurde, prüfen Sie, ob die hellblaue Kolbenspitze an der Spitze der Nadel sichtbar ist.
Zu Beginn und nach 3-monatiger Anwendung von LEPTOPROL muss sowohl der PSA- als auch der Gesamttestosterongehalt im Serum bestimmt werden. Das Prostatakarzinom ist androgenempfindlich, wenn nach 3 Monaten der Testosteronspiegel auf Kastrationsniveau liegt (< 0,5 ng/ml) und der PSA-Wert abgefallen ist. Ein früher deutlicher Abfall des PSA-Wertes (in der Größenordnung von etwa 80 % gegenüber dem Ausgangswert) kann als guter prognostischer Indikator für die Langzeitantwort auf den Androgenentzug angesehen werden. Eine hormonablative Therapie (z. B. LEPTOPROL ) ist dann angezeigt.
Wenn bei Patienten mit supprimiertem Testosteron der PSA-Wert unverändert bleibt oder angestiegen ist, ist das Prostatakarzinom androgenunempfindlich. In diesem Fall ist eine Fortführung der hormonablativen Therapie ungeeignet.
Sollte der Patient jedoch klinisch angesprochen haben (z. B. Besserung der Schmerzsymptomatik und der dysurischen Beschwerden, Verkleinerung der Prostata), muss ein falsch negatives Ergebnis in Betracht gezogen werden. In diesen seltenen Fällen sollte die Anwendung von LEPTOPROL über weitere 3 Monate fortgeführt und der PSA-Wert erneut überprüft werden; außerdem sollte der Patient mit Blick auf die klinische Symptomatik unter engmaschiger Überwachung stehen.
In der Regel ist die Therapie fortgeschrittener, hormonabhängiger Prostatakarzinome mit LEPTOPROL eine Langzeitbehandlung.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, oder gegen andere LHRH-Analoga.
Nachgewiesene Hormonunabhängigkeit des Karzinoms.
LEPTOPROL ist bei Frauen und pädiatrischen Patienten kontraindiziert.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Patienten mit Bluthochdruck sollten sorgfältig überwacht werden.
Bei Patienten, die mit LHRH-Agonisten, wie LEPTOPROL behandelt werden, besteht ein erhöhtes Risiko für Depressionen (die schwerwiegend sein können).
Die Patienten sind über dieses Risiko aufzuklären, und im Falle auftretender Symptomatik entsprechend zu behandeln.
Allergische und anaphylaktische Reaktionen wurden beobachtet. Diese beinhalten sowohl lokale Reaktionen an der Einstichstelle als auch systemische Symptome.
Nach chirurgischer Kastration bewirkt LEPTOPROL keine weitere Absenkung des Testosteronspiegels.
Wegen des kurzfristigen Anstiegs des Serumtestosteronspiegels zu Beginn der Therapie, der zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann, sollten Patientenmit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen sowie Harnwegsobstruktionen während der ersten Behandlungswochen unter ständiger, möglichst stationärer Überwachung stehen.
Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die Verschlechterung der klinischen Symptomatik abzuschwächen.
Der Therapieerfolg sollte regelmäßig (insbesondere aber bei Anzeichen für eine Progression trotz adäquater Therapie) durch klinische Untersuchungen (rektale Austastung der Prostata, Sonographie, Skelettszintigraphie, Computertomographie) und durch Überprüfung der Phosphatasen bzw. des prostataspezifischen Antigens (PSA) und des Serumtestosterons kontrolliert werden.
Der unter der Langzeittherapie mit LHRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen, wobei die Entwicklung einer Osteoporose nach Orchiektomie durch erhöhte Cortisolspiegel ausgeprägter ist als nach Applikation von LHRH-Analoga. Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosponats eine Knochendemineralisierung verhindern.
Bei manchen Patienten, die mit LHRH Analoga behandelt werden, wurde über eine Veränderung der Glucosetoleranz berichtet. Eine engmaschigere Überwachung von Diabetikern ist während der Behandlung mit LEPTOPROL zu empfehlen.
Androgendeprivationstherapie kann das QT-Intervall verlängern.
Bei Patienten mit QT-Verlängerung in der Vorgeschichte oder bei Patienten, die Risikofaktoren für eine QT-Verlängerung aufweisen und bei Patienten, die gleichzeitig Arzneimittel einnehmen, die das QT-Intervall verlängern können (siehe Abschnitt 4.5) sollte der Arzt das Nutzen-Risiko-Verhältnis einschließlich des Potenzials für Torsade de Pointes vor Beginn der Behandlung mit LEPTOPROL beurteilen.
Die Anwendung von LEPTOPROL kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von LEPTOPROL als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Da eine Androgendeprivationstherapie das QT-Intervall verlängern kann, ist die gleichzeitige Anwendung von LEPTOPROL mit Arzneimitteln, die das QT-Intervall verlängern oder von Arzneimitteln die Torsade de Pointes induzieren können wie Antiarrhythmika der Klasse IA (z. B. Chinidin, Disopyramid) oder der Klasse III (z. B. Amiodaron, Sotalol, Dofetilid, Ibutilid), Methadon, Moxifloxacin, Antipsychotika usw. sorgfältig abzuwägen (siehe Abschnitt 4.4).
4.6 Fertilität, Schwangerschaft und Stillzeit
LEPTOPROL ist nur für die Anwendung bei männlichen Patienten vorgesehen.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Wegen der bei wenigen Patienten insbesondere zu Therapiebeginn auftretenden Müdigkeit, welche auch durch die zugrunde liegende Tumorerkrankung bedingt sein kann, kann dieses Arzneimittel auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Anfangs kommt es regelmäßig zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompressionen, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass LEPTOPROL abgesetzt werden muss.
Aufgrund des Entzuges der Geschlechtshormone kann es zum Auftreten von Nebenwirkungen kommen.
Tabellarische Auflistung der Nebenwirkungen
Die Nebenwirkungen werden nach Systemorganklassen und den Häufigkeiten gemäß MedDRA-Konvention aufgeführt:
Sehr häufig: > 1/10
Häufig: > 1/100, < 1/10
Gelegentlich: > 1/1.000, < 1/100
Selten: > 1/10.000, < 1/1.000
Sehr selten: < 1/10.000
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
|
Sehr häufig |
Häufig |
Gelegent lich |
Selten |
Sehr selten |
Nicht bekannt | |
|
Erkrankungen des Immunsystems |
allgemein allergische Reaktionen (Fieber, Juckreiz, Eosinophilie, Hautaus schlag) |
Anaphylak tische Reaktionen | ||||
|
Stoffwechsel- und Ernäh-rungsstörungen |
Gewichts zunahme |
Appetit-verminderung, Appetitzunahme, Gewichtsabnahme |
Veränderung einer diabetischen Stoffwechsellage (Erhöhung oder Senkung von Blutzucker werten) | |||
|
Psychiatri sche Erkrankun gen |
Stim- mungs- schwan kungen, Depres sion, Schlafstö rungen | |||||
|
Erkrankungen des Nervensystems |
Kopf schmerz, Parästhesie |
Schwindel, vorüber gehende Ge schmacks- verände rungen |
Apoplexie der Hypophyse nach initialer Verabreichung von Leuprore-lin bei Patienten mit Hypophy- senade- nom* | |||
|
Herzerkran kungen |
QT-Verlängerung (siehe Abschnitte 4.4 und 4.5) |
|
Sehr häufig |
Häufig |
Gelegent lich |
Selten |
Sehr selten |
Nicht bekannt | |
|
Gefäßer krankungen |
Hitzewallun gen |
Blutdruck- verände rungen (Hypertonie oder Hypotonie), Thrombose | ||||
|
Erkrankungen der Atemwege, des Brustraums und Mediasti nums |
Lungenem bolie | |||||
|
Erkrankungen des Gastrointestinal-trakts |
Übelkeit/Er- brechen |
Durchfall | ||||
|
Erkrankungen der Haut und des Unterhaut zellgewe bes |
trockene Haut bzw. Schleimhaut, Nachtschweiß |
Haarausfall | ||||
|
Skelettmuskulatur-, Bindege-webs-und Knochenerkrankungen |
Knochen schmerzen |
Gelenk-bzw. Rückenschmerzen, Muskelschwäche, Perineum-Schmerzen, Oberbauchschmerzen | ||||
|
Erkrankungen der Niere und der Harnwege |
Nykturie, Dysurie, Pollakisurie |
Harnverhal tung | ||||
|
Erkrankungen der Geschlechts-organe und Brustdrüse |
Verminderung oder Verlust der Libido und der Potenz, Verkleinerung der Hoden |
Gynäko mastie |
testikuläre Schmerzen |
|
Sehr häufig |
Häufig |
Gelegent lich |
Selten |
Sehr selten |
Nicht bekannt | |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
vermehrtes Schwitzen; Reaktionen an der Injektionsstelle, z. B. Rötung, Schmerzen, Ödeme, Juckreiz, die sich in der Regel auch bei fortgesetzter Behandlung zurückbildeten |
Müdigkeit, periphere Ödeme, allgemeine Schwäche |
In Einzelfällen trat ein Abszess an der Injekti-onsstel-le auf | |||
|
Untersu chungen |
Anstieg der LDH, der Transami-nasen (ALT, AST), der Gamma-GT und der alkalischen Phosphatase, die jedoch auch Ausdruck der Grunderkrankung sein können |
*Apoplexie der Hypophyse:
Wie auch bei anderen Arzneimitteln dieser Stoffklasse wurde in sehr seltenen Fällen über eine Apoplexie der Hypophyse nach initialer Verabreichung von LEPTOPROL bei Patienten mit Hypophysenadenom berichtet.
Nach Zulassung wurde überwiegend in Japan über das Auftreten interstitieller Pneumonien berichtet.
In einem Einzelfall trat eine Thrombose der Arteria centralis retinae auf.
Besondere Hinweise
Die Reaktion auf die LEPTOPROL-Therapie kann durch Messung der Serumspiegel von Testosteron, saurer Phosphatase und PSA (prostataspezifisches Antigen) kontrolliert werden. So steigt der Testosteronspiegel bei Behandlungsbeginn zunächst an und sinkt dann während eines Zeitraumes von 2 Wochen wieder ab. Nach 2 - 4 Wochen werden Testosteronspiegel erreicht, wie sie nach einer beidseitigen Orchiektomie beobachtet werden, und die über den gesamten Behandlungszeitraum bestehen bleiben.
Ein Anstieg saurer Phosphatasespiegel kann in der Anfangsphase der Therapie erfolgen und ist vorübergehender Natur. Gewöhnlich werden nach einigen Wochen wieder Normalwerte bzw. annähernde Normalwerte erreicht.
Der unter der Langzeittherapie mit LHRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen (siehe Abschnitt 4.4). Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosponats eine Knochendemineralisierung verhindern.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
Selbst bei Verabreichung von Dosen bis zu 20 mg Leuprorelinacetat pro Tag über 2 Jahre, die bei ersten klinischen Studien Anwendung fanden, konnten keine anderen bzw. neuen Nebenwirkungen, die sich von denen nach täglicher Applikation von 1 mg oder 3-monatlicher Applikation von 11,25 mg unterschieden, gefunden werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Hormone und verwandte Mittel, Gonadotropin-
Releasing-Hormon-Analoga
ATC Code: L02AE02
Leuprorelinacetat, der Wirkstoff von LEPTOPROL, ist ein synthetisches Analogon des natürlich vorkommenden hypothalamischen “Releasing-Faktors” LHRH, der die Freisetzung der gonadotropen Hormone LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon) aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die gonadale Steroidsynthese.
Im Gegensatz zum physiologischen LHRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert das auch als LHRH-Agonist bezeichnete Leuprorelinacetat bei therapeutischer Daueranwendung die LHRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen kurzfristigen Stimulation deren Desensibilisierung ("down regulation”). Als Folge kommt es zu einer reversiblen hypophysären Suppression der Gonadotropin-Freisetzung mit nachfolgendem Abfall der Testosteronspiegel. Die Testosteronkonzentration sinkt, und beeinflusst damit das Wachstum des karzinomatös veränderten Prostatagewebes, das durch Dihydrotestosteron — gebildet durch Reduktion von Testosteron in den Prostatazellen — normalerweise stimuliert wird.
Die kontinuierliche Applikation von Leuprorelinacetat führt zu einer Abnahme der Anzahl und/oder der Empfindlichkeit (sogenannte "down regulation”) der in der Hypophyse vorhandenen Rezeptoren und in der Folge zum Abfall der LH-, FSH- und DHT-Spiegel. Der Testosteronspiegel wird dabei in den Kastrationsbereich abgesenkt.
Auch in Tierversuchen konnte die antiandrogene Wirkung und Wachstumshemmung von Prostatakarzinomen nachgewiesen werden.
Den experimentellen und klinischen Studien zufolge bewirkt die 3-monatliche Behandlung mit Leuprorelinacetat nach anfänglicher Stimulation eine Hemmung der Gonadotropinfreisetzung.
Beim Mann bewirkt die subkutane Verabreichung von Leuprorelinacetat einen anfänglichen Anstieg von LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon), gekennzeichnet durch einen passageren Spiegelanstieg von Testosteron und Dihydrotestosteron.
Da in Einzelfällen in den ersten 3 Wochen eine damit zusammenhängende kurzfristige symptomatische Verschlechterung des Krankheitsbildes beobachtet wurde, ist bei Männern mit Prostatakarzinom die zusätzliche Gabe von Antiandrogenen zu erwägen.
Die Langzeittherapie mit Leuprorelinacetat bewirkt dagegen bei allen Patienten eine Erniedrigung der LH- und FSH-Spiegel; es werden beim Mann Androgenspiegel erreicht, wie sie nach einer beidseitigen Orchiektomie vorliegen. Diese Veränderungen treten meist 2 - 3 Wochen nach Therapiebeginn auf und sind über den gesamten Behandlungszeitraum manifest. Aus diesem Grund kann auch mit Leuprorelinacetat die Hormonempfindlichkeit eines Prostatakarzinoms und der mögliche therapeutische Wert einer Orchiektomie geprüft werden. Gegebenenfalls kann die Orchiektomie durch die 3-monatliche Gabe von Leuprorelinacetat ersetzt werden. Kastrationsspiegel für Testosteron konnten bisher nach kontinuierlicher Gabe von Leuprorelinacetat über 5 Jahre gehalten werden.
5.2 Pharmakokinetische Eigenschaften
Der Wirkstoff Leuprorelinacetat wird kontinuierlich aus dem PolymilchsäurePolymer über einen Zeitraum bis zu 182 Tagen (26 Wochen) nach der Injektion des biologisch abbaubaren Implantats LEPTOPROL freigesetzt. Das Polymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Innerhalb von 2 Stunden nach Applikation einer subkutanen Einzeldosis von LEPTOPROL wurden maximale Leuprorelin-Serumspiegel von 5216 pg/ml (5,2 ng/ml) gemessen.
Die AUC während einer 3-monatigen Behandlung mit LEPTOPROL betrug 32,4 ng/ml*d. Nachweisbare Serumspiegel liegen bis 182 Tage (26 Wochen) nach Applikation vor.
Das Verteilungsvolumen von Leuprorelin beträgt bei Männern 36 l, die totale Clearance liegt bei 139,6 ml/min.
Die Leuprorelinspiegel von Patienten mit eingeschränkter Nieren- bzw. Leberfunktion lagen dabei im Bereich nieren- bzw. lebergesunder Patienten. Bei chronischer Niereninsuffizienz wurden teilweise höhere Leuprorelinserumspiegel gemessen. Klinisch scheint diese Beobachtung jedoch ohne Relevanz.
5.3 Präklinische Daten zur Sicherheit
Präklinische Studien mit LEPTOPROL zeigten Effekte auf die Fortpflanzungsorgane, die aufgrund der bekannten pharmakologischen Eigenschaften von Leuprorelin zu erwarten waren.
Kanzerogenität
Bei Ratten wurde (nach subkutaner Injektion) eine dosisabhängige Zunahme von Hypophysenadenomen bei Dosierungen von 0,6 - 4 mg/kg/Tag während 12 und 24 Monaten beobachtet. Kein derartiger Effekt wurde bei Mäusen über 24 Monate beobachtet.
Mutagenität
In vitro- und in v/Vo-Untersuchungen mit Leuprorelinacetat zum Nachweis von Gen-und Chromosomenmutationen ergaben keine Hinweise auf ein mutagenes Potenzial.
Reproduktionstoxizität
In Untersuchungen zur Reproduktionstoxizität an Kaninchen wurde eine gesteigerte fetale Mortalität und ein vermindertes fetales Gewicht beobachtet. Die Auswirkungen auf die fetale Mortalität sind zu erwartende Folgen der pharmakodynamischen Wirkung dieser Substanz.
Lokale Verträglichkeit
Präklinische Studien an Hunden und Kaninchen zeigten eine gute lokale Verträglichkeit von LEPTOPROL.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Polymilchsäure
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 30°C lagern.
6.5 Art und Inhalt des Behältnisses
Plastik-Fertigspritze aus Polycarbonat mit einem Kolben aus Acrylnitril-ButadienStyrol Copolymer und einer Nadel, verpackt in einem Beutel aus PET/Al/PE-Verbundfolie.
Packungsgrößen:
1 x 1 Implantat mit 5 mg Leuprorelin (als Leuprorelinacetat)
2 x 1 Implantat mit 5 mg Leuprorelin (als Leuprorelinacetat)
3 x 1 Implantat mit 5 mg Leuprorelin (als Leuprorelinacetat)
5 x 1 Implantat mit 5 mg Leuprorelin (als Leuprorelinacetat)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
89944.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG 13. Januar 2015
10. STAND DER INFORMATION
Januar 2015
11 .VERKAUFSABGRENZUNG
Verschreibungspflichtig