Leuprorelin Hexal 3,6 Mg
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Leuprorelin HEXAL 3,6 mg Implantat
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Implantat enthält 3,6 mg Leuprorelin (als Acetat)
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Implantat
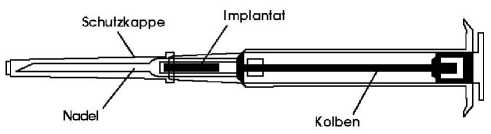
Biologisch abbaubares weißes bis leicht gelbliches zylinderförmiges Stäbchen (Länge: 10 mm) in einer Fertigspritze
4. KLINISCHE ANGABEN 4.1 Anwendungsgebiete
Palliative Behandlung von Patienten mit fortgeschrittenem hormonabhängigen Prostatakarzinom.
4.2. Dosierung, Art und Dauer der Anwendung Dosierung
Die Indikationsstellung zur Behandlung und die längerfristige Therapiekontrolle sollte von in der Geschwulsttherapie erfahrenen Ärzten vorgenommen werden.
Die empfohlene Dosis beträgt 3,6 mg Leuprorelin als monatliche Einzeldosis.
Nach der 2. Applikation kann die Anwendung in Ausnahmefällen um bis zu 2 Wochen verschoben werden. Dabei dürfte bei den meisten Patienten die therapeutische Wirkung nicht beeinträchtigt sein (siehe Abschnitt 5.2).
Spezielle Patientengruppen
Für Patienten mit eingeschränkter Nieren- oder Leberfunktion, oder für ältere Patienten ist keine Dosisanpassung notwendig.
Pädiatrische Patienten
Leuprorelin HEXAL 3,6 mg ist bei Kindern und Jugendlichen kontraindiziert, siehe Abschnitt 4.3.
Art der Anwendung
Ein Implantat wird subkutan in die vordere Bauchwand injiziert.
Vor der Injektion kann ein Lokalanästhetikum gegeben werden.
Es wird empfohlen, als Zusatztherapie etwa 5 Tage vor Beginn der Behandlung mit Leuprorelin HEXAL 3,6 mg mit der Gabe eines Antiandrogens zu beginnen (siehe Abschnitt 4.4).
1. Desinfizieren Sie die Injektionsstelle auf der vorderen Bauchwand unterhalb der Nabellinie.
2. Entnehmen Sie die Spritze aus dem Sterilbeutel und prüfen Sie, ob das Implantat im Depot sichtbar ist. Die Spritze dabei ggf. gegen das Licht halten oder leicht schütteln.
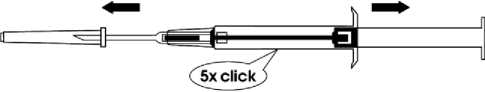
3. Ziehen Sie den Spritzenkolben vollständig bis zum Anschlag zurück. Dabei „clickt“ es mehrmals. Entfernen Sie dann die Schutzkappe von der Nadel.
Bitte beachten: Der Kolben lässt sich zur Injektion des Implantats nur dann nach vorne schieben, wenn er zuvor vollständig zurückgezogen wurde!
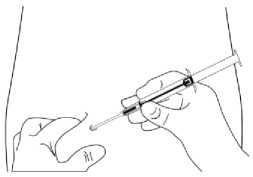
Anwendungshinweise
4. Halten Sie den Spritzenkörper mit einer Hand fest. Drücken Sie mit der anderen Hand die Haut des Patienten zusammen. Führen Sie die gesamte Nadel leicht schräg, fast parallel zur Haut mit der Nadelöffnung nach oben in das subkutane Gewebe der vorderen Bauchwand unterhalb der Nabellinie ein.
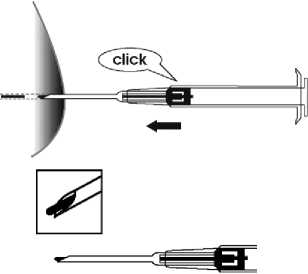
5. Ziehen Sie die Spritze ca. 1 cm vorsichtig zurück (Stichkanal für das Implantat). Schieben Sie nun den Kolben vollständig nach vorne bis dieser hörbar („click“) einrastet, um das Implantat in den Stichkanal zu injizieren.
6. Ziehen Sie die Nadel heraus. Um sicherzustellen, dass das Implantat injiziert wurde, prüfen Sie, ob die weiße Kolbenspitze an der Spitze der Nadel sichtbar ist.
Zu Beginn und nach 3-monatiger Anwendung von Leuprorelin HEXAL 3,6 mg muss sowohl der PSA-als auch der Gesamttestosterongehalt im Serum bestimmt werden. Das Prostatakarzinom ist androgenempfindlich, wenn nach 3 Monaten der Testosteronspiegel auf Kastrationsniveau liegt (< 0,5 ng/ml) und der PSA-Wert abgefallen ist. Ein früher deutlicher Abfall des PSA-Wertes (in der Größenordnung von etwa 80 % gegenüber dem Ausgangswert) kann als guter prognostischer Indikator für die Langzeitantwort auf den Androgenentzug angesehen werden. Eine hormonablative Therapie (z. B. Leuprorelin HEXAL 3,6 mg) ist dann angezeigt.
Wenn bei Patienten mit supprimiertem Testosteron der PSA-Wert unverändert bleibt oder angestiegen ist, ist das Prostatakarzinom androgenunempfindlich. In diesem Fall ist eine Fortführung der hormonablativen Therapie ungeeignet.
Sollte der Patient jedoch klinisch angesprochen haben (z. B. Besserung der Schmerzsymptomatik und der dysurischen Beschwerden, Verkleinerung der Prostata), muss ein falsch negatives Ergebnis in Betracht gezogen werden. In diesen seltenen Fällen sollte die Anwendung von Leuprorelin HEXAL 3,6 mg über weitere 3 Monate fortgeführt und der PSA-Wert erneut überprüft werden; außerdem sollte der Patient mit Blick auf die klinische Symptomatik unter engmaschiger Überwachung stehen.
In der Regel ist die Therapie fortgeschrittener, hormonabhängiger Prostatakarzinome mit Leuprorelin HEXAL 3,6 mg eine Langzeitbehandlung.
4.3. Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile, oder gegen andere LHRH-Analoga.
Nachgewiesene Hormonunabhängigkeit des Karzinoms.
Leuprorelin HEXAL 3,6 mg ist bei Frauen und pädiatrischen Patienten kontraindiziert.
4.4. Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Patienten mit Bluthochdruck sollten sorgfältig überwacht werden.
Bei Patienten, die mit LHRH-Agonisten (Gonadotropin-Releasing-Hormon Agonisten), wie Leuprorelin behandelt werden, besteht ein erhöhtes Risiko für Depressionen (die schwerwiegend sein können). Die Patienten sind über dieses Risiko aufzuklären, und im Falle auftretender Symptomatik entsprechend zu behandeln.
Allergische und anaphylaktische Reaktionen wurden beobachtet. Diese beinhalten sowohl lokale Reaktionen an der Einstichstelle als auch systemische Symptome.
Nach chirurgischer Kastration bewirkt Leuprorelin HEXAL 3,6 mg keine weitere Absenkung des Testosteronspiegels.
Wegen des kurzfristigen Anstiegs des Serumtestosteronspiegels zu Beginn der Therapie, der zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann, sollten Patientenmit drohenden neurologischen Komplikationen, Wirbelsäulenmetastasen sowie Harnwegsobstruktionen während der ersten Behandlungswochen unter ständiger, möglichst stationärer Überwachung stehen.
Für die Initialphase der Behandlung sollte die zusätzliche Gabe eines geeigneten Antiandrogens erwogen werden, um so die möglichen Folgeerscheinungen des anfänglichen Testosteronanstiegs und die Verschlechterung der klinischen Symptomatik abzuschwächen.
Der Therapieerfolg sollte regelmäßig (insbesondere aber bei Anzeichen für eine Progression trotz adäquater Therapie) durch klinische Untersuchungen (rektale Austastung der Prostata, Sonographie, Skelettszintigraphie, Computertomographie) und durch Überprüfung der Phosphatasen bzw. des prostataspezifischen Antigens (PSA) und des Serumtestosterons kontrolliert werden.
Der unter der Langzeittherapie mit LHRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen, wobei die Entwicklung einer Osteoporose nach Orchiektomie durch erhöhte Cortisolspiegel ausgeprägter ist als nach Applikation von LHRH-Analoga. Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosponats eine Knochendemineralisierung verhindern.
Bei manchen Patienten, die mit LHRH Analoga behandelt werden, wurde über eine Veränderung der Glucosetoleranz berichtet. Eine engmaschigere Überwachung von Diabetikern ist während der Behandlung mit Leuprorelin HEXAL 3,6 mg zu empfehlen.
Die Anwendung von Leuprorelin HEXAL 3,6 mg kann bei Dopingkontrollen zu positiven Ergebnissen führen. Die Anwendung von Leuprorelin HEXAL 3,6 mg als Dopingmittel kann zu einer Gefährdung der Gesundheit führen.
4.5. Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Wechselwirkungen mit anderen Mitteln sind nicht bekannt geworden.
4.6. Fertilität, Schwangerschaft und Stillzeit
Leuprorelin HEXAL 3,6 mg ist nur für den Gebrauch bei männlichen Patienten vorgesehen.
4.7. Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Wegen der bei wenigen Patienten insbesondere zu Therapiebeginn auftretenden Müdigkeit, welche auch durch die zugrunde liegende Tumorerkrankung bedingt sein kann, kann dieses Arzneimittel auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen so weit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr oder zum Bedienen von Maschinen beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8. Nebenwirkungen
Anfangs kommt es regelmäßig zu einem kurzfristigen Anstieg des Serumtestosteronspiegels, was zu einer vorübergehenden Verstärkung bestimmter Krankheitssymptome führen kann (Auftreten oder Zunahme von Knochenschmerzen, Harnwegsobstruktion und deren Folgen, Rückenmarkskompressionen, Muskelschwäche in den Beinen, Lymphödeme). Diese Zunahme der Beschwerden geht üblicherweise spontan zurück, ohne dass Leuprorelin HEXAL 3,6 mg abgesetzt werden muss.
Aufgrund des Entzuges der Geschlechtshormone kann es zum Auftreten von Nebenwirkungen kommen.
Tabellarische Auflistung der Nebenwirkungen:
Die Nebenwirkungen werden nach Systemorganklassen und den Häufigkeiten gemäß MedDRA-Konvention aufgeführt:
Sehr häufig: > 1/10 Häufig: > 1/100, < 1/10
Gelegentlich: > 1/1.000, < 1/100 Selten: > 1/10.000, < 1/1.000
Sehr selten: < 1/10.000
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
|
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt | |
|
Erkrankung en des Immunsyst ems |
allgemein allergische Reaktionen (Fieber, Hautausschl ag, Juckreiz, Eosinophilie) anaphylaktis che Reaktionen | |||||
|
Stoffwechs el- und Ernährungs störungen |
Appetitzuna hme |
Appetitvermi nderung, Veränderung einer diabetischen Stoffwechsel lage (Erhöhung oder Senkung von Blutzuckerw erten) Gewichtszun ahme, Gewichtsabn ahme | ||||
|
Psychiatris che Erkrankung en |
Schlafstörun gen Stimmungss chwankunge n, Depression | |||||
|
Erkrankung en des Nervensyst ems |
Parästhesie |
Kopfschmerz , Schwindel |
vorübergehe nde Geschmack sveränderun gen Apoplexie der Hypophyse* | |||
|
Gefäßerkra nkungen |
Hitzewallung en mit Schweißaus brüchen |
Blutdruckver änderungen (Hypertonie oder Hypotonie) |
Thrombose | |||
|
Erkrankung en der Atemwege, des Brustraums und Mediastinu ms |
Atembeschw erden |
Lungenemb olie |
|
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt | |
|
Erkrankung en des Gastrointes tinaltrakts |
Durchfall |
Übelkeit/Erb rechen | ||||
|
Erkrankung en der Haut und des Unterhautz ellgewebes |
Haarausfall, trockene Haut bzw. Schleimhaut, Nachtschwei ß | |||||
|
Skelettmus kulatur-, Bindegewe bs- und Knochener krankungen |
Knochensch merzen |
Gelenk- bzw. Rückensch merzen und Muskelbesc hwerden | ||||
|
Erkrankung en der Niere und der Harnwege |
Nykturie, Dysurie, Pollakisurie |
Harnverhaltu ng | ||||
|
Erkrankung en der Geschlecht sorgane und Brustdrüse |
Verminderun g der Libido und der Potenz |
Verkleinerun g der Hoden, testikuläre Schmerzen, Gynäkomasti e | ||||
|
Allgemeine Erkrankung en und Beschwerd en am Verabreich ungsort |
vermehrtes Schwitzen |
Ödeme, Müdigkeit; lokale Hautreaktion en, z.B. Rötungen oder Verhärtunge n an der Injektionsste lle, die sich in der Regel auch bei fortgesetzter Behandlung zurückbilden |
In Einzelfällen trat ein Abszess an der Injektionsste lle auf |
|
Sehr häufig |
Häufig |
Gelegentlic h |
Selten |
Sehr selten |
Nicht bekannt | |
|
Untersuchu ngen |
Anstieg von Enzymen wie Lactatdehydr ogenase (LDH), alkalischer Phosphatase (AP) oder Transaminas en wie ALT (SGPT), AST (SGOT) oder y-GT |
*Apoplexie der Hypophyse:
Wie auch bei anderen Arzneimitteln dieser Stoffklasse wurde in sehr seltenen Fällen über eine Apoplexie der Hypophyse nach initialer Verabreichung von Leuprorelin HEXAL 3,6 mg bei Patienten mit Hypophysenadenom berichtet.
Nach Zulassung wurde überwiegend in Japan über das Auftreten interstitieller Pneumonien berichtet.
In einem Einzelfall trat eine Thrombose der Arteria centralis retinae auf.
Besondere Hinweise
Die Reaktion auf die Leuprorelin HEXAL 3,6 mg-Therapie kann durch Messung der Serumspiegel von Testosteron, saurer Phosphatase und PSA (prostataspezifisches Antigen) kontrolliert werden. So steigt der Testosteronspiegel bei Behandlungsbeginn zunächst an und sinkt dann während eines Zeitraumes von 2 Wochen wieder ab. Nach 2 - 4 Wochen werden Testosteronspiegel erreicht, wie sie nach einer beidseitigen Orchiektomie beobachtet werden, und die über den gesamten Behandlungszeitraum bestehen bleiben.
Ein Anstieg saurer Phosphatasespiegel kann in der Anfangsphase der Therapie erfolgen und ist vorübergehender Natur. Gewöhnlich werden nach einigen Wochen wieder Normalwerte bzw. annähernde Normalwerte erreicht.
Der unter der Langzeittherapie mit LHRH-Analoga bzw. Orchiektomie auftretende Hypogonadismus kann zu einer Osteoporose mit erhöhtem Frakturrisiko führen (siehe Abschnitt 4.4). Bei Risikopatienten kann die zusätzliche Gabe eines Bisphosponats eine Knochendemineralisierung verhindern.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung über das
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: http://www.bfarm.de anzuzeigen.
4.9. Überdosierung
Intoxikationssymptome wurden bisher nicht beobachtet.
Selbst bei Verabreichung von Dosen bis zu 20 mg Leuprorelinacetat pro Tag über 2 Jahre, die bei ersten klinischen Studien Anwendung fanden, konnten keine anderen bzw. neuen Nebenwirkungen, die sich von denen nach täglicher Applikation von 1 mg oder monatlicher Applikation von 3,75 mg unterschieden, gefunden werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1. Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Hormone und verwandte Mittel, Gonadotropin-Releasing HormonAnaloga
ATC Code: L02A E02
Leuprorelinacetat, der Wirkstoff von Leuprorelin HEXAL 3,6 mg, ist ein synthetisches Analogon des natürlich vorkommenden hypothalamischen “Releasing-Faktors” LHRH, der die Freisetzung der gonadotropen Hormone LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon) aus dem Hypophysenvorderlappen kontrolliert. Diese Hormone stimulieren ihrerseits die gonadale Steroidsynthese.
Im Gegensatz zum physiologischen LHRH, das pulsatil vom Hypothalamus freigesetzt wird, blockiert das auch als LHRH-Agonist bezeichnete Leuprorelinacetat bei therapeutischer Daueranwendung die LHRH-Rezeptoren der Hypophyse kontinuierlich und verursacht nach einer initialen, kurzfristigen Stimulation deren Desensibilisierung (“down regulation”). Als Folge kommt es zu einer reversiblen hypophysären Suppression der Gonadotropin-Freisetzung mit nachfolgendem Abfall der Testosteronspiegel. Die Testosteronkonzentration sinkt, und beeinflusst damit das Wachstum des karzinomatös veränderten Prostatagewebes, das durch Dihydrotestosteron — gebildet durch Reduktion von Testosteron in den Prostatazellen — normalerweise stimuliert wird.
Die kontinuierliche Applikation von Leuprorelinacetat führt zu einer Abnahme der Anzahl und/oder der Empfindlichkeit (sogenannte “down regulation”) der in der Hypophyse vorhandenen Rezeptoren und in der Folge zum Abfall der LH-, FSH- und DHT-Spiegel. Der Testosteronspiegel wird dabei in den Kastrationsbereich abgesenkt.
Erst zwischen Tag 70 und 77 nach der Erstapplikation würde der Testosteronspiegel wieder ansteigen und den Kastrationsbereich verlassen.
Auch in Tierversuchen konnte die antiandrogene Wirkung und Wachstumshemmung von Prostatakarzinomen nachgewiesen werden.
Den experimentellen und klinischen Studien zufolge bewirkt die monatliche Behandlung mit Leuprorelinacetat nach anfänglicher Stimulation eine Hemmung der Gonadotropinfreisetzung.
Beim Mann bewirkt die subkutane Verabreichung von Leuprorelinacetat einen anfänglichen Anstieg von LH (luteinisierendes Hormon) und FSH (follikelstimulierendes Hormon), gekennzeichnet durch einen passageren Spiegelanstieg von Testosteron und Dihydrotestosteron.
Da in Einzelfällen in den ersten 3 Wochen eine damit zusammenhängende kurzfristige symptomatische Verschlechterung des Krankheitsbildes beobachtet wurde, ist bei Männern mit Prostatakarzinom die zusätzliche Gabe von Antiandrogenen zu erwägen.
Die Langzeittherapie mit Leuprorelinacetat bewirkt dagegen bei allen Patienten eine Erniedrigung der LH- und FSH-Spiegel; es werden beim Mann Androgenspiegel erreicht, wie sie nach einer beidseitigen Orchiektomie vorliegen. Diese Veränderungen treten meist 2 - 3 Wochen nach Therapiebeginn auf und sind über den gesamten Behandlungszeitraum manifest. Aus diesem Grund kann auch mit Leuprorelinacetat die Hormonempfindlichkeit eines Prostatakarzinoms und der mögliche therapeutische Wert einer Orchiektomie geprüft werden. Gegebenenfalls kann die Orchiektomie durch die monatliche Gabe von Leuprorelinacetat ersetzt werden. Kastrationsspiegel für Testosteron konnten bisher nach kontinuierlicher Gabe von Leuprorelinacetat über 5 Jahre gehalten werden.
5.2. Pharmakokinetische Eigenschaften
Der Wirkstoff Leuprorelinacetat wird nach Injektion des Implantats kontinuierlich aus dem Polymer, bestehend aus Glycolsäure und Milchsäure im Verhältnis 1:1, über einen Zeitraum von 1 Monat freigesetzt. Das Polymer wird dabei wie chirurgisches Nahtmaterial resorbiert.
Innerhalb 1 Stunde wurden Serumspiegel von 676 pg/ml gemessen. Nachweisbare Leuprorelin-Serumspiegel liegen für mehr als 1 Monat vor. Nach 2 Injektionen von Leuprorelin HEXAL 3,6 mg im Abstand von 28 Tagen sind nachweisbare Leuprorelin-Serumspiegel bis zu 67 Tage nach der ersten Applikation vorhanden..
Das Verteilungsvolumen von Leuprorelin beträgt bei Männern 36 l, die totale Clearance liegt bei 139,6 ml/min.
Bei Patienten mit eingeschränkter Nierenfunktion wurden nach Gabe von Leuprorelinacetat teilweise höhere Leuprorelinserumspiegel gemessen, bei Patienten mit eingeschränkter Leberfunktion dagegen verminderte Werte. Klinisch scheint diese Beobachtung jedoch ohne Relevanz.
5.3. Präklinische Daten zur Sicherheit
Präklinische Studien mit Leuprorelinacetat zeigten Effekte auf die Fortpflanzungsorgane, die aufgrund der bekannten pharmakologischen Eigenschaften von Leuprorelin zu erwarten waren.
Kanzerogenität
Bei Ratten wurde (nach subkutaner Injektion) eine dosisabhängige Zunahme von Hypophysenadenomen bei Dosierungen von 0,6 - 4 mg/kg/Tag während 12 und 24 Monaten beobachtet. Kein derartiger Effekt wurde bei Mäusen über 24 Monate beobachtet.
Mutagenität
In vitro- und in vivo-Untersuchungen mit Leuprorelinacetat zum Nachweis von Gen- und Chromosomenmutationen ergaben keine Hinweise auf ein mutagenes Potenzial.
Reproduktionstoxizität
In Untersuchungen zur Reproduktionstoxizität an Kaninchen wurde eine gesteigerte fetale Mortalität und ein vermindertes fetales Gewicht beobachtet. Die Auswirkungen auf die fetale Mortalität sind zu erwartende Folgen der pharmakodynamischen Wirkung dieser Substanz.
Lokale Verträglichkeit
Präklinische Studien an Hunden und Kaninchen zeigten eine gute lokale Verträglichkeit von Leuprorelinacetat HEXAL 3,6 mg.
6. PHARMAZEUTISCHE ANGABEN
6.1. Liste der sonstigen Bestandteile
Poly(glycolsäure-co-milchsäure) 1:1
6.2. Inkompatibilitäten
Nicht zutreffend.
3 Jahre.
6.4. Besondere Vorsichtsmaßnahmen für die Aufbewahrung Nicht über 30°C lagern.
6.5. Art und Inhalt des Behältnisses
Plastik-Fertigspritze aus Polycarbonat mit einem Kolben aus Acrylnitril-Butadien-Styrol Copolymer und einer Nadel verpackt in einem Beutel aus Polyethylenterephthalat/Aluminium/PE-Verbundfolie. Der Beutel enthält auch ein Natrium-Aluminium-Silikat Trockenmittel.
Packungsgrößen: 1 x 1 Implantat mit 3,6 mg Leuprorelin (als Acetat)
3 x 1 Implantat mit 3,6 mg Leuprorelin (als Acetat)
6.6. Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
Hexal AG Industriestraße 25 83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMER
62069.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung:19. April 2007 Datum der letzten Verlängerung der Zulassung: -
10. STAND DER INFORMATION
Juli 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig