Levo-C Al 100/25
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
Levo-C AL 100/25
Levodopa 100 mg und Carbidopa 25 mg pro Tablette Levo-C AL 200/50
Levodopa 200 mg und Carbidopa 50 mg pro Tablette
2. Qualitative und quantitative Zusammensetzung
Levo-C AL 100/25
1 Tablette enthält 100 mg Levodopa und 27 mg Carbidopa-Monohydrat (entspr. 25 mg Carbidopa).
Levo-C AL 200/50
1 Tablette enthält 200 mg Levodopa und 54 mg Carbidopa-Monohydrat (entspr. 50 mg Carbidopa).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Tablette
Levo-C AL 100/25
Weiße, runde Tablette mit einseitiger Bruchkerbe (Snap-tab).
Levo-C AL 200/50
Weiße, runde Tablette mit beidseitiger Bruchkerbe (Snap-tab).
Die Tabletten können in gleiche Dosen geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
• Parkinson-Syndrome.
Hinweis:
Levo-C AL ist nicht indiziert bei medikamentös induziertem Parkinson-Syndrom.
4.2 Dosierung und Art der Anwendung
Die Dosierung richtet sich nach der Schwere der extrapyramidalen
Symptomatik und der Verträglichkeit im Einzelfall. Es kann nötig sein, sowohl die Einzeldosis als auch die Dosierungsintervalle anzupassen. Hohe Einzeldosen sollten vermieden werden. Die Behandlung wird mit langsam ansteigender Dosierung durchgeführt.
Die Behandlung muss langsam einschleichend erfolgen, um das Ausmaß der Nebenwirkungen gering zu halten und einen möglichen Behandlungserfolg nicht zu gefährden.
Hinweis zur Teilbarkeit:
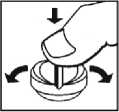
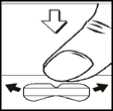
Levo-C AL 100/25 und Levo-C AL 200/50 ermöglichen durch eine neue Tablettenform (Snap-tab) eine einfache und genaue Teilung der Tabletten.
Die Tabletten können - wie andere Tabletten auch - mit zwei Händen zerteilt werden. Außerdem können die Tabletten auf eine harte, flache Unterlage mit der Bruchkerbe nach oben (Levo-C AL 100/25) bzw. mit der größeren der beiden Bruchkerben nach unten (Levo-C AL 200/50) gelegt werden und durch leichten Daumendruck in zwei gleich große Teile geteilt werden.
Levo-C AL 100/25: Levo-C AL 200/50:
Dosierung
Levo-C AL 100/25
Bei bisher unbehandelten Kranken wird mit einer Tagesdosis von % bis 1% Tabletten Levo-C AL 100/25 (entspr. 50 bis 150 mg Levodopa in Kombination mit 12,5 bis 37,5 mg Carbidopa/Tag) begonnen.
Eine Dosissteigerung kann um 1 Tablette Levo-C AL 100/25 (entspr. 100 mg Levodopa und 25 mg Carbidopa) jeden 3. bis 7. Tag vorgenommen werden.
Tagesdosen von täglich bis zu 7 Tabletten Levo-C AL 100/25 (entspr. 700 mg Levodopa und 175 mg Carbidopa/Tag) sollen in der Regel nicht überschritten werden.
Levo-C AL 200/50
Bei bisher unbehandelten Kranken wird mit einer Tagesdosis von % oder 1 Tablette Levo-C AL 200/50 (entspr. 100 bis 200 mg Levodopa in Kombination mit 25 bis 50 mg Carbidopa/Tag) begonnen.
Eine Dosissteigerung kann um eine % Tablette Levo-C AL 200/50 (entspr. 100 mg Levodopa und 25 mg Carbidopa) jeden 3. bis 7. Tag vorgenommen werden.
Tagesdosen von täglich bis zu 4 Tabletten Levo-C AL 200/50 (entspr. 800 mg
Levodopa und 200 mg Carbidopa/Tag) sollen in der Regel nicht überschritten werden.
Bei Auftreten von Nebenwirkungen wird die Dosissteigerung zunächst unterbrochen oder die Dosis vorübergehend gesenkt und die weitere Erhöhung langsamer vorgenommen. Bei stärkeren gastrointestinalen Beschwerden können Antiemetika wie Domperidon verabreicht werden.
Umstellung von einem reinen Levodopa-Präparat Da sowohl therapeutische Effekte als auch Nebenwirkungen unter Levodopa/Carbidopa schneller auftreten als unter Levodopa alleine, müssen Patienten während der Dosiseinstellung besonders sorgfältig beobachtet werden. Insbesondere unwillkürliche Bewegungen werden unter Levodopa/Carbidopa schneller auftreten als unter Levodopa, da durch die Wirkung von Carbidopa mehr Levodopa das Gehirn erreicht und daher mehr Dopamin gebildet wird. Das Auftreten von unwillkürlichen Bewegungen kann eine Dosisreduktion nötig machen. Blepharospasmus kann ein nützliches frühes Zeichen für eine Überdosierung sein.
Levodopa sollte mindestens 12 Stunden vor Beginn der Therapie mit Levodopa/Carbidopa abgesetzt werden (24 Stunden, falls retardierte LevodopaFormen gegeben werden). Es sollte eine Dosierung für Levodopa/Carbidopa gewählt werden, die etwa 20% der bisherigen Levodopa-Menge liefert.
Umstellung von einem Präparat mit Levodopa und einem anderen Decarboxylasehemmer
Wird ein Patient, der bisher Levodopa und einen anderen Decarboxylasehemmer erhalten hat, auf Levodopa/Carbidopa umgestellt, sollte die Dosierung von Levodopa/Carbidopa zu Beginn so gewählt werden, dass die Levodopa-Dosis der des bisher eingenommenen Präparates entspricht.
Art der Anwendung
Die Einnahme erfolgt am besten 30 Minuten vor oder 90 Minuten nach den Mahlzeiten mit etwas Flüssigkeit und Gebäck. Vor der Einnahme sind große eiweißreiche Mahlzeiten zu vermeiden.
Dauer der Anwendung
Levo-C AL wird in der Regel über einen längeren Zeitraum eingenommen (Substitutionstherapie). Die Dauer der Anwendung ist bei guter Verträglichkeit nicht begrenzt.
4.3 Gegenanzeigen
Levo-C AL darf nicht angewendet werden bei:
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
• gleichzeitiger Gabe von nicht-selektiven MAO-Hemmern. Diese MAOHemmer müssen spätestens 2 Wochen vor Beginn der Therapie mit Levodopa/Carbiodpa abgesetzt werden. Levo C AL kann gleichzeitig mit selektiven MAO-Typ-B-Hemmern (z.B. Selegilin) in der empfohlenen Dosierung angewandt werden. Die Kombination aus MAO-A und MAO-B Inhibitoren sollte nicht zusammen mit Levo C AL gegeben werden.
• verdächtigen, nicht diagnostizierten Hautveränderungen oder einem anamnestisch bekannten Melanom, da Levodopa ein malignes Melanom aktivieren kann,
• Engwinkelglaukom
• Jugendlichen unter 18 Jahren.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Levo-C AL sollte nicht gegeben werden bei:
• schwerer Herz-Kreislauf- oder Lungenerkrankung, Bronchialasthma, Nieren, Leber- oder endokriner Erkrankung (z.B. Schilddrüsenüberfunktion, Phäochromozytom, Cushing Syndrom) sowie bei einem peptischen Ulcus oder Krampfanfällen in der Vorgeschichte.
• Tachykardien.
• schweren Störungen des hämopoietischen Systems sowie bei Vorliegen einer Kontraindikation für Sympathomimetika,
• Psychosen,
Hinweise
Bei der Gabe von Levodopa/Carbiodopa an Patienten mit Vorhof-, Knoten- oder Kammerarrhythmie nach durchgemachtem Herzinfarkt ist, wie bei Levodopa, Vorsicht geboten. Bei der Einstellung dieser Patienten auf Levodopa/Carbiodopa sollte die Herzfunktion in einer Einrichtung mit der Möglichkeit intensivmedizinischer Betreuung besonders sorgfältig überwacht werden (Monitoring).
Die Ausscheidung der wirksamen Bestandteile von Levodopa/Carbiodopa in Urin, Speichel und Schweiß kann Flecken in der Kleidung verursachen, die nach dem Antrocknen nicht mehr entfernt werden können, weshalb die Flecken in frischem Zustand ausgewaschen werden sollten.
Warnhinweise
Nach langjähriger Behandlung mit Präparaten, die Levodopa enthalten, kann ein plötzliches Absetzen oder sehr rasche Dosisreduzierung von Levo-C AL zu einem malignen Levodopa-Entzugssyndrom (malignes neuroleptisches Syndrom mit Hyperpyrexie, Muskelrigidität, psychischen Auffälligkeiten und einem Anstieg der Serumkreatin-Phosphokinase) oder einer akinetischen Krise führen. Beide Zustände sind lebensbedrohlich. Aus therapeutischen Gründen indizierte Levodopa-Pausen dürfen daher nur in der Klinik durchgeführt werden, vor allem wenn der Patient Neuroleptika erhält.
Impulskontrollstörungen
Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten und / oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich Levo-C AL, behandelt werden, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen auftreten können, einschließlich pathologischer Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang. Die Überprüfung der Behandlung wird empfohlen, wenn solche Symptome auftreten.
Levodopa wurde mit Somnolenz und plötzlich auftretenden Schlafattacken in Verbindung gebracht. In sehr seltenen Fällen wurde über plötzlich auftretende Schlafattacken während der Aktivitäten des täglichen Lebens berichtet, welche in manchen Fällen unbewusst oder völlig unerwartet auftraten. Patienten müssen darüber informiert und darauf hingewiesen werden, während einer Behandlung mit Levodopa im Straßenverkehr oder beim Bedienen von Maschinen vorsichtig zu sein. Patienten, bei denen Somnolenz und/oder plötzlich auftretende Schlafattacken aufgetreten sind, dürfen kein Fahrzeug führen und keine Maschinen bedienen. Darüber hinaus sollte eine Dosisreduktion oder eine Beendigung der Therapie erwogen werden.
Hinweise zur Überwachung der Behandlung In der Einstellungsphase sind häufigere Kontrollen der Leber- und Nierenfunktion sowie des Blutbildes zu empfehlen (später mindestens einmal jährlich).
Bei Herzinfarktanamnese, Herzrhythmusstörungen oder koronaren Durchblutungsstörungen sollen regelmäßige, vor allem zu Beginn der Behandlung häufige, Kreislauf- und EKG-Kontrollen vorgenommen werden.
Patienten mit Konvulsionen oder Magen-Darm-Ulcera in der Vorgeschichte sollten ebenfalls ärztlich besonders beobachtet werden.
Patienten mit einem chronischen Weitwinkelglaukom können behutsam mit Levodopa/Carbiodopa behandelt werden, wenn der intraokuläre Druck gut eingestellt ist und regelmäßig kontrolliert wird.
Patienten mit Risikofaktoren (z.B. ältere Patienten, Patienten, die gleichzeitig mit Antihypertensiva oder anderen Arzneimitteln mit orthostatischem Potenzial behandelt werden) oder orthostatischer Hypotonie in der Anamnese sollten engmaschig überwacht werden. Dies gilt besonders am Anfang der Behandlung und bei Dosissteigerungen.
Alle Patienten sollten sorgfältig auf psychische Veränderungen und auf Anzeichen einer Depression mit und ohne Suizidtendenzen überwacht werden. Patienten mit Psychosen oder Psychosen in der Vorgeschichte sollten mit Vorsicht behandelt werden.
Malignes Melanom: Parkinson-Patienten haben nach epidemiologischen
Studien ein etwa 2 - 6 fach erhöhtes Risiko ein malignes Melanom zu entwickeln als die allgemeine Bevölkerung. Es ist unklar, ob das erhöhte Risiko auf die Parkinson-Erkrankung zurückzuführen ist oder auf andere Faktoren, wie z.B. auf die Arzneimittel zur Behandlung der Erkrankung.
Daher sollten Patienten und Angehörige bzw. Betreuungspersonen angewiesen werden, während der Behandlung mit Levodopa/Carbiodopa die Haut häufig und regelmäßig auf Anzeichen eines Melanoms zu untersuchen. Im Idealfall sollten regelmäßige Hautuntersuchungen durch einen Hautarzt durchgeführt werden.
In sehr seltenen Fällen wurde bei Parkinson-Patienten eine eigenmächtige, missbräuchliche Dosissteigerung beobachtet.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Pharmakokinetische Wechselwirkungen
Bei gleichzeitiger Gabe von Levodopa/Carbidopa mit dem anticholinerg wirksamen Trihexyphenidyl wird die Geschwindigkeit, jedoch nicht das Ausmaß der Levodopa-Resorption reduziert.
Metoclopramid erhöht die Geschwindigkeit der Levodopa-Resorption.
Vorsicht ist geboten, wenn die nachfolgend genannten Substanzen gleichzeitig mit Levodopa/Carbiodopa gegeben werden:
Antihypertensiva
Bei Patienten, die Levodopa/Decarboxylasehemmer-Präparate zusammen mit Antihypertonika (insbesondere reserpinhaltige Präparate) erhielten, ist eine symptomatische orthostatische Hypotonie aufgetreten. Daher kann zu Beginn der Behandlung mit Levodopa/Carbiodopa eine Anpassung der Antihypertonika-Dosis erforderlich werden.
Antidepressiva
Über Nebenwirkungen, einschließlich Hypertonie und Dyskinesie, bei gleichzeitiger Anwendung von trizyklischen Antidepressiva und Levodopa/Carbidopa-Präparaten wurde selten berichtet. Unter kombinierter Therapie mit Selegilin und Levodopa/Carbidopa kann eine massive orthostatische Hypotonie auftreten, die nicht allein auf Levodopa/Carbidopa zurückzuführen ist.
Levodopa/Carbidopa darf nicht gleichzeitig mit einem irreversiblen nicht selektiven Monoaminoxidase-Hemmer verabreicht werden. Es muss ein Mindestabstand von 2 Wochen nach Beendigung der Therapie mit dem MAOHemmer Hemmer eingehalten werden, bevor Levodopa/Carbidopa gegeben werden kann. Die Gabe eines reinen MAO-B-Hemmers (z.B. Selegilin,
Rasagilin) oder eines selektiven MAO-A-Hemmers (z.B. Moclobemid) ist nicht kontraindiziert. Es wird empfohlen, die Levodopa-Dosis abhängig Wirksamkeit und Verträglichkeit neu einzustellen. Die gleichzeitige Gabe von MAO-A- und MAO-B-Hemmern entspricht in der Wirkung einer nicht selektiven MAOHemmung. Aus diesem Grund darf diese Kombination nicht gleichzeitig mit Madopar verabreicht werden (siehe Abschnitt 4.3.
Kombination mit anderen Antiparkinsonmitteln Es ist möglich, Levo-C AL mit allen bekannten Antiparkinsonmitteln zu kombinieren, wobei eine eventuell notwendige Dosisverminderung von Levo-C AL oder der anderen Substanzen zu beachten ist.
Andere Arzneimittel
Antipsychotisch wirksame Arzneimittel, wie z.B. Phenothiazine, Butyrophenone und Risperidon können die therapeutische Wirkung von Levodopa beeinträchtigen, ebenso auch Isoniazid. Eine verminderte Anti-ParkinsonWirkung von Levodopa unter Phenytoin, Papaverin und Opioiden wurde berichtet. Patienten sollten sorgfäItig auf Verringerung oder Ausbleiben des therapeutischen Ansprechens beobachtet werden.
Die gleichzeitige Einnahme von Levodopa/Carbiodopa und Sympathomimetika (z.B. Epinephrin, Norepinephrin, Isoproterenol oder Amphetamine, die das sympathische Nervensystem stimulieren) kann deren Wirkung verstärken.
Daher wird diese Kombination nicht empfohlen. Sollte die Kombination dennoch nötig sein, muss das kardiovaskuläre System engmaschig überwacht werden und eine Dosisreduktion der Sympathomimetika kann erforderlich sein.
Die Wirkung von Levo-C AL wird durch Vitamin B6 in niedrigen Dosen nicht beeinträchtigt.
Die gleichzeitige Einnahme einer proteinreichen Mahlzeit oder von Eisensulfathaltigen oder Eisengluconat-haltigen Arzneimitteln kann zu einer geringeren Aufnahme von Levo-C AL im Magen-Darm-Trakt führen.
Es können verschiedene labordiagnostische Messungen gestört sein:
• Bestimmungen von Katecholaminen, Kreatinin, Harnsäure, Glukose, alkalischer Phosphatase, SGOT, SGPT, LDH, Bilirubin und Blutharnstoff-N,
• Erniedrigtes Hämoglobin und Hämatokrit, erhöhte Serum-Glucose und Urinbefunde (Leukozyten, Bakterien im Blut) wurden beobachtet.
• falsch-positiver Keton-Nachweis bei Verwendung von Teststreifen (durch Kochen der Urinprobe wird diese Reaktion nicht verändert),
• falsch-negativer Harnzuckernachweis bei Verwendung der GlucoseOxidase-Methode,
• falsch-positiver Coombs-Test (zu einer hämolytischen Anämie kam es dabei nur äußerst selten).
Hinweis:
Vor Narkosen mit Halothan, Cyclopropan und anderen Substanzen, die das Herz gegenüber sympathomimetischen Aminen sensibilisieren, muss Levo-C AL wenigstens 8 Stunden vorher abgesetzt werden, sofern nicht gleichzeitig Opioide zur Anwendung kommen.
Wenn die Therapie vorübergehend unterbrochen wird, sollte die übliche Tagesdosis wieder eingenommen werden, sobald der Patient wieder orale Arzneimittel einnehmen kann.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Über mögliche Risiken durch dieses Arzneimittel in der Schwangerschaft liegen unzureichende Daten vor. Das Arzneimittel führte in präklinischen Untersuchungen zu pathologischen Veränderungen an inneren Organen und Skelett beim Kaninchen.
Levo-C AL sollte in der Schwangerschaft nicht angewendet werden. Es ist jedoch im Einzelfall zu entscheiden, ob ein Absetzen der Therapie mit Levo-C AL bei der Schwangeren verantwortet werden kann, weil es aufgrund der Schwere der unbehandelten Erkrankung möglicherweise zu einer ernsthaften Gefährdung der Patientin kommen kann.
Stillzeit
Es ist nicht bekannt, ob der Wirkstoff Carbidopa in die Muttermilch übergeht. In einer Studie mit einer stillenden Mutter mit Parkinsonscher Erkrankung wurde die Ausscheidung von Levodopa in die Muttermilch beobachtet.
Levodopa/Carbidopa hemmen die Prolaktinausschüttung und somit die Laktation. Ist eine Behandlung mit Levo-C AL während der Stillzeit erforderlich, muss abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Wenn es bei Patienten unter der Einnahme von Levodopa/Carbidopa zu Somnolenz und/oder plötzlich auftretenden Schlafattacken kommt, müssen sie darüber informiert werden, dass sie kein Fahrzeug führen oder Tätigkeiten ausüben dürfen, bei denen eine Beeinträchtigung der Aufmerksamkeit das Risiko schwerwiegender Verletzungen oder des Todes für sich selbst oder andere nach sich ziehen kann, bis Somnolenz und Schlafattacken nicht mehr auftreten (siehe Abschnitt 4.4).
4.8 Nebenwirkungen
Die unter Levodopa/Carbidopa -Behandlung häufig beobachteten Nebenwirkungen sind auf die zentralen neuropharmakologischen Wirkungen des Dopamin zurückzuführen. Diese Reaktionen können in der Regel durch Dosisreduktion verringert werden.
Zu den häufigsten Nebenwirkungen zählen Dyskinesien (choreoforme, dystone und andere unwillkürliche Bewegungen) und Übelkeit. Muskelzucken und Blepharospasmus können frühzeitig eine zu hohe Dosis anzeigen.
In klinischen Studien und seit Markteinführung wurden außerdem die folgenden Nebenwirkungen beobachtet.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Blutes und des Lymphsystems
Selten: Agranulozytose, Leukopenie, hämolytische und nicht-hämolytische Anämie, Thrombozytopenie
Stoffwechsel- und Ernährungsstörungen Häufig: Anorexie
Psychiatrische Erkrankungen
Häufig: Konfusion, depressive Verstimmungen u.U. mit Suizidtendenzen, Albträume, Halluzinationen Gelegentlich: Agitiertheit
Selten: Demenz, psychotische Zustandsbilder wie Wahnideen und paranoide Gedankenbildung
Impulskontrollstörungen
Pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich Levo-C AL, behandelt werden (siehe Abschnitt 4.4).
Erkrankungen des Nervensystems
Häufig: on-off-Phänomene (Wechsel von Beweglich- und Unbeweglichkeit), Schwindel, Parästhesien (z.B. Kribbeln und Einschlafen der Glieder), Schläfrigkeit (einschließlich sehr selten auftretender übermäßiger Tagesmüdigkeit und Schlafattacken)
Gelegentlich: Synkope
Selten: Krampfanfälle (Konvulsionen, der kausale Zusammenhang mit Levodopa/Carbidopa ist nicht gesichert), malignes neuroleptisches Syndrom (siehe Warnhinweise)
Herzerkrankungen Gelegentlich: Herzklopfen Selten: kardiale Arrhythmien
Gefäßerkrankungen
Häufig: orthostatische Regulationsstörungen (Blutdruckabfall beim Wechsel der Körperlage) einschließlich hypotensiver Episoden selten: Hypertonie, Phlebitis
Erkrankungen der Atemwege, des Brustraums und Mediastinums Häufig: Atemnot
Erkrankungen des Gastrointestinaltrakts Häufig:Durchfall, Erbrechen
Selten: dunkler Speichel, Entwicklung eines Duodenalulcus, abdominale Blutungen
Erkrankungen der Haut und des Unterhautzellgewebes Gelegentlich: Urtikaria
Selten: Alopezie, Angioödem, dunkler Schweiß, Henoch-Schonlein Purpura, Pruritus, Hautausschlag
Erkrankungen der Nieren und Harnwege Selten: dunkler Urin
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufig: Brustschmerzen
Andere unter Levodopa oder Levodopa/Carbidopa berichtete Nebenwirkungen umfassen:
Gutartige, bösartige und unspezifische Neubildungen (einschl. Zysten und Polypen)
malignes Melanom (siehe Abschnitt 4.3 Gegenanzeigen)
Stoffwechsel- und Ernährungsstörungen Gewichtszunahme, Gewichtsverlust
Psychiatrische Erkrankungen
Angst, Zähneknirschen, Orientierungsstörungen, Euphorie, Schlaflosigkeit Erkrankungen des Nervensystems
Aktivierung eines latenten Horner-Syndroms, Ataxie, bitterer Geschmack, verminderte geistige Leistungsfähigkeit; Bewegungs- und extrapyramidalmotorische Störungen, Ohnmachtsgefühl, Kopfschmerz, verstärkter Tremor der Hände, Taubheitsgefühl, angeregte Stimmung
Augenerkrankungen
Blepharospasmus, Verschwommensehen, Pupillenerweiterung, Diplopie, Blickkrämpfe (okulogyrische Krisen)
Gefäßerkrankungen
Flushing, Hitzegefühl
Erkrankungen der Atemwege, des Brustraums und Mediastinums unregelmäßige Atmung, Heiserkeit
Erkrankungen des Gastrointestinaltrakts
Zungenbrennen, Verstopfung, Mundtrockenheit, Dyspepsie, Dysphagie, Bauchschmerzen, Flatulenz, Schluckauf, Speichelfluss
Erkrankungen der Haut und des Unterhautzellgewebes vermehrtes Schwitzen
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Muskelkrämpfe, Trismus
Erkrankungen der Nieren und Harnwege Harninkontinenz, Harnretention
Erkrankungen der Geschlechtsorgane und der Brustdrüse Priapismus
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Asthenie, Ödeme, Abgeschlagenheit, Gangstörungen,Mattigkeit, Schwäche
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen Fallneigung
Untersuchungen
Siehe Abschnitt 4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Die Symptome einer Überdosierung entsprechen den in Abschnitt 4.8 beschriebenen Nebenwirkungen.
Therapiemaßnahmen bei Überdosierung
Die Therapiemaßnahmen bei akuter Überdosierung mit Levodopa/Carbidopa entsprechen weitgehend den bei Überdosierung mit Levodopa, außer dass Pyridoxin nicht wirksam ist. Bei akuter Überdosierung von Levo-C AL sind neben einer sofortigen Magenspülung eine intensivmedizinische Überwachung und Stützmaßnahmen unter besonderer Beachtung der Herz- und Kreislauffunktionen erforderlich. Kardiale Arrhythmien können die Anwendung von Antiarrhythmika, wie z.B. ß-Rezeptorenblockern, erforderlich machen. Ein spezifisches Antidot existiert nicht. Es liegen keine Dialyseerfahrungen vor.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antiparkinsonmittel (Dopamin-Vorstufe mit Decarboxylasehemmer).
ATC-Code: N04BA10
Die Aminosäure Levodopa dient der Substitution des beim Parkinson-Syndrom bestehenden Dopamin-Mangels. Da wenigstens 95% des oral verabreichten Levodopa bereits in extrazerebralen Organen (Darm, Leber, Niere, Herz,
Magen) decarboxyliert werden, gelangen nur geringe Mengen ins Gehirn. Durch das extrazerebral gebildete Dopamin und die aus ihm entstehenden adrenergen Substanzen sind zahlreiche Nebenwirkungen gastrointestinaler und kardiovaskulärer Art bei der Monotherapie mit Levodopa bedingt.
Durch die gleichzeitige Gabe des Decarboxylasehemmers Carbidopa wird die Decarboxylierung von Levodopa in der Peripherie weitgehend verhindert. Dadurch kann die Dosis Levodopa, die zur Erreichung vergleichbarer klinischer Effekte notwendig ist, auf bis zu 20% der bei der Monotherapie notwendigen Dosis gesenkt werden. Die gastrointestinalen und kardiovaskulären Nebenwirkungen werden damit weitgehend vermieden.
5.2 Pharmakokinetische Eigenschaften
Die orale Gabe von 25 mg Carbidopa-Monohydrat in Kombination mit 100 mg bzw. 250 mg Levodopa führte nach 0,9 h bzw. 0,6 h zu maximalen LevodopaPlasmakonzentrationen von 1091 ng/ml und 1413 ng/ml. Die Bioverfügbarkeit von Carbidopa lag zwischen 58% und 71%. Maximale Carbidopa-Konzentrationen im Plasma, die nach 1,9 h bis 2,4 h erreicht wurden, betrugen
69.2 bis 93,6 ng/ml.
Die Plasmahalbwertszeit von Levodopa steigt mit zunehmender Carbidopadosierung von 1,1 h bei 10 mg Carbidopa-Monohydrat/100 mg Levodopa auf 1,5 h bei 62,5 mg Carbidopa-Monohydrat/250 mg Levodopa. Die
Plasmaclearance für Levodopa war bei Kombination mit Carbidopa nur etwa halb so groß wie bei der Monotherapie. Die Eiweißbindung von Carbidopa liegt bei 36%. Es wurde eine Eliminationshalbwertszeit von 7,7 h bis 11,7 h gemessen.
Die Hemmung der peripheren Decarboxylasen führt, wenn man die Plasmakonzentration der Metabolite bei Mono- und Kombinationstherapie vergleicht, zu erhöhten Plasmakonzentrationen bei den Aminosäuren (Levodopa und sein 3-O-Methyl-Derivat) und zur Abnahme der Plasmakonzentration bei den Catecholaminen (Dopamin, Noradrenalin), der Homovanillinsäure und der 3,4-Dihydroxyphenylessigsäure. So konnte z.B. die maximale Dopaminkonzentration im Plasma durch Carbidopazusatz von 300 ng/ml auf unter 2,5 ng/ml gesenkt werden. 50% bis 60% der applizierten Carbidopa-Dosis wurden renal ausgeschieden. Davon konnte etwa ein Drittel als unverändertes Carbidopa identifiziert werden.
Als Metabolite fand man im Urin:
• 2-Methyl-3’-methoxy-4’-hydroxyphenylpropionsäure,
• 2-Methyl-3,4-dihydroxyphenylpropionsäure,
• 3-Hydroxy-a-methylphenylpropionsäure und
• 3,4-Dihydroxyphenylaceton.
Diese vier Metabolite traten überwiegend in konjugierter Form auf.
Auch die Metabolite des Levodopa werden hauptsächlich über die Nieren ausgeschieden. Bei gleichzeitiger Gabe von Carbidopa konnte im 48 h-Sammelharn eine deutliche Abnahme der Homovanillinsäure- und Dopaminmenge festgestellt werden.
5.3 Präklinische Daten zur Sicherheit
Akute Toxizität Carbidopa
Die orale LD50 von Carbidopa beträgt 1750 mg/kg bei erwachsenen weiblichen Mäusen, 4810 mg/kg bei jungen erwachsenen weiblichen und 5610 mg/kg bei jungen erwachsenen männlichen Ratten. Die akute orale Toxizität von Carbidopa ist bei entwöhnten Ratten und erwachsenen Ratten ähnlich, die Verbindung erweist sich jedoch für die jungen Ratten als toxischer. Die toxischen Anzeichen (Ptose, Ataxie und Abnahme der Aktivität) waren bei Mäusen und Ratten gleich. Bei Mäusen wurde noch Bradypnoe festgestellt. Der Tod trat gewöhnlich über Nacht ein, gelegentlich erst nach 12 Tagen.
Levodopa
Die orale LD50 von Levodopa reicht von 800 mg/kg bei jungen noch nicht geschlechtsreifen männlichen und weiblichen Ratten bis 2260 mg/kg bei herangewachsenen weiblichen Ratten. Toxische Zeichen waren: Lautäußerungen, Reizbarkeit, Erregbarkeit, Ataxie sowie verstärkte Aktivität, der nach 1 bis 2 Stunden eine verminderte Aktivität folgte. Der Tod trat gewöhnlich - frühestens nach 30 Minuten - über Nacht ein, gelegentlich erst nach 5 Tagen.
Kombination von Carbidopa und Levodopa
Die orale LD50 verschiedener Kombinationen von Carbidopa und Levodopa reicht bei Mäusen von 1930 mg/kg bei einem VerhäItnis von 1:1 bis zu 3270 mg/kg bei einem VerhäItnis von 1:3. Diese Mengen sind die Summe der Einzeldosen von Carbidopa und Levodopa. Andere Testkonzentrationen über 1:3 (1:4, 1:5, 1:10) veränderten die beim VerhäItniswert 1:3 gefundene LD50 nicht merklich. Die VerhäItniswerte 1:3 und darüber waren weniger toxisch als die 1:1- und 1:2-Relationen. Toxizitätsanzeichen waren aufgestellte Schwänze, Piloerektion, Ataxie, Tränenfluss und verstärkte Aktivität. Klonische Konvulsionen und erhöhte Reizbarkeit traten bei Dosen von 1500 mg/kg und höher auf. Bei Dosen von 4120 mg/kg und höher kam es zum Anschwellen des Kopfes und zu Tremor des ganzen Körpers. Der Tod trat bei Gaben von 4120 und 5780 mg/kg nach 30 Minuten bis 24 Stunden, bei Dosen von 2940 mg/kg spätestens nach 12 Tagen ein.
Chronische Toxizität/Subchronische Toxizität Carbidopa
Chronische orale Toxizitätsuntersuchungen von Carbidopa wurden ein Jahr lang an Affen und 96 Wochen an Ratten mit Dosen von 25 mg bis 135 mg/kg/Tag durchgeführt. Bei den Affen konnten keine arzneimittelbedingten Wirkungen festgestellt werden. Bei den Ratten wurden in allen Dosierungsgruppen einige Fälle von Schwächeerscheinungen beobachtet. Das durchschnittliche Gewicht der Rattennieren war in der höchsten Dosierungsgruppe signifikant höher als das bei den entsprechenden Kontrolltieren, obwohl sich weder makroskopische noch mikroskopische Veränderungen fanden, die als Ursache dafür hätten gelten können. Es zeigten sich keine auf die Behandlung zurückzuführenden histologischen Veränderungen. Carbidopa beeinflusste bei der 96 Wochen andauernden Untersuchung an Ratten weder die Art noch das Auftreten von Neoplasmen.
Carbidopa hatte bei Hunden einen Pyridoxinmangel zur Folge, der durch die zusätzliche Gabe von Pyridoxin kompensiert wurde. Abgesehen vom Pyridoxinmangel bei Hunden zeigte Carbidopa keine Anzeichen einer Toxizität, die mit Hydrazinen in Zusammenhang stehen.
Kombination von Carbidopa und Levodopa
Drei verschiedene Dosiskombinationen von Carbidopa und Levodopa, die 54 Wochen lang Affen und 106 Wochen lang Ratten oral verabreicht wurden, zeigten, dass die physischen Hauptwirkungen auf die pharmakologische Aktivität der Substanzen zurückzuführen waren. Die untersuchten Dosierungen waren (Carbidopa/Levodopa) 10/20, 10/50 und 10/100 mg/kg/Tag. Dosierungen von 10/20 mg/kg/Tag hatten keine sichtbaren physischen Effekte zur Folge.
Bei Affen konnte man mit Dosierungen von 10/50 und 10/100 mg/kg/Tag
Hyperaktivität feststellen, die unter der höheren Dosis 32 Wochen lang anhielt. Mit der Dosierung von 10/50 mg/kg/Tag verringerte sich bei Fortdauer der Untersuchung die Hyperaktivität; nach der 14. Woche war sie nicht mehr vorhanden. Störungen der Muskelkoordination und Schwäche waren unter der Dosis von 10/100 mg/kg/Tag bis zur 22. Woche zu beobachten. Pathologischanatomische Untersuchungen zeigten keine morphologischen Veränderungen.
Ratten, die 10/50 und 10/100 mg/kg/Tag erhielten, wiesen eine Verlangsamung der normalen Aktivität auf und zeigten eine anomale Körperhaltung. Die höhere Dosis verursachte exzessive Salivation. Die Körpergewichtszunahme war vermindert.
Organuntersuchungen ließen bei zwei Ratten, die 26 Wochen lang 10/100mg/kg/Tag erhalten hatten, eine sehr leichte Hypertrophie der azinösen Zellen der Unterkieferdrüsen erkennen. Unter keiner Dosis wurden histomorphologische Veränderungen nach 54 bzw. 106 Wochen festgestellt. Hypertrophie der azinösen Zellen der Speicheldrüse wurde bei Ratten beobachtet, die mit höheren Dosen der Kombination für kürzere Zeitabschnitte und mit Levodopa allein behandelt wurden.
Reproduktionstoxikologie
Carbidopa
In Ratten beeinflusste die perorale Verabreichung von Carbidopa in Dosen von 30, 60 oder 120 mg/kg/Tag weder das Paarungsverhalten noch die Fruchtbarkeit oder das Überleben des Nachwuchses. Die höchste genannte Dosis verursachte eine geringfügige Verringerung der Gewichtszunahme bei männlichen Tieren. Carbidopa, verabreicht an Mäuse und Kaninchen in Dosen bis zu 120 mg/kg/Tag, zeigte keinerlei Anzeichen teratogener Wirkungen.
Levodopa
Levodopa verursachte bei Gaben von 125 und 250 mg/kg/Tag viszerale Missbildungen und Veränderungen des Skeletts bei Kaninchen.
Kombination von Carbidopa und Levodopa
Mit Carbidopa/Levodopa Kombinationen, verabreicht in Dosen von 25/250 bis 100/500 mg/kg/Tag, war bei Mäusen kein Hinweis auf Missbildungen festzustellen; bei Kaninchen hingegen traten Deformationen am Skelett bzw. viszerale Missbildungen auf, die quantitativ und qualitativ denen unter der alleinigen Gabe von Levodopa ähnlich waren.
Carbidopa/Levodopa-Kombinationen, verabreicht in Dosen von 10/20, 10/50 oder 10/100mg/kg/Tag, hatten weder auf die Fruchtbarkeit und Fortpflanzungsfähigkeit männlicher oder weiblicher Ratten noch auf das Wachstum oder die Überlebensfähigkeit der Jungen irgendwelche nachteiligen Auswirkungen.
Mutagenität
Carbidopa
Carbidopa wurde nur unzureichend bezüglich mutagener Wirkungen untersucht. Carbidopa erwies sich im mikrobiellen Mutagenitätstest als nicht mutagen.
Levodopa
Levodopa wurde nicht getestet, da es sich um eine natürlicherweise vorhandene Substanz handelt.
Kanzerogenität
Carbidopa
In Ratten ergab die perorale Verabreichung von Carbidopa während 96 Wochen in den Dosierungen 25, 45 oder 135 mg/kg/Tag hinsichtlich der Mortalität und der Kanzerogenität keine Unterschiede im Vergleich der behandelten mit den Kontroll-Tieren.
Kombination von Carbidopa und Levodopa
Ratten erhielten peroral Kombinationen von Carbidopa und Levodopa während 106 Wochen in Dosen von 10/20, 10/50 und 10/100 mg/kg/Tag. Hinsichtlich der Mortalität, des Auftretens von Neoplasien sowie deren Art ergaben sich keine Unterschiede im Vergleich der behandelten mit den Kontroll-Tieren.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Mikrokristalline Cellulose, vorverkleisterte Stärke (aus Mais), wasserfreie Citronensäure (Ph.Eur.), Magnesiumstearat (Ph.Eur.).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für diese Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
Braunglasflaschen und Verschlusskappen aus Polyethylen mit Trockenmittel. Originalpackung mit 100 und 200 (2x100) Tabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
ALIUD PHARMA® GmbH Gottlieb-Daimler-Straße 19 D-89150 Laichingen Telefon: 07333/9651-0
Telefax: 07333/9651-6004
8. Zulassungsnummern
45923.00.00
45923.01.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
16.08.1999/28.02.2005
10. Stand der Information
Mai 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
17