Levocetirizin-Ratiopharm 5 Mg Filmtabletten
Wortlaut der für die Fachinformation vorgesehenen Angaben
F achinformation
1. BEZEICHNUNG DES ARZNEIMITTELS
Levocetirizin-ratiopharm® 5 mg Filmtabletten
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede Filmtablette enthält 5 mg Levocetirizindihydrochlorid (entsprechend 4,2 mg Levocetirizin).
Sonstiger Bestandteil:
Jede Filmtablette enthält 63,5 mg Lactose-Monohydrat.
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Filmtablette.
Weiße bis cremefarbene, ovale Filmtablette. Die eine Seite der Tablette besitzt die Prägung „LC5“, die andere Seite der Tablette ist glatt.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Levocetirizin ist angezeigt:
- zur Linderung von nasalen und okulären Symptomen bei saisonaler und perennialer allergischer Rhinitis
- zur Linderung von Symptomen bei chronischer idiopathischer Urtikaria
4.2 Dosierung, Art und Dauer der Anwendung
Die Filmtabletten sind unzerkaut mit Flüssigkeit einzunehmen. Die Einnahme kann zu oder unabhängig von den Mahlzeiten erfolgen.
Erwachsene und Jugendliche ab 12 Jahren
Die empfohlene Tagesdosis beträgt einmal täglich 5 mg (1 Filmtablette).
Kinder von 6 bis 12 Jahren
Die empfohlene Tagesdosis beträgt einmal täglich 5 mg (1 Filmtablette).
Bei Kindern unter 6 Jahren wird die Anwendung von Levocetirizin aufgrund nicht ausreichender Daten zur Sicherheit und Wirksamkeit nicht empfohlen.
Ältere Patienten
Derzeit deuten die Daten nicht darauf hin, dass die Dosis bei älteren Patienten - soweit die Nierenfunktion unauffällig ist - reduziert werden muss.
Patienten mit mittelschwerer bis schwerer Niereninsuffizienz Daten, die das Wirksamkeits-/Sicherheits-Verhältnis belegen, liegen für Patienten mit Niereninsuffizienz nicht vor. Da Levocetirizin hauptsächlich über die Niere ausgeschieden wird (siehe Abschnitt 5.2), muss in Fällen, in denen keine alternative Behandlung angewendet werden kann, das Dosisintervall individuell der Nierenfunktion entsprechend angepasst werden. Die Dosisanpassung sollte gemäß der folgenden Tabelle vorgenommen werden. Bei der Anwendung dieser Tabelle zur Dosisanpassung muss der Wert der Kreatinin-Clearance (CLcr) des Patienten in ml/min abgeschätzt werden. Die CLcr in ml/min kann aus der Serum-KreatininKonzentration (mg/dl) nach folgender Formel bestimmt werden:
CLcr = r 140 - Alter (Jahre)] x Gewicht (kg) (x 0,85 bei Frauen)
72 x Serumkreatinin (mg/dl)
Dosisanpassung bei Erwachsenen mit eingeschränkter Nierenfunktion
|
Gruppe |
Kreatinin-Clearance (ml/min) |
Dosis und Einnahmehäufigkeit |
|
normal |
> 80 |
1 Tablette täglich |
|
leicht |
50-79 |
1 Tablette täglich |
|
mäßig |
30-49 |
1 Tablette alle 2 Tage |
|
schwer |
< 30 |
1 Tablette alle 3 Tage |
|
terminale Niereninsuffizienz - dialysepflichtige Patienten |
< 10 |
kontraindiziert |
Bei Kindern mit eingeschränkter Nierenfunktion muss die Dosis unter Berücksichtigung der renalen Clearance, des Alters und des Körpergewichts individuell an den Patienten angepasst werden.
Patienten mit eingeschränkter Leberfunktion
Bei Patienten mit ausschließlich eingeschränkter Leberfunktion ist keine Dosisanpassung erforderlich.
Patienten mit gleichzeitig eingeschränkter Leber- und Nierenfunktion
Eine Dosisanpassung wird empfohlen (siehe zuvor bei „Patienten mit mittelschwerer bis
schwerer Niereninsuffizienz“).
4.3 Gegenanzeigen
Überempfindlichkeit gegen Levocetirizin, einen der sonstigen Bestandteile, Hydroxyzin oder andere Piperazinderivate.
Patienten mit schwerer Niereninsuffizienz mit einer Kreatinin-Clearance unter 10 ml/min.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Levocetirizin-ratiopharm® 5 mg Filmtabletten nicht einnehmen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Die angegebene Dosierung darf nicht überschritten werden.
Für Kinder unter 6 Jahren wird die Anwendung von Levocetirizin-ratiopharm® 5 mg Filmtabletten nicht empfohlen, da mit diesen Filmtabletten keine geeignete Dosisanpassung möglich ist.
Bei therapeutischen Dosierungen wurden im Zusammenhang mit Alkohol keine klinisch signifikanten Wechselwirkungen festgestellt (bei einem Alkoholblutspiegel von 0,5 g/l). Dennoch ist bei gleichzeitiger Einnahme mit Alkohol Vorsicht geboten.
Bei Patienten mit Epilepsie und bei Patienten mit Krampfneigung wird zur Vorsicht geraten.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Aufgrund der Pharmakokinetik, Pharmakodynamik und des Verträglichkeitsprofils von Levocetirizin sind keine Wechselwirkungen mit diesem Antihistaminikum zu erwarten. Tatsächlich wurden weder pharmakodynamische noch signifikante pharmakokinetische Wechselwirkungen in durchgeführten Interaktionsstudien berichtet, insbesondere nicht mit Pseudoephedrin oder Theophyllin (400 mg/Tag).
Das Ausmaß der Resorption von Levocetirizin wird durch Nahrungsaufnahme nicht vermindert, obwohl die Resorptionsgeschwindigkeit herabgesetzt ist.
4.6 Schwangerschaft und Stillzeit
Es liegen nur sehr begrenzte klinische Daten zur Anwendung bei Schwangeren vor. Tierexperimentelle Studien lassen nicht auf direkte oder indirekte schädliche Wirkungen auf die Schwangerschaft, embryonale/fetale Entwicklung, Entbindung oder postnatale Entwicklung schließen. Bei der Verschreibung an Schwangere oder Stillende ist Vorsicht geboten, da Levocetirizin in die Muttermilch übergeht.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Objektive Messungen der Fahrtüchtigkeit, Schlaflatenz und Leistung am Fließband haben bei der empfohlenen Dosis von 5 mg keine klinisch relevanten Wirkungen gezeigt. Daher sollten Patienten, die Autofahren wollen, ohne sicheren Halt arbeiten oder Maschinen bedienen, die empfohlene Dosis nicht überschreiten und die individuelle Reaktion auf das Arzneimittel abwarten. Bei diesen empfindlichen Patienten kann die gleichzeitige Einnahme mit Alkohol oder zentral dämpfenden Mitteln zu einer zusätzlichen Verminderung der Aufmerksamkeit und einer Leistungsbeeinträchtigung führen.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Häufig |
Gelegentlic |
Selten |
Sehr selten |
|
h | ||||
|
Erkrankungen des Blutes und des Lymphsystems |
Thrombozytopenie | |||
|
Erkrankungen des Immunsystems |
Über empfindlichkeit |
Anaphylaktischer Schock | ||
|
Psychiatrische Erkrankungen |
Somnolenz |
Agitiertheit |
Aggressivität, Verwirrtheit, Depression, Halluzina tionen, Schlaflosigkeit |
Tic |
|
Erkrankungen des Nervensystems |
Schwindel, Kopf schmerzen |
Parästhesien |
Konvulsionen, Bewegungs störungen |
Dysgeusie, Synkope, Tremor, Dystonie, Dyskinesie |
|
Augenerkrankunge n |
Akkommodationsstörungen, verschwommenes Sehen, Okulogyra-tion | |||
|
Herzerkrankungen |
Tachykardie | |||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Pharyngitis, Rhinitis* | |||
|
Erkrankungen des Gastrointestinaltrakts |
Bauch schmerzen, Mund trockenheit, Übelkeit |
Diarrhoe | ||
|
Leber- und Gallenerkrankungen |
auffällige Leberfunktion (erhöhte Werte für Transamin-asen, alkalische Phosphatase, y-GT und Bilirubin) | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Pruritus, Ausschlag |
Urtikaria |
Angioneurotisches Ödem, fixes Arzneimittelexanthem | |
|
Erkrankungen der Nieren und Harnwege |
Dysurie, Enuresis | |||
|
Allgemeine Erkrankungen und Beschwerden am V erabreichungsort |
Müdigkeit |
Asthenie, Unwohlsein |
Ödeme | |
|
Untersuchungen |
Gewichts zunahme |
* bei Kindern
4.9 Überdosierung
Symptome
Die Symptome, die nach einer Levocetirizin-Überdosierung beobachtet wurden, stehen meist in Zusammenhang mit ZNS-Wirkungen oder Wirkungen, die auf einen anticholinergen Effekt deuten könnten.
Nach Einnahme von mindestens dem 5-fachen der empfohlenen Tagesdosis wurden als Nebenwirkungen gemeldet: Verwirrtheit, Diarrhö, Schwindel, Müdigkeit, Kopfschmerzen, Unwohlsein, Mydriasis, Pruritus, Ruhelosigkeit, Sedierung, Somnolenz, Stupor, Tachykardie, Tremor und Harnretention.
Behandlung einer Überdosierung
Es gibt kein bekanntes spezifisches Antidot gegen Levocetirizin.
Bei einer Überdosierung wird eine symptomatische oder unterstützende Behandlung empfohlen. Kurze Zeit nach Auftreten einer Überdosierung kann auch eine Magenspülung erwogen werden.
Levocetirizin wird durch eine Dialyse nicht wirksam entfernt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antihistaminika zur systemischen Anwendung, PiperazinDerivate
ATC-Code: R06AE09
Levocetirizin, das (R)-Enantiomer von Cetirizin, ist ein wirksamer und selektiver, peripherer H1 -Rezeptorantagonist.
Bindungsstudien haben ergeben, dass Levocetirizin eine hohe Affinität zu humanen H1-Rezeptoren hat (Ki = 3,2 nmol/l). Die Affinität von Levocetirizin ist damit doppelt so hoch wie die von Cetirizin (Ki = 6,3 nmol/l). Levocetirizin dissoziiert von den H1-Rezeptoren mit einer Halbwertszeit von 115 ± 38 Minuten. Die Rezeptorbesetzung von Levocetirizin betrug nach einmaliger Anwendung 90 % nach 4 Stunden und 57 % nach 24 Stunden.
In pharmakodynamischen Studien bei gesunden Probanden wurde gezeigt, dass Levocetirizin in nur halber Dosierung von Cetirizin sowohl auf der Haut als auch in der Nase eine mit Cetirizin vergleichbare Wirkung hat.
Die pharmakodynamische Aktivität von Levocetirizin wurde in randomisierten, kontrollierten Studien untersucht.
In einer Vergleichsstudie zu den Wirkungen von Levocetirizin 5 mg, Desloratadin 5 mg und Placebo auf die histamininduzierte Erythem- und Quaddelbildung führte die Levocetirizin-Therapie im Vergleich zu Placebo und Desloratadin zu einer signifikant reduzierten Erythem-und Quaddelbildung, die in den ersten 12 Stunden am ausgeprägtesten war und 24 Stunden lang anhielt (p < 0,001).
In placebokontrollierten Studien wurde mittels Modell der Allergenprovokationskammer für Levocetirizin 5 mg zur Kontrolle von polleninduzierten Symptomen der Wirkungseintritt
1 Stunde nach Substanzeinnahme beobachtet.
In-vitro-Studien (Boyden-Kammer und Zellschicht-Techniken) ergaben, dass Levocetirizin die Eotaxin-induzierte transendotheliale Migration von Eosinophilen sowohl durch Haut- als auch durch Lungenzellen inhibiert.
Levocetirizin hemmt die Histamin-vermittelte frühe Phase der allergischen Reaktion und vermindert ebenso die Migration bestimmter Entzündungszellen sowie die Freisetzung bestimmter Mediatoren, die mit der späten allergischen Reaktion in Zusammenhang stehen.
Die Wirksamkeit und Unbedenklichkeit von Levocetirizin wurde in mehreren doppelblinden, placebokontrollierten klinischen Studien bei erwachsenen Patienten mit saisonaler allergischer Rhinitis oder perennialer allergischer Rhinitis nachgewiesen.
In einer 6-monatigen klinischen Studie bei 551 erwachsenen Patienten (von denen 276 mit Levocetirizin behandelt wurden) mit persistierender allergischer Rhinitis (Symptome an 4 Tagen pro Woche über mindestens 4 aufeinander folgende Wochen) sowie Hausstaubmilben-und Gräserpollensensibilisierung wurde gezeigt, dass 5 mg Levocetirizin die Gesamtsymptomatik der allergischen Rhinitis über die ganze Studiendauer klinisch und statistisch signifikant besser linderten als Placebo. Eine Tachyphylaxie wurde nicht beobachtet. Während der gesamten Studiendauer verbesserte Levocetirizin signifikant die Lebensqualität der Patienten.
Die Sicherheit und Wirksamkeit von Levocetirizin-Tabletten bei Kindern wurde in
2 placebokontrollierten klinischen Studien bei Patienten im Alter von 6-12 Jahren untersucht, die an saisonaler bzw. perennialer allergischer Rhinitis litten. In beiden Studien verbesserte Levocetirizin die Symptome und die gesundheitsbezogene Lebensqualität.
In einer placebokontrollierten klinischen Studie bei 166 Patienten mit chronischer idiopathischer Urtikaria wurden 85 Patienten mit Placebo und 81 Patienten mit 1-mal täglich 5 mg Levocetirizin 6 Wochen lang behandelt. Die Behandlung mit Levocetirizin führte zu einem signifikanten Rückgang des Juckreizschweregrades in der 1. Woche und über die gesamte Behandlungsdauer im Vergleich zu Placebo. Levocetirizin verbesserte im Vergleich zu Placebo auch in höherem Maße die gesundheitsbezogene Lebensqualität, die anhand des Dermatology Life Quality Index beurteilt wurde.
Beziehung zwischen Pharmakokinetik und Pharmakodynamik
5 mg Levocetirizin zeigen ein ähnliches Muster bei der Hemmung der histamininduzierten Erythem- und Quaddelbildung wie 10 mg Cetirizin. Wie bei Cetirizin war die Wirkung auf die histamininduzierten Hautreaktionen nicht phasengleich mit den Plasmakonzentrationen.
Im EKG wurden keine relevanten Auswirkungen von Levocetirizin auf das QT-Intervall beobachtet.
5.2 Pharmakokinetische Eigenschaften
Die Pharmakokinetik von Levocetirizin ist linear sowie dosis- und zeitunabhängig, wobei die interindividuelle Variabilität gering ist. Das pharmakokinetische Profil ist identisch bei Gabe von Levocetirizin in Form des einen Enantiomers oder als Cetirizin (Razemat). Im Verlauf der Resorption und Elimination tritt keine chirale Inversion auf.
Resorption
Levocetirizin wird nach oraler Applikation schnell und umfassend resorbiert. Maximale Plasmakonzentrationen werden 0,9 Stunden nach Einnahme erreicht. Der Steady State wird nach 2 Tagen erreicht. Die maximalen Konzentrationen nach einer Einmalgabe von 5 mg bzw. nach einer mehrtägigen Gabe von 1-mal täglich 5 mg betragen 270 ng/ml bzw. 308 ng/ml. Das Ausmaß der Resorption ist dosisunabhängig und wird durch gleichzeitige Nahrungsaufnahme nicht verändert, die maximale Plasmakonzentration wird aber hierdurch reduziert und erst verzögert erreicht.
Verteilung
Zur Verteilung von Levocetirizin im menschlichen Gewebe liegen keine Daten vor, auch nicht zur Überwindung der Blut-Hirn-Schranke. Bei Ratten und Hunden wurden die höchsten Gewebespiegel in Leber und Nieren gefunden, die niedrigsten im zentralen Nervensystem.
Levocetirizin ist zu 90 % an Plasmaproteine gebunden. Die Verteilung von Levocetirizin ist eingeschränkt und das Verteilungsvolumen beträgt 0,4 l/kg.
Biotransformation
Beim Menschen werden weniger als 14 % der Levocetirizin-Dosis metabolisiert. Daher ist anzunehmen, dass Unterschiede aufgrund genetischer Polymorphismen oder gleichzeitiger Einnahme von Enzyminhibitoren vernachlässigbar sind. Zu den Metabolisierungsprozessen gehören aromatische Oxidation, N- und O-Dealkylierung und Taurin-Konjugation. Die Dealkylierung wird primär über CYP3A4 vermittelt, während zahlreiche und/oder nicht identifizierte CYP-Isoformen an der aromatischen Oxidation beteiligt sind. Levocetirizin hat in Konzentrationen, die weit über den nach einer oralen Dosis von 5 mg erreichten maximalen Konzentrationen liegen, keine Wirkung auf die Aktivitäten der CYP-Isoenzyme 1A2, 2C9, 2C19, 2D6, 2E1 und 3A4.
Da Levocetirizin nur zu einem geringen Teil metabolisiert wird und zu keiner Enzyminhibition führt, sind Wechselwirkungen mit anderen Substanzen unwahrscheinlich.
Elimination
Die Plasmahalbwertszeit bei Erwachsenen beträgt 7,9 ± 1,9 Stunden. Die mittlere apparente Gesamtkörperclearance beträgt 0,63 ml/min/kg. Der Hauptausscheidungsweg von Levocetirizin und seiner Metaboliten ist die renale Ausscheidung mit durchschnittlich 85,4 % der eingenommenen Dosis. Mit den Faeces werden nur 12,9 % der Dosis ausgeschieden. Levocetirizin wird sowohl durch glomeruläre Filtration als auch durch aktive tubuläre Sekretion ausgeschieden.
Eingeschränkte Nierenfunktion
Die apparente Körperclearance von Levocetirizin korreliert mit der Kreatinin-Clearance. Bei Patienten mit mäßig bis stark eingeschränkter Nierenfunktion sollten daher die Dosierungsintervalle von Levocetirizin entsprechend der Kreatinin-Clearance angepasst werden. Bei Patienten mit anurischer terminaler Niereninsuffizienz ist die Gesamtkörperclearance verglichen mit Gesunden um etwa 80 % verringert.
5.3 Präklinische Daten zur Sicherheit
Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Genotoxizität, zum kanzerogenen Potential und zur Reproduktionstoxizität lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Tablettenkem Mikrokristalline Cellulose Lactose-Monohydrat Hochdisperses Siliciumdioxid Magnesiumstearat (Ph.Eur.) (E572)
Filmüberzug Hypromellose (E464)
Titandioxid (E171)
Macrogol 400
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
OPA/Alu/PV C/Alu-Blisterpackungen
20 Filmtabletten 50 Filmtabletten 100 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
ratiopharm GmbH Graf-Arco-Str. 3 89079 Ulm
8. ZULASSUNGSNUMMER(N)
71228.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER
ZULASSUNG
Datum der Erteilung der Zulassung: 22. Juni 2010
10. STAND DER INFORMATION
Juli 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Zusätzliche Angaben der Firma ratiopharm GmbH zur Bioverfügbarkeit von Levocetirizin-ratiopharm® 5 mg
Für Levocetirizin-ratiopharm® 5 mg wurde im Jahr 2007 eine Bioäquivalenzstudie an 20 Probanden durchgeführt.
Ergebnisse
Pharmakokinetische Parameter von Levocetirizin nach Einmalgabe von 1 Tablette
Levocetirizin-ratiopharm® 5 mg bzw. Xusal®:
|
Levocetirizin-ratiopharm® 5 mg (MW ± C.V.) |
Xusal® (MW |
± |
C.V.) | |||
|
C max |
[ng/ml] |
228,97 |
± 19,4 % |
217,79 |
± |
16,7 % |
|
AUC0-t |
[ng x h/ml] |
1879,58 |
± 16,4 % |
1878,77 |
± |
15,6 % |
|
AUC0-» |
[ng x h/ml] |
1975,02 |
± 17,2 % |
1968,41 |
± |
15,7 % |
Cmax maximale Plasmakonzentration
AUC0-t Fläche unter der Konzentrations-Zeit-Kurve
AUC0-<X) Fläche unter der Konzentrations-Zeit-Kurve
MW Mittelwert
C.V. Variationskoeffizient
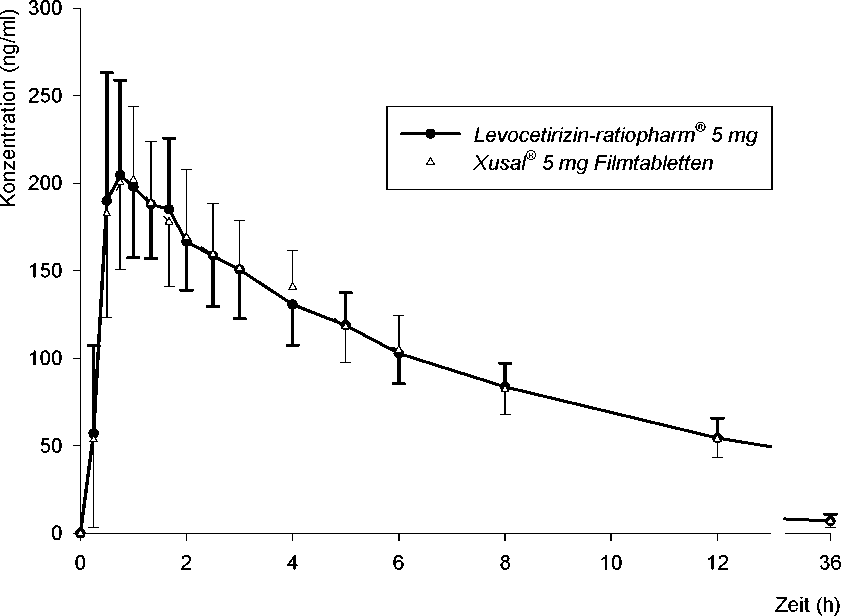
Abb.: Mittelwerte und Standardabweichungen der Plasmakonzentration von Levocetirizin nach Einmalgabe von 1 Tablette Levocetirizin-ratiopharm® 5 mg bzw. Xusal®.
Die mittlere relative Bioverfügbarkeit von Levocetirizin-ratiopharm® 5 mg im Vergleich zum Referenzpräparat beträgt 100 % (berechnet aus den arithmetischen Mittelwerten s. o.).
Die statistische Bewertung der pharmakokinetischen Zielgrößen Cmax, AUC0-t und AUC0-<X)dieser Studie beweist Bioäquivalenz zum Referenzpräparat.
11