Levopar 62,5Mg
Fachinformation (Zusammenfassung der Merkmale der Arzneimittel)
1. BEZEICHNUNG DER ARZNEIMITTEL
Levopar® 62,5 mg, Hartkapseln Levopar® 125 mg, Hartkapseln Levopar® 250 mg, Hartkapseln
Wirkstoffe: Levodopa und Benserazid
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Levopar 62,5 mg
1 Hartkapsel enthält 50 mg Levodopa und 14,25 mg Benserazidhydrochlorid (entsprechend
12,5 mg Benserazid).
Levopar 125 mg
1 Hartkapsel enthält 100 mg Levodopa und 28,5 mg Benserazidhydrochlorid (entsprechend 25 mg Benserazid).
Levopar 250 mg
1 Hartkapsel enthält 200 mg Levodopa und 57 mg Benserazidhydrochlorid (entsprechend 50 mg Benserazid).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Hartkapsel
Levopar 62,5 mg
Levopar 62,5 mg sind Hartkapseln, mit blauem Kapseloberteil und grauem Kapselunterteil, gefüllt mit cremefarbenem Pulver.
Levopar 125 mg
Levopar 125 mg sind Hartkapseln, mit blauem Kapseloberteil und rosafarbenem Kapselunterteil, gefüllt mit cremefarbenem Pulver.
Levopar 250 mg
Levopar 250 mg sind Hartkapseln, mit blauem Kapseloberteil und -unterteil, gefüllt mit cremefarbenem Pulver.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
- Parkinson-Krankheit (Schüttellähmung, eine Erkrankung mit grobschlägigem Zittern, Bewegungsverlangsamung und Starre der Muskeln)
- Symptomatische Parkinson-Syndrome (Krankheitserscheinungen, die der Parkinsonschen Krankheit entsprechen, aber infolge von Vergiftungen, Hirnentzündungen und ateriosklerotischen Hirnveränderungen auftreten). Ausgenommen hiervon ist das medikamentös induzierte Parkinson-Syndrom (Parkinson-ähnliche Krankheitserscheinungen, die durch bestimmte Arzneimittel ausgelöst werden).
4.2 Dosierung und Art der Anwendung
Die Dosierung richtet sich nach der Schwere der extrapyramidalen Symptomatik und der Verträglichkeit im Einzelfall. Hohe Einzeldosen sollten vermieden werden. Die Behandlung wird mit langsam ansteigender Dosierung durchgeführt.
Die Behandlung muss langsam einschleichend erfolgen, um das Ausmaß der Nebenwirkungen gering zu halten und einen möglichen Behandlungserfolg nicht zu gefährden.
Dosierung
Bei bisher unbehandelten Kranken wird mit einer Tagesdosis von 100-200 mg Levodopa in Kombination mit 28,5-57 mg Benserazidhydrochlorid begonnen.
Eine Dosissteigerung kann um 50-100 mg Levodopa in Kombination mit 14,25-28,5 mg Benserazidhydrochlorid jeden 3.-7. Tag vorgenommen werden. Es empfiehlt sich, in diesen Fällen höher dosierte Formen von Levodopa/Benserazid einzusetzen.
Tagesdosen von 800 mg Levodopa und 228 mg Benserazidhydrochlorid sollen in der Regel nicht überschritten werden.
Anfangs wird die Tagesdosis auf 1-4 Einzelgaben verteilt. Später soll die Tagesdosis in wenigstens 4 Einzeldosen genommen werden.
Bei Auftreten von Nebenwirkungen (siehe Abschnitt 4.8wird die Dosissteigerung zunächst unterbrochen oder die Dosis vorübergehend gesenkt und die weitere Erhöhung langsamer vorgenommen. Bei gastrointestinalen Beschwerden können Antiemetika, wie z. B. Domperidon, verabreicht werden.
Bei der Umstellung von einem reinen Levodopa-Präparat ist zu berücksichtigen, dass zur Erreichung vergleichbarer klinischer Effekte mit der Kombination Levodopa und Benserazid nur etwa 20 % der bisherigen Levodopa-Dosis benötigt werden. Ein medikationsfreies Intervall von 12 Stunden ist einzuhalten.
Spezielle Dosierungsanweisungen
Bei älteren Patienten muss die Behandlung langsam und einschleichend erfolgen.
Parkinson-Patienten, die bereits mit einem anderen Antiparkinson-Präparat behandelt werden, können zusätzlich Levodopa/Benserazid einnehmen. Sobald jedoch der Wirkungseintritt von Levodopa/Benserazid ersichtlich ist, sollte die Dosierung der anderen Medikamente überprüft und gegebenenfalls langsam reduziert und dann abgesetzt werden.
Patienten, die unter schweren Fluktuationsschwankungen während des Tages leiden („ON-OFF"-Phänomene), sollten öfters geringere Einzelgaben erhalten.
Art der Anwendung
Die Hartkapseln werden unzerkaut mit Flüssigkeit eingenommen.
Levopar sollte mindestens 30 Minuten vor oder 1 Stunde nach einer Mahlzeit eingenommen werden. Unerwünschte gastrointestinale Wirkungen, die hauptsächlich in einem frühen Stadium der Behandlung auftreten, können durch Einnahme von Levodopa/Benserazid mit etwas Nahrung oder Flüssigkeit oder durch langsame Dosissteigerung weitgehend beherrscht werden.
Levodopa/Benserazid wird in der Regel über einen längeren Zeitraum eingenommen (Substitutionstherapie). Die Anwendung ist bei guter Verträglichkeit nicht begrenzt.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen die Wirkstoffe oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Patienten unter 25 Jahren
• schwere endokrine Funktionsstörungen, wie z. B. Schilddrüsenüberfunktion, Cushing Syndrom und Phäochromozytom
• schwere Stoffwechsel-, Leber-, Nieren- und Knochenmarkserkrankungen
• schwere Herzerkrankungen, wie z. B. schwere Tachykardien, schwere Herzrhythmusstörungen und Herzversagen
• endogene und exogene PsychosenBehandlung mit Reserpin, nichtselektiven MAOHemmern oder einer Kombination von MAO-A- und MAO-B-Hemmern (siehe Abschnitt 4.5)
• Engwinkelglaukom.
Levodopa/Benserazid darf von Schwangeren oder Frauen im gebärfähigen Alter ohne gesicherten Empfängnisschutz nicht eingenommen werden (siehe Abschnitt 4.6). Wenn es bei einer Frau, die mit Levodopa/Benserazid behandelt wird, zu einer Schwangerschaft kommt, muss das Arzneimittel nach Anweisung des verschreibenden Arztes abgesetzt werden.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei empfindlichen Personen können Überempfindlichkeitsreaktionen auftreten.
Veränderungen des Blutbildes(hämolytische Anämie, Leukopenie und Thrombozytopenie) wurden berichtet (siehe Abschnitt 4.8Einzelfälle von Agranulozytose und Panzytopenie wurden von Patienten mit Levodopa/Benserazid-Behandlung berichtet; ein Zusammenhang mit der Levodopa/Benserazid Behandlung konnte weder belegt noch vollständig ausgeschlossen werden. Deshalb sollte das Blutbild der Patienten in der Einstellungsphase häufig und während der Dauer der Behandlung regelmäßig kontrolliert werden.
Bei Patienten mit Herzinfarktanamnese, bestehenden Herzrhythmusstörungen, koronaren Durchblutungsstörungen oder Herzversagen ist Vorsicht geboten (siehe Abschnitt 4.3). Kreislauf- und EKG-Kontrollen sollen deshalb in der Einstellungsphase häufig und während der Dauer der Behandlung regelmäßig vorgenommen werden.
Patienten mit Magen-Darm-Ulzera in der Vorgeschichte sowie Osteomalazie sollten ebenfalls ärztlich besonders beobachtet werden.
Bei Patienten mit Weitwinkelglaukom sind regelmäßige Kontrollen des intraokulären Druckes angezeigt, da Levodopa theoretisch das Potential besitzt, den intraokulären Druck zu erhöhen.
Bei Patienten mit Risikofaktoren (z. B. ältere Patienten, gleichzeitige Einnahme von Blutdrucksenkern oder anderen Medikamenten mit orthostatischem Potenzial) können gelegentlich hypotone orthostatische Kreislaufregulationsstörungen auftreten (siehe Abschnitt 4.8). Diese Patienten sollten, ebenso wie Patienten mit hypotonen orthostatischen Kreislaufregulationsstörungen, besonders zu Beginn der Behandlung oder bei Dosissteigerungen sorgfältig überwacht werden. Hypotone Kreislaufstörungen können aber in der Regel durch Dosisreduktion von Levodopa/Benserazid beherrscht werden.
Gastrointestinale Nebenwirkungen wie Übelkeit, Erbrechen und Diarrhö (siehe Abschnitt 4.8), die vor allem bei Behandlungsbeginn auftreten, können weitgehend durch Einnahme von Levodopa/Benserazid mit etwas Nahrung oder Flüssigkeit oder durch langsamere Dosissteigerung beherrscht werden.
Unter der Behandlung mit Levodopa/Benserazid können Depressionen auftreten (siehe Abschnitt 4.8). Diese können jedoch bei Patienten mit Parkinson-Krankheit auch Teil des klinischen Krankheitsbildes sein. Alle Patienten sollten deshalb sorgfältig auf psychische Veränderungen und Depressionen mit und ohne Suizidtendenzen überwacht werden.
Bei exzessiver Verabreichung von Levodopa/Benserazid entgegen dem medizinischen Rat und weit über den zur Behandlung der motorischen Störungen erforderlichen Dosen kann ein Syndrom einer Dopamin-Fehlregulation ausgelöst werden. Eine kleine Untergruppe von Parkinson-Patienten leidet dann unter kognitiven und Verhaltensstörungen, die direkt der Einnahme zunehmend hoher Dosen des Arzneimittels zugeordnet werden können.
Eine Behandlung mit Levodopa/Benserazid darf nicht plötzlich beendet werden. Nach langjähriger Behandlung mit Präparaten, die Levodopa enthalten, kann ein plötzliches Absetzen zu einem malignen Levodopa-Entzugssyndrom mit Hyperpyrexie, Muskelrigidität, gegebenenfalls psychischen Auffälligkeiten und einem Anstieg der Serumkreatin-Phosphokinase führen. In schweren Fällen kann es auch zu Myoglobinurie, Rhabdomyolyse und akutem Nierenversagen oder einer akinetischen Krise kommen. Diese Zustände sind lebensbedrohlich. Falls diese Symptome auftreten, muss der Patient überwacht und erforderlichenfalls stationär aufgenommen werden. Es muss umgehend eine geeignete symptomatische Behandlung eingeleitet werden, einschließlich einer möglichen Wiederaufnahme der Therapie mit Levodopa/Benserazid nach angemessener Prüfung. Aus therapeutischen Gründen indizierte Levodopa-Pausen dürfen daher nur in der Klinik durchgeführt werden.
Dyskinesien (z. B. choreiform oder athetotisch; siehe Abschnitt 4.8im fortgeschrittenen Stadium der Behandlung können in der Regel durch Dosisreduktion beherrscht werden.
Fluktuationen im therapeutischen Ansprechen („Freezing"-, „End-of-Dose"- und „ON-OFF"-Phänomene; siehe Abschnitt 4.8) können nach Langzeitbehandlung auftreten und werden gewöhnlich durch Dosisanpassung und durch häufigere Gabe kleiner Dosen vermindert oder tolerabel. Ein Versuch, die Dosis von Levodopa zur Verbesserung der therapeutischen Wirkung wieder anzuheben, kann dann stufenweise unternommen werden (siehe Abschnitt 4.2).
Im Falle einer Allgemeinanästhesie soll die Behandlung mit Levodopa/Benserazid so weit wie möglich bis zum Zeitpunkt der Operation fortgesetzt werden, außer wenn Halothan gegeben wird. Falls eine Allgemeinanästhesie mit Halothan benötigt wird, muss Levodopa/Benserazid 12-48 Stunden vor der Operation abgesetzt werden, da es bei der gleichzeitigen Verabreichung von Levodopa/Benserazid und Halothan zu Blutdruckschwankungen und/oder zu Arrhythmien kommen kann. Nach der Operation kann die Therapie mit Levodopa/Benserazid wieder, mit langsam ansteigender Dosierung bis auf die Ausgangswerte vor der Operation, aufgenommen werden.
Levodopa wurde mit Somnolenz und plötzlich auftretenden Schlafattacken in Verbindung gebracht. In sehr seltenen Fällen wurde über plötzlich auftretende Schlafattacken während der Aktivitäten des täglichen Lebens berichtet, welche in manchen Fällen unbewusst oder völlig unerwartet auftraten. Patienten müssen darüber informiert und darauf hingewiesen werden, während einer Behandlung mit Levodopa im Straßenverkehr oder beim Bedienen von Maschinen vorsichtig zu sein. Patienten, bei denen Somnolenz und/oder plötzlich auftretende Schlafattacken aufgetreten sind, dürfen kein Fahrzeug führen und keine Maschinen bedienen. Darüber hinaus sollte eine Dosisreduktion oder eine Beendigung der Therapie erwogen werden (siehe Abschnitt 4.7).
Impulskontrollstörungen
Die Patienten sollten regelmäßig hinsichtlich der Entwicklung von Impulskontrollstörungen überwacht werden. Patienten und Betreuer sollten darauf aufmerksam gemacht werden, dass bei Patienten, die mit Dopaminagonisten und/oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich Levopar, behandelt werden, Verhaltensauffälligkeiten im Sinne von Impulskontrollstörungen auftreten können, einschließlich pathologischer Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang. Die Überprüfung der Behandlung wird empfohlen, wenn solche Symptome auftreten.
Laboruntersuchungen
Während der Behandlung mit Levodopa/Benserazid sollten regelmäßige Kontrollen des Blutbildes, sowie der Leber-, Nieren-, und Herzfunktion durchgeführt werden. Bei Diabetikern sollen die Blutzuckerwerte öfter überprüft und die Dosierung der antidiabetischen Therapie an die Blutzuckerwerte angepasst werden.
Malignes Melanom
Epidemiologische Untersuchungen haben gezeigt, dass Parkinson-Patienten im Vergleich zur Allgemeinbevölkerung ein um das ca. 2- bis 6-fach erhöhtes Risiko haben, Melanome zu entwickeln. Es ist nicht bekannt, ob das erhöhte Risiko der Krankheit selbst oder anderen Faktoren, wie z. B. der Behandlung mit Levodopa, zuzuschreiben ist. Deshalb sollten Patienten und medizinisches Fachpersonal bei einer Levodopa/Benserazid Behandlung die Haut regelmäßig auf verdächtige Veränderungen hin untersuchen, die auf ein Melanom hinweisen können. Die regelmäßigen Hautuntersuchungen sollten durch geeignete Fachkräfte (z. B. Dermatologen) erfolgen.
Die Ausscheidung der wirksamen Bestandteile von Levopar in Urin, Speichel und Schweiß kann Flecken in der Kleidung verursachen, die nach dem Antrocknen nicht mehr entfernt werden können, weshalb die Flecken in frischem Zustand ausgewaschen werden sollten.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Levopar nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen Pharmakokinetische Wechselwirkungen
Bei gleichzeitiger Gabe von Levodopa/Benserazid mit dem anticholinerg wirksamen Trihexyphenidyl wird die Geschwindigkeit, jedoch nicht das Ausmaß der LevodopaResorption reduziert.
Eisensulfat erniedrigt die maximale Plasmakonzentration und die AUC von Levodopa um 3050 %. Die pharmakokinetischen Veränderungen, die während einer gleichzeitigen Behandlung mit Eisensulfat beobachtet wurden, scheinen bei einigen, aber nicht bei allen Patienten, klinisch signifikant zu sein.
Metoclopramid erhöht die Geschwindigkeit der Levodopa-Resorption.
Pharmakodynamische Wechselwirkungen
Arzneimittel mit Wirkung auf das extrapyramidalmotorische System
Die Wirkung von Levodopa/Benserazid wird eingeschränkt durch Opioide, reserpinhaltige
Antihypertensiva und Neuroleptika.
Antipsychotika
Die gleichzeitige Anwendung von Antipsychotika mit dopaminrezeptorblockierenden Eigenschaften, insbesondere D2-Rezeptorantagonisten, kann die Wirkung von Levodopa/Benserazid hemmen und sollte deshalb mit Vorsicht erfolgen. Die Patienten sollten hinsichtlich eines möglichen Verlustes der Wirkung und einer Verschlechterung der Parkinson-Symptomatik sorgfältig überwacht werden.
MAO-Hemmstoffe
Levopar darf nicht gleichzeitig mit einem irreversiblen, nicht selektiven Monoaminoxidase (MAO)-Hemmer verabreicht werden. Die Gabe eines reinen MAO-B-Hemmers (z. B. Selegilin, bis zu 10 mg täglich, oder Rasagilin) oder eines selektiven MAO-A-Hemmers (z. B. Moclobemid) ist nicht kontraindiziert. Selegilin kann unter Umständen die AntiparkinsonWirkung von Levodopa verstärken, ohne gefährliche Interaktionen auszulösen. Es wird empfohlen, die Levodopa Dosis entsprechend der individuellen Bedürfnisse des Patienten -sowohl im Bezug auf Wirksamkeit als auch auf Verträglichkeit - neu einzustellen.
Die gleichzeitige Gabe von MAO-A- und MAO-B-Hemmern entspricht in der Wirkung einer nicht selektiven MAO-Hemmung. Aus diesem Grund darf diese Kombination nicht gleichzeitig mit Levodopa/Benserazid verabreicht werden (siehe Abschnitt 4.3).
Bei gleichzeitiger Gabe eines nicht selektiven, irreversiblen MAO-Hemmers (z. B. Tranylcypromin) kann es - unter Umständen bis zu 2 Wochen nach Absetzen des MAOHemmstoffes - zu hypertensiven Krisen kommen. Zwischen dem Absetzen einer Therapie mit einem nicht selektiven MAO-Hemmer und dem Beginn einer Behandlung mit Levodopa/Benserazid muss deshalb ein behandlungsfreies Intervall von mindestens 2 Wochen liegen.
Sympathomimetika
Die gleichzeitige Einnahme von Levodopa/Benserazid und Sympathomimetika, wie Adrenalin, Noradrenalin, Isoproterenol oder Amphetamin, kann deren Wirkung verstärken und wird deshalb nicht empfohlen. Falls die gleichzeitige Einnahme von Levodopa/Benserazid und Sympathomimetika erforderlich ist, sollte das Herz-KreislaufSystem überwacht und die Dosis der Sympathomimetika reduziert werden.
Andere Antiparkinsonmittel
Es ist möglich, Levodopa/Benserazid mit allen bekannten Antiparkinsonmitteln (z. B. Dopaminagonisten, Amantadin, Anticholinergika) zu kombinieren, wobei jedoch sowohl die erwünschten als auch die unerwünschten Wirkungen der Therapie verstärkt werden können. Eine eventuell notwendige Dosisverminderung von Levodopa/Benserazid oder der anderen Substanzen ist zu beachten. Wenn eine adjuvante Therapie mit einem COMT-Hemmer begonnen wird, kann eine Reduzierung der Dosis von Levodopa/Benserazid notwendig werden. Bei Ergänzung einer Therapie um den Bestandteil Levodopa/Benserazid sollte die vorbestehende Behandlung mit Anticholinergika nicht abrupt beendet werden, da die Levodopa-Wirkung nicht sofort einsetzt.
Antihypertensiva
Symptomatische orthostatische Blutdruckabfälle wurden beobachtet, wenn Levodopa in Kombination mit einem Decarboxylasehemmer bei Patienten angewendet wurde, die bereits Antihypertensiva erhielten. Bei diesen Patienten muss Levodopa/Benserazid vorsichtig eingeführt werden. Da es zu einer verstärkten Wirkung von Antihypertensiva kommen kann, muss der Blutdruck regelmäßig kontrolliert werden und es müssen, soweit erforderlich, Dosisanpassungen vorgenommen werden.
Proteinreiche Mahlzeiten
Die gleichzeitige Einnahme einer proteinreichen Mahlzeit kann zu einer Wirkungsverminderung von Levodopa/Benserazid führen.
Veränderungen von labordiagnostischen Messungen
Es können verschiedene labordiagnostische Messungen gestört sein:
• Levodopa kann die labordiagnostischen Messergebnisse von Katecholaminen, Kreatinin, Harnsäure und Glucose beeinflussen
• falsch-positiver Ketonnachweis bei Verwendung von Teststreifen (durch Kochen der Urinprobe wird diese Reaktion nicht verändert)
• falsch-negativer Harnzuckernachweis bei Verwendung der Glucose-Oxidase-Methode
falsch-positiver Coombs-Test
Hinweis
Allgemeinanästhesie und Halothan
Falls eine Allgemeinanästhesie mit Halothan benötigt wird, muss Levodopa/Benserazid 1248 Stunden vor der Operation abgesetzt werden, da es zu Blutdruckschwankungen und/oder zu Arrhythmien kommen kann.
Zur Allgemeinanästhesie mit anderen Narkotika siehe Abschnitt 4.4.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Levodopa/Benserazid darf in der Schwangerschaft nicht angewendet werden (siehe Abschnitt 4.3), da keine Erfahrungen beim Menschen vorliegen und in Tierversuchen für beide Wirkstoffe Reproduktionstoxizität beschrieben wurde (siehe Abschnitt 5.3 Frauen im gebärfähigen Alter müssen während der Behandlung mit Levodopa/Benserazid geeignete Maßnahmen zur Empfängnisverhütung ergreifen. Bei Eintreten einer Schwangerschaft muss Levodopa/Benserazid unter schrittweiser Dosisreduktion abgesetzt werden.
Stillzeit
Levodopa hemmt die Prolaktinausschüttung und somit die Laktation. Da nicht bekannt ist, ob Benserazid in die Muttermilch übergeht, und da bei heranwachsenden Tieren nach Gabe von Benserazid degenerative Skelettveränderungen beobachtet wurden, dürfen Frauen während der Behandlung mit Levodopa/Benserazid nicht stillen. Ist eine Behandlung mit Levodopa/Benserazid während der Stillzeit erforderlich, muss abgestillt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Wenn es bei Patienten unter der Einnahme von Levodopa/Benserazid zu Somnolenz und/oder plötzlich auftretenden Schlafattacken kommt, müssen sie darüber informiert werden, dass sie kein Fahrzeug führen oder Tätigkeiten ausüben dürfen, bei denen eine Beeinträchtigung der Aufmerksamkeit das Risiko schwerwiegender Verletzungen oder des Todes für sich selbst oder andere nach sich ziehen kann, bis Somnolenz und Schlafattacken nicht mehr auftreten (siehe Abschnitt 4.4).
4.8 Nebenwirkungen
Bei der Einnahme von Levodopa/Benserazid kann es zu den nachstehenden Nebenwirkungen kommen, deren Häufigkeit nicht bekannt ist, d. h. auf Grundlage der verfügbaren Daten nicht abgeschätzt werden kann.
Der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
|
Infektionen und parasitäre Erkrankungen | |
|
Nicht bekannt |
fieberhafte Infektionen, Bronchitis, Schnupfen |
|
Erkrankungen des Blutes und des Lymphsystems | |
|
Nicht bekannt |
hämolytische Anämie, Thrombozytopenie, Leukopenie |
|
Stoffwechsel- und Ernährungsstörungen | |
|
Nicht bekannt |
Anorexie |
|
Psychiatrische Erkrankungen | |
|
Nicht bekannt |
Dopamin-Fehlregulationssyndrom, Verwirrtheit, Depressionen, innere Unruhe1, Ängstlichkeit1, Schlafstörungen1, Halluzinationen1, Wahnvorstellungen1, zeitliche Desorientierung1, pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken, Esszwang |
|
Erkrankungen des Nervensystems | |
|
Nicht bekannt |
Geschmacksverlust, Änderungen des Geschmacksempfindens, Dyskinesie (choreiform oder athetotisch), Fluktuationen im therapeutischen Ansprechen („Freezing"-, „End-of-Dose"- und „ON-OFF"-Phänomene) , Müdigkeit, übermäßige Tagesmüdigkeit, plötzlich auftretende Schlafattacken, Schwindel, Kopfschmerzen, Mundtrockenheit |
|
Herzerkrankungen | |
|
Nicht bekannt |
Arrhythmie |
|
Gefäßerkrankungen | |
|
Nicht bekannt |
hypotone orthostatische Kreislaufregulationsstörungen |
|
Erkrankungen des Gastrointestinaltrakts | |
|
Nicht bekannt |
Übelkeit, Erbrechen, Diarrhö, Verfärbungen von Speichel, Zunge, Zähnen und Mundschleimhaut |
|
Leber- und Gallenerkrankungen | |
|
Nicht bekannt |
Erhöhung der Lebertransaminasen, der alkalischen Phosphataseund der Gamma-Glutamyltransferase |
Erkrankungen der Haut und des Unterhautzellgewebes
|
Nicht bekannt |
allergische Hautreaktionen (z. B. Pruritus, Rash) |
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen
|
Nicht bekannt |
Restless Legs Syndrom |
|
Erkrankungen der Nieren und Harnwege: | |
|
Nicht bekannt |
Erhöhung der Harnstoff-Stickstoff-Werte (BUN), Chromaturie |
Pathologische Spielsucht, Libidosteigerung, Hypersexualität, zwanghaftes Geldausgeben oder Einkaufen, Essattacken und Esszwang können bei Patienten auftreten, die mit Dopaminagonisten oder anderen dopaminergen Substanzen, die Levodopa enthalten, einschließlich Levopar, behandelt werden (siehe Abschnitt 4.4).
Erkrankungen des Nervensystems
Im fortgeschrittenen Stadium der Behandlung mit Levodopa/Benserazid können Dyskinesien auftreten (z. B. choreiform oder athetotisch) (siehe Abschnitt 4.4). Diese können normalerweise durch Dosisreduktion verhindert oder erträglich gemacht werden.
Nach Langzeitbehandlung können auch Fluktuationen im therapeutischen Ansprechen auftreten („Freezing“-, „End-of-Dose“- und „ON-OFF“-Phänomene) (siehe Abschnitt 4.4). Auch diese Ereignisse können normalerweise durch Dosisanpassung oder häufigere Gabe kleinerer Dosen verhindert oder erträglich gemacht werden.
Ein Versuch, die Dosis von Levodopa zur Verbesserung der therapeutischen Wirkung wieder anzuheben, kann dann stufenweise unternommen werden.
Levodopa/Benserazid wurde mit Müdigkeit, sehr selten mit übermäßiger Tagesmüdigkeit und plötzlich auftretenden Schlafattacken in Verbindung gebracht (siehe Abschnitt 4.4).
Gefäßerkrankungen
Orthostatische Ereignisse verbessern sich üblicherweise nach Dosisreduktion.
Erkrankungen des Gastrointestinaltrakts
Unerwünschte gastrointestinale Wirkungen, die meist zu Behandlungsbeginn auftreten, können in der Regel durch die Einnahme von Levodopa/Benserazid zusammen mit etwas Nahrung, Flüssigkeit oder durch langsame Dosissteigerung kontrolliert werden.
Untersuchungen
Harnverfärbungen (meist eine leichte Rotfärbung, die sich bei längerem Stehenlassen dunkel färbt).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte
Abt. Pharmakovigilanz
Kurt-Georg-Kiesinger Allee 3
D-53175 Bonn
Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Die Symptome und Anzeichen einer Überdosierung entsprechen qualitativ den Nebenwirkungen von Levodopa/Benserazid in therapeutischer Dosierung, sie können jedoch stärker ausgeprägt sein. Eine Überdosierung kann somit zu kardiovaskulären Nebenwirkungen (z. B. kardialen Arrhythmien), psychiatrischen Störungen (z. B. Verwirrtheit und Schlaflosigkeit), gastrointestinalen Nebenwirkungen (z. B. Übelkeit und Erbrechen) und unwillkürlichen Bewegungen führen (siehe Abschnitt 4.8
Behandlung einer Überdosierung
Die Vitalparameter des Patienten sind zu beobachten und unterstützende Maßnahmen entsprechend dem klinischen Bild des Patienten sind zu ergreifen. Insbesondere können kardiovaskuläre Nebenwirkungen die Anwendung von Antiarrhythmika und zentralnervöse Nebenwirkungen die Gabe von Atemstimulanzien oder Neuroleptika erforderlich machen.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: dopaminerge Mittel; Levodopa in Kombination mit
Benserazid
ATC-Code: N04B A11
Wirkmechanismus
Levodopa ist eine Aminosäure, die in Kombination mit dem peripheren Decarboxylasehemmer Benserazid der Substitution eines zentralnervösen Dopaminmangels dient.
Klinische Wirksamkeit und Sicherheit
Da wenigstens 95 % des oral verabreichten Levodopa bereits in extrazerebralen Organen (Darm, Leber, Niere, Herz, Magen) decarboxyliert werden, gelangen bei einer LevodopaMonotherapie nur geringe Mengen in das Zentralnervensystem. Durch das extrazerebral gebildete Dopamin und die aus ihm entstehenden adrenergen Substanzen sind zahlreiche Nebenwirkungen gastrointestinaler und kardiovaskulärer Art der Monotherapie mit Levodopa bedingt.
Der Decarboxylasehemmer Benserazid tritt in der vorliegenden Dosierung nicht in nennenswertem Umfang in das Gehirn über (weniger als 6 % der Plasmakonzentration). Durch die gleichzeitige Gabe von Benserazid wird die Decarboxylierung von Levodopa in der Peripherie, vor allem in der Darmschleimhaut, nahezu vollständig verhindert. Dadurch kann die Dosis Levodopa, die zur Erreichung vergleichbarer klinischer Effekte notwendig ist, auf ca. 20 % der bei der Monotherapie notwendigen Dosis gesenkt werden. Die gastrointestinalen und kardiovaskulären Nebenwirkungen von peripher gebildetem Dopamin werden dadurch weitgehend vermieden.
Der Benserazid-Anteil in der Kombination führt infolge der Decarboxylasehemmung zu einer Erhöhung der Prolaktinkonzentration.
5.2 Pharmakokinetische Eigenschaften Resorption
Levodopa wird hauptsächlich im oberen Abschnitt des Dünndarms resorbiert, unabhängig von der Region. Die maximale Plasmakonzentration von Levodopa wird etwa 1 Stunde nach der Einnahme einer Standardform von Levodopa/Benserazid erreicht (tmax). Die maximale Plasmakonzentration von Levodopa und das Ausmaß der Resorption von Levodopa (AUC) steigt dosisproportional im Bereich von 50-200 mg Levodopa.
Nahrungsaufnahme reduziert die Geschwindigkeit und das Ausmaß der Resorption von Levodopa. Die maximale Plasmakonzentration von Levodopa ist um 30 % niedriger und wird erst nach der doppelten oder 3-fachen Zeit erreicht, wenn Levodopa/Benserazid zusammen mit einer Standardmahlzeit eingenommen wird. Das Ausmaß der Resorption des Wirkstoffs wird bei gleichzeitiger Nahrungsaufnahme um 15 % reduziert. Ferner beeinflussen Änderungen in der Entleerungszeit des Magens die Resorption von Levodopa.
Verteilung
Levodopa überwindet die Blut-Hirnschranke durch einen sättigbaren Transportmechanismus. Es wird nicht an Plasmaproteine gebunden. Sein
Verteilungsvolumen beträgt 57 Liter. Die AUC von Levodopa in der Zerebrospinalflüssigkeit beträgt 12 % von derjenigen im Plasma.
Im Gegensatz zu Levodopa überwindet Benserazid in therapeutischen Dosen nicht die BlutHirnschranke. Die Benserazid-Konzentrationen sind in den Nieren, in der Lunge, im Dünndarm und in der Leber am höchsten. Benserazid passiert die Plazenta.
BiotransformationLevodopa wird hauptsächlich durch Decarboxylierung, O-Methylierung, Transaminierung und Oxidation metabolisiert. Die Decarboxylierung von Levodopa zu Dopamin durch eine Decarboxylase für aromatische Aminosäuren ist der Hauptweg der Levodopa-Metabolisierung. Die Hauptmetaboliten sind Homovanillinsäure und Dihydroxyphenylessigsäure. Die Methoxylierung von Levodopa zu 3-O-Methyldopa durch die Catechol-O-Methyltransferase (COMT) stellt einen 2. Metabolisierungsweg dar. Die Eliminationshalbwertszeit von 3-O-Methyldopa beträgt 15 Stunden. Daher akkumuliert dieser Metabolit bei Patienten, die therapeutische Dosen von Levodopa/Benserazid erhalten.
Gleichzeitige Verabreichung von Levodopa und Benserazid verringert die periphere Decarboxylierung. Dies zeigt sich in erhöhten Plasmaspiegeln von Aminosäuren (Levodopa, 3-O-Methyldopa) und niedrigeren Plasmaspiegeln von Katecholaminen (Dopamin, Noradrenalin) und Phenylcarbonsäuren (Homovanillinsäure, Dihydroxyphenylessigsäure).
Benserazid wird in der Darmwand und in der Leber zu Trihydroxybenzylhydrazin hydroxyliert. Dieser Metabolit ist ein wirkungsvoller Inhibitor der aromatischen Aminosäure-Decarboxylase.
Elimination
Bei peripherer Hemmung der Levodopa-Decarboxylase beträgt die Eliminationshalbwertszeit von Levodopa etwa 1,5 Stunden. Bei älteren Parkinson-Patienten (Alter 65-78 Jahre) ist die Eliminationshalbwertszeit um ca. 25 % verlängert. Die Clearance von Levodopa beträgt 430 ml/min.
Benserazid wird fast vollständig in Form von Metaboliten eliminiert. Die Metaboliten werden hauptsächlich über die Niere (64 %) und zu einem geringeren Anteil über die Fäzes (24 %) ausgeschieden.
5.3 Präklinische Daten zur Sicherheit Chronische Toxizität
In Studien zur chronischen Toxizität an Ratten verursachte die orale Gabe von Levodopa plus Benserazid dosisabhängig ausgeprägte Skelettveränderungen, die ihren Ausgangspunkt von den noch nicht geschlossenen Epiphysenfugen nahmen. Knochenveränderungen traten nur im wachsenden Organismus auf und wurden durch Benserazid verursacht. Bei Hunden wurden dosisabhängig ein Anstieg der Leberenzyme sowie eine Leberverfettung, eine Verlängerung der Thromboplastinzeit sowie eine Verminderung des blutbildenden Gewebes im Knochenmark nach hohen Dosen beobachtet.
Genotoxizität
Im Ames-Test konnte für Levodopa und Benserazid keine mutagene Wirkung beobachtet werden. Weitere Befunde liegen nicht vor.
Karzinogenes Potential
Studien zur Karzinogenität liegen nicht vor.
Reproduktionstoxizität
Mit Levodopa/Benserazid wurden keine Fertilitätsstudien durchgeführt. Studien zur Reproduktionstoxizität von Levodopa/Benserazid zeigten bei Mäusen (400 mg/kg), Ratten (600 mg/kg) und Kaninchen (120 mg/kg; 150 mg/kg) keine teratogene Wirkung oder Beeinflussung der Skelettentwicklung.
Dosierungen im maternaltoxischen Bereich verursachten bei Kaninchen eine Erhöhung der Embryoletalität und bei Ratten eine Gewichtsabnahme beim Fötus.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Gelatine
Lactose-Monohydrat Magnesiumstearat (Ph.Eur.) hochdisperses Siliciumdioxid gereinigtes Wasser
Farbstoffe Indigocarmin (E 132), Titandioxid (E 171)
Zusätzlich für Levopar 62,5 mg Farbstoff Eisen(N,IN)-oxid (E 172)
Zusätzlich für Levopar 125 mg Farbstoff Eisen(IN)-oxid (E 172)
Hinweis für Diabetiker Levopar 62,5 mg
1 Hartkapsel enthält weniger als 0,01 BE.
Levopar 125 mg 1 Hartkapsel enthält 0,01 BE.
Levopar 250 mg 1 Hartkapsel enthält 0,03 BE.
6.2 Inkompatibilitäten
Nicht zutreffend
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
Gut verschlossen aufbewahren!
6.5 Art und Inhalt des Behältnisses
Packungen mit
20, 50, 100 und 200 (2x100) Hartkapseln
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen
7. INHABER DER ZULASSUNGEN
Hexal AG Industriestraße 25
83607 Holzkirchen Telefon: (08024) 908-0 Telefax: (08024) 908-1290 E-Mail: medwiss@hexal.com
8. ZULASSUNGSNUMMERN
Levopar 62,5 mg 26469.00.00
Levopar 125 mg
26469.01.00
Levopar 250 mg
26469.02.00
9. DATUM DER ERTEILUNG DER ZULASSUNGEN / VERLÄNGERUNG DER ZULASSUNGEN
22.10.1997 / 17.12.2003
10. STAND DER INFORMATION
Juni 2014
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
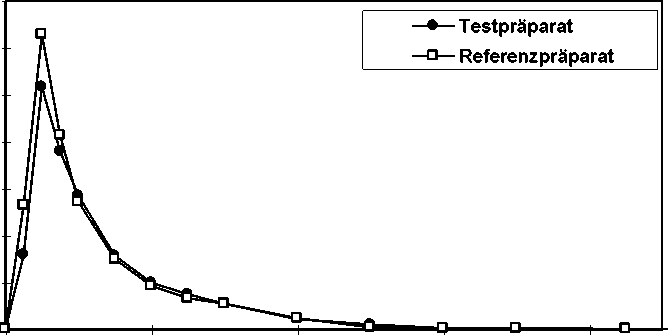
Eine im Jahr 1995 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 28 gesunden männlichen Probanden (25-40 Jahre) ergab nach jeweils einmaliger Gabe von 1 Hartkapsel (Levodopa 50 mg/Benserazid 12,5 mg) im Vergleich zum Referenzpräparat folgende Werte für Levodopa:
Referenzpräparat 734,08 ± 321,13
0,63 ± 0,51 665,59 ± 195,78
T estpräparat
Cmax [ng/ml] 673,44 ± 342,77
maximale Plasmakonzentration
tmax [h] 0,81 ± 0,55
Zeitpunkt der maximalen Plasmakonzentration
AUC(0-<x,) [ng/ml*h] 626,60 ± 190,11
Fläche unter der Konzentrations-Zeit-Kurve
Angabe der Werte als Mittelwert und Streubreite (Standardabweichung)
Mittlere Plasmaspiegelverläufe von Levodopa im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
4 6 8
0
2
Zeit [h]
700
600
E
'S) 500 c
u
I 400 IS
£ 300 o
N
= 200 100 0
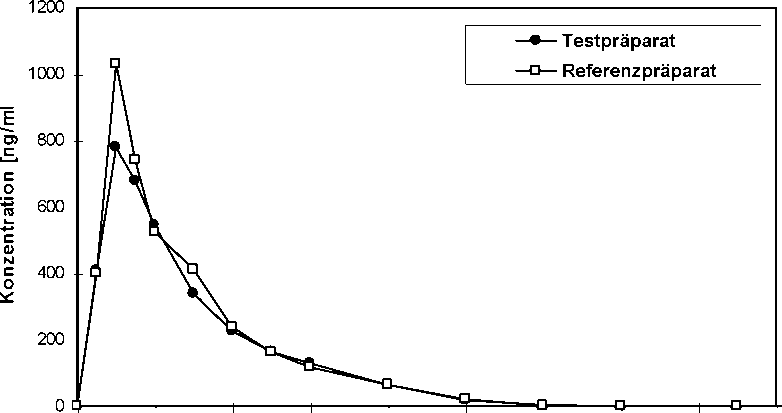
Eine im Jahr 1995 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 28 gesunden männlichen Probanden (24-45 Jahre) ergab nach jeweils einmaliger
|
Gabe von 1 Hartkapsel (Levodopa 100 mg/Benserazid 25 mg) im Vergleich zum Referenzpräparat folgende Werte für Levodopa: T estpräparat Referenzpräparat | ||
|
Cmax [ng/ml] maximale Plasmakonzentration |
1.110,05 ± 573,68 |
1.280,92 ± 638,87 |
|
tmax [h] Zeitpunkt der maximalen Plasmakonzentration |
0,74 ± 0,40 |
0,73 ± 0,45 |
|
AUC(0-») [ng/ml*h] Fläche unter der Konzentrations-Zeit-Kurve |
1.272,16 ± 254,47 |
1.377,48 ± 328,93 |
Angabe der Werte als Mittelwert und Streubreite (Standardabweichung)
Mittlere Plasmaspiegelverläufe im Vergleich zu einem Referenzpräparat in einem KonzentrationsZeit-Diagramm:
01 23456789
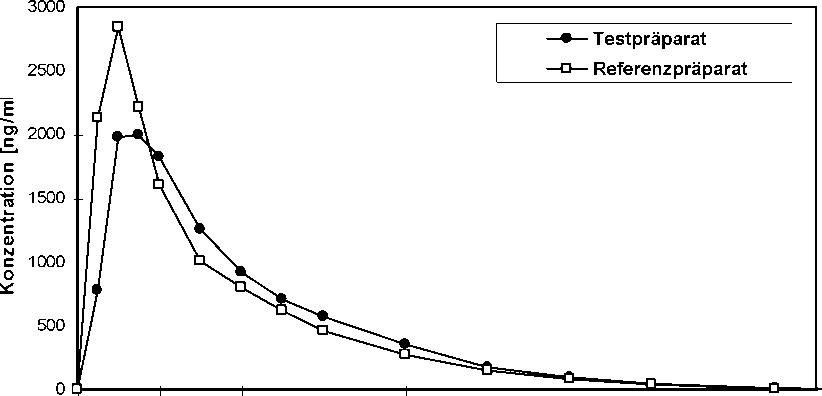
Eine im Jahr 1994 durchgeführte vergleichende Bioverfügbarkeitsuntersuchung (offen, cross-over, randomisiert) an 30 gesunden männlichen Probanden (24-44 Jahre) ergab nach jeweils einmaliger
|
Gabe von 1 Hartkapsel (Levodopa 200 mg/Benserazid 50 mg) im Vergleich zum Referenzpräparat folgende Werte für Levodopa: T estpräparat Referenzpräparat | ||
|
Cmax [ng/ml] maximale Plasmakonzentration |
2.975,36 ± 1.276,34 |
3.300,80 ± 1.762,87 |
|
tmax [h] Zeitpunkt der maximalen Plasmakonzentration |
1,08 ± 0,79 |
0,71 ± 0,44 |
|
AUC(0-») [ng/ml*h] Fläche unter der Konzentrations-Zeit-Kurve |
4.410,77 ± 1.132,55 |
4.513,79 ± 1.091,00 |
Angabe der Werte als Mittelwerte und Streubreite (Standardabweichung)
Mittlere Plasmaspiegelverläufe von Levodopa im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
01 23456789
Zeit [h]
Diese Nebenwirkungen können insbesondere bei älteren Patienten oder bei Patienten mit entsprechender Anamnese auftreten.
Impulskontrollstörungen