Licain 10 Mg/Ml Injektionslösung
FI -949-05/16
FACHINFORMATION
1. BEZEICHNUNG DER ARZNEIMITTEL
Licain® 10 mg/ml Injektionslösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Wirkstoff: Lidocainhydrochlorid 1 H2O
1 ml Injektionslösung enthält 10 mg Lidocainhydrochlorid 1 H2O. Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Injektionslösung
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Licain ist ein Arzneimittel zur örtlichen Betäubung (Lokalanästhetikum vom Säureamid-Typ). Anwendungsgebiete: Lokale und regionale Nervenblockade
Lidocainhydrochlorid wird bei Erwachsenen und Kindern angewendet. Besondere Vorsicht ist bei der Behandlung von Kindern unter 4 Jahren geboten.
4.2 Dosierung und Art der Anwendung
Licain wird im Allgemeinen durch einen Arzt angewendet.
Licain wird in Abhängigkeit vom jeweiligen Anästhesieverfahren intracutan, subcutan, zur Regionalanästhesie intravenös oder zur rückenmarksnahen Leitungsanästhesie peridural injiziert, in einem umschriebenen Bezirk in das Gewebe eingespritzt (Infiltration) oder in Abhängigkeit von den anatomischen Verhältnissen nach gezielter Punktion lokal appliziert.
Licain sollte nur von Personen mit entsprechenden Kenntnissen zur erfolgreichen Durchführung der jeweiligen Anästhesieverfahren angewendet werden.
Grundsätzlich gilt, dass bei kontinuierlicher Anwendung nur niedrig konzentrierte Lösungen von Lidocainhydrochlorid 1 H2O appliziert werden.
Die Injektionslösung ist nur zur einmaligen Entnahme vorgesehen. Die Anwendung muss unmittelbar nach Öffnung des Behältnisses erfolgen. Nicht verbrauchte Reste sind zu verwerfen.
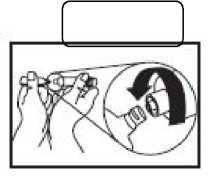
Spritze mjt Luer-Lock-Ansatz
Spritze ohne Luer-Lock-Ansatz.
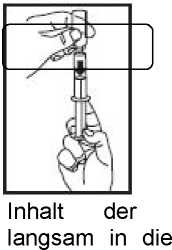
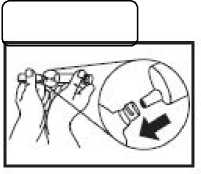
Handhabung der One-Point-Cut-(OPC-) Glasampullen:
Zunächst die Flüssigkeit aus dem Ampullenhals nach unten schütteln.
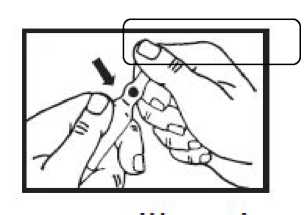
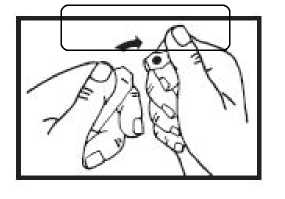
Die Sollbruchstelle befindet Den Ampullenhals von diesem
sich unterhalb der Markierung. Punkt wegbrechen.
Handhabung der Luer-Lock®-System Ampullen:
Ampulle Spritze aufziehen. Falls hierbei entlüftet werden muss, Ampulle unbedingt vorher abnehmen.
Wieviel und wie oft wird Licain angewendet?
Grundsätzlich gilt, dass nur die kleinste Dosis verabreicht werden darf, mit der die gewünschte ausreichende Anästhesie erreicht wird. Die Dosierung ist entsprechend den Besonderheiten des Einzelfalles individuell vorzunehmen.
Bei Applikation in Gewebe, aus denen eine schnelle Resorption von Substanzen erfolgt, sollte eine Einzeldosierung von 300 mg Lidocainhydrochlorid 1 H2O ohne gefäßverengenden Zusatz oder 500 mg Lidocainhydrochlorid 1 H2O mit gefäßverengendem Zusatz nicht überschritten werden. Bei Kindern und älteren Patienten muss eine Dosisanpassung vorgenommen werden.
Für die einzelnen Anwendungsarten gelten als Einzeldosen für Jugendliche über 15 Jahre und Erwachsene mit einer durchschnittlichen Körpergröße folgende Empfehlungen von verschieden konzentrierten Lidocainhydrochlorid 1 H2O-haltigen Injektionslösungen:
|
Oberflächenanästhesie (hier unabhängig von der Darreichungsform) |
bis zu 300 mg | |
|
Hautquaddeln pro Quaddel |
bis zu 20 mg |
5 - 10 mg/ml |
|
Infiltration |
bis zu 300 mg |
5 - 20 mg/ml |
|
Infiltrations- und Leitungsanästhesie in der Zahnheilkunde |
bis zu 300 mg |
20 mg/ml |
|
Periphere Nervenblockade |
bis zu 300 mg |
10 - 20 mg/ml |
|
Stellatum-Blockade |
bis zu 100 mg |
10 mg/ml |
|
Grenzstrang-Blockade |
bis zu 300 mg |
10 mg/ml |
|
Paravertebralanästhesie |
bis zu 300 mg |
10 mg/ml |
5jährige
10jährige
15jährige
20jährige
40jährige
60jährige
80jährige
|
Epiduralanästhesie |
bis zu 300 mg |
5 - 20 mg/ml |
|
Feldblock |
bis zu 500 mg |
5 - 20 mg/ml |
|
Intravenöse Regionalanästhesie |
bis zu 300 mg |
5 mg/ml |
Bei der Periduralanästhesie ist altersabhängig zu dosieren, für den Lumbalbereich gelten Richtwerte:
olgende
0,5 ml/Segment 0,9 ml/Segment
1.3 ml/Segment 1,5 ml/Segment
1.3 ml/Segment 1,0 ml/Segment 0,7 ml/Segment
Licain wird bei Erwachsenen und Kindern angewendet. Besondere Vorsicht ist bei der Behandlung von Kindern unter 4 Jahren geboten. Die zu injizierende Menge sollte anhand des Alters und des Gewichtes des Kindes und des Ausmaßes der Operation bestimmt werden.
Die Anästhesie-Methode sollte sorgfältig ausgewählt werden. Schmerzhafte Anästhesie-Techniken sollten vermieden werden. Das Verhalten des Kindes sollte während der Behandlung sorgfältig überwacht werden.
Die durchschnittliche Dosis, die zu verwenden ist, beträgt zwischen 20 und 30 mg Lidocainhydrochlorid pro Eingriff. Alternativ kann die Dosis in mg von Lidocainhydrochlorid, die Kindern verabreicht werden darf, nach der folgenden Formel berechnet werden: Gewicht des Kindes (in kg) x 1,33. Eine Verabreichung von 5 mg Lidocainhydrochlorid pro Kilogramm Körpergewicht darf nicht überschritten werden.
Lidocainhydrochlorid 1 H2O kann außer zur intravenösen Regionalanästhesie mit einem gefäßverengenden Zusatz, wie z. B. Epinephrin, zur Wirkungsverlängerung kombiniert werden; bewährt hat sich ein Epinephrinzusatz von 1:100000 bis 1:200000. Besonders im Bereich der Zahnheilkunde kann die Verwendung eines Lokalanästhetikums mit gefäßverengendem Zusatz bei Einsatz von kurz- bis mittellangwirkenden Substanzen unverzichtbar sein.
Lidocainhydrochlorid 1 H2O mit Epinephrinzusatz sollte nur für Anästhesien im Gesichtsbereich (Zahn, Mund, Kiefer) eingesetzt werden.
Bei Patienten mit reduziertem Allgemeinzustand bzw. veränderter Plasmaeiweißbindung (z.B. schweren Nieren-, Leber- oder Tumorerkrankungen, Schwangerschaft) müssen grundsätzlich kleinere Dosen angewendet werden.
Bei Patienten mit Niereninsuffizienz wird eine verkürzte Wirkzeit der Lokalanästhetika beobachtet. Dies wird auf einen beschleunigten Transport des Lokalanästhetikums in die Blutbahn durch Blutübersäuerung und gesteigertes Herz-Zeit-Volumen zurückgeführt.
Bei Lebererkrankungen ist die Toleranz gegen Säureamid-Lokalanästhetika herabgesetzt. Verantwortlich hierfür wird eine verminderte Stoffwechselleistung der Leber gemacht sowie eine verringerte Proteinsynthese mit einer daraus resultierenden niedrigeren Plasmaproteinbindung von Lokalanästhetika. In diesen Fällen wird ebenfalls eine erniedrigte Dosis empfohlen.
Bei Patienten mit zerebralem Anfallsleiden muss verstärkt auf die Manifestation zentralnervöser Symptome geachtet werden. Auch bei nicht hohen Lidocainhydrochlorid 1 H2O-Dosen muss mit einer gesteigerten Krampfbereitschaft gerechnet werden. Beim Melkersson-Rosenthal-Syndrom können allergische und toxische Reaktionen des Nervensystems auf Lokalanästhetika vermehrt auftreten.
Bei Patienten mit Zeichen einer Herzinsuffizienz oder klinisch relevanten Störungen der Erregungsbildung und -ausbreitung im Herzen ist die Dosis zu reduzieren und eine stete Kontrolle der Funktionsparameter erforderlich, auch nach Wirkungsende des Lokalanästhetikums. Nichtsdestoweniger kann die lokale oder regionale Nervenblockade das anästhesiologische Verfahren der Wahl sein.
In der geburtshilflichen Periduralanästhesie ist wegen der veränderten anatomischen Verhältnisse eine Dosisreduktion um etwa ein Drittel erforderlich.
4.3 Gegenanzeigen
Licain darf nicht angewendet werden,
- bei Überempfindlichkeit gegen den Wirkstoff, andere Lokalanästhetika vom Säureamid-Typ oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile,
- bei schweren Störungen des Herz-Reizleitungssystems,
- bei akutem Versagen der Herzleistung
- bei Schock
- in der Geburtshilfe bei einer drohenden oder bereits bestehenden Blutung zur Epiduralanästhesie
Zusätzlich sind die speziellen Gegenanzeigen für die Spinal- und Periduralanästhesie zu beachten, wie z.B.
- nicht korrigierter Mangel an Blutvolumen
- erhebliche Störungen der Blutgerinnung
- erhöhter Hirndruck
Zur Durchführung einer rückenmarksnahen Anästhesie unter den Bedingungen einer Blutgerinnungsprophylaxe siehe unter 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung".
Hinweis
Das Risiko postspinaler Kopfschmerzen, das bei Jugendlichen und Erwachsenen bis ca. 30 Jahren bei der Durchführung der Spinalanästhesie gegeben ist, lässt sich durch die Wahl geeigneter dünner Injektionskanülen deutlich senken.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Besondere Vorsicht bei der Anwendung von Licain ist erforderlich,
- bei Nieren- oder Lebererkrankung
- Myasthenia gravis
- Injektion in ein entzündetes (infiziertes) Gebiet
Vor einer Lokalanästhesie ist grundsätzlich auf eine gute Auffüllung des Kreislaufes zu achten.
Eine intravenöse Injektion oder Infusion darf nur unter sorgfältiger Kreislaufüberwachung vorgenommen werden. Alle Maßnahmen zur Beatmung, Therapie von Krampfanfällen und Wiederbelebung müssen vorhanden sein.
Ist eine Allergie gegen Lidocainhydrochlorid 1 H2O bekannt, so muss mit einer Kreuzallergie gegen andere Säureamid-Lokalanästhetika gerechnet werden.
Bei Lösen der Blutsperre im Rahmen der intravenösen Regionalanästhesie ist das Risiko von Nebenwirkungen erhöht. Daher sollte das Lokalanästhetikum fraktioniert abgelassen werden.
Bei Anwendung im Hals-Kopf-Bereich besteht ein höherer Gefährdungsgrad, weil das Risiko für zentralnervöse Vergiftungserscheinungen erhöht ist.
Zur Vermeidung von Nebenwirkungen sollten folgende Punkte beachtet werden:
- Bei Risikopatienten und bei Verwendung höherer Dosierungen (mehr als 25% der maximalen Einzeldosis bei einzeitiger Gabe) intravenösen Zugang für Infusion anlegen (Volumensubstitution)
- Dosierung so niedrig wie möglich wählen
- In der Regel keinen gefäßverengenden Zusatz verwenden (s. Dosierungsanleitung)
- Korrekte Lagerung des Patienten beachten
- Vor Injektion sorgfältig in zwei Ebenen aspirieren (Drehung der Kanüle)
- Vorsicht bei Injektion in infizierte Bereiche (aufgrund verstärkter Resorption bei herabgesetzter Wirksamkeit)
- Injektion langsam vornehmen
- Blutdruck, Puls und Pupillenweite kontrollieren
- Allgemeine und spezielle Kontraindikationen sowie Wechselwirkungen mit anderen Mitteln beachten
Es ist zu beachten, dass unter Behandlung mit Blutgerinnungshemmern (Antikoagulanzien, wie z. B. Heparin), nichtsteroidalen Antirheumatika oder Plasmaersatzmitteln nicht nur eine versehentliche Gefäßverletzung im Rahmen der Schmerzbehandlung zu ernsthaften Blutungen führen kann, sondern dass allgemein mit einer erhöhten Blutungsneigung gerechnet werden muss. Entsprechende Laboruntersuchungen sind vor der Anwendung von Licain durchzuführen. Gegebenenfalls ist die Antikoagulanzientherapie zeitig genug abzusetzen.
Eine Anästhesie bei gleichzeitiger Vorsorgetherapie zur Vermeidung von Thrombosen (Thromboseprophylaxe) mit niedermolekularem Heparin sollte nur unter besonderer Vorsicht durchgeführt werden.
Bei bestehender Behandlung mit nichtsteroidalen Antirheumatika (z. B. Acetylsalicylsäure) wird in den letzten fünf Tagen vor der geplanten rückenmarksnahen Injektion eine Bestimmung der Blutungszeit als notwendig angesehen.
Kinder
Für Kinder sind Dosierungen individuell unter Berücksichtigung von Alter und Gewicht zu berechnen. Für die Anwendung zur Anästhesie bei Kindern sollten niedrigkonzentrierte Lidocainhydrochlorid 1 H2O - Lösungen (5 mg/ml) gewählt werden. Zur Erreichung von vollständigen motorischen Blockaden kann die Verwendung von höher konzentrierten Lidocainhydrochlorid 1 H2O-Lösungen (10 mg/ml) erforderlich sein.
Ältere Menschen
Für ältere Menschen sind Dosierungen individuell unter Berücksichtigung von Alter und Gewicht zu berechnen. Vornehmlich bei älteren Patienten kann eine plötzliche arterielle Hypotension als Komplikation bei einer Periduralanästhesie mit Licain auftreten.
Eine 10 ml-Ampulle Licain 10 mg/ml Injektionslösung enthält 1,2 mmol (27,6 mg) Natrium. Dies ist zu berücksichtigen bei Personen unter Natrium kontrollierter (natriumarmer/- kochsalzarmer) Diät.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Die gleichzeitige Gabe gefäßverengender Arzneimittel führt zu einer längeren Wirkdauer von Licain.
Bei gleichzeitiger Gabe von Licain und Secale-Alkaloiden (wie z. B. Ergotamin) oder Epinephrin kann ein ausgeprägter Blutdruckabfall auftreten.
Vorsicht ist geboten bei Einsatz von Beruhigungsmitteln, die ebenfalls die Funktion des Zentralnervensystems (ZNS) beeinflussen und die schädigende Wirkung von Lokalanästhetika verändern können. Es besteht ein Wechselspiel zwischen Lokalanästhetika einerseits und Beruhigungsmitteln andererseits. Die letztgenannte Medikamentengruppe hebt die Krampfschwelle des ZNS an.
Bei gleichzeitiger Anwendung von Aprindin und Licain ist eine Verstärkung der Nebenwirkungen möglich. Aprindin hat aufgrund der chemischen Strukturähnlichkeit mit Lokalanästhetika ähnliche Nebenwirkungen.
Vorsicht ist geboten bei gleichzeitiger Therapie mit bestimmten Herzmedikamenten (Propranolol, Diltiazem und Verapamil). Durch eine Abnahme der Lidocainhydrochlorid 1 H2O-Ausscheidung kommt es zu einer deutlichen Verlängerung der Eliminationshalbwertszeit Ausscheidungszeit mit der Gefahr der Anhäufung von Lidocain.
Kombinationen verschiedener Lokalanästhetika rufen additive Wirkungen am Herz-Kreislauf-System und ZNS hervor.
Vorsicht ist geboten bei gleichzeitiger Gabe des H2-Blocker Cimetidin. Durch eine Abnahme der Leberdurchblutung und Hemmung des Abbaus können bereits nach Interkostalblockade schädigende Lidocain-Blutkonzentrationen auftreten.
Die Wirkung nichtdepolarisierender Muskelrelaxanzien (bestimmte Arzneimittel zur Muskelerschlaffung) wird durch Licain verlängert.
Licain kann die methämoglobinbildende Wirkung von Arzneimitteln, die als Methämoglobinbildner bekannt sind (z.B. Sulfonamide), verstärken.
4.6 Schwangerschaft und Stillzeit
Schwangerschaft
Lidocain soll in der Schwangerschaft nur bei strenger Indikationsstellung angewendet werden. Kontraindiziert ist die Periduralanästhesie mit Lidocain in der Geburtshilfe bei drohenden oder bestehenden Blutungen.
Stillzeit
Eine Gefährdung des Säuglings bei Anwendung von Lidocain in der Stillzeit erscheint unwahrscheinlich.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bei operativer, zahnärztlicher oder großflächiger Anwendung von Licain muss vom Arzt im Einzelfall entschieden werden, ob der Patient aktiv am Straßenverkehr teilnehmen oder Maschinen bedienen darf.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (>1/100, < 1/10)
Gelegentlich (> 1/1.000, < 1/100)
Selten (> 1/10.000, < 1/1.000)
Sehr selten (< 1/10.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die möglichen Nebenwirkungen nach Anwendung von Licain entsprechen weitgehend denen anderer Lokalanästhetika vom Säureamid-Typ. Unerwünschte Wirkungen für den gesamten Körper können bei höheren Blutspiegeln auftreten (über 5 bis 10 ^g Lidocain pro ml) und betreffen das Zentralnerven- und das Herzkreislaufsystem.
Bei Blutspiegeln, wie sie bei richtiger Anwendung im Allgemeinen erreicht werden, wird der Blutdruck in der Regel nur gering von Licain beeinflusst.
Ein Blutdruckabfall kann ein erstes Zeichen für eine relative Überdosierung im Sinne einer herzschädigenden Wirkung sein.
Die Auslösung eines schweren Fieberanfalls (maligne Hyperthermie) ist, wie bei anderen Lokalanästhetika, auch für Lidocainhydrochlorid 1 H2O nicht auszuschließen. Im Allgemeinen wird jedoch der Einsatz von Lidocainhydrochlorid 1 H2O bei Patienten mit einer solchen Erkrankung in der Vorgeschichte für sicher gehalten, auch wenn über das Auftreten einer malignen Hyperthermie bei einem Patienten, der Lidocainhydrochlorid 1 H2O zur Epiduralanästhesie erhalten hatte, berichtet wurde.
Allergische Reaktionen auf Licain in Form von Juckreiz, Schwellung des Gewebes durch Wassereinlagerung, Verkrampfungen der Atemwege oder eines Atemnotsyndroms sowie Kreislaufreaktionen werden gelegentlich beschrieben. Anaphylaktische Reaktionen werden nur sehr selten beschrieben.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Symptome einer Überdosierung
Licain wirkt in niedrigen schädigenden Dosierungen als zentrales Nervenstimulans, in hohen schädigenden Dosisbereichen kommt es zur Dämpfung der zentralen Funktionen. Eine schwere Überdosierung verläuft in zwei Phasen:
Sie werden unruhig, klagen über Schwindel, akustische und visuelle Störungen sowie Kribbeln, vor allem an Zunge und Lippenbereich. Die Sprache ist verwaschen, Schüttelfrost und Muskelzuckungen sind Vorboten eines drohenden generalisierten Krampfanfalls. Bei
fortschreitender Überdosierung kommt es zu einer zunehmenden Funktionsstörung des Hirnstammes mit den Symptomen Atemdepression und Koma bis hin zum Tod.
b) Notfallmaßnahmen und Gegenmittel werden durch den behandelnden Arzt entsprechend der Krankheitszeichen sofort eingeleitet.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lokalanästhetika vom Säureamid-Typ ATC-Code: N01BB02
Lidocainhydrochlorid 1 H2O ist ein Lokalanästhetikum vom Säureamid-Typ. Die Base hemmt die Funktionen erregbarer Strukturen, wie sensorische, motorische und autonome Nervenfasern sowie die Erregungsleitung des Herzens. Lidocain hebt reversibel und örtlich begrenzt das Leitungsvermögen der sensiblen Nervenfasern auf. Nach der Schmerzempfindung wird in dieser fallenden Reihenfolge die Empfindung für Kälte bzw. Wärme, für Berührung und Druck herabgesetzt.
Lidocain wirkt außerdem antiarrhythmisch. Es zeigt zusätzlich eine schwache antihistaminerge und parasympatholytische Wirkung. Im Gegensatz zu den meisten anderen Lokalanästhetika besitzt Lidocain keine gefäßerweiternde Wirkung.
Lidocain setzt die Membranpermeabilität für Kationen, insbesondere für Natriumionen, in höheren Konzentrationen auch für Kaliumionen, herab. Dies führt konzentrationsabhängig zu einer verminderten Erregbarkeit der Nervenfaser, da der zur Ausbildung des Aktionspotenzials notwendige, plötzliche Anstieg der Natriumpermeabilität verringert ist. Lidocain dringt vom Zellinneren in den geöffneten Na-Kanal der Zellmembran ein und blockiert durch Besetzung einer spezifischen Bindungsstelle dessen Leitfähigkeit. Eine direkte Wirkung des in die Zellmembran eingelagerten Lidocain ist demgegenüber von untergeordneter Bedeutung. Da Lidocain jedoch, um an seinen Wirkort zu gelangen, zunächst in die Zellen eindringen muss, ist die Wirkung vom Pka-
Wert der Substanz und vom pH-Wert des Milieus abhängig, also vom Anteil an ungeladener Base, die besser als die Kationen in die lipophile Nervenmembran permeieren kann. Im entzündeteten Gewebe ist die Wirkung aufgrund des dort vorliegenden sauren pH-Werts herabgesetzt.
Nach intravenöser Gabe verteilt sich die Substanz schnell in stark durchbluteten Organen (Herz, Leber, Lunge), gefolgt von einer Umverteilung in die Skelettmuskulatur und das Fettgewebe.
Die Wirkdauer beträgt ca. 30 Minuten.
5.2 Pharmakokinetische Eigenschaften
Die Halbwertszeit der alpha-Verteilungsphase liegt bei 6 bis 9 Minuten.
Nach intramuskulärer Injektion von 400 mg Lidocainhydrochlorid-1 H2O (Interkostalblock) wurde Cmax im Plasma mit 6,48 pg Lidocain/ml bestimmt. Die tmax nach intramuskulärer Applikation wurde zu 5 bis 15 min ermittelt, bei Dauerinfusion wird der Steady-state-Plasmaspiegel erst nach 6 h (Bereich 5 bis 7 h) erreicht. Therapeutische Wirkspiegel stellen sich aber bereits nach 15 bis 60 min ein. Im Vergleich hierzu lagen die cmax-Werte nach subcutaner Gabe bei 4,91 pg Lidocain/ml (Vaginalapplikation) bzw. bei 1,95 pg Lidocain/ml (Abdominalapplikation). In einer Studie mit 5 gesunden Probanden wurde 30 min nach maxillar-buccaler Infiltrationsanästhesie mit 36 mg Lidocainhydrochlorid 1 H2O in 2%iger Lösung ein Cmax-Wert von durchschnittlich 0,31 pg Lidocain/ml erreicht. Bei Injektion in den Epiduralraum scheint die gemessene maximale Plasmakonzentration nicht linear abhängig von der applizierten Dosis zu sein. 400 mg Lidocainhydrochlorid 1 H2O führten hier zu Cmax-Werten von 4,27 pg Lidocain/ml bzw. 2,65 pg Lidocain/ml.
Zum pharmakokinetischen Verhalten nach intrathekaler Applikation liegen keine Daten vor.
Die Bioverfügbarkeit nach oraler Aufnahme wurde aufgrund des First-pass-Effektes mit 35 % bestimmt.
Das Verteilungsvolumen beträgt bei Gesunden 1,5 l/kg (Bereich 1,3 bis 1,7 l/kg), ist bei Herzinsuffizienz erniedrigt auf 0,8 bis 1,0 l/kg und bei Leberinsuffizienz erhöht auf etwa 2,3 l/kg. Bei Neugeborenen liegt VD bei 2,7 l/kg.
Lidocain und sein Metabolit Monoethylglycinxylidid passieren langsam die Blut-Hirn-Schranke. Lidocain wird an alpha1-saures Glycoprotein gebunden (60 bis 80%).
Lidocain wird in der Leber durch Monooxygenasen rasch metabolisiert. Hauptrichtung der Biotransformation sind die oxydative Entalkylierung, Ringhydroxylierung und Amidhydrolyse. Hydroxyderivate werden konjugiert. Insgesamt werden etwa 90% der verabreichten Dosis zu 4-Hydroxy-2,6-xylidin, 4-Hydroxy-2,6-xylidinglucuronid und in geringerem Maß zu den noch wirksamen Metaboliten Monoethylglycinxylidid und Glycinxylidid metabolisiert, die aufgrund ihrer längeren Halbwertszeit besonders bei längerdauernden Infusionen und bei Niereninsuffizienz kumulieren können. Bei Lebererkrankungen kann die Metabolisierungsrate auf 10 bis 50% des Normalwerts abfallen.
Lidocain und seine Metabolite werden renal eliminiert. Der Anteil an unveränderter Substanz beträgt etwa 5 bis 10%.
Die Eliminationshalbwertszeit liegt bei 1,5 bis 2 h bei Erwachsenen bzw. 3 h bei Neugeborenen. Sie kann bei schwerer Herzinsuffizienz auf 4 bis 10 (bis 12) h, bei chronisch alkoholgeschädigter Leber auf 4,5 bis 6 h verlängert sein. Die Halbwertszeiten der beiden noch wirksamen Metabolite Monoethylglycinxylidid und Glycinxylidid liegen bei 2 bzw. 10 h. Die Halbwertszeiten von Lidocain und Monoethylglycinxylidid verlängern sich bei Patienten mit Myokardinfarkt, ebenso die Halbwertszeit von Glycinxylidid bei Herzinsuffizienz nach einem Herzinfarkt.
Bei Niereninsuffizienz wurden Plasmahalbwertszeiten für Glycinxylidid von etwa 10 h, für Lidocain von 2 bis 3 h gemessen. Bei wiederholter intravenöser Applikation von Lidocain besteht in den genannten Fällen die Gefahr einer Kumulation.
Die Eliminationsgeschwindigkeit ist pH-abhängig und wird durch Ansäuern des Harns erhöht. Die Clearance liegt bei 0,95 l/min.
Lidocain passiert die Plazenta mittels einfacher Diffusion und erreicht wenige Minuten nach Applikation den Feten. Das Verhältnis der fetalen zur maternalen Serumkonzentration liegt nach epiduraler Applikation bei 0,5 - 0,7. Nach Infiltration des Perineums und paracervikaler Blockade wurden deutlich höhere Konzentrationen im Nabelschnurblut gemessen. Die Eliminationshalbwertzeit von Lidocain beim Neugeborenen nach Epiduralanästhesie der Mutter beträgt ungefähr drei Stunden, nach Infiltration des Perineums und paracervikaler Blockade war Lidocain noch über 48 Stunden im Urin der Neugeborenen nachweisbar.
Lidocain wird mit der Muttermilch ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Es liegen zahlreiche Untersuchungen an unterschiedlichen Tierarten zur akuten Toxizität von Lidocain vor. Anzeichen einer Toxizität waren ZNS-Symptome. Dazu zählten auch Krampfanfälle mit tödlichem Ausgang.
Die beim Menschen ermittelte toxische (kardiovaskuläre oder zentralnervöse Symptome, Krämpfe) Plasmakonzentration von Lidocain wird mit 5 pg/ml bis > 10 pg/ml Blutplasma angegeben.
Mutagenitätsuntersuchungen mit Lidocain verliefen negativ. Dagegen gibt es Hinweise, dass ein bei der Ratte, möglicherweise auch beim Menschen aus Lidocain entstehendes Stoffwechselprodukt, 2,6-Xylidin, mutagene Wirkungen haben könnte. Diese Hinweise ergeben sich aus in-vitro-Tests, in denen dieser Metabolit in sehr hohen, fast toxischen Konzentrationen eingesetzt wurde. Darüber hinaus zeigte 2,6 Xylidin in einer Kanzerogenitätsstudie an Ratten mit transplazentarer Exposition und nachgeburtlicher Behandlung der Tiere über 2 Jahre ein tumorigenes Potenzial. In diesem hochempfindlichen Testsystem wurden bei sehr hohen Dosierungen bösartige und gutartige Tumoren vor allem in der Nasenhöhle (Ethmoturbinalia) beobachtet. Da eine Relevanz dieser Befunde für den Menschen nicht hinreichend sicher auszuschließen ist, sollte Lidocain nicht über längere Zeit in hohen Dosen verabreicht werden.
Studien zur Reproduktionstoxizität ergaben keine Hinweise auf teratogene Eigenschaften. Allein eine Reduzierung des Fetalgewichtes wurde beobachtet. Bei Nachkommen von Ratten, die während der Trächtigkeit eine Dosis Lidocain erhielten, die fast der für den Menschen empfohlenen Maximaldosis entspricht, wurde von Verhaltensänderungen berichtet.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Die sonstigen Bestandteile sind: Natriumchlorid, Natriumhydroxid (E 524), Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Bisher keine bekannt
6.3 Dauer der Haltbarkeit
Glasampullen: 5 Jahre 5 ml Luer-Lock®-System Ampullen: 2 Jahre 10 ml Luer-Lock®-System Ampullen: 3,5 Jahre .
Die Injektionslösung ist nur zur einmaligen Anwendung bestimmt. Die Anwendung muss unmittelbar nach Öffnung der Ampulle erfolgen. Nicht verbrauchte Reste sind zu verwerfen.
Nur klare Lösungen in unversehrten Behältnissen zur Injektion verwenden.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Das Behältnis im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen. Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses
Klare, farblose Injektionslösung in Glas- und Luer-Lock®-System Ampullen
Licain@ 10 mg/ml Injektionslösung
Glasampullen zu 10 ml 5 Ampullen (N2)
50 Ampullen (PC)
PC= Praxis-/Sprechstundenbedarf
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
PUREN Pharma GmbH & Co. KG Willy-Brandt-Allee 2 81829 München Telefon: 089/558909-0 Telefax: 089/558909-240
8. ZULASSUNGSNUMMER
6368504.03.00
9. DATUM DER ERTEILUNG DER ZULASSUNG/ VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 21. Mai.1999
Datum der letzten Verlängerung der Zulassung: 06. Mai.2004
10. STAND DER INFORMATION
05.2016
11. VERKAUFSABGRENZUNG
Verschreibungspflichtig
Seite 11 von 11