Lifsar Pulmojet 50 Mikrogramm/500 Mikrogramm Pro Inhalation Pulver Zur Inhalation
FACHINFORMATION
1. BEZEICHNUNG DES ARZNEIMITTELS
Lifsar PulmoJet® 50 Mikrogramm/500 Mikrogramm pro Inhalation Pulver zur Inhalation
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
Jede einzelne Inhalation enthält eine abgegebene Menge (die aus dem Mundstück abgegebene Menge) von 45 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 465 Mikrogramm Fluticason-17-propionat. Dies entspricht einer abgemessenen Menge von 50 Mikrogramm Salmeterol (als Salmeterolxinafoat) und 500 Mikrogramm Fluticason-17-propionat.
Sonstiger Bestandteil mit bekannter Wirkung:
Bis zu 7 mg Lactose-Monohydrat pro abgemessener Menge.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Pulver zur Inhalation.
Der Inhalator enthält ein weißes Pulver. Das Inhalatorgehäuse ist grau und weiß, bestehend aus einer grauen Basis und einem grauen Mundstück, einer weißen Schutzkappe und einem violetten oder grauen Bodendeckel.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Lifsar PulmoJet ist angezeigt für die symptomatische Behandlung von Patienten mit COPD mit einem FEV1 < 60 % des Normwertes (vor Anwendung eines Bronchodilatators) und wiederholt aufgetretenen Exazerbationen, die trotz regelmäßiger bronchienerweiternder Therapie signifikante Symptome aufweisen.
Lifsar PulmoJet ist nur zur Anwendung bei Erwachsenen im Alter von 18 Jahren und älter bestimmt.
4.2 Dosierung und Art der Anwendung Dosierung
Art der Anwendung: Zur Inhalation.
Patienten sollten darauf hingewiesen werden, dass es für den Behandlungserfolg erforderlich ist, Lifsar PulmoJet täglich anzuwenden, auch wenn sie symptomfrei sind.
Lifsar PulmoJet ist nur in der Stärke 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticasonpropionat pro abgemessener Dosis erhältlich.
Empfohlene Dosis Erwachsene
2-mal täglich 1 Inhalation mit 50 Mikrogramm Salmeterol und 500 Mikrogramm Fluticason-17-propionat.
Spezielle Patientengruppen
Die Dosierung muss bei älteren Patienten oder bei Patienten mit eingeschränkter Nierenfunktion nicht speziell angepasst werden. Für die Anwendung von Lifsar PulmoJet bei Patienten mit eingeschränkter Leberfunktion liegen keine Daten vor.
Kinder und Jugendliche
Lifsar PulmoJet darf bei Kindern und Jugendlichen im Alter von unter 18 Jahren nicht angewendet werden.
Art der Anwendung
Patienten sollten in die korrekte Handhabung Ihres Inhalators eingewiesen werden (siehe Gebrauchsinformation).
Mundstück
Lufteinlässe
Zählerfenster
Inhalations
Kontrollfenster
Hinweis: Die Zahl, die im Zählerfenster angezeigt wird, bezieht sich auf die initiale Anzahl an Inhalationen (60), die sich im Inhalator befinden. Diese Zahl ändert sich nicht, auch wenn der Inhalator leer ist. Die grüne Farbe im Zählerfenster zeigt an, wie viele Inhalationen noch in etwa zur Verfügung stehen (siehe Abschnitt „Wann sollte der Inhalator ersetzt werden?”).
Grundprinzipien für die Anwendung von Lifsar PulmoJet
1. ÖFFNEN: Weiße Schutzkappe entfernen.
2. INHALIEREN: Das Mundstück mit den Lippen umschließen und tief einatmen.
3. SCHLIESSEN, BIS ES KLICKT: Schutzkappe wieder vollständig aufsetzen.
Gebrauchsanweisung
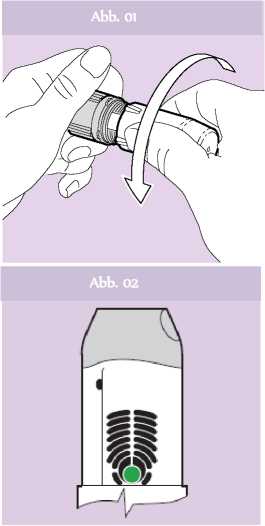
Abb. 03
1.
2.
ÖFFNEN
Den Inhalator mit beiden Händen halten: eine Hand an der grauen Basis und die andere Hand an der weißen Schutzkappe. Der Inhalator kann in jeder beliebigen Position gehalten werden. Die weiße Schutzkappe sollte von der grauen Basis entfernt werden, indem beide Teile in entgegengesetzte Richtungen gedreht werden (Abb. 01). Der Patient wird einen leichten Widerstand spüren, sobald der Inhalator halb geöffnet ist.
Die grüne Farbe im Inhalations-Kontrollfenster bestätigt, dass der Inhalator einsatzbereit ist (Abb. 02).
INHALIEREN
Den Inhalator fest an der grauen Basis und vom Mund entfernt halten. Langsam ausatmen, soweit es ohne Anstrengung möglich ist.
Der Patient sollte nicht durch den Inhalator ausatmen.
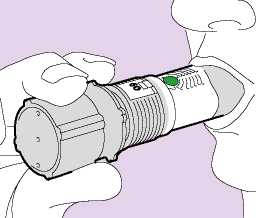
Die Lippen sollten das graue Mundstück umschließen (Abb. 03) ohne die Lufteinlässe mit den Lippen zu verdecken. Der Patient sollte nicht in das Mundstück beißen oder daran kauen.
Es sollte so tief und stark wie möglich durch den Mund eingeatmet werden (nicht durch die Nase).
Der Patient sollte nicht aufhören zu inhalieren, wenn ein leicht ploppendes Geräusch zu hören ist. Das leicht ploppende Geräusch während des Inhalationsvorgangs zeigt an, dass die Inhalation abgegeben wurde.
Der Patient sollte den Atem zusätzlich für 5 bis 10 Sekunden anhalten bzw. so lange, wie es dem Patienten ohne Anstrengung möglich ist. Anschließend sollte langsam durch die Nase ausgeatmet werden und eine Rückkehr zu einer normalen Atmung erfolgen.
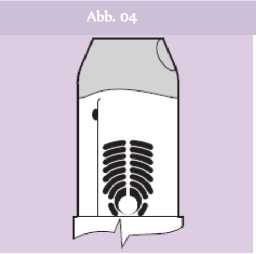
Die grüne Farbe im Inhalations-Kontrollfenster sollte nun verschwunden sein und damit anzeigen, dass die Inhalation erfolgreich abgegeben wurde (Abb. 04).
3. SCHLIESSEN, BIS ES KLICKT
Abb. 05
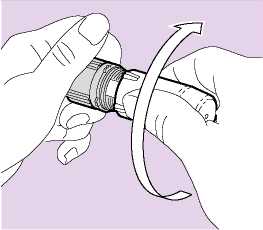
Abb. 06
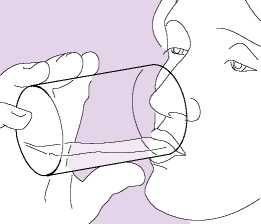
Die weiße Schutzkappe wieder fest auf die graue Basis drehen, bis ein Klicken zu hören ist (Abb. 05).
Es ist wichtig, dass die Schutzkappe komplett gedreht wird, bis ein Klicken zu hören ist, denn dadurch erfolgt die Beladung mit der nächsten Inhalation des Arzneimittels. Die Ausrichtungslinien auf Schutzkappe und Boden sollten übereinstimmen.
Wenn vom Arzt mehr als eine Inhalation verordnet wird, sollte der Patient die oben aufgeführten Schritte wiederholen.
Die Patienten sollten vom Arzt angewiesen werden, nach jeder Inhalation ihren Mund mit Wasser zu spülen (und auszuspucken) und/oder Ihre Zähne zu putzen, um das Risiko einer Candidiasis (Soorbefall) im Mund- und Rachenraum und Heiserkeit zu minimieren (Abb. 06).
Wann sollte der Inhalator ersetzt werden?
Abb. 07
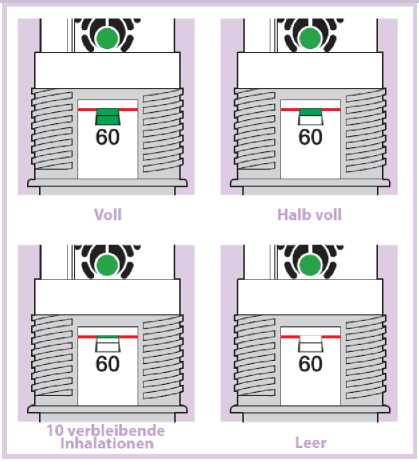
Die Zahl, die im Zählerfenster angezeigt wird, zeigt die initiale Anzahl an Inhalationen (60), die sich im Inhalator befinden (Abb. 07). Diese Zahl ändert sich nicht, auch wenn der Inhalator leer ist.
Die grüne Farbe im Zählerfenster zeigt an, wie viele Inhalationen noch in etwa zur Verfügung stehen. Dazu den Inhalator aufrecht auf Augenhöhe halten, um zu überprüfen, wie viel im Inhalator verblieben ist.
Wenn die grüne Farbe die Position der roten Linie erreicht hat, stehen noch etwa 10 Inhalationen im Inhalator zur Verfügung (Abb. 07 - 10 verbleibende Inhalationen). Der Patient kann den Inhalator weiterhin anwenden, sollte jedoch einen Arzt aufsuchen, um eine neue Verschreibung zu erhalten.
Der Inhalator ist leer, sobald die grüne Kontrolle nicht mehr sichtbar ist (Abb. 07 -Leer)
Reinigung des Inhalators
- Das Mundstück kann durch Abwischen mit einem trockenen, sauberen Tuch gereinigt werden. Kein Wasser oder andere Flüssigkeiten verwenden, um das Mundstück reinigen.
- Den Inhalator immer mit der weißen Schutzkappe verschließen, wenn er nicht verwendet wird.
- Den Inhalator vor Feuchtigkeit schützen.
Weitere Informationen über den Inhalator
- Die weiße Schutzkappe lässt sich auch noch drehen und es ist ein Klicken zu hören, selbst wenn der Inhalator leer ist.
- Das Geräusch, das beim Schütteln des Inhalators zu hören ist, wird durch ein Trockenmittel und nicht durch das Arzneimittel hervorgerufen. Deshalb kann anhand des Geräusches nicht bestimmt werden, wie viel Arzneimittel noch im Inhalator vorhanden ist.
- Es ist nicht möglich, den Inhalator mit mehr als einer Inhalation zu beladen.
- Wenn der Inhalator ohne Kappe fallen gelassen wird, dann sollte die Kappe zunächst wieder komplett aufgesetzt werden, bevor die nächste Inhalation angewendet wird.
4.3 Gegenanzeigen
Überempfindlichkeit gegen die Wirkstoffe, Milchprotein oder den in Abschnitt 6.1 genannten sonstigen Bestandteil.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Bei Patienten mit COPD, die Exazerbationen aufweisen, ist üblicherweise die Behandlung mit systemischen Kortikoiden angezeigt. Deshalb sollten Patienten angewiesen werden, medizinischen Rat zu suchen, wenn sich die Symptome unter Lifsar PulmoJet verschlechtern.
Wegen des Risikos einer Exazerbation sollte die Behandlung mit Lifsar PulmoJet nicht abrupt beendet werden.
Bei COPD-Patienten kann das Absetzen der Therapie auch mit einer Verschlechterung der Symptome verbunden sein, es sollte deshalb von einem Arzt überwacht werden.
Wie alle kortikoidhaltigen Arzneimittel zur Inhalation ist Lifsar PulmoJet bei Patienten mit aktiver oder ruhender Lungentuberkulose und Pilzinfektionen, viralen oder anderen Infektionen der Luftwege mit Vorsicht anzuwenden. Eine entsprechende Behandlung sollte, wenn indiziert, umgehend erfolgen.
Lifsar PulmoJet kann in seltenen Fällen Herzrhythmusstörungen, z. B. supraventrikuläre Tachykardie, Extrasystolen und Vorhofflimmern, und bei hohen therapeutischen Dosierungen eine geringe vorübergehende Reduktion des Serumkaliumspiegels verursachen. Lifsar PulmoJet ist bei Patienten mit schweren kardiovaskulären Erkrankungen oder Herzrhythmusstörungen und bei Patienten mit Diabetes mellitus, Thyreotoxikose, unbehandelter Hypokaliämie oder bei Patienten mit einer Prädisposition zu niedrigen Serumkaliumspiegeln mit Vorsicht anzuwenden.
Es ist sehr selten über einen Anstieg der Blutglucosespiegel berichtet worden (siehe Abschnitt 4.8), und dies sollte bei der Verordnung für Patienten mit Diabetes mellitus in der Vorgeschichte berücksichtigt werden.
Wie bei anderer Inhalationsbehandlung können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens und Kurzatmigkeit nach der Anwendung ausgelöst werden. Ein paradoxer Bronchospasmus spricht auf schnell wirksame Bronchodilatatoren an und ist umgehend zu behandeln. Die Anwendung von Lifsar PulmoJet sollte dann unverzüglich abgebrochen, der Patient untersucht und - wenn notwendig -eine alternative Behandlung begonnen werden.
Es wurde über die pharmakologischen Nebenwirkungen einer ß2-Agonisten-Behandlung, wie Tremor, Palpitationen und Kopfschmerzen, berichtet. Sie sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab.
Systemische Effekte können bei der Behandlung mit jedem inhalativen Kortikoid auftreten, insbesondere unter hohen Dosierungen, die für einen langen Zeitraum verschrieben werden. Diese Effekte sind allerdings unter der Inhalationsbehandlung viel weniger wahrscheinlich als unter der oralen Gabe von Kortikoiden. Mögliche systemische Effekte schließen Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Verminderung der Knochendichte, Katarakt und Glaukom ein und seltener eine Reihe von Wirkungen auf die Psyche oder das Verhalten, einschließlich psychomotorische Überaktivität, Schlafstörungen, Angst, Depression oder Aggression (besonders bei Kindern). Deshalb ist es wichtig, den Patienten regelmäßig zu kontrollieren und die Dosis des inhalativen Kortikoids auf die niedrigste Dosierung zu reduzieren, mit der eine effektive Kontrolle des Asthmas aufrechterhalten werden kann.
Die Inhalation von hohen Dosierungen inhalativer Kortikoide über einen längeren Zeitraum kann zu einer Nebennierenrindensuppression und akuter adrenaler Krise führen. Sehr seltene Fälle von Nebennierenrindensuppression und akuter adrenaler Krise wurden auch bei Dosen zwischen 500 und weniger als 1000 Mikrogramm beschrieben. Eine akute adrenale Krise kann möglicherweise durch Umstände wie Verletzung, Operation, Infektion oder jede schnelle Dosisreduktion ausgelöst werden. Die Symptome sind typischerweise unspezifisch, wie z. B. Appetitlosigkeit, Bauchschmerzen,
Gewichtsverlust, Müdigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Hypotonie, Bewusstseinstrübung, Hypoglykämie und Krampfanfälle.
Während Stressperioden oder im Rahmen einer geplanten Operation sollte eine zusätzliche systemische Gabe von Kortikoiden in Betracht gezogen werden.
Eine Inhalationsbehandlung mit Fluticasonpropionat sollte den Bedarf an oralen Kortikoiden senken. Die Umstellung von oral kortikoidpflichtigen Patienten auf die Inhalationsbehandlung und deren anschließende Betreuung erfordern eine sorgfältige Überwachung, da sich die durch eine langfristige systemische Kortikoidtherapie eingeschränkte Nebennierenrindenfunktion nur allmählich normalisiert. Deshalb sollten diese Patienten mit besonderer Vorsicht behandelt werden und die Nebennierenrindenfunktion ist regelmäßig zu kontrollieren. Patienten, die in der Vorgeschichte hohe Dosierungen systemisch applizierter Kortikoide erhielten, sind durch eine solche möglicherweise noch bestehende Suppression ebenfalls gefährdet. Bei allen Patienten mit eingeschränkter Nebennierenrindenfunktion sollte geprüft werden, ob in besonderen Stresssituationen (z. B. Exazerbation des Asthmas, Atemwegsinfektion, Operation) die Anwendung oraler Kortikoide notwendig ist.
Ritonavir kann die Plasmakonzentration von Fluticasonpropionat erheblich erhöhen. Deshalb sollte eine gleichzeitige Anwendung vermieden werden, es sei denn, der mögliche Nutzen für den Patienten überwiegt das Risiko systemischer Kortikoidnebenwirkungen. Ebenso besteht ein erhöhtes Risiko systemischer Nebenwirkungen bei Kombination von Fluticasonpropionat mit anderen potenten Inhibitoren des Enzyms CYP3A (siehe Abschnitt 4.5).
Bei der TORCH-Studie wurde bei Patienten mit COPD, die Salmeterol/Fluticasonpropionat 50 Mikrogramm/500 Mikrogramm zweimal täglich angewendet haben, vermehrt über Infektionen der unteren Atemwege berichtet (insbesondere Pneumonie und Bronchitis) im Vergleich zu Patienten, die Placebo erhielten. Dies wurde auch in den Studien SCO40043 und SCO100250 berichtet, in denen die niedrigere, nicht für Patienten mit COPD zugelassene Dosis von Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm zweimal täglich mit Salmeterol 50 Mikrogramm zweimal täglich allein verglichen wurde (siehe Abschnitte 4.8 und 5.1).
In sämtlichen Studien wurde in der Salmeterol/Fluticasonpropionat-Gruppe eine ähnliche Häufigkeit von Pneumonien beobachtet. In der TORCH-Studie hatten ältere Patienten, Patienten mit einem geringeren Body-Mass-Index (< 25 kg/m2) und Patienten mit sehr schwerer Erkrankung (FEV1 < 30 % des Normwertes), unabhängig von der Behandlung, das größte Risiko, eine Pneumonie zu entwickeln. Ärzte sollten bei Patienten mit COPD aufmerksam hinsichtlich der möglichen Entwicklung einer Pneumonie und anderer Infektionen der unteren Atemwege bleiben, da sich das klinische Erscheinungsbild solcher Infektionen und einer Exazerbation häufig überschneidet. Wenn ein Patient mit schwerer COPD eine Pneumonie entwickelt hat, sollte die Behandlung mit Lifsar PulmoJet überprüft werden.
Daten aus einer großen klinischen Studie (Salmeterol Multi-Center Asthma Research Trial, SMART) weisen darauf hin, dass afroamerikanische Patienten unter Salmeterol ein höheres Risiko für schwere atemwegsbedingte Ereignisse oder Todesfälle haben als unter Placebo (siehe Abschnitte 4.8 und 5.1). Es ist nicht bekannt, ob dies auf pharmakogenetische oder andere Faktoren zurückzuführen ist. Patienten mit schwarzafrikanischer oder afrokaribischer Abstammung sollten daher aufgefordert werden, die Behandlung fortzusetzen, aber ärztlichen Rat zu suchen, wenn keine Kontrolle der Asthmasymptome zu erreichen ist oder sich diese unter der Anwendung von Lifsar PulmoJet verschlechtern.
Die gleichzeitige systemische Anwendung von Ketoconazol erhöht die systemische Verfügbarkeit von Salmeterol in hohem Maße. Dies kann zu einem Anstieg der Inzidenz von systemischen Wirkungen (z. B. Verlängerung des QT-Intervalls und Palpitationen) führen. Die gleichzeitige Behandlung mit Ketoconazol oder anderen potenten CYP3A4-Inhibitoren sollte deshalb vermieden werden, sofern der Nutzen das potenziell erhöhte Risiko von systemischen Nebenwirkungen der Behandlung mit Salmeterol nicht überwiegt (siehe Abschnitt 4.5).
Lifsar PulmoJet enthält bis zu 7 Milligramm Lactose-Monohydrat pro Inhalation. Diese Menge ist im Allgemeinen bei Patienten mit Lactose-Intoleranz unbedenklich. Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Lifsar PulmoJet nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
ß-Blocker können die Wirkung von Salmeterol schwächen oder ihr entgegenwirken. Die Anwendung von sowohl nicht selektiven als auch selektiven ß-Blockern sollte vermieden werden, solange es nicht zwingende Gründe für ihre Anwendung gibt. Eine potentiell schwere Hypokaliämie kann aus einer ß2-Agonisten-Therapie resultieren. Besondere Vorsicht ist bei akutem schwerem Asthma angeraten, da diese Wirkung bei gleichzeitiger Behandlung mit Xanthinderivaten, Steroiden und Diuretika verstärkt werden kann.
Die gleichzeitige Anwendung von anderen ß-adrenergen Arzneimitteln kann einen potenziell additiven Effekt haben.
Fluticasonpropionat
Unter normalen Umständen werden nach inhalativer Anwendung aufgrund eines ausgeprägten First-PassMetabolismus und einer hohen systemischen Clearance durch das Cytochrom P450 3A4 in Darm und Leber niedrige Plasmakonzentrationen von Fluticasonpropionat erreicht. Daher sind durch Fluticasonpropionat vermittelte, klinisch relevante Wechselwirkungen unwahrscheinlich.
In einer Interaktionsstudie an gesunden Probanden erhöhten 2-mal täglich 100 mg Ritonavir (ein hochpotenter Inhibitor des Cytochrom P450 3A4) die Plasmakonzentrationen von nasal appliziertem Fluticasonpropionat um mehrere hundert Mal, mit der Folge deutlich reduzierter Serumkortisolspiegel.
Für die inhalative Anwendung von Fluticasonpropionat liegen entsprechende Informationen nicht vor, jedoch ist ein deutlicher Anstieg der Plasmaspiegel von Fluticasonpropionat zu erwarten. Es wurde über Fälle von Cushing-Syndrom und adrenaler Suppression berichtet. Die Kombination sollte vermieden werden, sofern der Nutzen das erhöhte Risiko systemischer Kortikoidnebenwirkungen nicht überwiegt.
In einer kleinen Studie an gesunden Probanden erhöhte Ketoconazol, ein etwas weniger potenter Inhibitor von CYP3A, die Fluticasonpropionat-Exposition nach einer einzelnen Inhalation um 150 %. Dies reduzierte, im Vergleich mit Fluticasonpropionat allein, das Kortisol im Plasma stärker. Bei gleichzeitiger Behandlung mit anderen potenten Inhibitoren von CYP3A, wie z. B. Itraconazol, und moderaten CYP3A Inhibitoren, wie Erythromycin, ist ebenfalls eine Zunahme der systemischen FluticasonpropionatExposition und des Risikos systemischer Nebenwirkungen zu erwarten. Deshalb ist Vorsicht geboten, und eine Langzeitbehandlung mit solchen Arzneimitteln sollte, wenn möglich, vermieden werden.
Salmeterol
Potente CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Ketoconazol (400 mg oral/einmal täglich) und Salmeterol (50 Mikrogramm inhalativ/zweimal täglich) zeigte bei 15 Probanden über 7 Tage einen deutlichen Anstieg der Plasmaspiegel von Salmeterol (1,4-fache Cmax und 15-fache AUC). Dies kann zu einem Anstieg der Inzidenz von anderen systemischen Wirkungen der Behandlung mit Salmeterol (z. B. Verlängerung des QT-Intervalls und Palpitationen) führen, verglichen zu einer Behandlung mit Salmeterol und Ketoconazol allein (siehe Abschnitt 4.4).
Klinisch signifikante Auswirkungen wurden im Hinblick auf den Blutdruck, den Herzschlag sowie den Glucose- und Kaliumspiegel im Blut nicht beobachtet. Die gleichzeitige Anwendung von Ketoconazol erhöhte nicht die Eliminationshalbwertszeit oder die Akkumulation von Salmeterol nach wiederholter Anwendung.
Die gleichzeitige Anwendung von Ketoconazol soll vermieden werden, sofern der Nutzen das potenziell erhöhte Risiko von systemischen Nebenwirkungen der Behandlung mit Salmeterol nicht überwiegt. Ein ähnliches Wechselwirkungsrisiko kann sich möglicherweise mit anderen potenten CYP3A4-Inhibitoren (z. B. Itraconazol, Telithromycin, Ritonavir) ergeben.
Moderate CYP3A4-Inhibitoren
Die gleichzeitige Anwendung von Erythromycin (500 mg oral/dreimal täglich) und Salmeterol (50 Mikrogramm inhalativ/zweimal täglich) zeigte bei 15 Probanden über 6 Tage eine geringe, aber nicht statistisch signifikante Erhöhung der Verfügbarkeit von Salmeterol (1,4-fache Cmax und 1,2-fache AUC). Die gleichzeitige Anwendung von Erythromycin war nicht mit schwerwiegenden unerwünschten Ereignissen verbunden.
4.6 Fertilität, Schwangerschaft und Stillzeit
Fertilität
Es liegen keine ausreichenden Daten am Menschen vor. In Tierstudien wurden jedoch keine Effekte von Salmeterol oder Fluticasonpropionat auf die Fertilität gezeigt.
Schwangerschaft
Weitergehende Erfahrungen an schwangeren Frauen (zwischen 300 bis 1.000 Schwangerschaftsausgänge) deuten nicht auf ein Fehlbildungsrisiko oder eine fötale/neonatale Toxizität von Salmeterol und Fluticasonpropionat hin. Tierexperimentelle Studien haben eine Reproduktionstoxizität nach der Anwendung von ß2-Adrenozeptoragonisten und Glukokortikoiden gezeigt (siehe Abschnitt 5.3).
Die Anwendung von Lifsar PulmoJet bei Schwangeren sollte nur in Betracht gezogen werden, wenn der erwartete Nutzen für die Mutter größer ist als jedwedes mögliche Risiko für den Fötus.
Bei der Behandlung von schwangeren Frauen sollte die niedrigste wirksame Dosis an Fluticasonpropionat eingesetzt werden, die nötig ist, um eine adäquate Kontrolle der Krankheitssymptome zu gewährleisten.
Stillzeit
Es ist nicht bekannt, ob Salmeterol, Fluticasonpropionat und ihre Metaboliten beim Menschen in die Muttermilch ausgeschieden werden.
Studien haben gezeigt, dass sowohl Salmeterol und Fluticasonpropionat und ihre Metaboliten in die Milch laktierender Ratten ausgeschieden werden.
Ein Risiko für Neugeborene/Säuglinge, die gestillt werden, kann nicht ausgeschlossen werden. Es muss eine Entscheidung darüber getroffen werden, ob das Stillen zu unterbrechen ist oder ob die Behandlung mit Lifsar PulmoJet zu unterbrechen ist. Dabei soll sowohl der Nutzen des Stillens für das Kind als auch der Nutzen der Therapie für die Frau berücksichtigt werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Lifsar PulmoJet hat keinen oder einen zu vernachlässigenden Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Da Lifsar PulmoJet Salmeterol und Fluticasonpropionat enthält, können diejenigen Nebenwirkungen nach Art und Schweregrad erwartet werden, die mit jedem der beiden Wirkstoffe verbunden sind. Es gibt keinen Hinweis darauf, dass zusätzliche Nebenwirkungen nach einer gemeinsamen Anwendung der beiden Wirkstoffe auftreten.
Nebenwirkungen, die bei der Anwendung von Salmeterol/Fluticasonpropionat auftraten, sind nachfolgend aufgeführt, geordnet nach Systemorganklassen und Häufigkeit. Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: sehr häufig (> 1/10), häufig (> 1/100 bis < 1/10), gelegentlich (> 1/1.000 bis < 1/100), selten (> 1/10.000 bis < 1/1.000), sehr selten (< 1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar). Häufigkeiten wurden aus den Daten der klinischen Studien abgeleitet. Das Auftreten in der Placebo-Gruppe wurde nicht berücksichtigt.
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Infektionen und parasitäre Erkrankungen |
Candidiasis (Soorbefall) im Mund- und Rachenraum |
Häufig |
|
Pneumonie |
Häufig1, 3 5 | |
|
Bronchitis |
Häufig1, 3 | |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen mit den folgenden Erscheinungen: | |
|
- Überempfindlichkeitsreaktionen der Haut - Atembeschwerden (Dyspnoe) |
Gelegentlich | |
|
- Angioödem (überwiegend faziales und oropharyngeales Ödem) - Anaphylaktische Reaktionen, einschließlich anaphylaktischer Schock - Atembeschwerden (Bronchospasmus) |
Selten | |
|
Endokrine Erkrankungen |
Cushing-Syndrom, cushingoide Erscheinungen, adrenale Suppression, Wachstumsverzögerung bei Kindern und Jugendlichen, Verminderung der Knochendichte |
Selten4 |
|
Stoffwechsel- und Ernährungsstörungen |
Hypokaliämie |
Häufig3 |
|
Hyperglykämie |
Gelegentlich4 | |
|
Psychiatrische Erkrankungen |
Angst, Schlafstörungen |
Gelegentlich |
|
Verhaltensänderungen, einschließlich psychomotorische Hyperaktivität und Reizbarkeit (überwiegend bei Kindern) |
Selten | |
|
Depression, Aggression (überwiegend bei Kindern) |
Häufigkeit nicht bekannt | |
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Sehr häufig1 |
|
Tremor |
Gelegentlich | |
|
Augenerkrankungen |
Katarakt |
Gelegentlich |
1 unter Placebo häufig berichtet.
|
Systemorganklasse |
Nebenwirkung |
Häufigkeit |
|
Glaukom |
Selten4 | |
|
Herzerkrankungen |
Palpitationen, Tachykardie, Vorhofflimmern, Angina Pectoris |
Gelegentlich |
|
Kardiale Arrhythmien (einschließlich supraventrikuläre Tachykardie und Extrasystolie) |
Selten | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Nasopharyngitis |
Sehr häufig2, 3 |
|
Irritation der Rachenschleimhaut, Heiserkeit/Dysphonie |
Häufig | |
|
Sinusitis |
Häufig1, 3 | |
|
Paradoxer Bronchospasmus |
Selten4 | |
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Blutergüsse |
Häufig1, 3 |
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Muskelkrämpfe, Arthralgien, Myalgien |
Häufig |
|
Traumatische Frakturen |
Häufig1, 3 |
2 unter Placebo sehr häufig berichtet.
3 in einer COPD Studie über 3 Jahre berichtet.
4 siehe Abschnitt 4.4.
5 siehe Abschnitt 5.1.
Beschreibung ausgewählter Nebenwirkungen
Über die pharmakologischen Nebenwirkungen einer ß2-Agonisten-Behandlung, wie Tremor, Palpitationen und Kopfschmerzen, ist berichtet worden. Sie sind aber meist vorübergehend und klingen bei regelmäßiger Behandlung wieder ab.
Wie bei anderen Inhalationsbehandlungen können paradoxe Bronchospasmen mit einer sofortigen Zunahme des Giemens und von Kurzatmigkeit nach der Anwendung ausgelöst werden. Ein paradoxer Bronchospasmus spricht auf schnell wirksame Bronchodilatatoren an und ist umgehend zu behandeln. Die Anwendung von Lifsar PulmoJet sollte dann unverzüglich abgebrochen, der Patient untersucht und -wenn notwendig - eine alternative Behandlung begonnen werden.
Durch den Fluticasonpropionat-Anteil können bei einigen Patienten Heiserkeit und Candidiasis (Soorbefall) im Mund- und Rachenraum, sowie selten des Ösophagus, auftreten.
Sowohl einer Heiserkeit als auch dem Auftreten einer Candidiasis kann vorgebeugt werden, indem nach der Anwendung von Lifsar PulmoJet der Mund mit Wasser ausgespült wird und/oder die Zähne geputzt werden. Bei symptomatischer Candidiasis im Mund- und Rachenraum empfiehlt sich die lokale Behandlung mit einem gegen diese Pilzerkrankung wirksamen Arzneimittel. Die Anwendung von Lifsar PulmoJet sollte währenddessen fortgeführt werden.
Lactose enthält geringe Mengen Milchprotein und kann deshalb allergische Reaktionen hervorrufen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Es liegen keine Daten aus klinischen Prüfungen zur Überdosierung mit Lifsar PulmoJet verfügbar. Im Folgenden sind jedoch Daten zur Überdosierung mit den Einzelwirkstoffen aufgeführt:
Die Anzeichen und Symptome einer Überdosierung mit Salmeterol sind Schwindel, Anstieg des systolischen Blutdrucks, Tremor, Kopfschmerzen und Tachykardie. Wenn die Behandlung mit Lifsar PulmoJet aufgrund einer Überdosierung des ß-Agonisten-Anteils des Arzneimittels abgebrochen werden muss, sollte die Anwendung einer geeigneten Kortikoidersatzbehandlung in Erwägung gezogen werden. Zusätzlich kann eine Hypokaliämie auftreten, und deshalb sollten die Serumkaliumspiegel kontrolliert werden. Eine Kaliumsubstitution sollte in Erwägung gezogen werden.
Akute Überdosierung
Die kurzzeitige Inhalation von höheren als den therapeutisch empfohlenen Dosierungen von Fluticasonpropionat kann zu einer zeitweiligen Suppression der Nebennierenrindenfunktion führen. Diese erfordert keine Notfallbehandlung, da die Nebennierenrindenfunktion innerhalb weniger Tage wieder hergestellt ist, wie durch Plasma-Kortisol-Messungen belegt wurde.
Chronische Überdosierung von inhaliertem Fluticasonpropionat:
Siehe Abschnitt. 4.4: Risiko einer Nebennierenrindensuppression
Die Nebennierenreserve sollte kontrolliert werden, und es kann eine Behandlung mit einem systemischen Kortikoid notwendig sein. Wenn eine Stabilisierung eingetreten ist, sollte die Behandlung mit einem inhalativen Kortikoid bei empfohlener Dosierung fortgeführt werden.
In den Fällen einer akuten als auch chronischen Überdosierung mit Fluticasonpropionat sollte die Behandlung mit Lifsar PulmoJet in einer geeigneten Dosierung zur Kontrolle der Symptome weiter fortgeführt werden.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Inhalative Sympathomimetika; Sympathomimetika in Kombination mit Corticosteroiden oder anderen Mitteln, exkl. Anticholinergika,
ATC-Code: R03AK06.
Wirkmechanismus und pharmakodynamische Wirkungen:
Lifsar PulmoJet enthält Salmeterol und Fluticasonpropionat, die verschiedene Wirkmechanismen haben. Die beiden Wirkmechanismen werden im Folgenden dargestellt:
Salmeterol
Salmeterol ist ein selektiver langwirksamer (12 Stunden) ß2-Agonist mit einer langen Seitenkette, die an die Exo-Seite des ß2-Rezeptors bindet.
Salmeterol bewirkt mit mindestens 12 Stunden eine länger anhaltende Bronchodilatation als herkömmliche kurzwirksame ß2-Agonisten in empfohlenen Dosierungen.
Fluticasonpropionat (FP)
Das Kortikoid Fluticasonpropionat hat bei inhalativer Anwendung in den empfohlenen Dosierungen eine antientzündliche Wirkung in der Lunge. Hieraus resultiert eine Abnahme der Asthmasymptome und Exazerbationen mit weniger Nebenwirkungen als bei einer systemischen Kortikoidtherapie.
Klinische Wirksamkeit und Sicherheit
Klinische Prüfungen bei COPD-Patienten
TORCH war eine 3-Jahres-Studie bei COPD-Patienten zur Beurteilung der Wirksamkeit der Behandlung mit jeweils 2-mal täglicher Anwendung von Salmeterol/Fluticasonpropionat 50 Mikrogramm/500 Mikrogramm, Salmeterol 50 Mikrogramm, Fluticasonpropionat (FP)
500 Mikrogramm oder von Placebo hinsichtlich der Gesamtsterblichkeit. COPD-Patienten mit FEV1 <
60 % des Normwertes (vor Anwendung eines Bronchodilatators) als Ausgangswert wurden doppelblind randomisiert. Während der Studie war es den Patienten erlaubt, ihre übliche COPD-Therapie anzuwenden, mit Ausnahme anderer inhalativer Kortikoide, langwirksamer Bronchodilatatoren und systemischer Dauertherapie mit Kortikoiden. Für alle Patienten wurde der Überlebensstatus nach 3 Jahren bestimmt, unabhängig von einem eventuellen Absetzen der Studienmedikation. Der primäre Endpunkt war die Reduktion der Gesamtmortalität nach 3 Jahren unter Salmeterol/Fluticasonpropionat versus Placebo.
|
Placebo N = 1.524 |
Salmeterol 50 N = 1.521 |
FP 500 N = 1.534 |
Salmeterol + FP 50/500 N = 1.533 | |
|
Gesamtmortalität nach 3 Jahren | ||||
|
Anzahl Todesfälle (%) |
231 (15,2 %) |
205 (13,5 %) |
246 (16,0 %) |
193 (12,6 %) |
|
Hazard Ratio vs. Placebo (KI) p-Wert |
N/A |
0,879 (0,73, 1,06) 0,180 |
1,060 (0,89, 1,27) 0,525 |
0,825 (0,68, 1,00) 0,052' |
|
Hazard Ratio Salmeterol + FP 50/500 vs. Einzelwirkstoffe (KI) p-Wert |
N/A |
0,932 (0,77, 1,13) 0,481 |
0,774 (0,64, 0,93) 0,007 |
N/A |
|
1 Nicht signifikanter p-Wert, hinsichtlich des primären Endpunktes, nach Berücksichtigung von 2 Interimsanalysen im log-rank Test, stratifiziert nach Raucherstatus. | ||||
Es bestand ein Trend zu einer höheren Überlebenswahrscheinlichkeit bei Patienten, die über 3 Jahre mit Salmeterol/Fluticasonpropionat behandelt wurden, im Vergleich zu Placebo, auch wenn das statistische Signifikanzniveau p < 0,05 nicht erreicht wurde.
Der Prozentsatz an Patienten, die innerhalb von 3 Jahren an COPD-bedingten Ursachen verstarben, betrug 6 % unter Placebo, 6,1 % unter Salmeterol, 6,9 % unter Fluticasonpropionat und 4,7 % unter Salmeterol/Fluticasonpropionat.
Die durchschnittliche Anzahl mittelschwerer und schwerer Exazerbationen pro Jahr war unter Salmeterol/Fluticasonpropionat signifikant reduziert, im Vergleich zur Behandlung mit Salmeterol, FP und Placebo (durchschnittliche Rate in der Salmeterol/Fluticasonpropionat-Gruppe 0,85 im Vergleich zu 0,97 in der Salmeterol-Gruppe, 0,93 in der FP-Gruppe und 1,13 unter Placebo). Dies schlägt sich nieder in einer Reduktion der Rate mittelschwerer und schwerer Exazerbationen um 25 % (95 %
Konfidenzintervall: 19-31 %; p < 0,001) im Vergleich zu Placebo, um 12 % im Vergleich zu Salmeterol (95 % Konfidenzintervall: 5-19 %; p = 0,002) und um 9 % im Vergleich zu FP (95 % Konfidenzintervall: 1-16 %; p = 0,024). Salmeterol und Fluticasonpropionat reduzierten signifikant die Exazerbationsraten um 15 % (95 % Konfidenzintervall: 7-22 %; p < 0,001) und entsprechend um 18 % (95 % Konfidenzintervall: 1124 %; p < 0,001) im Vergleich zu Placebo.
Die gesundheitsbezogene Lebensqualität, gemessen mit dem St. George's Respiratory Questionnaire (SGRQ), wurde im Vergleich zu Placebo in allen 3 Verum-Behandlungsarmen verbessert. Die durchschnittliche Verbesserung über 3 Jahre unter Salmeterol/Fluticasonpropionat betrug -3,1 Einheiten (95 % Konfidenzintervall: -4,1 bis -2,1; p < 0,001) im Vergleich zu Placebo, -2,2 Einheiten im Vergleich zu Salmeterol (p < 0,001) und -1,2 Einheiten im Vergleich zu FP (p = 0,017). Eine Abnahme um vier Einheiten wird als klinisch relevant angesehen.
Die geschätzte 3-Jahres-Wahrscheinlichkeit einer als unerwünschtes Ereignis berichteten Pneumonie betrug 12,3 % für Placebo, 13,3 % für Salmeterol, 18,3 % für FP und 19,6 % für Salmeterol/Fluticasonpropionat (Hazard ratio für Salmeterol/Fluticasonpropionat versus Placebo: 1,64,
95 % Konfidenzintervall: 1,33 bis 2,01; p < 0,001). Es gab keinen Anstieg Pneumonie-assoziierter Todesfälle; Todesfälle, die unter der Behandlung als primär Pneumonie-bedingt gewertet wurden, waren 7 unter Placebo, 9 unter Salmeterol, 13 unter FP und 8 unter Salmeterol/Fluticasonpropionat. Es gab keinen signifikanten Unterschied in der Wahrscheinlichkeit von Knochenbrüchen (5,1 % unter Placebo, 5,1 % unter Salmeterol, 5,4 % unter FP und 6,3 % unter Salmeterol/Fluticasonpropionat; Hazard ratio für Salmeterol/Fluticasonpropionat versus Placebo: 1,22, 95 % Konfidenzintervall: 0,87 bis 1,72; p = 0,248).
Placebo-kontrollierte klinische Prüfungen über 6 und 12 Monate haben gezeigt, dass die regelmäßige Anwendung von Salmeterol/Fluticasonpropionat 50 Mikrogramm/500 Mikrogramm die Lungenfunktion verbessert und Atemnot sowie die Anwendung von Bedarfsmedikation reduziert.
Die Studien SCO40043 und SCO100250 waren randomisierte, doppelblinde Parallelgruppen-Studien mit identischem Design zur Beurteilung der Wirksamkeit einer Behandlung mit
Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm zweimal täglich (diese Dosierung ist für die Behandlung der COPD in der EU nicht zugelassen) oder der Anwendung von Salmeterol 50 Mikrogramm zweimal täglich hinsichtlich der jährlichen Rate mittelschwerer/schwerer Exazerbationen bei COPD-Patienten mit einem FEVi-Wert von weniger als 50 % des Sollwertes und anamnestisch bekannten Exazerbationen. Mittelschwere/schwere Exazerbationen wurden wie folgt definiert: Sich verschlechternde Symptome, die eine Behandlung mit oralen Kortikoiden und/oder Antibiotika oder Klinikeinweisungen erforderlich machten.
Die Studien starteten mit einer vierwöchigen Run-in Phase, in der alle Patienten open label Salmeterol/Fluticasonpropionat 50/250 erhielten, um die COPD-Pharmakotherapie zu standardisieren und die Erkrankung vor Randomisierung auf eine verblindete Studienmedikation (Anwendung über 52 Wochen) zu stabilisieren. Die Patienten wurden im 1:1-Modus auf Salmeterol/Fluticasonpropionat 50/250 (Gesamt ITT n = 776) oder Salmeterol (Gesamt ITT n = 778) randomisiert. Vor der Run-in Phase setzten die Patienten die bisherige COPD-Medikation bis auf kurzwirksame Bronchodilatatoren ab. Während des Behandlungszeitraums war die gleichzeitige Anwendung von inhalativen langwirksamen Bronchodilatatoren (ß2-Agonisten und Anticholinergika), von Kombinationsprodukten mit Ipratropium/Salbutamol, oralen ß2-Agonisten und Theophyllin-Präparaten nicht erlaubt. Orale Kortikoide und Antibiotika waren für die akute Behandlung von COPD-Exazerbationen unter Beachtung der speziellen Richtlinien zur Anwendung erlaubt. Salbutamol setzten die Patienten in den Studien als Bedarfsmedikation ein.
Die Ergebnisse beider Studien zeigten, dass die Behandlung mit Salmeterol/Fluticasonpropionat zu einer deutlich geringeren jährlichen Rate von mittelschweren/schweren COPD-Exazerbationen im Vergleich zu Salmeterol führte (SCO40043: 1,06 und 1,53/Patient pro Jahr bzw. relatives Risiko von 0,70, 95 % CI: 0,58 bis 0,83, p < 0,001; SCO100250: 1,10 bzw. 1,59/Patient pro Jahr bzw. relatives Risiko von 0,70,
95 % CI: 0,58 bis 0,83, p < 0,001). Die Ergebnisse für die sekundären Wirksamkeitsparameter (Zeit bis zur ersten mittelschweren/schweren Exazerbation, die jährliche Rate an Exazerbationen, die eine Behandlung mit oralen Kortikoiden erforderte, und die morgendliche präbronchodilatatorische FEVi) fielen deutlich zu Gunsten der Behandlung mit zweimal täglich Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm gegenüber Salmeterol aus. Die Nebenwirkungsprofile waren annähernd vergleichbar mit Ausnahme einer höheren Inzidenz von Pneumonien und bekannten lokalen Nebenwirkungen (Candidiasis und Heiserkeit) in der mit Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm zweimal täglich behandelten Gruppe verglichen mit Salmeterol. Ereignisse, die mit einer Pneumonie in Zusammenhang standen, wurden für 55 (7 %) Patienten in der Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm-Gruppe mit zweimal täglicher Behandlung verglichen mit 25 (3 %) in der Salmeterol-Gruppe berichtet. Die erhöhte Inzidenz von berichteten Pneumonien bei Anwendung von Salmeterol/Fluticasonpropionat 50 Mikrogramm/250 Mikrogramm zweimal täglich erreicht eine ähnliche Größenordnung wie die Pneumonie-Inzidenz in Folge der Behandlung mit Salmeterol/Fluticasonpropionat 50 Mikrogramm/500 Mikrogramm in der TORCH-Studie.
5.2 Pharmakokinetische Eigenschaften
Bei der Beurteilung der Pharmakokinetik kann jeder einzelne Wirkstoff getrennt betrachtet werden. Salmeterol
Salmeterol wirkt lokal in der Lunge, deshalb geben Plasmaspiegel keinen Hinweis auf therapeutische Wirkungen. Über die pharmakokinetischen Eigenschaften von Salmeterol sind außerdem nur begrenzte Daten verfügbar, da nach inhalativer Anwendung therapeutischer Dosierungen nur geringe Plasmakonzentrationen (ca. 200 pg/ml oder weniger) erreicht werden, die mit den verfügbaren Messmethoden technisch schwer zu bestimmen sind.
Fluticasonpropionat
Die absolute Bioverfügbarkeit einer Einzeldosis von inhaliertem Fluticasonpropionat bei Probanden liegt im Bereich von ca. 5 bis 11 % der angegebenen Dosis, abhängig vom verwendeten Inhalationsgerät. Bei Patienten mit Asthma bronchiale oder COPD ist ein geringeres Ausmaß der systemischen Exposition von inhaliertem Fluticasonpropionat beobachtet worden.
Die systemische Aufnahme findet hauptsächlich über die Lungen statt, und zwar anfangs schnell, dann verzögert. Der Rest der inhalierten Dosis kann zwar verschluckt werden, trägt aber aufgrund der geringen Wasserlöslichkeit und des vor-systemischen Metabolismus nur minimal zur systemischen Exposition bei, was eine orale Bioverfügbarkeit von weniger als 1 % zur Folge hat. Es zeigt sich ein linearer Anstieg der systemischen Exposition mit Erhöhung der inhalierten Dosis.
Fluticasonpropionat ist charakterisiert durch eine hohe Plasmaclearance (1.150 ml/min), ein großes Verteilungsvolumen im Steady State (ca. 300 l) und eine terminale Halbwertszeit von ca. 8 Stunden.
Die Plasmaproteinbindung beträgt 91 %.
Fluticasonpropionat wird sehr schnell aus dem Blutkreislauf entfernt. Hauptsächlich geschieht dies durch Metabolisierung durch das Cytochrom P450 Enzym CYP3A4 zu einem inaktiven Carboxylsäurederivat. Andere nicht identifizierte Metaboliten werden auch in den Fäzes gefunden.
Die renale Clearance von Fluticasonpropionat ist vernachlässigbar. Weniger als 5 % wird in Form von Metaboliten im Urin ausgeschieden. Der Großteil der Dosis wird in Form von Metaboliten und unveränderten Wirkstoffen in die Fäzes ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Die einzigen Sicherheitsbedenken für die Anwendung am Menschen, die sich aus tierexperimentellen Untersuchungen mit Salmeterol und Fluticasonpropionat, unabhängig voneinander eingesetzt, ableiten lassen, waren verstärkte pharmakologische Wirkungen.
In tierexperimentellen Reproduktionsstudien wurde gezeigt, dass Glukokortikoide Missbildungen hervorrufen (Gaumenspalten, Skelettfehlbildungen). Diese Ergebnisse aus tierexperimentellen Untersuchungen scheinen jedoch für den Menschen im empfohlenen Dosisbereich nicht von Bedeutung zu sein. Tierstudien mit Salmeterolxinafoat ergaben nur bei hoher Exposition Hinweise auf eine embryofötale Toxizität. Bei Ratten wurde bei gleichzeitiger Anwendung in Dosierungen, die mit bekannten Glukokortikoid-induzierten Anomalien verbunden sind, ein erhöhtes Auftreten von Transpositionen der Nabelarterien (Arteria umbilicalis) sowie eine unvollständige Ossifikation des Os occipitale festgestellt.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile Lactose-Monohydrat
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit 2 Jahre.
Haltbarkeit nach Anbruch: 30 Tage.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Die Schutzkappe fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Jede Faltschachtel enthält einen PulmoJet-Inhalator mit 60 Inhalationen. Das Inhalatorgehäuse ist grau und weiß, bestehend aus einer grauen Basis und einem grauen Mundstück, einer weißen Schutzkappe und einem violetten oder grauen Bodendeckel. Der Inhalator ist aus sechs verschiedenen Kunststoffen hergestellt:
Polypropylen/Polyethylen/Acrylnitril-Butadien-Styrol/thermoplastisches Elastomer/Polybutylenterephthalat und Silikon.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. INHABER DER ZULASSUNG
Zentiva Pharma GmbH 65927 Frankfurt am Main
92220.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 07.12.2015
10. STAND DER INFORMATION
Dezember 2015
11. VERKAUFSABGRENZUG
V erschreibungspflichtig.
16/16