Lithium Apogepha
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels / SPC)
1. Bezeichnung des Arzneimittels
®
Lithium Apogepha 295 mg Tabletten
2. Qualitative und quantitative Zusammensetzung
Wirkstoff: Lithiumcarbonat
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform Tablette
Die weißen runden Tabletten haben eine einseitige Bruchkerbe und können in gleiche Dosen geteilt werden.
4. Klinische Angaben
4.1 Anwendungsgebiete
- Zur Prophylaxe der bipolaren affektiven Störung und Episoden einer Major Depression
- Behandlung der manischen Episode
4.2 Dosierung und Art der Anwendung
Bei einem Serumlithiumspiegel von 0,5 bis 1,2 mmol/l erreicht Lithium in der Regel seine volle Wirksamkeit. Für die Prophylaxe ist meist ein Serumlithiumspiegel von 0,5 bis 0,8 mmol/l ausreichend, während in der Akutphase die Serumlithiumspiegel bis zu
1,2 mmol/l betragen können.
Aufgrund der geringen therapeutischen Breite muss die Dosierung von Lithium Apogepha® individuell gemäß dem Serumspiegel und der Reaktion der Patienten erfolgen. Die Pharmakokinetik variiert stark zwischen den Individuen. Höhere Dosen können bei manischen Patienten, Männern, physisch aktiven oder jungen Patienten erforderlich sein, bzw. solchen, die einen kürzeren Schlaf und/oder eine hohe Natrium-Aufnahme aufweisen.
Beginn der Phasenprophylaxe:
®
1.-3. Tag: 1% Tabletten Lithium Apogepha täglich (entsprechend 12 mmol Lithium) 4.-7. Tag: 3 Tabletten Lithium Apogepha täglich (entsprechend 24 mmol Lithium) Kontrolle der Serumlithiumspiegel
Der Serumlithiumspiegel ist nach 8 Tagen der Lithiumtherapie zu bestimmen. Die Bestimmung der Serumlithiumspiegel sollte möglichst genau 12 Stunden nach der letzten Einnahme erfolgen. Zweckmäßigerweise wird die Bestimmung am Morgen vor der weiteren Tablettengabe durchgeführt.
Die Bestimmung wird während des ersten Monats einmal wöchentlich wiederholt, danach im ersten halben Jahr einmal monatlich und später in der Regel in vierteljährlichem Abstand. Längere Zwischenräume können nur in Ausnahmefällen toleriert werden.
Langzeitbehandlung
Für die prophylaktische Wirkung sollte ein möglichst niedriger Lithiumserumspiegel angestrebt werden (0,5 - 0,8 mmol/l).
Eine Dosisreduktion während einer Langzeitbehandlung sollte in möglichst kleinen Schritten erfolgen, da Rückfälle bereits bei Verminderungen des Lithiumserumspiegels um mehr als 0,2 mmol/l beobachtet wurden.
Maniebehandlung
Es werden maximal 6 Tabletten Lithium Apogepha täglich (entsprechend 48 mmol Lithium) während der ersten 3 Tage gegeben. Danach wird die Dosis dem empfohlenen Serumspiegelbereich angepasst.
Während der akuten manischen Phase, in der Lithium besser toleriert wird, kann der Serumlithiumspiegel abfallen und somit eine Dosiserhöhung erforderlich werden. Die Lithiumtoleranz kann mit dem Abklingen der manischen Symptome sinken und erfordert dann wieder eine Dosisreduzierung.
Ältere Patienten
Bei älteren Patienten (über 65 Jahren) ist erfahrungsgemäß eine niedrigere Dosis für die gleiche Wirksamkeit ausreichend. Ein Serumlithiumspiegel über 0,6 mmol/l sollte nach Möglichkeit vermieden werden.
Weiterhin kann bei älteren Patienten aufgrund der abnehmenden Nierenfunktion und der dadurch verringerten Lithium-Elimination der Serumlithiumspiegel toxische Werte erreichen. Der Serumlithiumspiegel älterer Patienten sollte daher häufiger kontrolliert werden als im Regelfall empfohlen (siehe Abschnitt 4.4).
Art und Dauer der Einnahme
Da die Bioverfügbarkeit verschiedener lithiumhaltiger Arzneimittel unterschiedlich ist, entspricht die Umstellung auf eine andere lithiumhaltige Zubereitung einer neu beginnenden Behandlung und ist entsprechend zu überwachen.
®
Lithium Apogepha wird am besten in 2 (-3) Einzeldosen mit reichlich Flüssigkeit eingenommen, morgens die geringere, abends die größere Menge, jeweils zur gleichen Zeit.
Falls eine Einnahme versäumt wurde, sollte der Patient mit der Einnahme der nächsten Dosis bis zu dieser festgesetzten Zeit warten. Er sollte die versäumte Einnahme jedoch nicht mit einer doppelten Dosis ausgleichen.
Mitunter ist ein Behandlungserfolg erst nach 6 bis 12 Monaten zu diagnostizieren. Ein anfangs unbefriedigendes Ergebnis sollte kein Grund zum vorzeitigen Abbrechen der Therapie sein.
Unterbrechen oder Absetzen der Behandlung
Eine Unterbrechung einer erfolgreichen Lithiumprophylaxe kann in kürzester Zeit zu Rückfällen führen. Beim Absetzen sollte die Dosis schrittweise reduziert werden, um die Rezidivgefahr zu verringern.
Anwendung bei Kindern
Bei Kindern unter 12 Jahren ist eine Lithiumbehandlung nicht zu empfehlen, da bei dieser Altersgruppe keine Daten zur Sicherheit/Wirksamkeit vorliegen.
Hinweis
Eine sorgfältige klinische Überwachung des Patienten sowie regelmäßige Kontrollen des Serumlithiumspiegels sind dringend erforderlich (siehe Abschnitt 4.4).
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Akuter Herzinfarkt
- schwere Herz- und Nierenfunktionsstörungen
- Morbus Addison
- ausgeprägte Hyponatriämie, natriumarme Diät (Fastenkuren mit reduzierter Kochsalzzufuhr; Krankheiten, die eine natriumarme Diät erfordern)
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Vorsicht ist geboten bei
- renalen Störungen
- Herzrhythmusstörungen
- Herzinsuffizienz
- zerebralen Krampfleiden
- Myasthenia gravis
- Schilddrüsenunterfunktion
- Psoriasis
- myeloischer Leukämie
- Dehydratation.
Patienten sollten vor Beginn der Lithium-Therapie eine euthyreote Stoffwechsellage aufweisen.
Grundsätzlich ist bei der gleichzeitigen Behandlung mit Lithium und Neuroleptika Vorsicht geboten. Insbesondere wenn das EEG pathologische Werte zeigt, ist bei zusätzlicher neuroleptischer Behandlung größte Vorsicht geboten (siehe Abschnitt 4.5).
Bei einer lebensbedrohlichen psychiatrischen Erkrankung und wenn andere therapeutische Maßnahmen erfolglos waren, kann Lithium unter besonderer Vorsicht bei diesen Erkrankungen dennoch eingenommen werden. In diesem Fall sollte der Patient hospitalisiert sein und der Lithiumserumspiegel täglich kontrolliert werden. Gegebenenfalls muss eine Dosisanpassung erfolgen.
- Lithium kann ein Brugada-Syndrom, eine angeborene Erkrankung der kardialen NatriumKanäle mit charakteristischen elektrokardiographischen Veränderungen (Rechtsschenkelblock, ST-Streckenhebung in den rechten präkordialen Ableitungen), die zu Herzstillstand oder plötzlichem Tod führen können, demaskieren oder verstärken. Bei Patienten mit Brugada-Syndrom oder familiären Hintergrund von Brugadasyndrom darf Lithium nur nach Implantation eines automatischen Defibrillators unter EKG-Kontrolle verwendet werden. Die Lithium-Dosierung ist gegebenenfalls anzupassen.
Vorsicht ist geboten bei Patienten mit einem familiären Hintergrund von Herzstillstand oder plötzlichem Tod.
- Vorsichtshalber sollte Lithium bei Patienten mit angeborener QT-Verlängerung vermieden werden; bei Patienten mit Risikofaktoren für eine QT-Intervall-Verlängerung (z. B. nicht korrigierte Hypokaliämie, Bradykardie) ist Vorsicht geboten, ebenso bei Patienten, die mit anderen Arzneimitteln behandelt werden, die das QT-Intervall verlängern können (siehe Abschnitt 4.5 und 4.8).
- Es wurde über Fälle von benigner intrakranialer Hypertension berichtet. Patienten sollten aufgeklärt werden, anhaltende Kopfschmerzen und/oder Sehstörungen zu berichten (siehe Abschnitt 4.8).
- Lithium sollte 48 Stunden vor Operationen oder Narkosen abgesetzt werden (siehe Abschnitt 4.5). Nach Normalisierung der Nierenfunktion und des Elektrolythaushaltes kann erneut mit der Therapie begonnen werden.
- 48 Stunden vor einer Elektrokrampftherapie sollten Lithiumsalze abgesetzt werden, um die Gefahr eines Delirs zu reduzieren. Dieses kann auftreten, wenn beide Therapien gleichzeitig verabreicht werden.
- Diuretika und Neuroleptika sollten nur unter besonderer Vorsicht während einer Lithiumtherapie eingesetzt werden (siehe Abschnitt 4.5).
- Bei den ersten Anzeichen einer Intoxikation muss Lithium sofort abgesetzt werden (siehe Abschnitt 4.9).
Patienten sind über die Zeichen einer Intoxikation aufzuklären und sollen angehalten werden, folgende Zustände dem behandelnden Arzt zu berichten: Polyurie, Polydipsie, Brechreiz, Erbrechen, Durchfall, übermäßiges Schwitzen sowie Erkrankungen, die zu einer Dehydratation oder einem Salzverlust führen können (fieberhafte Infekte, Gastroenteritiden, Harnwegsinfektionen). In diesen Fällen ist der Lithium-Serumspiegel sorgfältig zu überwachen und, wenn nötig, eine Dosisanpassung vorzunehmen. Beim Auftreten von Infektionen sollte ggf. auch ein Absetzen der Behandlung erwogen werden.
- Eine Langzeittherapie mit Lithium kann mit morphologischen Nieren-Veränderungen (einschließlich tubulointerstitielle Nephropathie, renale Mikrozysten) einhergehen, und mit einer Verminderung der renalen Konzentrierungsfähigkeit, die sich in einem nephrogenen Diabetes insipidus mit Polyurie und Polydipsie äußert (siehe Abschnitt 4.8). In diesem Fall ist eine sorgfältige medizinische Betreuung notwendig, um eine Dehydratation mit daraus resultierender Lithium-Retention und Toxizität zu vermeiden. Nach Absetzen von Lithium ist dieser Zustand gewöhnlich reversibel.
- Nierentumoren: Bei Patienten mit schwerer Niereninsuffizienz, die über einen Zeitraum von mehr als 10 Jahren Lithium erhalten haben, wurden Fälle von Mikrozysten, Onkozytomen und Ductus Bellini-Karzinomen der Niere berichtet (siehe Abschnitt 4.8).
Auf ausreichende Kochsalz- und Flüssigkeitszufuhr ist zu achten. Dies gilt insbesondere für Patienten, die sich einer Abmagerungskur oder einer Diät unterziehen sowie bei sehr heißem Wetter oder wenn das Arbeitsumfeld eine erhöhte Flüssigkeits- und Elektrolytversorgung erfordert.
Kontrolluntersuchungen
Zu Beginn der Behandlung mit Lithiumsalzen sollte eine gründliche körperliche Untersuchung und während der gesamten Behandlungsdauer eine sorgfältige Überwachung des Patienten erfolgen. Folgende Untersuchungen sind durchzuführen:
1. Serumlithiumspiegel: siehe Abschnitt 4.2.
2. Serum-Kreatinin: Die Messung des Kreatinins im Serum sollte stets parallel zur Bestimmung der Lithiumkonzentration erfolgen.
3. Schilddrüsenfunktionstests (T3, T4, TSH, ggf. TRH-Test): jährlich
4. Natrium, Kalium, Kalziumbestimmung: jährlich
5. Blutbild: jährlich
6. Körpergewicht und Halsumfang: vierteljährliche Messung
7. Blutdruckmessung
8. EKG: jährlich
9. EEG: bedarfsweise, bzw. bei Gefahr von Wechselwirkungen bei Kombinationsbehandlungen (z.B. mit Neuroleptika)
10. 24-Stunden-Urinvolumen, Kreatininclearance: jährlich
11. Urinanalyse
12. Ggf. Überprüfung der renalen Konzentrationsleistung (Desmopressin-Test)
13. Regelmäßige Ultraschalluntersuchungen der Nieren nach Langzeitbehandlung (mehr als 10 Jahre): jährlich
Kürzere Untersuchungsintervalle bzw. außerplanmäßige Kontrollen können nötig sein bei:
- Begleiterkrankungen, die zu einer Veränderung des Serumlithiumspiegels führen können (z.B. starkes Erbrechen, hohes Fieber, heftige Durchfälle)
- Gleichzeitiger Gabe von Medikamenten, die den Serumlithiumspiegel beeinflussen können (siehe Abschnitt 4.5).
- Da im Alter die glomeruläre Filtrationsrate abnimmt und damit die Gefahr einer Intoxikation größer wird, ist bei älteren Patienten eine häufigere Kontrolle der Nierenfunktion notwendig.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Da Lithium mit einer Vielzahl von Arzneimitteln interagieren kann, ist stets besondere Vorsicht bei gleichzeitiger Gabe mit anderen Medikamenten geboten, insbesondere aber bei einer Kombination mit einem der im Folgenden aufgeführten Arzneimittel (in diesen Fällen sind engmaschige Kontrollen des Lithium-Serumspiegels und gegebenenfalls eine Dosisanpassung erforderlich):
Diuretika:
-Thiazide, Kaliumsparende Schleifendiuretika
Erhöhung des Lithium-Serumspiegels durch Verminderung der renalen Lithi-umclearance. Thiazide zeigen einen paradoxen antidiuretischen Effekt, der möglicherweise zu Wasserretention und Lithiumintoxikation führt.
-Osmotisch wirkende Diuretika, Carboanhydraseinhibitoren einschl. Acetazolamid Erniedrigung des Lithiumserumspiegels.
Antiepileptika (z.B. Phenytoin, Carbamazepin), Methyldopa; trizyklische Antidepressiva:
Erhöhung des Lithium-Serumspiegels mit Gefahr von Neurotoxizität.
Neuroleptika (z.B. Haloperidol, Thioridazin, Fluphenazin, Chlorpromazin, Clozapin)
Gehäuftes Auftreten von unerwünschten Wirkungen. Vor allem bei höherer Neurolepti-ka-Dosierung sollte auf Nebenwirkungen der Medikamente besonders geachtet werden. Eine dem neuroleptischen malignen Syndrom ähnliche Enzephalopathie - charakterisiert durch Schwäche, Lethargie, Fieber, Zittern, Verwirrtheit, Delir, Desorientiertheit, Myoklonus, Krampfanfälle und Häufung extrapyramidalmotorischer Symptome, Leukozytose, Anstieg der Serumenzyme - ist in seltenen Fällen nach Kombinationsbehandlung mit Lithium und Neuroleptika aufgetreten. Unter bestimmten Umständen hat dieses Syndrom zum irreversiblen Hirnschaden geführt. Wegen eines möglichen Kausalzusammenhanges in diesen Fällen sollten die Patienten mit Kombinationstherapie von Lithium und Neuroleptika engmaschig kontrolliert werden, und bei ersten Anzeichen einer Neurotoxizität sollten beide Arzneimittel sofort abgesetzt werden.
Substanzen, die den Serotonin-Stoffwechsel beeinflussen können (MAO-Hemmer, selektive Serotonin-Wiederaufnahmehemmer, 5 HT-Agonisten (Triptane))
Das Auftreten eines serotoninergen Syndroms (gekennzeichnet durch Symptome wie Bewusstseinsstörung, Koma, Ruhelosigkeit, Agitation, Verwirrtheit, Hypomanie, Muskelzucken, gesteigerte Reflexe, Rigidität, Akathisie, Myoklonus, Hypo- oder Hypertonie, Tachykardie, Hyperthermie, Schweißausbruch, Frösteln und Zittern, Diarrhö) wurde beschrieben. Das Serotonin-Syndrom ist eine potenziell lebensbedrohliche Neben-
5 von 13
Wirkung, die durch ein Übermaß an Serotonin (z. B. durch Überdosierung oder gleichzeitigen Gebrauch serotonerger Arzneimittel) verursacht wird, einen Krankenhausaufenthalt erfordert und auch den Tod verursachen kann. In diesem Fall ist die gesamte Medikation abzusetzen und ggf. eine (intensiv-)medizinische Behandlung einzuleiten. Das strenge Einhalten der empfohlenen Dosis ist eine grundlegende Voraussetzung, um dem Auftreten dieses Syndroms vorzubeugen.
Harnstoff, Xanthinpräparate (z.B. koffeinhaltige Getränke, Theophyllinhaltige Antiasth-matika; durchblutungsfördernde Mittel wie Pentoxifyllin, Xantinolnicotinat) und alkalisie-rende Substanzen (z.B. NaHCO3)
Erniedrigung des Serumlithiumspiegels durch erhöhte Lithiumausscheidung.
Neuromuskulär blockierende Substanzen (z.B. Pancuroniumbromid, Suxamethonium-chlorid)
Verlängerung der Wirkung durch Lithium. Daher sollte 48 Stunden vor einer Operation die Lithiumbehandlung unterbrochen werden.
Kaliumiodid
Verstärkung eines möglichen strumigenen Effekts des Lithiums.
Metronidazol, nichtsteroidale Antirheumatika (z.B. Diclofenac, Indometacin) inkl. Cyc-looxygenase-(COX-)2-Hemmer (z. B. Celecoxib), ACE-Hemmer [z.B. Captopril, Enalapril, Ramipril, Lisinopril), Angiotensin-II-Rezeptorantagonisten (z.B. Losartan, Candesartan, Valsartan, Telmisartan, Irbesartan), Steroide:
Erhöhung des Lithium-Serumspiegels kann zur Lithiumtoxizität führen.
Tetrazykline
Sowohl Erhöhung als auch Erniedrigung des Lithium-Serumspiegels wurden beschrieben.
Ca-Antagonisten (z.B. Diltiazem, Verapamil)
Erhöhung der Lithiumtoxizität. Der Lithiumspiegel sollte deshalb im unteren therapeutischen Bereich liegen.
Vorsicht ist geboten bei der gleichzeitigen Applikation mit Substanzen, die das QT Intervall verlängern, z. B. Antiarrhythmika Klasse IA (Chinidin, Disopyramid) oder Klasse III (Amiodaron, Sotalol), Cisaprid, Antibiotika wie Erythromycin, Antipsychotika wie beispielsweise Thioridazin oder Amisulprid.
Folgende Substanzen können in der Kombinationstherapie mit Lithium das Risiko einer Neurotoxizität erhöhen:
Calciumkanalantagonisten, Antipsychotika, Carbamazepin, Methyldopa, Triptanderi-vate, selektive Serotonin-Wiederaufnahmehemmer. Symptome der Neurotoxizität können wie folgt sein:
Ataxie, Tremor, erhöhter Muskeltonus, unfreiwillige Muskelzuckungen, Hyperreflexie, Artikulationsstörungen, Verwirrtheit, Somnolenz und Nystagmus.
Folgende Substanzen können in der Kombinationstherapie mit Lithium das Risiko von Krampfanfällen erhöhen:
Antidepressiva wie selektive Serotonin-Wiederaufnahmehemmer, trizyklische Antidepressiva, Antipsychotika, Anästhetika, Theophyllin.
4.6 Fertilität, Schwangerschaft und Stillzeit Schwangerschaft
Lithium Apogepha® sollte während der Schwangerschaft nicht angewendet werden, vor allem während des 1. Trimesters, es sei denn, die Weiterbehandlung wird für dringend erforderlich gehalten. Ein erhöhtes Fehlbildungs- und Komplikationsrisiko durch Lithium kann nicht ausgeschlossen werden. Es wurde über kardiale, v. a. EbsteinAnomalie, und andere Fehlbildungen berichtet. Vor Beginn der Behandlung mit Lithium Apogepha® ist das Bestehen einer Schwangerschaft auszuschließen, während der Behandlung ist eine sichere Empfängnisverhütung zu gewährleisten. Wenn dennoch eine Schwangerschaft eingetreten ist, kann die Behandlung mit Lithium dann fortgeführt werden, wenn es für die Patientin unbedingt erforderlich erscheint. Eine sorgfältige Dosisanpassung muss durch den Arzt vorgenommen werden und die Serumkonzentrationen von Lithium, die im Tagesverlauf auf gleichbleibend niedrigem Niveau liegen sollen, müssen engmaschig kontrolliert werden. In der Woche vor der Geburt soll die Dosis um 30-50 % reduziert und bei Beginn der Wehentätigkeit vollständig abgesetzt werden, um eine Erhöhung des Lithiumspiegels aufgrund der geburtsbedingten Veränderungen im Wasser- und Elektrolythaushalt zu vermeiden. Nach der Geburt kann das ursprüngliche Therapieregime mit Lithium Apogepha® fortgesetzt werden.
Nach einer Behandlung im 1. Trimenon wird eine sonographische Feindiagnostik und fetale Echokardiographie empfohlen.
Neugeborene können Zeichen einer Lithium-Intoxikation zeigen, wie Lethargie, schlaffer Muskeltonus oder Hypotonie. Eine sorgfältige Überwachung des Neugeborenen nach Lithium-Exposition in der Schwangerschaft ist erforderlich, und Lithium-Spiegel müssen, wenn notwendig, genau überwacht werden. Darüber hinaus ist eine Hypothyreose auszuschließen.
Tierexperimentelle Studien haben eine Reproduktionstoxizität gezeigt (siehe Abschnitt 5.3).
Stillzeit
Lithium geht in die Muttermilch über. Die Vorteile einer Behandlung der Mutter während der Stillzeit sollten sorgfältig gegen die Risiken für das Kind abgewogen werden. Bei Einnahme von Lithium Apogepha® nach der Geburt soll die Muttermilch in den ersten 2 Lebenswochen abgepumpt und verworfen werden.
Beim Säugling ist auf Vergiftungssymptome wie Hypotonie, Zyanose, Lethargie und EKG-Veränderungen zu achten, die Serumkonzentration von Lithium ist zu kontrollieren und die Dehydratation ist unbedingt zu vermeiden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Dieses Arzneimittel kann auch bei bestimmungsgemäßem Gebrauch das Reaktionsvermögen soweit verändern, dass die Fähigkeit zur aktiven Teilnahme am Straßenverkehr, zum Bedienen von Maschinen oder beim Arbeiten ohne sicheren Halt beeinträchtigt wird. Dies gilt in verstärktem Maße im Zusammenwirken mit Alkohol.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Sehr selten (< 1/10.000)
Häufigkeit nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Die Häufigkeit des Auftretens und die Intensität der Nebenwirkungen korrelieren im Allgemeinen mit dem Lithium-Serumspiegel und der individuellen Empfindlichkeit des Patienten auf Lithium.
Vorwiegend zu Beginn der Behandlung kann es zu den folgenden unerwünschten Wirkungen kommen, die aber meist mit der Fortdauer der Behandlung oder nach Verringerung der Dosis abklingen:
Stoffwechsel- und Ernährungsstörungen Häufigkeit nicht bekannt: Polydipsie
Erkrankungen des Nervensystems
Häufigkeit nicht bekannt: Muskelschwäche sowie feinschlägiger Tremor der Hände
Erkrankungen des Gastrointestinaltrakts Häufigkeit nicht bekannt: Übelkeit, Brechreiz, Durchfall
Erkrankungen der Nieren und Harnwege Häufigkeit nicht bekannt: Polyurie
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufigkeit nicht bekannt: allgemeines Unwohlsein, Schwindel
Diese unerwünschten Wirkungen klingen meist mit Fortdauer der Behandlung oder nach Verringerung der Dosis ab. Feinschlägiger Tremor der Hände, Polyurie und Polydipsie können persistieren.
Bei therapeutischem Serumlithiumspiegel können Symptome in folgenden Organsystemen auftreten:
Erkrankungen des Blutes und des Lymphsystems Häufigkeit nicht bekannt: Leukozytose
Endokrine Erkrankungen Selten: Hyperthyreosen
Häufigkeit nicht bekannt: Euthyreote Struma, Hypothyreosen, Hyperparathyreoidismus
Stoffwechsel- und Ernährungsstörungen
Häufig: Insbesondere in den ersten zwei Jahren der Behandlung ist häufig eine Gewichtszunahme, z.T. dosisabhängig, zu beobachten (Dem Patienten sollte geraten werden, den Genuss kalorienreicher Speisen und Getränke zu vermeiden).
Häufigkeit nicht bekannt: Anorexie, Hyperglykämie, Hyperkalzämie, Hypermagnesiä-mie
Psychiatrische Erkrankungen
Häufigkeit nicht bekannt: Halluzinationen, Verwirrung
Erkrankungen des Nervensystems
Selten: Eine Myasthenia gravis ist selten beobachtet worden.
Häufigkeit nicht bekannt: Tremor, v. a. feinschlägiger Tremor der Hände, Faszikulatio-nen, unwillkürliche Bewegungen der Extremitäten, Ataxie, choreoathetotische Bewegungen, periphere Neuropathie, hyperaktive Sehnenreflexe, extrapyramidalmotorische Symptome, Myoklonus, Synkopen, Krampfanfälle, verwaschene Sprache, Koordinationsstörungen, Kopfschmerzen, Schwindel, Benommenheit, Somnolenz, Gedächtnisverlust, Stupor, Koma, Geschmacksstörungen, Nystagmus, Gesichtsfeldausfälle, benigne intrakranialeHypertension (Pseudotumor cerebri)
Augenerkrankungen
Häufigkeit nicht bekannt: Verschwommenes Sehen Herzerkrankungen
Selten: Arrhythmien (meist Bradykardie, Sinusknotendysfunktion), EKG-Veränderungen (z.B. reversible Kurvenabflachung und T-Wellenumkehr, QT-Verlängerungen), Kardiomyopathien, AV-Block. Mögliche Demaskierung des Brugada-Syndroms.
In Einzelfällen mit tödlichem Verlauf Gefäßerkrankungen
Häufigkeit nicht bekannt: Hypotonie, Raynaud-Syndrom, Kreislaufversagen Erkrankungen des Gastrointestinaltrakts
Häufigkeit nicht bekannt: Übelkeit, Erbrechen, Durchfall, Gastritis, Mundtrockenheit sowie exzessive Speichelproduktion.
Erkrankungen der Haut und des Unterhautzellgewebes
Sehr selten: Alopezie, Akne oder akneiforme Dermatosen, Follikulitiden, Pruritus, Auftreten oder Exazerbationen von Psoriasis, Quincke-Ödem, Hautausschläge, Hautgeschwüre oder andere Zeichen von Überempfindlichkeit
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen Häufigkeit nicht bekannt: Muskelschwäche, Myalgie, Arthralgie
Erkrankungen der Nieren und Harnwege Sehr selten: nephrotisches Syndrom
Häufigkeit nicht bekannt: Initial Natrium- und Kaliumverlust durch verminderte Natrium-und Kaliumreabsorption an den renalen Tubuli. Innerhalb einer Woche sollte die Na-K-Konzentration auf Ausgangsniveau zurückkehren. Symptome eines nephrogenen Diabetes insipidus (siehe Abschnitt 4.4) sowie Harninkontinenz, normalerweise reversibel beim Absetzen von Lithium. Nach langjähriger Behandlung beobachtete morphologische Nierenveränderungen (z.B. interstitielle Fibrosen, renale Zysten, tubulointerstitiel-le Nephropathie) sind in der Regel unspezifisch, eine Langzeitbehandlung kann zu einer Einschränkung der Nierenfunktion und zu chronischem Nierenversagen führen. Mikrozysten, Onkozytome und Ductus Bellini-Karzinome der Niere (bei Langzeitbehandlung) (siehe Abschnitt 4.4).
Erkrankungen der Geschlechtsorgane und der Brustdrüse Häufigkeit nicht bekannt: Impotenz/sexuelle Dysfunktion
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort Häufigkeit nicht bekannt: Ödeme, periphere Ödeme, allgemeines Unwohlsein
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz,
Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn
Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Symptome einer Überdosierung
Die Lithiumtoxizität korreliert mit dem Serumlithiumspiegel. Im Allgemeinen treten Intoxikationen bei Serumlithiumspiegeln ab 1,5 mmol/l, verstärkt bei über 2,0 mmol/l auf, können aber bei empfindlichen Patienten bereits bei normalen oder bei geringen Erhöhungen des Serumlithiumspiegels auftreten. Auch bei Patienten unter chronischer Lithiumtherapie können bereits normale Serumlithiumspiegel, geringfügige Erhöhungen des Serumlithiumspiegels oder eine geringe Überdosierung zu schwerwiegenden Intoxikationen führen, da in diesem Fall das extravaskuläre Gewebe bereits mit Lithium gesättigt ist. Die Symptome können mit einer Verzögerung auftreten. In voller Ausprägung können die Symptome auch erst nach 24 Stunden auftreten, dies gilt vor allem bei Patienten, die keine Lithium-Langzeittherapie erhalten.
Bei den ersten Anzeichen einer Intoxikation sollte Lithium abgesetzt werden. Warn- und Initialsymptome einer Lithiumvergiftung können sein:
Polyurie, Polydipsie, zunehmende Appetitlosigkeit, Durchfall, Erbrechen, Dehydratation, Elektrolytstörungen, Muskelschwäche, erhöhter Muskeltonus, unfreiwillige Muskelzuckungen, periphere Neuropathie, verminderte oder fehlende Sehnenreflexe, Myoklonus, Müdigkeit, Koordinations-, Konzentrations- und Artikulationsstörungen, Verwirrtheit, Somnolenz, Schwindel, Nystagmus, Tremor, Hyperreflexie, EKG-Veränderungen (abgeflachte oder negative T-Wellen, QT-Verlängerung). Zu Bedingungen, die die renale Clearance von Lithium reduzieren können und eine Intoxikation begünstigen, siehe Abschnitte 4.4 und 5.2.
Bei höheren Serumlithiumspiegeln:
Tinnitus, verschwommenes Sehen, Ataxie, Apathie, eventuell kardiovaskuläre Ereignisse (Herzrhythmusstörungen, Kreislaufkollaps, AV-Block), renale Störungen (in seltenen Fällen ein akutes Nierenversagen). In besonders schweren Fällen (mehr als 2 -3 mmol/l Blut) kann es zu einer großen Ausscheidung von verdünntem Urin und renaler Insuffizienz mit zunehmender Verwirrtheit, zu Krämpfen, zum zerebralen Anfall, zum Koma und zum tödlichen Ausgang kommen.
Therapie von Intoxikationen
Es gibt kein Antidot. Eine stationäre Behandlung ist erforderlich. Eine supportive und symptomatische Behandlung sollte eingeleitet werden. Korrektur der Elektrolytbilanz und Flüssigkeitsersatz sind vordringlich. Regelmäßige Kontrollen der Lithiumkonzentration, z.B. im Abstand von 6 Stunden, sind von großer Bedeutung. Der Serumlithiumspiegel sollte nach 6 Stunden um ca. 20% und nach 24 Stunden auf die Hälfte abfallen. Neben EEG und EKG-Kontrollen sowie einer Infektionsprophylaxe sind Nierenfunktion sowie Flüssigkeits- und Elektrolytzufuhr (Na+-Infusion!) zu überwachen (Gabe von Saluretika vermeiden!).
In kritischen Fällen (falls der Lithium-Serumspiegel nicht rasch genug abfällt (z. B. durch Ausscheidungsstörungen), der Allgemeinzustand des Patienten schlecht ist, v. a. bei Patienten mit schwerwiegenden Störungen des Nervensystems oder einge-
10 von 13
schränkter Nierenfunktion und/oder der Lithium-Serumspiegel bei 3mmol/l oder höher liegt) empfiehlt sich eine Hämodialyse (doppelt so wirksam wie Peritonealdialyse) oder, wenn keine Möglichkeit dazu besteht, eine Peritonealdialyse. Da Lithium aus dem Gewebe nur langsam freigesetzt wird, sollte einige Tage symptomatisch behandelt werden. Die Dialyse wird bis zur vollständigen Elimination von Lithium aus dem Serum oder der Dialyseflüssigkeit fortgeführt. Engmaschige Kontrollen des LithiumSerumspiegels für mindestens eine weitere Woche sind erforderlich, um eine verzögerte Freisetzung von Lithium aus dem Gewebe zu erfassen.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Lithiumsalz, Psychopharmakon ATC- Code: N05AN01
Der Wirkungsmechanismus von Lithium ist noch nicht genau bekannt. Die enge Verwandtschaft von Lithium mit Natrium und Kalium ist möglicherweise für eine Reihe von pharmakologischen Wirkungen verantwortlich. Lithium wird überwiegend intrazellulär angereichert. Dadurch werden elektrophysiologische Eigenschaften von Neuronen und Membranen verändert.
Die Pathogenese der manisch-depressiven Erkrankung ist noch nicht geklärt. Veränderungen im Transmittermechanismus des ZNS, regulierende Funktion an den Membranen der Nervenzellen und auch Beeinflussung des Noradrenalin- bzw. Serotoninstoffwechsels über Konkurrenz an Bindungsstellen und Ionenkanäle von Na+, K+, Ca++ und Mg++ werden diskutiert. Im Tierversuch bewirkt Lithium eine Erregbarkeitsdämpfung.
5.2 Pharmakokinetische Eigenschaften
Resorption
Lithiumcarbonat wird nach oraler Aufnahme schnell und nahezu vollständig resorbiert. Verteilung
Lithium bindet nicht an Plasmaproteine. Die Verteilung in den Körperflüssigkeiten ist nicht uniform. Es erfolgt keine schnelle Passage der Blut-Hirn-Schranke.
Metabolismus / Elimination
Lithium passiert den Körper unverändert. Es wird hauptsächlich über die Nieren ausgeschieden. Die renale Lithiumclearance kann bei interkurrenten Infektionen, Erbrechen, Durchfall, Flüssigkeitsmangel und Medikamenten (siehe 4.5) reduziert sein und dadurch eine Intoxikation hervorrufen. Die Eliminationshalbwertzeit beträgt durchschnittlich 24 Stunden, beim älteren Menschen 30 bis 36 und beim Jugendlichen etwa 18 Stunden.
Ein therapeutischer Serumspiegel wird nach 4 - 7 Tagen erreicht. Bei Neueinstellungen oder Dosisänderungen sollten nach etwa einer Woche die ersten Bestimmungen der Serumlithiumspiegel vorgenommen werden.
5.3 Präklinische Daten zur Sicherheit
Lithium besitzt nur eine geringe therapeutische Breite. Die ersten Symptome einer Intoxikation treten meist schon bei Serumkonzentrationen von über 1,5 bis 2,0 mmol/l auf. Untersuchungen der subchronischen und chronischen Toxizität am Versuchstier ergaben Funktionsstörungen und Vergrößerungen der Schilddrüse sowie Schädigungen der Niere und des ZNS.
Studien am Tier ergaben Hinweise auf ein reproduktionstoxikologisches und teratoge-nes Potential von Lithium. Bei Ratten, Mäusen und Schweinen wurden mehr intrauterine Resorptionen, kleinere Würfe und postpartal weniger überlebende Neugeborene beobachtet, bei Ratten und Mäusen traten außerdem Knochenmissbildungen auf.
Untersuchungen in vitro und in Versuchstieren zeigten, dass Lithiumverbindungen in einem sehr hohen, zytotoxischen Dosisbereich Chromosomenmutationen induzieren können. Unter klinischen Expositionsbedingungen ist das Auftreten solcher Effekte unwahrscheinlich. Zum karzinogenen Potential von Lithium liegen keine gesicherten Daten vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Cellulosepulver, Magnesiumstearat (Ph.Eur.), Maisstärke, Mikrokristalline Cellulose, Carboxymethylstärke-Natrium (Typ a) (Ph.Eur.); Polyvinylalkohol
®
Lithium Apogepha ist gluten- und lactosefrei.
6.2 Inkompatibilitäten Nicht zutreffend.
6.3 Dauer der Haltbarkeit
Haltbarkeit im Tablettengläschen: 5 Jahre
Haltbarkeit in der PVC/PCTFE-Blisterverpackung: 3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Das Tablettenbehältnis fest verschlossen halten, um den Inhalt vor Feuchtigkeit zu schützen.
In der Originalverpackung aufbewahren, um den Inhalt vor Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Packung mit 50 (N2) Tabletten.
Packung mit 100 (N3) Tabletten.
Lithium Apogepha® im Tablettengläschen hat einen kindersicheren Verschluss, der nach Verschieben des Riegels in Pfeilrichtung und Anheben leicht zu öffnen ist.
Kindergesicherte Verpackung.
Aufgrund der kindersicheren, festeren Folie ist die Entnahme der Tabletten erschwert. Bei zentralem Druck kann die Tablette zerbrechen.
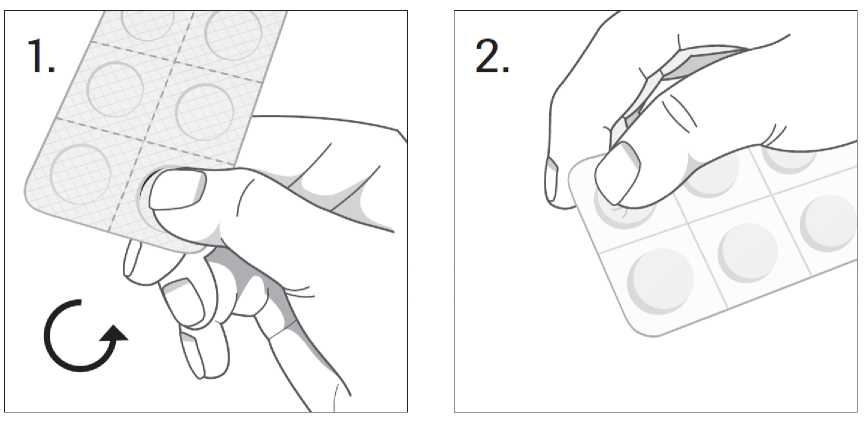
Zur Entnahme der Tablette bitte die Folie mit dem Fingernagel jeweils am Rand der runden Näpfchen eindrücken (1). Dann kann die Tablette mit leichtem Druck aus der umgedrehten Verpackung gedrückt werden (2).
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine speziellen Hinweise.
7. Inhaber der Zulassung
APOGEPHA Arzneimittel GmbH
Kyffhäuserstr. 27
01309 Dresden
Telefon: 0351 3363-3
Telefax: 0351 3363-440
8. Zulassungsnummer
3000569.00.00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
20.07.2004
10. Stand der Information
September 2016
11. Verkaufsabgrenzung
Verschreibungspflichtig
13 von 13