Magnesiocard I.v.
Fachinformation
1. Bezeichnung der Arzneimittel
Magnesiocard® i.v.
3 mmol Injektionslösung i.v. Magnesiocard® i.m.
2,5 mmol Injektionslösung i.m.
2. Qualitative und quantitative Zusammensetzung
Wirkstoff: Magnesiumaspartat-hydrochlorid 3H2O
Magnesiocard® i.v.
1 Ampulle zu 10 ml enthält:
Magnesiumaspartat-hydrochlorid 3H2O 737,6 mg (entsprechend 3 mmol = 72,9 mg Magnesium)
Magnesiocard® i.m.
1 Ampulle zu 5 ml enthält:
Magnesiumaspartat-hydrochlorid 3H2O 614,8 mg (entsprechend 2,5 mmol = 60,8 mg Magnesium)
Sonstige Bestandteile:
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Injektionslösung
4. Klinische Angaben
Anwendungsgebiete
4.1
Nachgewiesener Magnesiummangel, wenn er Ursache für Störungen der Muskeltätigkeit (neuromuskuläre Störungen, Wadenkrämpfe) ist und eine orale Therapie nicht möglich ist.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung Magnesiocard® i.v.
1 Ampulle zu 10 ml wird in 1- bis 2tägigem Abstand langsam intravenös injiziert. Die intravenöse Injektion muss sehr langsam am liegenden Patienten (die ersten 3 ml in 3 Minuten) erfolgen. Es empfiehlt sich, die Patienten nach der Injektion noch 10-20 Minuten ruhen zu lassen.
Es können gelegentlich Sensationen auftreten, wie sie von der Calcium-Injektion bekannt sind.
Magnesiocard® i.m.
1 Ampulle zu 5 ml wird in 1- bis 2tägigem Abstand tief intramuskulär injiziert.
Eine i.v. Injektion der i.m. Ampullejst unbedingt zu vermeiden, da dabei in verstärktem Maße Sensationen auftreten können, wie sie von der intravenösen Calcium-Injektion bekannt sind.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
AV-Block oder sonstige kardiale Überleitungsstörungen, schwere Niereninsuffizienz, Anu-rie, Exsikkose, Myasthenia gravis, Infektsteindiathese (Calcium-MagnesiumAmmoniumphosphatsteine).
Vorsichtige Dosierung ist erforderlich bei Patienten mit renaler Funktionseinschränkung. Der Serum-Magnesiumspiegel dieser Patienten ist zu überwachen.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Warnhinweise
Keine.
Vorsichtsmaßnahmen für die Anwendung
Starke Müdigkeitserscheinungen nach hochdosierter Gabe von Magnesiocard® i.v. / -i.m. können darauf hinweisen, dass bereits ein überhöhter Magnesium-Serum-Spiegel erreicht ist. In diesem Fall ist die Dosis zu verringern bzw. die Medikation vorübergehend abzusetzen.
Bei hochdosierter parenteraler Magnesiumtherapie muss Folgendes geprüft werden:
• Die Patellarsehnenreflexe müssen erhalten sein.
• Die Atemfrequenz darf 16 Atemzüge pro Minute nicht unterschreiten.
• Die Urinausscheidung soll mindestens 25 ml pro Stunde betragen. Ist sie geringer, besteht die Gefahr der Hypermagnesiämie.
• Als Antidot müssen Ampullen Calciumgluconat 10% bereit gehalten werden.
• Sollte bei lebensbedrohlichen Zuständen das Antidot nicht ausreichend sein, sind intensivmedizinische Maßnahmen zu ergreifen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Eine gleichzeitige intravenöse Injektion von Calcium mit Magnesiocard® i.v. / -i.m. sollte vermieden werden, da dadurch die Magnesiumwirkung vermindert wird.
Muskelrelaxantien vom Curaretyp verstärken die Magnesiumwirkung. Die gleichzeitige Gabe von Aminoglycosid-Antibiotika sollte vermieden werden. Magnesiocard® i.v. / -i.m. sollte nicht gleichzeitig mit Barbituraten, Narkotika oder Hypnotika, wegen des Risikos der Atemdepression, gegeben werden.
Eine Anwendung von Magnesiocard® i.v. / -i.m. bei gleichzeitiger Herzglycosid-Behandlung kann die Herzglycosid-Wirkung vermindern.
4.6 Schwangerschaft und Stillzeit
Für Magnesium liegen keine Hinweise auf ein Fehlbildungsrisiko vor. Magnesiocard® i.v. / -i.m. kann in der Schwangerschaft und Stillzeit angewendet werden. Wird Magnesium parenteral hochdosiert kurz vor der Geburt verabreicht, sollte das Neugeborene während der ersten 24 - 48 Lebensstunden auf Anzeichen von Toxizität (neurologische Depression mit Atemdepression, Muskelschwäche, Verlust von Reflexen) überwacht werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Magnesiocard® i.v. und Magnesiocard® i.m. haben bei bestimmungsgemäßem Gebrauch keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1000 bis < 1/100)
Selten (> 1/10000 bis < 1/1000)
Sehr selten (<1/10000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Sehr selten Bradykardie, Überleitungsstörungen und periphere Gefäßerweiterungen.
Bei intravenöser Applikation von Magnesiocard® i.v. kann ein Wärmegefühl und Flush auftreten. Eine zu schnelle Injektion von Magnesiocard® i.v. kann zu Übelkeit, Erbrechen, Kopfschmerzen, Kribbeln, Schwitzen, vereinzelt starkem Schwindelgefühl, Mundtrockenheit, Agitiertheit, Erregung und Tremor führen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
a) Symptome der Intoxikation
Bei schwerer Niereninsuffizienz mit Anurie kann es zur Kumulation von Magnesium und zu Intoxikationserscheinungen kommen.
Pharmakologische und toxische Effekte erhöhter Magnesium-Plasmaspiegel:
|
Mg-Plasma-Konzentration mmol/l |
Symptone und unerwünschte Wirkungen |
|
> 1,5 |
Blutdruckabfall, Brechreiz, Erbrechen |
|
> 2,5 |
ZNS-Depressionen |
|
> 3,5 |
Hyporeflexie, EKG-Veränderungen |
|
> 5,0 |
Beginnende Atemdepression |
|
> 5,5 |
Koma |
|
> 7,0 |
Herzstillstand, Atemlähmung |
b) Therapie von Intoxikationen Calcium-Injektion i.v.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mineralstoffpräparate ATC-Code: A12CC
Magnesium ist für über 300 Enzymreaktionen innerhalb des Kohlenhydrat-, Lipid-, Nukleinsäure- und Proteinstoffwechsel sowie für energieerzeugende und energieverbrauchende Reaktionen, für die Regulation der Membranpermeabilität und die neuromuskuläre Erregbarkeit von Bedeutung.
5.2 Pharmakokinetische Eigenschaften
Die Normalwerte der Serum-Magnesium-Konzentration liegen im Bereich von 0,75 bis
1,1 mmol/l.
Magnesium wird aktiv über die Zellmembran nach den Gesetzen der Michaelis-Menten-Kinetik in die Zelle aufgenommen. Influx und Efflux sind gekoppelt und werden bestimmt durch ein energieabhängiges Transportsystem.
Die Verteilung des Magnesiums im Organismus ist wie folgt:
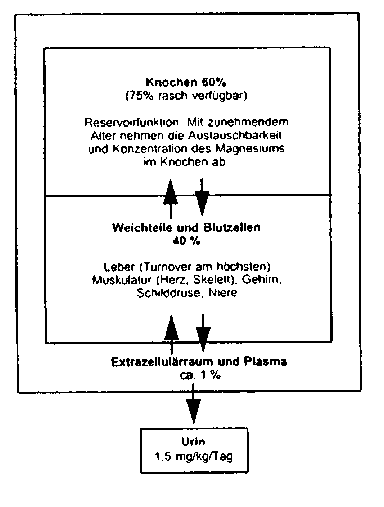
Blut-Liquor-Schranke
Magnesium wird entgegen einem elektrochemischen Gradienten durch ein Carriersystem über die Liquorschranke befördert. Die Liquor-Magnesium-Konzentration wird innerhalb sehr enger Grenzen aufrechterhalten und durch das aktive Magnesium-Transport-System reguliert.
Plazentaschranke
Für Magnesium besteht ein aktives Transportsystem, das die Passage über die Plazentaschranke reguliert. Die fetale Plasma-Magnesium-Konzentration ist höher als die maternale Magnesium-Konzentration. Der Transportprozess erfolgt gegen einen Konzentrationsgradienten.
Muttermilch
Die Magnesiumkonzentration der Muttermilch präeklamptischer Patientinnen nach MgSO4-Infusionen ist in den ersten 24 Stunden post partum signifikant erhöht. Es besteht eine direkte Korrelation zwischen Serum-Magnesium und Magnesium-Konzentration der Muttermilch.
Metabolismus
Magnesiumaspartat-hydrochlorid wird durch Enzyme in Mg2+, Asparaginsäure und Cl- gespalten. Die Asparaginsäure wird zu Oxalacetat abgebaut, das in den Zitronensäurezyklus eingeht.
Elimination
Resorbiertes Mg2+ wird innerhalb von 36 Stunden über die Nieren ausgeschieden.
5.3 Toxikologische Eigenschaften
Außer den bereits an anderer Stelle der Fachinformation gemachten Angaben liegen keine weiteren sicherheitsrelevanten Informationen vor.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Wasser für Injektionszwecke.
6.2 Inkompatibilitäten
Keine.
6.3 Dauer der Haltbarkeit
Die Dauer der Haltbarkeit beträgt bei Magnesiocard® i.v. 5 Jahre und bei Magnesiocard® i.m. 3 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Vor Licht geschützt aufbewahren!
6.5 Art und Inhalt des Behältnisses
Magnesiocard® i.v.
5 Ampullen i.v. 10 ml 10 Ampullen i.v. 10 ml 20 Ampullen i.v. 10 ml
50 Ampullen i.v. 10 ml (Ampullen im Umkarton)
Magnesiocard® i.m.
5 Ampullen i.m. 5 ml 10 Ampullen i.m. 5 ml 20 Ampullen i.m. 5 ml 50 Ampullen i.m. 5 ml (Ampullen im Umkarton)
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Verla-Pharm Arzneimittel GmbH & Co. KG
Hauptstraße 98 D-82327 Tutzing
Postfach 1261 D-82324 Tutzing
Telefon: 08158/257-0 Telefax: 08158/257-254
8. Zulassungsnummern
Magnesiocard® i.v.: 6182768.00.00
Magnesiocard® i.m.: 6182768.01.00
9. Datum der Verlängerung der Zulassung
Magnesiocard® i.v.: 29.07.2002
Magnesiocard® i.m.: 29.08.2002
10. Stand der Information
10/2013
11. Verkaufsabgrenzung
Apothekenpflichtig (rezeptfrei)
Seite: 9 von 9