Magnesium Verla N Konzentrat
F a c h i n f o r m a t i o n
1. Bezeichnung der Arzneimittel
Magnesium Verla® N Dragees
1,65 mmol magensaftresistente Tabletten
Magnesium Verla® N Konzentrat
5 mmol Pulver zur Herstellung einer Lösung zum Einnehmen
2. Qualitative und quantitative Zusammensetzung
Wirkstoffe:
Magnesium Verla® N Dragees:
Magnesiumcitrat, Magnesiumbis(hydrogen-L-glutamat)
Magnesium Verla® N Konzentrat: Magnesiumbis(hydrogenaspartat)
Magnesium Verla® N Dragees:
1 magensaftresistente Tablette enthält:
205 mg 90 mg
Magnesiumcitrat 9 H2O (berechnet wasserfrei)
Magnesiumbis(hydrogen-L-glutamat) 4 H2O (berechnet wasserfrei)
Magnesiumgehalt: 1,65 mmol/3,3 mval/40 mg
Magnesium Verla® N Konzentrat:
1 Beutel mit 5 g Pulver zur Herstellung einer Lösung zum Einnehmen enthält:
Magnesiumbis(hydrogenaspartat)-Dihydrat 1442 mg (berechnet wasserfrei)
Magnesiumgehalt: 5 mmol/10 mval/121,5 mg
Sonstige Bestandteile:
Magnesium Verla® N Dragees enthalten Sucrose (Zucker) und Glucose (siehe Abschnitt 4.4).
Magnesium Verla® N Konzentrat enthält Lactose (im Aroma) und Sucrose (Zucker) (siehe Abschnitt 4.4).
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
Magnesium Verla® N Dragees:
Magensaftresistente Tabletten
Magnesium Verla® N Konzentrat:
Pulver zur Herstellung einer Lösung zum Einnehmen
4. Klinische Angaben 4.1 Anwendungsgebiete
Behandlung von therapiebedürftigen Magnesiummangelzuständen, die keiner parenteralen Substitution bedürfen.
(Nachgewiesener) Magnesiummangel, wenn er Ursache für Störungen der Muskeltätigkeit (neuromuskuläre Störungen, Wadenkrämpfe) ist.
4.2 Dosierung, Art und Dauer der Anwendung
Dosierung:
Die Dosierung richtet sich nach dem Grad des Magnesiumdefizits. Bei erniedrigtem Serum-MagnesiumSpiegel - chronischer Magnesiummangel - ist eine Therapie über 4 Wochen zu empfehlen. Allgemein gelten folgende Dosierungsrichtlinien:
Magnesium Verla® N Dragees
3mal täglich 1 - 3 magensaftresistente Tabletten.
Magnesium Verla® N Konzentrat
Erwachsene und ältere Kinder:
1 - 3mal täglich den Inhalt je eines Beutels zu 5 g. Kinder von 4-12 Jahren:
2mal täglich den Inhalt je eines Beutels zu 5 g.
Kinder bis zum 4. Lebensjahr:
1mal täglich den Inhalt eines Beutels zu 5 g.
Art der Anwendung:
Magnesium Verla® N Dragees:
Die magensaftresistenten Tabletten werden unzerkaut mit etwas Flüssigkeit eingenommen.
Magnesium Verla® N Konzentrat:
Der Inhalt eines Beutels wird in einem halben Glas Wasser, Tee oder Fruchtsaft verrührt und getrunken.
Magnesium Verla® N Dragees und Magnesium Verla® N Konzentrat sollten vor dem Essen eingenommen werden, da sich dadurch die Resorption verbessert.
Dauer der Anwendung:
Empfehlenswert ist eine Einnahme über 4 Wochen. Auch eine Dauertherapie (über Jahre) ist bei normaler Nierenfunktion unbedenklich, da überschüssiges Magnesium über die Niere ausgeschieden wird.
4.3 Gegenanzeigen
Überempfindlichkeit gegenüber dem Wirkstoff oder einen der sonstigen Bestandteile.
Schwere Niereninsuffizienz, Anurie, Exsikkose, Infektsteindiathese (Calcium-MagnesiumAmmoniumphosphatsteine).
Vorsichtige Dosierung ist erforderlich bei Patienten mit renaler Funktionseinschränkung. Gegebenenfalls muss geprüft werden, ob sich aus dem Elektrolytstatus eine Gegenanzeige ergibt.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Magnesium Verla® N Dragees enthalten eine geringe Menge an Sucrose (Zucker) und Glucose (insgesamt ca. 0,09 g verwertbare Kohlenhydrate pro magensaftresistente Tablette, entsprechend ca. 0,01 Broteinheiten (BE)). Patienten mit der seltenen hereditären FructoseIntoleranz, Glucose-Galactose-Malabsorption oder Saccharase-Isomaltase-Mangel sollten Magnesium Verla® N Dragees nicht einnehmen.
Magnesium Verla® N Konzentrat enthält pro Beutel ca. 3 g Sucrose (Zucker) und 0,002 g Lactose (insgesamt ca. 3 g verwertbare Kohlenhydrate, entsprechend ca. 0,25 Broteinheiten (BE)). Dies ist bei Patienten mit Diabetes mellitus zu berücksichtigen. Der häufige und dauernde Gebrauch von Magnesium Verla® N Konzentrat kann schädlich für die Zähne sein (Karies). Patienten mit der seltenen hereditären Fructose-Intoleranz, Glucose-Galactose-Malabsorption, Saccharase-Isomaltase-Mangel, Galactose-Intoleranz oder Lactase-Mangel sollten Magnesium Verla® N Konzentrat nicht einnehmen. Bei primärem, erworbenem Lactase-Mangel reicht die geringe Menge an Lactose in den
meisten Fällen nicht aus, um die spezifischen Symptome auszulösen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Magnesium-Präparate sollten 3-4 Stunden versetzt zu Tetrazyklinen, Eisen- oder Natriumfluoridpräparaten eingenommen werden, um eine gegenseitige Beeinträchtigung der Resorption zu vermeiden.
4.6 Schwangerschaft und Stillzeit
Für Magnesium liegen keine Hinweise auf ein Fehlbildungsrisiko vor. Magnesium Verla® N Dragees und Magnesium Verla® N Konzentrat können in der Schwangerschaft und Stillzeit angewendet werden.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Magnesium Verla® N Dragees und Magnesium Verla® N Konzentrat haben keinen Einfluss auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1000 bis <1/100)
Selten (>1/10000 bis <1/1000)
Sehr selten (<1/10000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Gelegentlich können weiche Stühle oder Durchfall auftreten. Sie können die Folge einer hochdosierten oralen Magnesium-Therapie sein. Bei Auftreten störender Durchfälle sollte die Tagesdosis reduziert werden.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses
des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz,
Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Symptome:
Bei der oralen Magnesium-Therapie und intakter Nierenfunktion treten auch bei Überdosierung keine Intoxikationserscheinungen auf. Es können allerdings Durchfälle auftreten, die sich durch Reduzierung der Tagesdosis beheben lassen. Eventuelle Müdigkeitserscheinungen können ein Hinweis darauf sein, dass eine erhöhte Magnesiumkonzentration im Blut erreicht ist.
Nur bei schwerer Niereninsuffizienz mit Anurie kann es sowohl bei der oralen als auch parenteralen Therapie zur Kumulation von Magnesium und zu Intoxikationserscheinungen kommen.
Pharmakologische und toxische Effekte erhöhter Magnesium-Plasmaspiegel:
Mg-Plasma-Konzentration Symptome und unerwünschte
|
mmol/l |
Wirkungen | |
|
> 1,5 |
Blutdruckabfall, Brechreiz, Erbrechen | |
|
> 2,5 |
ZNS-Depressionen | |
|
> 3,5 |
Hyporeflexie, EKG-Veränderungen | |
|
> 5,0 |
Beginnende Atemdepression | |
|
> 5,5 |
Koma | |
|
> 7,0 |
Herzstillstand, Atemlähmung | |
|
Notfallmaßnahmen, Calcium-Injektion |
Gegenmittel: i.v. | |
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Mineralstoffpräparate
ATC-Code: A12CC
Magnesium Verla® N Dragees: A12CC30
Magnesium Verla® N Konzentrat: A12CC05
Magnesium Verla®
- wirkt antitetanisch durch Herabsetzung der neuromuskulären Erregbarkeit der Nervenendplatten, beseitigt daher Wadenkrämpfe und tetanische Beschwerden,
- hat eine kontraktionshemmende und spasmolytische Wirkung auf den Tonus der glatten Muskulatur,
- kontrolliert die Elektrolytverschiebungen durch Regulation der Zellmembranpermeabilität und Aktivierung der Na-K-ATPase der Ionenpumpe (beteiligt an der Wiederherstellung des Ruhemembranpotentials),
- verhindert die adrenerge Überstimulation,
- spielt die entscheidende Rolle bei der Energiebereitstellung und -Übertragung, da es an allen ATP-abhängigen enzymatischen Reaktionen beteiligt ist,
- verhindert einen stressbedingten intrazellulären Magnesiummangel und eine Calcium-Akkumulation in der Zelle und damit eine permanente Überlastung des Organismus.
5.2 Pharmakokinetische Eigenschaften
Resorption:
Magnesium wird aus Magnesium Verla® N Dragees und Magnesium Verla® N Konzentrat zu etwa 50 % in den distalen Dünndarmabschnitten resorbiert. Bei Vorliegen eines Magnesiummangels kann der resorbierte Anteil höher sein. Die Normalwerte der Serum-Magnesium-Konzentration liegen im Bereich von 0,75 bis 1,1 mmol/l.
Anstieg des Serum-Magnesium-Spiegels bei 267 Patienten mit erniedrigtem Serum-Magnesium-Spiegel während der Behandlung mit 3x1 Beutel Magnesium Verla® Konzentrat oder 3x3 Dragees Magnesium Verla® täglich.
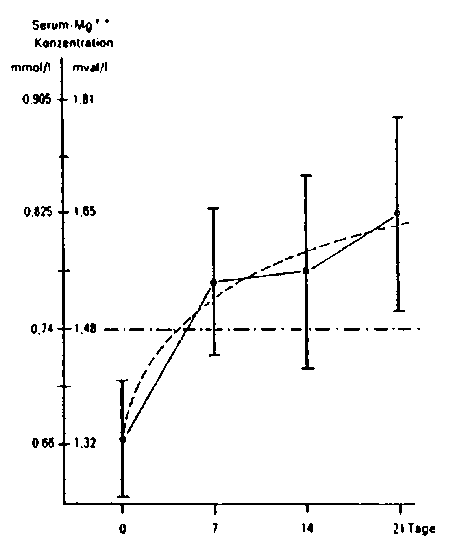
Verteilung in Organen und Geweben:
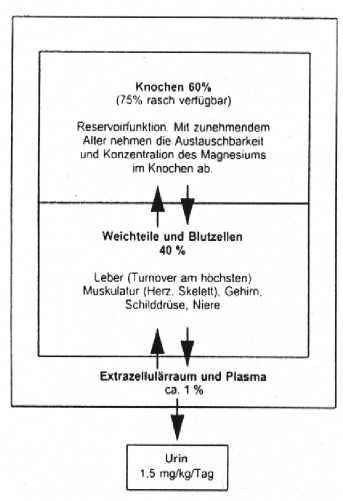
Magnesium wird aktiv über die Zellmembran nach den Gesetzen der Michaelis-Menten-Kinetik in die Zelle aufgenommen. Influx und Efflux sind gekoppelt und werden bestimmt durch ein energieabhängiges Transportsystem.
Die Verteilung des Magnesiums im Organismus ist wie folgt:
Blut-Liquor-Schranke:
Magnesium wird entgegen einem elektrochemischen Gradienten durch ein Carriersystem über die Liquorschranke befördert. Die Liquor-Magnesium-Konzentration wird innerhalb sehr enger Grenzen aufrechterhalten und durch das aktive MagnesiumTransport-System reguliert.
Plazentaschranke:
Für Magnesium besteht ein aktives Transportsystem, das die Passage über die Plazentaschranke reguliert. Die fetale Plasma-Magnesium-Konzentration ist höher als die maternale Magnesium-Konzentration. Der Transportprozess erfolgt gegen einen Konzentrationsgradienten.
Muttermilch:
Die Magnesiumkonzentration der Muttermilch
präeklamptischer Patientinnen nach MgSO4-Infusionen ist in den ersten 24 Stunden post partum signifikant erhöht. Es besteht eine direkte Korrelation zwischen Serum-Magnesium und Magnesium-Konzentration der Muttermilch.
5.3 Toxikologische Eigenschaften
Außer den bereits an anderer Stelle der Fachinformation gemachten Angaben liegen keine weiteren sicherheitsrelevanten Informationen vor.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Magnesium Verla® N Dragees:
Glycerol 85%, Povidon (K25), Sucrose, Macrogol 6000 und 35000, Methylacrylsäure-Ethylacrylat-Copolymer (1:1) (Ph.Eur.), Dimeticon (350 cSt), Triethylcitrat, Talkum, Calciumcarbonat, Kaliumdihydrogenphosphat, Vanillin, Glucose-Sirup, Montanglycolwachs, Titandioxid.
Magnesium Verla® N Konzentrat:
Riboflavin, Sucrose, Citronensäure, hochdisperses Siliciumdioxid, Saccharin-Natrium, Mandarinen-Aroma (enthält Lactose).
Magnesium Verla® N Dragees und -N Konzentrat enthalten kein Gluten, Magnesium Verla® N Dragees auch keine Lactose.
6.2 Inkompatibilitäten
Bisher keine bekannt.
Dauer der Haltbarkeit
6.3
Magnesium Verla® N Dragees:
Blister im Umkarton: Die Dauer der Haltbarkeit beträgt 5 Jahre.
Schüttdose:
Die Dauer der Haltbarkeit beträgt 48 Monate.
Nach dem ersten Öffnen der Dose beträgt die Dauer der Haltbarkeit 24 Monate.
Magnesium Verla® N Konzentrat:
Die Haltbarkeit beträgt 5 Jahre.
Nach Auflösen des Pulvers ist die trinkfertige Lösung 8 Stunden bei Raumtemperatur (20°C) haltbar.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Magnesium Verla® N Dragees:
Blister im Umkarton: Nicht über 30°C lagern! Schüttdose: Nicht über 25°C lagern!
Magnesium Verla® N Konzentrat:
Keine.
6.5 Art und Inhalt des Behältnisses
Magnesium Verla® N Dragees, magensaftresistente Tabletten; (Blister im Umkarton):
50 magensaftresistente Tabletten 100 magensaftresistente Tabletten 200 magensaftresistente Tabletten
1000 (20x50 / 10x100 / Schüttdose) magensaftresistente Tabletten
Magnesium Verla® N Konzentrat, Pulver zur Herstellung einer Lösung zum Einnehmen; (Beutel im Umkarton):
20 Beutel 50 Beutel 100 Beutel 500 Beutel
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Verla-Pharm Arzneimittel GmbH & Co. KG Hauptstraße 98 D-82327 Tutzing Postfach 1261 D-82324 Tutzing Telefon: (08158)257-0 Telefax: (08158)257-254 www.verla.de
8. Zulassungsnummer
Magnesium Verla® N Dragees: 6182716.00.00 Magnesium Verla® N Konzentrat: 6182739.00.00
9. Datum der Verlängerung der Zulassung
Magnesium Verla® N Dragees: 10.09.2002 Magnesium Verla® N Konzentrat: 08.07.2002
10. Stand der Information
10/2013
11. Verkaufsabgrenzung
Apothekenpflichtig
Seite 10 von 10