Magnevist 0,5 Mmol/Ml, Injektionslösung
Gebrauchsinformation: Information für Anwender
Magnevist® 0,5 mmol/ml, Injektionslösung
Gadopentetat-Dimeglumin
Zur Anwendung bei Säuglingen ab 4 Wochen, Kindern und Erwachsenen
Lesen Sie bitte die gesamte Packungsbeilage sorgfältig durch, bevor Ihnen dieses Arzneimittel verabreicht wird, denn sie enthält wichtige Informationen.
- Heben Sie bitte die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt (den Radiologen), der Ihnen Magnevist verabreicht oder an das medizinische Fachpersonal des Krankenhauses/MRT-Zentrums.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist Magnevist und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von Magnevist beachten?
3. Wie ist Magnevist anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist Magnevist aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist Magnevist und wofür wird es angewendet?
Magnevist enthält den Wirkstoff Gadopentetat-Dimeglumin, ein Kontrastmittel für die magnetische Resonanztomographie (MRT) von Gehirn, Wirbelsäule, Gefäßen und weiteren Körperregionen.
Dieses Arzneimittel ist ein Diagnostikum (nur für Untersuchungszwecke vorgesehen).
Nach intravenöser Injektion von Magnevist werden im Vergleich zu Aufnahmen ohne Kontrastmittel (Nativscan) bessere diagnostische Aussagen ermöglicht. Hirnareale mit gestörter oder fehlender BlutHirn-Schranke, Körperbereiche mit veränderter Durchblutung (Perfusion) und veränderten Extrazellulärräumen werden durch Magnevist kontrastreich dargestellt.
Magnevist wird angewendet bei:
Magnetischer Resonanztomographie des Kopfes und des Rückenmarkkanals (kraniale und spinale magnetische Resonanztomographie IMRTI)
Insbesondere zum Tumornachweis sowie zur weiteren differentialdiagnostischen Aufklärung bei Verdacht auf
- eine Geschwulst der Hirn- bzw. Rückenmarkshäute (Meningiom),
- eine Geschwulst des (Hör)Nerven ([Akustikus-]Neurinom),
- ins Gewebe (infiltrativ) hineinwuchernde Tumoren (z. B. Gliom) und Metastasen.
- Zum Nachweis kleiner und/oder vom gesunden Gewebe nicht unterscheidbarer (isointenser) Tumoren,
- bei Verdacht auf Wiederauftreten von Tumoren nach Operation oder Bestrahlungstherapie,
- zur differenzierten Darstellung seltener Geschwülste wie Hämangioblastome, Ependymome und kleiner Hypophysenadenome,
- zur verbesserten Bestimmung der Tumorausdehnung bei nicht hirneigenen Tumoren.
Zusätzlich bei der MRT des Rückenmarks
- Unterscheidung von Tumoren, die innerhalb (intramedullär) und außerhalb (extramedullär) des Rückenmarks liegen;
- Nachweis von nicht flüssigkeitsgefüllten (soliden) Tumoranteilen bei bekannter Rückenmarkszyste (Syrinx);
- Bestimmung der Tumorausdehnung im Rückenmark (intramedullär).
Ganzkörper-MRT
Insbesondere empfiehlt sich die Verwendung von Magnevist in der Tumordiagnostik
- zur besseren Unterscheidung von bösartigen und gutartigen Tumoren der weiblichen Brust,
- zur Unterscheidung zwischen Tumor- und Narbengewebe nach Therapie von Tumoren der weiblichen Brust,
- zur Unterscheidung zwischen Tumor- und Narbengewebe des aktiven und passiven Bewegungsapparates,
- zur Unterscheidung verschiedener Anteile von Knochentumoren (Tumorgewebe, Zerfallsgewebe und entzündliches Gewebe),
- zur Unterscheidung verschiedener Arten von Lebertumoren,
- zur Unterscheidung zwischen innerhalb und außerhalb der Niere gelegenen Tumoren,
- zur Bestimmung der Ausdehnung und Unterscheidung verschiedener Anteile von Tumoren der weiblichen Fortpflanzungsorgane (Adnexe).
Weiterhin empfiehlt sich die Verwendung von Magnevist bei folgenden speziellen Fragestellungen:
- zur Darstellung der Gefäße (Angiographie) im Ganzkörperbereich (außer Koronararterien), insbesondere zur Beurteilung bezüglich Stenosen, Verschlüssen sowie Kollateralen,
- zur Durchführung zielgenauer Gewebeentnahmen (Biopsien) bei Knochentumoren,
- zur Differenzierung zwischen erneutem Bandscheibenvorfall und Narbengewebe,
- zur Darstellung von akut geschädigtem Herzmuskelgewebe.
2. Was sollten Sie vor der Anwendung von Magnevist beachten?
Magnevist darf nicht angewendet werden,
- wenn Sie überempfindlich (allergisch) gegen Gadopentetat-Dimeglumin oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
Die Anwendung von Magnevist ist kontraindiziert bei Patienten mit schwerer Nierenfunktionsstörung (GFR < 30 ml/min/1,73m2) und/oder akuter Nierenschädigung, bei Patienten in der perioperativen Lebertransplantationsphase und bei Neugeborenen bis zu 4 Wochen.
Warnhinweise und Vorsichtsmaßnahmen
Bitte sprechen Sie mit Ihrem Arzt oder dem medizinischen Fachpersonal, bevor Ihnen Magnevist verabreicht wird.
Magnevist soll nicht direkt im Rückenmarkskanal (intrathekal) angewendet werden
- bei Überempfindlichkeit
Bei allen Kontrastmitteln zur intravenösen Anwendung, so auch bei Magnevist, können allergoide oder andere Überempfindlichkeitsreaktionen (sogenannte idiosynchratische Reaktionen) auftreten. Betroffen sein können die Haut, das Atmungssystem, das Herz-Kreislauf-System bis hin zum Schock (siehe auch Abschnitt 4.).
Die meisten dieser Reaktionen treten innerhalb einer halben Stunde nach Gabe des Kontrastmittels auf. Wie bei anderen Kontrastmitteln derselben Klasse auch, können in seltenen Fällen Spätreaktionen auftreten (nach Stunden oder Tagen).
Wie auch bei anderen diagnostischen Untersuchungen mit Kontrastmitteln wird nach der Untersuchung eine Beobachtung des Patienten empfohlen.
Das Risiko für Überempfindlichkeitsreaktionen ist in den folgenden Fällen erhöht:
- wenn Sie an einer Allergie (z. B. Heuschnupfen, Nesselausschlag) oder Asthma leiden oder jemals gelitten haben.
Vor der Injektion eines Kontrastmittels sollte deswegen der Patient über bestehende Allergien (z. B. Allergie gegen Meeresfrüchte, Heuschnupfen, Nesselsucht [Urtikaria]), Kontrastmittelüberempfindlichkeit und Bronchialasthma befragt werden und eine Vormedikation mit Antihistaminika und/oder Glukokortikoiden erwogen werden.
- wenn es bei Ihnen schon einmal zu einer Reaktion gegenüber Kontrastmitteln gekommen ist.
- wenn Sie an Bronchialasthma leiden.
In diesem Fall ist insbesondere das Risiko des Auftretens von Krämpfen der Bronchialmuskulatur (Bronchospasmen) erhöht.
- wenn Sie mit Betablockern behandelt werden.
In diesem Fall könnten Sie bei auftretenden Überempfindlichkeitsreaktionen auf die Behandlung mit Beta-Agonisten möglicherweise nicht ansprechen.
- wenn Sie an Erkrankungen des Herz-Kreislauf-Systems leiden.
In diesem Fall können Überempfindlichkeitsreaktionen besonders schwerwiegend sein. Auch Todesfälle wurden berichtet. Insbesondere bei ernsthaften Herzerkrankungen (z. B. schwerer Herzinsuffizienz und koronarer Herzkrankheit) können Kreislaufreaktionen verstärkt werden.
- wenn bei Ihnen Störungen des zentralen Nervensystems vorliegen.
Bei Patienten mit Epilepsie oder Hirnläsionen kann sich das Risiko von Krampfanfällen während der Untersuchung erhöhen, wie es selten im Zusammenhang mit der Magnevist-Anwendung beobachtet wurde.
Bei diesen Patienten sollten Vorsichtsmaßnahmen getroffen werden (z. B. genaue Beobachtung) und die erforderlichen Geräte und Medikamente sollten für den Fall eines Krampfanfalls bereitstehen.
Wenn Überempfindlichkeitsreaktionen auftreten (siehe auch Abschnitt 4.), ist die Zufuhr des Kontrastmittels sofort abzubrechen und - wenn notwendig - über einen venösen Zugang eine spezifische Therapie einzuleiten. Es empfiehlt sich, während der gesamten Röntgenuntersuchung eine flexible Verweilkanüle oder einen Katheter (für schnellen intravenösen Zugang) einzusetzen. Um im Notfall unverzüglich reagieren zu können, sollen entsprechende Medikamente und Instrumente für die Notfalltherapie (u. a. Trachealtubus und Beatmungsgerät) bereitgestellt sein.
Nierenfunktionsstörungen
Magnevist darf Ihnen nicht verabreicht werden, wenn Sie an schweren Nierenproblemen und/oder akuter Nierenschädigung leiden, oder wenn Sie ein Patient sind, der im Begriff ist, sich einer Lebertransplantation zu unterziehen oder sich vor kurzem einer Lebertransplantation unterzogen hat, da die Anwendung von Magnevist bei Patienten mit diesen Voraussetzungen mit einer Erkrankung, genannt nephrogene systemische Fibrose (NSF), in Verbindung gebracht wurde. NSF ist eine Erkrankung die eine Verdickung der Haut und des Bindegewebes zur Folge hat. NSF kann zu einer schweren eingeschränkten Beweglichkeit der Gelenke, Muskelschwäche führen oder kann die normale Funktion innerer Organe beeinträchtigen, was möglicherweise lebensbedrohlich sein kann.
Magnevist darf auch Neugeborenen bis zu 4 Wochen nicht verabreicht werden.
Sagen Sie Ihrem Arzt, wenn
- Ihre Nieren nicht richtig funktionieren und/oder Sie an akuter Nierenschädigung leiden
- Sie sich vor kurzem einer Lebertransplantation unterzogen haben, oder bald eine erwarten
Bevor Sie Magnevist erhalten, benötigen Sie eine Blutuntersuchung, um zu prüfen, wie gut Ihre Nieren arbeiten.
Magnevist darf bei Neugeborenen bis zu 4 Wochen nicht angewendet werden. Da die Nierenfunktion bei Säuglingen bis zu 1 Jahr noch unreif ist, wird Magnevist bei Säuglingen nur nach sorgfältiger Abwägung des Arztes angewendet werden.
Säuglinge ab 4 Wochen und Kleinkinder bis zu 2 Jahre
Bei Säuglingen ab 4 Wochen und Kleinkindern bis zu 2 Jahren verbietet sich der Einsatz eines automatischen Applikationssystems, um einer versehentlichen Überdosierung vorzubeugen. Die zu verabreichende Dosis ist bei dieser Patientengruppe per Hand zu verabreichen.
Anwendung von Magnevist zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder das medizinische Fachpersonal, wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden.
Aus der Anwendung von Kontrastmitteln ist bekannt, dass Überempfindlichkeitsreaktionen bei Patienten, die Betablocker erhalten, in verstärkter Form auftreten können (siehe auch Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“). Informieren Sie Ihren Arzt bitte ausdrücklich darüber, wenn Sie mit Betablockern behandelt werden.
Beeinflussung diagnostischer Untersuchungen
Die Serumeisenbestimmung mit komplexometrischen Methoden (z. B. Bathophenanthrolin) kann durch das in der Kontrastmittellösung enthaltene Pentetat-Pentameglumin bis zu 24 Stunden nach der Untersuchung mit Magnevist zu niedrig ausfallen.
Anwendung von Magnevist zusammen mit Nahrungsmitteln und Getränken
Zwei Stunden vor der Untersuchung sollten Sie nicht mehr essen, um Übelkeit und Erbrechen während der Untersuchung zu vermeiden.
Schwangerschaft und Stillzeit
Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder das medizinische Fachpersonal um Rat.
Schwangerschaft
Sagen Sie Ihrem Arzt, wenn Sie denken, dass Sie schwanger sind oder schwanger werden könnten, da Magnevist während der Schwangerschaft nicht angewendet werden darf, außer wenn dies unbedingt notwendig ist.
Stillzeit
Sagen Sie Ihrem Arzt, wenn Sie stillen oder kurz davor sind, mit dem Stillen zu beginnen. Das Stillen sollte für mindestens 24 Stunden unterbrochen werden, nachdem Sie Magnevist erhalten haben.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zu den Auswirkungen auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen durchgeführt.
Beachten Sie beim Führen von Fahrzeugen oder dem Bedienen von Maschinen bitte dennoch, dass gelegentlich Übelkeit oder niedriger Blutdruck auftreten können.
3. Wie ist Magnevist anzuwenden?
Magnevist wird von medizinischem Fachpersonal unmittelbar vor der MRT-Untersuchung direkt in eine Vene injiziert (intravenöse Anwendung).
Allgemeines
Die für eine magnetische Resonanztomographie (MRT) üblichen Sicherheitsregeln sind zu beachten, z. B. Ausschluss von Herzschrittmachern, ferromagnetischen Implantaten.
Zwischen 0,14 Tesla und 1,5 Tesla sind die Anwendungsempfehlungen unabhängig von der Feldstärke des Magneten.
Die für Sie geeignete Dosis richtet sich nach Ihrem Körpergewicht und der zu untersuchenden Körperregion (siehe auch Abschnitt „Dosierung“).
Die notwendige Dosis Magnevist wird ausschließlich intravenös appliziert, auch als Bolusinjektion. Unmittelbar danach kann die kontrastverstärkte MRT beginnen.
Die Kontrastmittelgabe ist möglichst am liegenden Patienten vorzunehmen, der nach Applikationsende überwacht werden sollte, da die Mehrzahl unerwünschter Reaktionen innerhalb von 30 Minuten auftritt.
Säuglinge ab 4 Wochen und Kleinkinder bis zu 2 Jahre
Um einer versehentlichen Überdosierung vorzubeugen, ist bei dieser Patientengruppe die zu verabreichende Dosis per Hand zu verabreichen (siehe auch Abschnitt „Warnhinweise und V orsichtsmaßnahmen“).
Ängstlichkeit
Ausgeprägte Erregungszustände, Unruhe und Schmerzen können das Risiko für unerwünschte Wirkungen erhöhen oder die Kontrastmittel-abhängigen Reaktionen verstärken. Diesen Patienten kann ein Beruhigungsmittel verabreicht werden.
Dosierung
Kraniale und spinale MRT
Für Erwachsene, Jugendliche und Kinder (Säuglinge ab 4 Wochen und Kleinkinder bis zu 2 Jahren) gelten folgende Dosierungsrichtlinien:
Im Allgemeinen ist die Gabe von 0,2 ml Magnevist je kg Körpergewicht ausreichend für eine gute Kontrastverstärkung und zur Beantwortung der klinischen Fragestellung.
Sollte trotz unauffälligen Befundes ein starker klinischer Verdacht auf einen Krankheitsherd weiterbestehen, so kann die nochmalige Gabe von 0,2 ml Magnevist/kg Körpergewicht, bei Erwachsenen sogar 0,4 ml Magnevist/kg Körpergewicht, innerhalb von 30 Minuten mit anschließender MRT die Aussagekraft der Untersuchung erhöhen.
Zum Ausschluss von Metastasen oder bei erneutem Auftreten von Tumoren bei Erwachsenen erhöht die Verabreichung von 0,6 ml Magnevist/kg Körpergewicht oft die diagnostische Sicherheit. Maximaldosis: 0,6 ml (Erwachsene) oder 0,4 ml (Kinder) Magnevist/kg Körpergewicht.
Für Neugeborene bis zu 4 Wochen und Säuglinge bis zu 1 Jahr siehe auch „Dosierung bei besonderen Patientengruppen“.
Ganzkörper-MRT
Für Erwachsene, Jugendliche und Kinder (Säuglinge ab 4 Wochen und Kleinkinder bis zu 2 Jahren) gelten die folgenden Dosierungsrichtlinien:
Im Allgemeinen ist die Gabe von 0,2 ml Magnevist je kg Körpergewicht ausreichend für eine gute Kontrastverstärkung und zur Beantwortung der klinischen Fragestellung.
Für die Anwendung in der Ganzkörper-MRT bei Kindern unter 2 Jahren liegen eingeschränkte Erfahrungen vor.
In besonderen Fällen, z. B. bei Läsionen mit geringer Durchblutung und/oder kleinem Extrazellulärraum, können insbesondere bei Anwendung von relativ schwach T 1-gewichteten
Aufnahmesequenzen zur ausreichenden Kontrastierung 0,4 ml Magnevist je kg Körpergewicht erforderlich sein.
Zum Ausschluss einer Läsion oder eines erneut auftretenden Tumors bei Erwachsenen kann die Verabreichung von 0,6 ml Magnevist/kg Körpergewicht die diagnostische Sicherheit erhöhen.
Für die Darstellung von Gefäßen kann bei Erwachsenen in Abhängigkeit der Untersuchungstechnik und der zu untersuchenden Region die Maximaldosis erforderlich sein.
Maximaldosis: 0,6 ml (Erwachsene) oder 0,4 ml (Kinder über 2 Jahre) Magnevist/kg Körpergewicht.
Für Neugeborene bis zu 4 Wochen und Säuglinge bis zu 1 Jahr siehe auch „Dosierung bei besonderen Patientengruppen“.
Dosierungsempfehlungen/Maximaldosierung
|
0,2 ml Magnevist/kg Körpergewicht (entspr. 0,1 mmol/kg Körpergewicht) |
Normaldosis bei Erwachsenen, Jugendlichen und Kindern (Alter über 4 Wochen bis 2 Jahre) für kraniale, spinale und Ganzkörper-MRTs |
|
0,4 ml Magnevist/kg Körpergewicht (entspr. 0,2 mmol/kg Körpergewicht) |
Bei schwierigen Fragestellungen Maximaldosis bei Kindern (Alter über 2 Jahren) |
|
0,6 ml Magnevist/kg Körpergewicht (entspr. 0,3 mmol/kg Körpergewicht) |
Maximaldosis bei Erwachsenen |
Dosierung bei besonderen Patientengruppen
Magnevist darf Ihnen nicht verabreicht werden, wenn Sie an schweren Nierenproblemen und/oder akuter Nierenschädigung leiden, oder wenn Sie ein Patient sind, der im Begriff ist, sich einer Lebertransplantation zu unterziehen oder sich vor kurzem einer Lebertransplantation unterzogen hat. Magnevist darf auch bei Neugeborenen bis zu 4 Wochen nicht angewendet werden.
Wenn Sie eine mittelgradig eingeschränkte Nierenfunktion haben, dürfen Sie nur eine Dosis von Magnevist während einer Aufnahme erhalten und Sie dürfen für mindestens 7 Tage keine zweite Injektion erhalten.
Da die Nierenfunktion bei Säuglingen bis zu 1 Jahr unreif ist, dürfen Säuglinge nur eine Dosis von Magnevist während einer Aufnahme erhalten und sie dürfen keine zweite Injektion für mindestens 7 Tage erhalten.
Es gibt keine Notwendigkeit, Ihre Dosis anzupassen, wenn Sie 65 Jahre oder älter sind, aber Sie werden eine Blutuntersuchung haben, um zu prüfen, wie gut Ihre Nieren arbeiten.
Wenn bei Ihnen eine größere Menge von Magnevist angewendet wurde, als vorgesehen
In der klinischen Anwendung wurden bisher keine Vergiftungsanzeichen nach einer Überdosierung beobachtet bzw. berichtet.
Dieses Arzneimittel wird Ihnen von medizinischem Fachpersonal verabreicht. Wenn Sie glauben, dass Sie zuviel von dem Arzneimittel erhalten haben, informieren Sie bitte umgehend Ihren Arzt oder die Krankenschwester. Sollte es zu einer Überdosierung gekommen sein, wird Ihr Arzt erwägen, Magnevist durch Hämodialyse aus dem Körper zu entfernen.
Eine Vergiftung durch versehentliche perorale Aufnahme des Kontrastmittels ist im Hinblick auf die äußerst geringe gastrointestinale Resorptionsrate (< 1%) von Magnevist äußerst unwahrscheinlich.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kriterien zugrunde gelegt
Sehr häufig: Kann mehr als 1 von 10 Behandelten betreffen
Häufig: Kann bis zu 1 von 10 Behandelten betreffen
Gelegentlich: Kann bis zu 1 von 100 Behandelten betreffen
Selten: Kann bis zu 1 von 1.000 Behandelten betreffen
Sehr selten: Kann bis zu 1 von 10.000 Behandelten betreffen
Nicht bekannt: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Bedeutsame Nebenwirkungen oder Zeichen, auf die Sie achten sollten
Die Nebenwirkungen, die im Zusammenhang mit der Anwendung von Magnevist auftreten, sind in der Regel leicht bis mittelschwer und vorübergehend. Es wurden aber auch schwerwiegende und lebensbedrohliche Reaktionen, auch Todesfälle, beobachtet.
Die am häufigsten beobachteten Reaktionen sind Übelkeit, Erbrechen, Kopfschmerzen, Schwindel und verschiedenartige Reaktionen an der Injektionsstelle (z. B. Schmerzen, Kältegefühl, Wärmegefühl).
In seltenen Fällen kann es zu allergieartigen Reaktionen einschließlich schwerwiegenden Reaktionen (Schock) kommen, die eine sofortige medizinische Intervention erfordern.
Spätreaktionen im Zusammenhang mit Kontrastmitteln sind selten berichtet worden (siehe auch Abschnitt „Warnhinweise und Vorsichtsmaßnahmen“).
Die Einschätzungen der Häufigkeitsangaben basieren sowohl auf Daten, die in klinischen Studien vor der Zulassung erhalten wurden, als auch auf Daten aus Spontanmeldungen nach der Zulassung. Basierend auf Erfahrungen aus der Anwendung bei mehr als 11.000 Patienten in klinischen Studien, wurden die in der nachstehenden Tabelle aufgeführten Nebenwirkungen als arzneimittelbedingt eingestuft.___
|
Systemorganklasse |
Gelegentlich |
Selten |
|
Erkrankungen des Blutes und des Lymphsystems |
vorübergehende Veränderungen der Serumeisen-§ und Serumbilirubinwerte§ | |
|
Erkrankungen des Immunsystems |
anaphylaktoide/allergoide Reaktionen§/Überempfindlichkeitsreaktionen §/anaphylaktoider Schock§ mit folgenden möglichen Beschwerden: leichte Hautschwellungen (Quinckeödem)§, Bindehautentzündung (Konjunktivitis)*, Husten*, Juckreiz (Pruritus)*, Schnupfen (Rhinitis), Niesen*, Nesselsucht (Urtikaria)*, Krämpfe der Bronchialmuskulatur (Bronchospasmus)§, Krämpfe der Kehlkopfmuskulatur (Laryngospasmus)§, Schwellung des Kehlkopfs oder des Rachens (Larynx-§ oder Pharynxödem§), niedriger Blutdruck (Hypotonie)§, Schock§ | |
|
Erkrankungen des Nervensystems |
Schwindelgefühle*, Kopfschmerzen* |
Unruhe (Agitiertheit), Desorientierung*, Verwirrtheit, Sprach- und Geruchsstörungen, Krämpfe (Konvulsionen)* §, Empfindungsstörungen (Parästhesien) *, Zittern (Tremor)*, Kraftlosigkeit (Asthenie)*, Koma§, Schläfrigkeit (Somnolenz)§, Brennen* |
|
Augenerkrankungen |
Tränenfluss, Augenschmerzen, Sehstörungen | |
|
Erkrankungen des Ohrs und des Labyrinths |
Ohrenschmerzen, Hörstörungen | |
|
Erkrankungen des Herz-KreislaufSystems |
klinisch relevante vorübergehende Störungen der Herzfrequenz (Anstieg der Herzfrequenz (Tachykardie* §, Reflextachykardie), Abfall der Herzfrequenz (Bradykardie)§) und des Blutdrucks (Blutdruckanstieg), Herzrhythmusstörungen (Arrhythmie)* und Herzfunktionsstörungen sowie Herzstillstand§ |
|
Systemorganklasse |
Gelegentlich |
Selten |
|
Gefäßerkrankungen |
Kreislaufreaktionen, die mit Erweiterung kleiner Blutgefäße (peripherer Vasodilatation)*, nachfolgendem Blutdruckabfall (Hypotonie)§ und Ohnmacht (Synkope)§, Anstieg der Herzfrequenz (Reflextachykardie), Unruhe (Agitiertheit), Verwirrtheit und Abnahme des Blutsauerstoffgehalts (Zyanose)§ einhergehen und bis zur Bewusstlosigkeit§ führen können, Venenentzündung teilweise nach Blutgerinnsel (Thrombophlebitis)* | |
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Vorübergehende Veränderungen der Atemfrequenz (Anstieg oder Abfall der Atemfrequenz), Kurzatmigkeit* §, Atemnot* §, Husten*, Atemstillstand§, keuchende Atmung (Giemen)*, Lungenödeme§, Halsirritationen/Engegefühl im Hals* §, pharyngolaryngeale Schmerzen/Beschwerden im Rachen*, Niesen* | |
|
Erkrankungen des Gastrointestinaltrakts |
Übelkeit*, Erbrechen*, Geschmacksstörungen (Dysgeusie)* |
Bauchschmerzen*, Magenbeschwerden*, Durchfall*, Mundtrockenheit*, Speichelfluss, Zahnschmerzen*, Weichteilschmerzen und Missempfindungen (Parästhesien) im Mund* |
|
Leber- und Gallenerkrankungen |
vorübergehende Veränderungen (Anstieg) der Leberenzymwerte, erhöhtes Blutbilirubin | |
|
Erkrankungen der Haut und des Unterhautzellgewebe s |
Leichte Hautschwellungen (Quinckeödem)§, Hautrötungen* und Erröten (Flush)* mit Gefäßerweiterung (Vasodilatation)*, Nesselsucht (Urtikaria)*, Juckreiz (Pruritus)* und Hautausschlag (Exantheme)* | |
|
Erkrankungen der Skelettmuskulatur, des Bindegewebes und des Knochens |
Schmerzen in den Gliedmaßen (Extremitäten)* | |
|
Erkrankungen der Nieren und Harnwege |
Harninkontinenz, akuter Harndrang, Erhöhung der Serumkreatininwerte und akutes Nierenversagen§ bei Patienten mit vorhandener Beeinträchtigung der Nierenfunktion |
|
Systemorganklasse |
Gelegentlich |
Selten |
|
Allgemeine Erkrankungen und Beschwerden am Verabreichungsort |
Hitzegefühl*, Kältegefühl*, Schmerzen*, Austritt des Kontrastmittels ins umliegende Gewebe (Extravasation), lokale Schmerzen*, Kältegefühl*, leichtes Wärmegefühl*, Schwellungen (Ödeme)*, Entzündungen, Gewebsabbau (Gewebsnekrose), V enenentzündung (Phlebitis), Venenentzündung teilweise nach Blutgerinnsel (Thrombophlebitis), Empfindungsstörungen (Parästhesie)*, Schwellung*, Reizung*, Austritt von Blut aus den Gefäßen in das umgebende Gewebe (Hämorrhagie)* Rötung der Haut (Erythem)*, Beschwerden* |
Rückenschmerzen, Gelenkschmerzen, Schmerzen im Brustraum (Thoraxschmerzen)*, Unwohlsein*, Schüttelfrost, Schwitzen, vasovagale Reaktionen, Veränderungen (Anstieg oder Abfall) der Körpertemperatur, Fieber*, geschwollenes Gesicht* §, periphere Schwellungen (Ödeme)*, Müdigkeit*, Durst* |
|
* Nebenwirkungen aus |
klinischen Studien | |
§ lebensbedrohliche oder tödliche Fälle wurden berichtet
Bei Patienten mit dialysepflichtiger Niereninsuffizienz, die ein Gadopentetat-Dimeglumin-haltiges Kontrastmittel erhielten, wurden häufig verzögerte und transiente entzündungsähnliche Reaktionen wie Fieber, Schüttelfrost und ein Anstieg des C-reaktiven Proteins beobachtet. Diese Patienten hatten die MRT-Untersuchung mit einem Gadopentetat-Dimeglumin-haltigen Kontrastmittel am Tag vor der Hämodialyse.
Es wurden Fälle von nephrogener systemischer Fibrose (die eine Verhärtung der Haut zur Folge hat und außerdem das Bindegewebe und die inneren Organe betreffen kann) berichtet. §
Wenn Sie eine dieser Nebenwirkungen bemerken:
- leichtes Anschwellen von Augenlidern, Gesicht, Lippen, Zunge oder Rachen
- Husten oder Niesen
- Schwierigkeiten beim Atmen
- Juckreiz
- laufende Nase
- Hautausschlag (nesselartiger Ausschlag)
benachrichtigen Sie sofort das Personal der MRT-Abteilung, Ihren Arzt oder Radiologen; es
könnten erste Anzeichen einer schweren Reaktion sein. Es kann sein, dass Ihre Untersuchung abgebrochen werden muss und Sie behandelt werden müssen.
In seltenen Fällen wurden verzögerte, d. h. Stunden oder einige Tage nach der Anwendung von Magnevist auftretende Reaktionen beobachtet. Sollte dies bei Ihnen der Fall sein, setzen Sie sich bitte mit Ihrem Arzt oder Radiologen in Verbindung.
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Magnevist aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem Umkarton nach „Verwendbar bis/Verw. bis“ angegebenen Verfalldatum nicht mehr anwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Durchstechflaschen, Flaschen und Fertigspritze im Umkarton aufbewahren, um den Inhalt vor Licht zu schützen.
Hinweis auf Haltbarkeit nach Anbruch
Chemische und physikalische Stabilität wurde nachgewiesen für 24 Stunden bei 30 °C.
Aus mikrobiologischer Sicht ist das Arzneimittel sofort zu verwenden, es sei denn, die Art des Öffnens schließt das Risiko einer mikrobiellen Kontaminierung aus. Falls es nicht sofort verwendet wird, ist der Anwender für die Dauer und die Bedingungen der Aufbewahrung (normalerweise nicht länger als 24 Stunden bei 2 bis 8 °C) verantwortlich.
Das Arzneimittel darf nicht im Abwasser oder Haushaltsabfall entsorgt werden. Fragen Sie Ihren Apotheker wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen Was Magnevist enthält
Der Wirkstoff ist: Gadopentetat-Dimeglumin.
1 ml wässrige Injektionslösung enthält 469 mg Gadopentetat-Dimeglumin (entsprechend 0,5 mmol Gadopentetat-Dimeglumin bzw. 78,63 mg Gadolinium).
Die sonstigen Bestandteile sind: Pentetat-Pentameglumin, Meglumin und Wasser für Inj ektionszwecke.
Wie Magnevist aussieht und Inhalt der Packung
Magnevist ist eine klare und partikelfreie Injektionslösung.
Packungsgrößen
5 Fertigspritzen zu je 10, 15 oder 20 ml.
10 Durchstechflaschen zu je 5, 10, 15, 20 oder 30 ml.
10 Flaschen zu je 100 ml.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Bayer Vital GmbH
51368 Leverkusen
Tel.: 0214/30-5 13 48
Fax: 0214/30-5 16 03
E-Mail: bayer-vital@bayerhealthcare.com
Hersteller
Bayer Pharma AG 13353 Berlin
Diese Packungsbeilage wurde zuletzt überarbeitet im Juli 2015.
Magnevist ist ein nierengängiges Kontrastmittel, das speziell für die magnetische Resonanztomographie entwickelt wurde.
Magnevist wird innerhalb von 24 Stunden praktisch vollständig aus dem Körper ausgeschieden. Ausführliche Informationen zum Präparat, die der Arzt benötigt, sind in speziellen Druckschriften enthalten.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt: 1 ml wässrige Injektionslösung enthält 469 mg Gadopentetat-Dimeglumin (entsprechend 0,5 mmol Gadopentetat-Dimeglumin bzw. 78,63 mg Gadolinium).
|
Konzentration an Gadopentetat-Dimeglumin (mg/ml) (mmol/ml) |
469 0,5 | |
|
Gehalt an Gadopentetat-Dimeglumin |
in (g) | |
|
Durchstechflasche |
zu 5 ml |
2,3 |
|
Durchstechflasche/Fertigspritze |
zu 10 ml |
4,7 |
|
Durchstechflasche/Fertigspritze |
zu 15 ml |
7,0 |
|
Durchstechflasche/Fertigspritze |
zu 20 ml |
9,4 |
|
Durchstechflasche |
zu 30 ml |
14,1 |
|
Flasche |
zu 100 ml |
46,9 |
Physikochemische bzw. physikalische Eigenschaften
|
pH |
7,0 - 7,9 |
|
Viskosität (mPas bzw. cP) | |
|
bei 20 °C |
4,9 |
|
bei 37 °C |
2,9 |
|
Osmolalität | |
|
(mOsm/kg H2O) |
1960 |
|
Dichte (g/ml) | |
|
bei 20 °C |
1,210 |
|
bei 37 °C |
1,195 |
Vor der Verabreichung von Magnevist ist bei allen Patienten durch Laboruntersuchungen das Vorliegen einer Nierenfunktionsstörung abzuklären.
Im Zusammenhang mit der Anwendung von Magnevist und einigen anderen gadoliniumhaltigen Kontrastmitteln sind bei Patienten mit akuter oder chronischer schwerer Nierenfunktionsstörung (GFR < 30 ml/min/1,73 m2) und/oder akuter Nierenschädigung Fälle von nephrogener systemischer Fibrose (NSF) berichtet worden. Magnevist ist bei diesen Patienten kontraindiziert. Patienten, die sich
einer Lebertransplantation unterziehen, sind besonders gefährdet, da das Auftreten eines akuten Nierenversagens in dieser Gruppe hoch ist. Daher darf Magnevist bei Patienten in der perioperativen Lebertransplantationsphase nicht angewendet werden. Magnevist darf auch Neugeborenen bis zu 4 Wochen nicht verabreicht werden.
Bei Patienten mit mittelgradig eingeschränkter Nierenfunktion (GFR 30-59 ml/min/1,73 m1) ist das Risiko für die Entstehung von NSF unbekannt, daher sollte Magnevist bei Patienten mit mittelgradig eingeschränkter Nierenfunktion nur nach sorgfältiger Risiko/Nutzen-Abwägung, in einer Dosierung, die 0,1 mmol/kg Körpergewicht nicht übersteigt, angewendet werden. Während einer Aufnahme darf nicht mehr als eine Dosis verwendet werden. Aufgrund des Fehlens von Informationen zur wiederholten Verabreichung, dürfen Magnevist-Injektionen nicht wiederholt werden, außer das Intervall zwischen den Injektionen beträgt mindestens 7 Tage.
Aufgrund der unreifen Nierenfunktion bei Säuglingen bis zu 1 Jahr, darf Magnevist bei diesen Patienten nur nach sorgfältiger Abwägung, in einer Dosierung, die 0,1 mmol/kg Körpergewicht nicht übersteigt, angewendet werden. Während einer Aufnahme darf nicht mehr als eine Dosis verwendet werden. Aufgrund des Fehlens von Informationen zur wiederholten Verabreichung dürfen Magnevist-Injektionen nicht wiederholt werden, außer das Intervall zwischen den Injektionen beträgt mindestens 7 Tage. Magnevist darf bei Neugeborenen bis zum Alter von 4 Wochen nicht angewendet werden.
Da die renale Clearance von Gadopentetat-Dimeglumin bei älteren Patienten herabgesetzt sein kann, ist es besonders wichtig, bei Patienten ab 65 Jahren das Vorliegen einer Nierenfunktionsstörung abzuklären.
Eine Hämodialyse kurz nach der Anwendung von Magnevist kann nützlich sein, um Magnevist aus dem Körper zu entfernen. Es gibt keine Belege, die dafür sprechen, bei bisher nicht dialysepflichtigen Patienten mit der Hämodialyse zu beginnen, um einer NSF vorzubeugen oder sie zu behandeln.
Magnevist darf nicht während der Schwangerschaft verwendet werden, es sei denn, der klinische Zustand der Frau macht die Verwendung von Gadopentetat-Dimeglumin erforderlich.
Nach der Verabreichung von Magnevist sollte das Stillen für mindestens 24 Stunden unterbrochen werden.
Das Abziehetikett zur Rückverfolgung auf den Durchstechflaschen/Spritzen/Flaschen ist auf die Patientenakte zu kleben, um eine genaue Dokumentation des verwendeten Gadolinium-haltigen Kontrastmittels sicherzustellen. Die verwendete Dosis ist ebenfalls anzugeben. Falls elektronische Patientenakten verwendet werden, sind die Arzneimittelbezeichnung, die Chargenbezeichnung und die Dosis darin zu dokumentieren.
Hinweise zur Anwendung
Art der Anwendung
Dieses Arzneimittel ist nur zur intravenösen Anwendung bestimmt.
Visuelle Kontrolle
Das Arzneimittel muss vor der Anwendung visuell überprüft werden. Magnevist liegt als klare, farblose bis schwach gelbliche Lösung vor. Bei starker Verfärbung, Vorhandensein von Partikeln oder defektem Behältnis darf Magnevist nicht angewendet werden.
Hinweise für die Anwendung der Durchstechflasche
Magnevist soll erst unmittelbar vor der Untersuchung in die Spritze aufgezogen werden. Der Gummistopfen darf nur einmal durchstochen werden. Die in einem Untersuchungsgang nicht verbrauchte Kontrastmittellösung ist zu verwerfen.
Hinweise für die Anwendung der Fertigspritze
Die Fertigspritze soll erst unmittelbar vor der Untersuchung der Packung entnommen und für die Injektion vorbereitet werden. Die Verschlusskappe sollte erst unmittelbar vor der Anwendung der
Fertigspritze entfernt werden. Die in einem Untersuchungsvorgang nicht verbrauchte Kontrastmittellösung ist zu verwerfen.
Soll das Arzneimittel mit einem automatischen Applikationssystem gegeben werden, muss die Eignung für die beabsichtigte Anwendung vom Medizinproduktehersteller belegt sein. Die Anwendungshinweise der Medizinprodukte sind unbedingt zu beachten. Bei Säuglingen und Kleinkindern verbietet sich der Einsatz eines automatischen Applikationssystems. 2 1 3 4 5 6
Glas-Fertigspritze
|
1 |
r^%\ | ||
|
3 | |||
Kunststoff-Fertigspritze INJEKTION PER HAND
INJEKTION MITTELS INJEKTOR
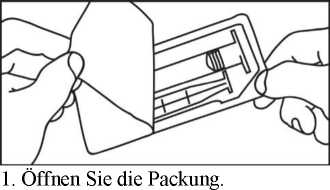

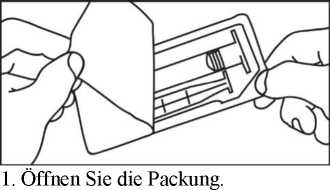
4. Öffnen Sie die Kappe durch Drehen.
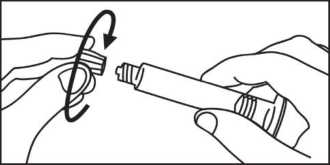
3. Öffnen Sie die Kappe durch Drehen.
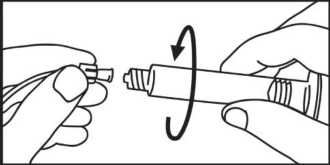
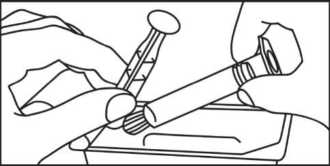
2. Nehmen Sie die Spritze und den Kolben aus der Packung.
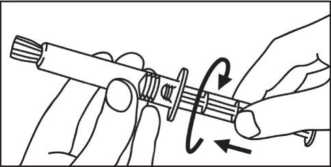
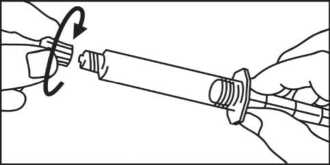
3. Drehen Sie den Kolben im Uhrzeigersinn in die Spritze.
2. Nehmen Sie die Spritze aus der Packung.
4. Verbinden Sie die Spritzenspitze mit dem Schlauchsystem im Uhrzeigersinn und fahren Sie fort nach den Anweisungen des Geräteherstellers.
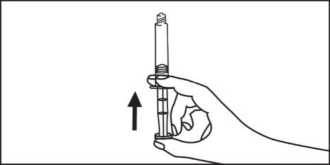
5. Entfernen Sie die Luft aus der Spritze.
15
Schrauben Sie den Kolben an die Spritze.
Öffnen Sie die Packung.
Brechen Sie die Schutzkappe ab.
Entfernen Sie die Schutzkappe.
Entfernen Sie den Gummistopfen.
Entfernen Sie die Luft aus der Spritze.