Mebeverin Puren 135 Mg Filmtabletten
F achinform ation
1. Bezeichnung des Arzneimittels
Mebeverin PUREN 135 mg Filmtabletten
2. Qualitative und quantitative Zusammensetzung
Wirkstoff: Mebeverinhydrochlorid (entsprechend 124,44 mg Mebeverin)
1 Filmtablette enthält 135 mg Mebeverinhydrochlorid (entsprechend 124,44 mg Mebeverin). Sonstiger Bestandteil mit bekannter Wirkung: Lactose.
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Filmtablette.
Weiße, runde Filmtabletten mit einem Durchmesser von 10 mm und mit der Markierung „MV 135“ auf einer Seite.
4. Klinische Angaben
4.1 Anwendungsgebiete
Colon irritabile, gekennzeichnet durch abdominelle Schmerzen, Wechsel von unspezifischer Diarrhoe und Obstipation sowie Flatulenz.
4.2 Dosierung und Art der Anwendung Dosierung:
Erwachsene:
3 x täglich 1 überzogene Tablette (entsprechend 3 x 135 mg = 405 mg Mebeverinhydrochlorid pro Tag).
Kinder und Jugendliche:
Mebeverin PUREN 135 mg wird für die Anwendung bei Kindern und Jugendlichen unter 18 Jahren aufgrund ungenügender Daten bezüglich Wirksamkeit und Unbedenklichkeit nicht empfohlen.
Besondere Patientengruppen:
Es wurden keine Dosierungsstudien bei älteren Patienten oder Patienten mit Nieren- und/oder Leberfunktionsstörungen durchgeführt. Aus den zur Verfügung stehenden Daten nach Markteinführung konnte kein spezifisches Risiko für diese Patientengruppen ermittelt werden.
Art der Anwendung Zum Einnehmen.
Mebeverin PUREN sollten als Ganzes, unzerkleinert und unzerkaut mit einer ausreichenden Menge Wasser (mindestens 100 ml) vorzugsweise 20 Minuten vor den Mahlzeiten eingenommen werden. Die Dauer der Anwendung ist zeitlich nicht begrenzt.
Sollten eine oder mehrere Einnahmen vergessen worden sein, so sollte der Patient mit der nächsten Dosis wie gewohnt fortfahren; die vergessene Dosis sollte nicht zusätzlich zu der regulären eingenommen werden.
4.3 Gegenanzeigen
Mebeverin PUREN darf nicht eingenommen werden bei einem paralytischen Ileus und bei Überempfindlichkeit bzw. Allergie gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Mebeverin PUREN enthält Laktose: Patienten mit der seltenen heriditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Mebeverin PUREN nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Klinische Studien zu Wechselwirkungen von Mebeverin mit anderen Arzneimitteln wurden nicht durchgeführt.
In-vitro- bzw. Tierstudien machen eine Wechselwirkung mit Alkohol unwahrscheinlich. Die klinische Bedeutung dieser Untersuchungen ist unklar.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Bisher liegen keine oder nur sehr begrenzte Erfahrungen mit der Anwendung von Mebeverin bei Schwangeren vor. Es liegen keine ausreichenden tierexperimentellen Studien in Bezug auf eine Reproduktonstoxizität vorn (siehe Abschnitt 5.3). Die Anwendung von Mebeverin PUREN wird während der Schwangerschaft nicht empfohlen.
Stillzeit:
Es ist nicht bekannt, ob Mebeverin oder seine Abbauprodukte in die Muttermilch übergehen. Der Übergang in die Milch ist in Tieren nicht untersucht worden. Mebeverin PUREN sollte daher während der Stillzeit nicht eingenommen werden.
Fertilität
Es liegen keine klinischen Daten zum Einfluss von Mebeverin auf die männliche oder weibliche Fertilität vor. Begrenzte Studien am Tier mit Mebeverin weisen jedoch auf keine schädlichen Wirkungen hin (siehe Abschnitt 5.3).
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien bezüglich der Auswirkungen auf die Verkehrsfähigkeit oder dem Bedienen von Maschinen durchgeführt; aufgrund des selektiven Wirkmechanismus ist jedoch nicht davon auszugehen.
4.8 Nebenwirkungen
Allergische Reaktionen, hauptsächlich aber nicht ausschließlich der Haut (s.u.), wurden beobachtet. In Einzelfällen trat ein anaphylaktischer Schock auf.
Weiterhin wurden sehr selten Schwindel, Benommenheit, Verwirrtheit und Übelkeit beobachtet. Immunsystem:
Sehr selten: Überempfindlichkeit Haut und Unterhautgewebe:
Sehr selten: Pruritus, Exanthem, Urtikaria, Angioödem (meist im Gesicht).
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit.
Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger Allee 3 D-53175 Bonn Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Theoretisch könnte eine Erregbarkeit des zentralen Nervensystems auftreten. In Fällen, in denen Mebeverin überdosiert eingenommen wurde, waren die Symptome entweder nicht oder nur mild vorhanden und gewöhnlich rasch reversibel. Beobachtete Symptome einer Überdosierung waren neurologischer und kardiovaskulärer Natur.
Da ein spezifisches Antidot nicht bekannt ist, ist eine symptomatische Therapie zu empfehlen. Eine Magenentleerung sollte nur im Fall einer multiplen Intoxikation, die innerhalb einer Stunde entdeckt wurde, in Betracht gezogen werden. Die Absorption verringernde Maßnahmen sind nicht notwendig.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Synthetische Anticholinergika, Ester mit tertiären Aminogruppen. ATC-Code: A03AA04
Wirkmechanismus und Pharmakodynamische Wirkungen
Mebeverin ist ein muskulotropes Spasmolytikurn mit einer selektiver Wirkung auf die glatte Muskulatur des Verdauungstraktes.
Es lindert Krämpfe, ohne die normale Darmtätigkeit zu beeinflussen. Da dieser Effekt nicht durch das autonome Nervensystem vermittelt wird, treten keine typischen anticholinergen Nebenwirkungen auf. Die Wirkung ist qualitativ mit der des Papaverins vergleichbar, jedoch 3-5x stärker ausgeprägt.
5.2 Pharmakokinetische Eigenschaften
Absorption
Mebeverin wird nach oraler Administration schnell und vollständig absorbiert.
Verteilung
Eine signifikante Akkumulation konnte auch nach Mehrfachgabe nicht festgestellt werden. Biotransformation
Mebeverinhydrochlorid wird hauptsächlich durch Esterasen hydrolysiert, welche zunächst die Esterbindungen spalten, wodurch Veratrumsäure und Mebeverinalkohol entstehen. Der Hauptmetabolit im Plasma ist DMAC (demethylierte Carboxylsäure). Die Eliminationshalbwertzeit von DMAC im steady-state liegt bei t1/2 = 2,45 h. Bei Mehrfachgaben der überzogenen Tabletten liegt cmax von DMAC bei 1670 ng/ml und tmax beträgt 1 Stunde.
Elimination
Mebeverin wird komplett metabolisiert und nahezu vollständig (95-98%) ausgeschieden. Veratrumsäure wird in den Urin ausgeschieden, ebenso Mebeverinalkohol, dieser jedoch zu einem Teil als korrespondierende Carboxylsäure (MAC) und zum anderen als demethylierte Carboxylsäure (DMAC).
Kinder und Jugendliche
Mit keiner Darreichungsform von Mebeverin wurden pharmakokinetische Studien bei Kindern durchgeführt.
5.3 Präklinische Daten zur Sicherheit
Nach sehr hohen oralen und parenteralen Dosen weisen die Hauptsymptome in Tieren auf eine Beteiligung des ZNS mit Verhaltenserregungen, hauptsächlich Tremor und Konvulsionen, hin.
Mebeverin ist im Tierversuch unzureichend auf reproduktionstoxische Eigenschaften untersucht. Jedoch gab es keinen Hinweis auf ein teratogenes Potential bei Ratten und Kaninchen bei täglichen Einmaldosen bis zu 100 mg/kg/Tag.
Embryotoxische Effekte (vermindertes Wachstum, Embryoletalität) wurden allerdings bei Ratten beobachtet, die 2x täglich 50 mg/kg erhielten, welches einer 2-fachen klinischen Maximaldosis für Menschen entspricht. Diese Effekte wurden bei Kaninchen nicht beobachtet.
In einer oralen Fertilitätsstudie an weiblichen und männlichen Ratten wurden in Dosierungen bis einschließlich der einfachen humanen Dosis keine Effekte bei der F0 und drei F1 Generationen gesehen.
In den Standard in-vivo und in-vitro Genotoxizitätstests zeigte Mebeverin keine genotoxischen Effekte. Es wurden keine Kanzerogenitätsstudien durchgeführt.
6. PHARMAZEUTISCHE ANGABEN 6.1 Liste der sonstigen Bestandteile
Lactose-Monohydrat; Hypromellose; Talkum; Povidon K 29/32; Carboxymethylstärke-Natrium, Magnesiumstearat; mikrokristalline Cellulose; Macrogol 400; Titandioxid (E 171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
4 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25°C lagern! In der Originalpackung aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen!
6.5 Art und Inhalt des Behältnisses
PVC-Aluminium Blister.
Originalpackungen mit 20, 50 und 100 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
PUREN Pharma GmbH & Co. KG Willy-Brandt-Allee 2 81829 München
Telefon: 089/558909-0 Telefax: 089/558909-240
8. Zulassungsnummer
30095.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
09.12.1996 / 17.08.2009
10. Stand der Information
November 2015
11.
Verkaufsabgrenzung
V erschreibungspflichtig
Zusätzliche Angaben der Firma Mylan dura GmbH zur Bioverfügbarkeit von Mebeverin dura 135 mg
Auf Grund der physiko-chemischen Eigenschaften von Mebeverin, seiner großen therapeutischen Breite, seiner Wirkungsmechanismen und der Tatsache, dass Mebeverin normal funktionierende glatte Muskulatur nur gering beeinflusst, sind Bioäquivalenzprobleme nicht zu erwarten.
Eine im Jahre 1990 durchgeführte Singledose-Studie mit Crossoverdesign mit Mebeverin PUREN 135 mg an 12 Probanden belegte Bioäquivalenz mit dem Erstanmeldepräparat im Hinblick auf Plasmaspiegel des Metaboliten Veratrumsäure (3,4-Dimethoxybenzoesäure). Die aktive Substanz ist im Plasma kaum nachweisbar.
Die Studie brachte folgende Ergebnisse:
|
AUC0-unendl. |
C max |
Tmax |
T1/2 | |
|
(pg/ml .Std) |
((pg/ml) |
(Std.) |
(Std.) | |
|
Test |
37,01 ±8,77 |
12,95 ±3,33 |
0,85 ±0,41 |
2,02 ±0,4 |
|
Referenz |
37,08 ±5,33 |
13,09 ±2,70 |
0,85 ±0,21 |
2,11 ±0,35 |
|
Ratio Test/Referenz |
0,998 |
0,989 |
1,0 |
0,957 |
|
Varianzanalyse |
p - 0,431 |
p =0,666 |
p = 0,944 |
- |
|
90 %-Konfidenzintervall |
91-108 % |
90-108 % |
- | |
|
Power |
96,5 % |
95 % |
- |
- |
Mittlere Plasmaspiegelverläufe von Veratrumsäure im Vergleich zu einem Referenzpräparat in einem Konzentrations-Zeit-Diagramm:
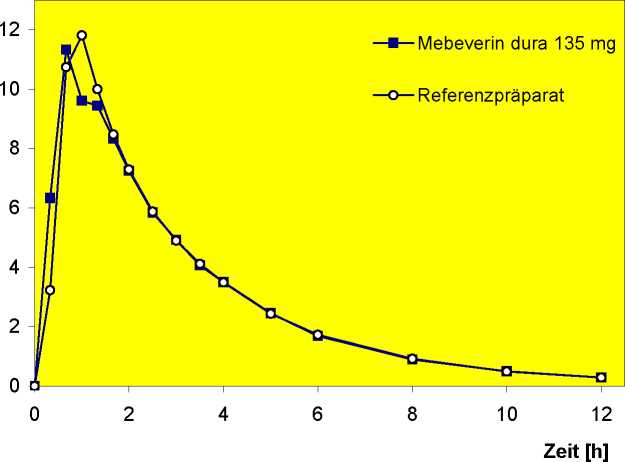
Beurteilung: Der Nachweis der Bioäquivalenz zum Referenzpräparat ist erbracht.