Meladinine
Fachinformation
1. Bezeichnung des Arzneimittels
Meladinine® 10 mg Tabletten
2. Qualitative und quantitative Zusammensetzung
Methoxsalen (Synonyme: Ammoidin, 8-Methoxypsoralen)
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. Darreichungsform
Tabletten
Die Bruchkerbe dient nur zum Teilen der Tablette für ein erleichtertes Schlucken und nicht zum Aufteilen in gleiche Dosen.
4. Klinische Angaben
4.1 Anwendungsgebiete
Schwere Formen der Psoriasis vulgaris. Mycosis fungoides und andere Formen des kutanen T-Zell-Lymphoms (besonders frühe Stadien mit Plaques, weniger späte Stadien mit tumorösen Veränderungen). Vitiligo bei entsprechendem Hauttyp (ab Typ III).
4.2 Dosierung, Art und Dauer der Anwendung
Falls vom Arzt nicht anders verordnet, erfolgt die Einnahme von Meladinine nach dem Körpergewicht, beginnend mit 2 Tabletten bei 30 - 50 kg Körpergewicht und mit 4 Tabletten bei 70 kg Körpergewicht. Eine Dosis von 6 Tabletten sollte auch bei schwergewichtigen Patienten nicht überschritten werden. Die optimale Dosierung beträgt 0,6 mg pro kg Körpergewicht. Die Einnahme darf nur an den Tagen erfolgen, an denen auch eine Bestrahlung vorgenommen wird.
Meladinine (Methoxsalen) wird ausschließlich im Zusammenhang mit UVA therapeutisch eingesetzt (PUVA-Therapie).
Die Einnahme von Meladinine 10 mg Tabletten erfolgt 2 Stunden vor Bestrahlungsbeginn, sofern der Arzt nichts anderes vorschreibt. Wenn möglich sollte die Einnahme im Anschluss an eine kleine Mahlzeit erfolgen. Ein Lichttreppentest zur Feststellung der minimalen phototoxischen Dosis, die gleichzeitig die erste therapeutische Dosis darstellt, ist mit dem verwendeten Bestrahlungsgerät bei Beginn der Therapie empfehlenswert.
Während der Therapie wird je nach Zustand der Hautpigmentierung und deren behandlungsbedingter Zunahme ausschließlich die Bestrahlungsdosis (Bestrahlungsdauer) variiert. Das Auftreten einer leichten Hautreaktion (Rötung) gilt dabei als Indikator für das Erreichen des optimalen Dosisbereiches und ist erwünscht. Während der Bestrahlung und mindestens bis zu 24 Stunden nach Tabletteneinnahme ist Augenschutz erforderlich.
Der Genitalbereich sollte bei der PUVA-Therapie möglichst ausgespart werden. Als UVA-dichte Abdeckung genügt das Tragen normaler, dichtgewebter, am besten dunkel gefärbter Unterwäsche aus Wolle oder Baumwolle bei der Bestrahlung. (s.a. 4.4)
Es ist empfehlenswert, bei lang dauernder Einnahme von Meladinine Tabletten vor Beginn der Therapie und dann in regelmäßigen Abständen (etwa alle 6 Monate) Urin-und Blutkontrollen durchzuführen.
Da bei der Einnahme von Meladinine Tabletten auch im Auge, insbesondere der Linse, Gewebespiegel der Wirksubstanz nachgewiesen wurden, die diesen Bereich empfindlicher gegenüber Ultraviolett-Licht machen, empfiehlt sich vor Therapiebeginn eine augenärztliche Untersuchung. Diese soll, je nach Befund, in regelmäßigen Abständen während der Behandlung wiederholt werden.
Bei evtl. auftretenden stärkeren sonnenbrandähnlichen Hauterscheinungen sind für kurze Zeit die therapeutischen Anwendungen zu unterbrechen; entzündungshemmende Präparate (z. B. Corticosteroide) können angewendet werden.
Wenn Juckreiz während der Behandlung auftritt, der häufig mit einem Trockenheitsgefühl der Haut einhergeht, sollte zur Linderung eine Fettcreme angewendet werden. Gegebenenfalls ist die Einnahme eines Juckreiz stillenden Präparates (Antihistaminikum) zweckmäßig.
Psoriasis
Zu Beginn sollte die Behandlung viermal pro Woche durchgeführt werden, jedoch an 2mal 2 Tagen hintereinander mit einer Behandlungspause von einem Tag. Nach dem Abklingen der akuten Hautveränderungen bei Psoriasis vulgaris wird eine Intervalltherapie mit Bestrahlungen empfohlen.
Vitiligo
Allgemein wird 1 - 2mal pro Woche über 6 Monate bis zu 2 Jahren therapiert. Die Behandlung muss konsequent durchgeführt werden, um einen Behandlungserfolg zu sichern.
Mycosis fungoides und andere T-Zell-Lymphome
Bei Mycosis fungoides und anderen T-Zell-Lymphomen entspricht das Therapieschema dem bei Psoriasis mit etwa um die Hälfte reduzierter Bestrahlungsdosis.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile.
- Xeroderma pigmentosum
- mit bösartigen inneren Tumoren vergesellschaftete erbliche Dermatosen (Dysplastisches Nävussyndrom)
- bösartiger Hauttumor (Malignes Melanom)
- lichtprovozierbare Dermatosen wie Lupus erythematodes, Dermatomyositis oder Porphyrien.
Alter unter 12 Jahren, Schwangerschaft, Laktation, Aphakie oder Katarakt, schwere Herzerkrankung, Hepatopathie, stark eingeschränkte Nierenfunktion, Tuberkulose, Behandlung mit Zytostatika oder potentiell photosensibilisierenden Medikamenten.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Das Präparat darf nicht zu kosmetischen Zwecken (Hautbräunung) verwendet werden.
Ein erhöhtes Risiko besteht für Patienten mit bösartigen Hauttumoren in der Vorgeschichte (Plattenepithel-Karzinom, Basalzellkarzinom, M. Bowen), Patienten mit früherer Arsen-, Zytostatika- (z. B. Methotrexat), Immunsuppressiva-Behandlung (z. B. Ciclosporin), Patienten mit früherer Behandlung mit ionisierenden Strahlen oder N-Lost, Patienten mit Immundefekten.
Patienten unter systemischer PUVA-Therapie sollten unbedingt mindestens 24 Stunden nach der Einnahme von Meladinine außer der Bestrahlung mit UVA-Licht unter Aufsicht des Arztes jede weitere UV-Exposition meiden (Sonnenlicht, Solarien). Dies bedeutet, dass bei Aufenthalt im Freien eine Schutzbrille mit UV-absorbierenden Gläsern zu tragen ist (spezielle Kantenfiltergläser mit UV-Kante bei 400 nm und Seitenschutz z.B. der Fa. Schweizer, Zeiss, Rodenstock oder Essilor). Des Weiteren sind Lichtschutzmittel an freiliegenden Hautbereichen aufzutragen sowie Handschuhe zu verwenden. Bei den Lichtschutzmitteln für exponierte Hautstellen ist darauf zu achten, ein Präparat mit hohem Lichtschutzfaktor und integriertem UVA-Filter zu wählen.
Phototoxische Reaktionen können auch hinter Fenstergläsern auftreten (Kraftfahrer, Kranführer, Piloten).
Vorsicht ist geboten bei Patienten mit orthostatischen Regulationsstörungen.
Das Gesicht und die Genitalregion sind bei der Behandlung abzudecken/auszusparen.
In der wissenschaftlichen Literatur wird ein mögliches Langzeitrisiko der PUVA-Therapie hinsichtlich Neubildungen der Haut noch kontrovers diskutiert. Untersuchungen außerhalb von Deutschland, vor allem USA, halten ein gegenüber der Normalbevölkerung erhöhtes Hautkrebsrisiko für möglich. In Deutschland durchgeführte Langzeitstudien finden keine Erhöhung des Risikos. Im Sinne größtmöglicher Arzneimittelsicherheit sollen die PUVA-Patienten in regelmäßigen Abständen diesbezüglich untersucht werden. Da die amerikanischen Studien das Risiko besonders im Genitalbereich postulieren, sollte dieser Bereich bei der PUVA-Therapie möglichst ausgespart werden. Als UVA-dichte Abdeckung genügt das Tragen normaler, dichtgewebter, am besten dunkel gefärbter Unterwäsche aus Wolle oder Baumwolle bei der Bestrahlung.
Patienten mit Herzerkrankungen sollten vor der Behandlung auf ihre Belastungsfähigkeit untersucht werden.
Patienten mit der seltenen hereditären Galactose-Intoleranz, Lactase-Mangel oder Glucose-Galactose-Malabsorption sollten Meladinine 10 mg Tabletten nicht einnehmen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Gleichzeitige Einnahme potentiell phototoxischer Medikamente wie z. B. Dimethylchlortetrazyklin, bestimmter Phenothiazine, Sulfonamidderivate und Furocumarine sind zu vermeiden. Ebenso wird empfohlen, äußerlich keine potentiell photoallergisierenden Substanzen wie z. B. halogenierte Salizylanilide zu verwenden.
Tolbutamid kann Methoxsalen in pharmakokinetisch signifikanter Weise aus der Albuminbindung verdrängen.
Senkung des Serumspiegels von Methoxsalen durch Phenytoin.
Methoxsalen oral kann den Metabolismus von Paracetamol in der Leber hemmen und damit dessen Ausscheidung.
Methoxsalen reduziert die Antipyrin-Clearance beim Menschen.
Methoxsalen ist ein potenter Inhibitor der Cumarin-7-Hydroxylierung. So kommt es bei gleichzeitiger Einnahme von Meladinine® Tabletten und Cumarin-haltigen Präparaten zu einem verlangsamten metabolischen Abbau von Cumarin; höhere Cumarin-Spiegel können auftreten.
Vorangegangene oder gleichzeitige Behandlung mit Methotrexat, Teer und UVB, Arsen oder mit ionisierenden Strahlen erhöhen das Karzinomrisiko.
4.6 Schwangerschaft und Stillzeit
Meladinine 10 mg Tabletten ist während Schwangerschaft und Stillzeit kontraindiziert (siehe Abschnitt 4.3), da hierzu kein wissenschaftliches Erkenntnismaterial vorliegt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Bis zu 4 Stunden nach Therapieende kann Müdigkeit auftreten, daher ist die Fähigkeit zum Führen von Fahrzeugen und Bedienen von Maschinen möglicherweise eingeschränkt.
4.8 Nebenwirkungen
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt:
Sehr häufig (>1/10)
Häufig (>1/100 bis <1/10)
Gelegentlich (>1/1.000 bis <1/100)
Selten (>1/10.000 bis <1/1.000)
Sehr selten (<1/10.000)
Häufig treten bei systemischer PUVA-Therapie Pruritus, Erythem, Nausea, PUVA-Lentigines auf.
Gelegentlich wurden Kopfschmerzen, Schwindel, Schmerzen in der Haut und ein durch PUVA ausgelöstes Köbner-Phänomen bei Psoriasis vulgaris beobachtet.
Selten Verbrennungen bei bestimmungsgemäßem Gebrauch.
In Einzelfällen Hypertrichose, Hyperpigmentierungen, (PUVA-moddlings), Kontaktallergie bzw. Photokontaktallergie, asthmatische Beschwerden bzw. Husten, reversible Onycholyse, Nagelpigmentierungen, reversible Transaminaseerhöhung, Katarakt, Malignome, Auftreten von antinukleären Antikörpern (ANA) im Serum, Müdigkeit.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger- Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
a) Notfallmaßnahmen Giftentfernung
Bei Kleinkindern sollte wegen der nicht bekannten humantoxischen Wirkungen ab Ingestion von mehr als 4-6mg/kg Körpergewicht primäre Giftentfernung durch induziertes Erbrechen und nachfolgende Kohle- und Laxansgabe durchgeführt werden. Ab einer Einnahmemenge von 30-40 mg/kg Körpergewicht sollte vorsichtshalber in jedem Falle eine primäre Giftentfernung mit Magenspülung und nachfolgender Kohle- und Laxansgabe durchgeführt werden.
Elementarhilfe
Entsprechend den hohen LD-Dosen im Tierversuch wäre beim Menschen auch bei Einnahme einer oder zweier Packungseinheiten keine vitale Bedrohung zu erwarten. Bei cerebralen Krämpfen ist Diazepam, bei Atemstillstand Intubation und künstliche Beatmung angezeigt.
Weitere Maßnahmen
Nach jeder erheblichen Überdosierung sollte der Patient mindestens 12 Stunden in einem abgedunkelten Raum verbringen und für weitere 5 Tage eine starke UV-Exposition vermeiden. Diese Zeiten verlängern sich bei Leberschäden und Niereninsuffizienz.
Leber- und Nierenwerte sollten während der nächsten 2 Wochen kontrolliert werden. Eine stationäre Überwachung für 48 Stunden ist zu gewährleisten.
Therapie der Hauterscheinungen
Bei schwerem sonnenbrandartigem Erythem, evtl. mit Blasenbildung, nach Überdosierung des Medikaments oder der UV-Bestrahlung Aufenthalt im abgedunkeltem Raum und - je nach Schweregrad - Zufuhr von Elektrolyten, Humanalbumin, evtl. Corticoidgabe, evtl. Therapie wie bei Verbrennungen.
b) Symptome der Intoxikation
Vergiftungen beim Menschen sind bisher nicht bekannt. Zu erwarten sind Magenbeschwerden mit Übelkeit, analog zum Tierversuch wären bei subletalen Dosen Schädigung von Leber, Niere, Milz und Lunge sowie Hautrötung und Krampfanfälle möglich. Außerdem ist eine verstärkte und verlängerte Photosensibilität gegeben, die unter extremen Bedingungen zu lebensgefährlichen Verbrennungen führen kann. Augenschäden sind ebenfalls möglich. Bei letalen Vergiftungen kann es schon nach 10 Minuten zu Hyperventilation, Ataxie, cerebralen Krämpfen, Koma und Tod durch Atemversagen kommen.
Gegenmittel
Spezifische Antidote sind nicht bekannt.
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Psoralene zur systemischen Anwendung ATC-Code: D05BA02
Die therapeutisch genutzte Wirkung von Methoxsalen beruht auf dessen photosensibilisierenden Eigenschaften. Methoxsalen wird daher im Rahmen der Photochemotherapie (PUVA) eingesetzt.
Aufgrund seiner planaren Struktur lagert sich Methoxsalen zwischen den beiden Strängen der DNA-Doppelhelix ein und bildet lockere Komplexe mit den Pyrimidin-Basen (Interkalierung). Unter dem Einfluss von UVA bildet das interkalierte Methoxsalen mit den Pyrimidin-Basen der DNA Monoaddukte. Werden diese Monoaddukte erneut durch Bestrahlung mit UVA photoaktiviert, so bilden sich Quervernetzungen zwischen den DNA-Strängen, sogenannte cross-links, aus (phototoxische-Typ-I-Reaktion).
Es wurden auch sogenannte Typ-II-Reaktionen der Psoralene an Membransystemen und bei Enzyminaktivierungen beobachtet, wobei dem Singulett-Sauerstoff eine Rolle als aktives Zwischenprodukt zugeschrieben wird.
Das Aktionsspektrum der Psoralene liegt zwischen 320 und 400 nm mit einem Maximum bei 330 bis 360 nm.
PUVA bewirkt eine Hemmung der DNA-Synthese, eine Erhöhung der Rate an sister-chromatid-exchanges und eine Vermehrung von Chromosen-Aberrationen. Diese Veränderungen persistieren zum Teil über den aktuellen Zellzyklus hinaus und inhibieren die Zell-Proliferation. PUVA bewirkt außerdem Veränderungen der Membranoberfläche und der Oberflächenantigene, wodurch (z. B. bei Mastzellen) Änderungen der Zellfunktion verursacht werden.
PUVA vermindert die Anzahl der immunkompetenten Langerhans-Zellen in der Epidermis. Methoxsalen führt unter Einfluss von UVA zu einer Verminderung der Mastzellen bei Patienten mit systemischer Mastozytose; in vitro wird die Freisetzung von Mediatoren aus Ratten-Mastzellen gehemmt.
Durch PUVA wird (dosisabhängig) ein Erythem erzeugt, dessen zeitlicher Ablauf gegenüber dem UVB-Erythem verzögert ist: Beginn des PUVA-Erythems nach 12 - 24 Stunden, Maximum nach 48 - 72 Stunden (demgegenüber Beginn des UVB-Erythems nach 2 Stunden, Maximum nach 24 Stunden).
Im Tierversuch konnte gezeigt werden, dass PUVA eine Immuntoleranz gegenüber Allotransplantaten bewirkt und zellulär vermittelte allergische Reaktionen beeinträchtigt.
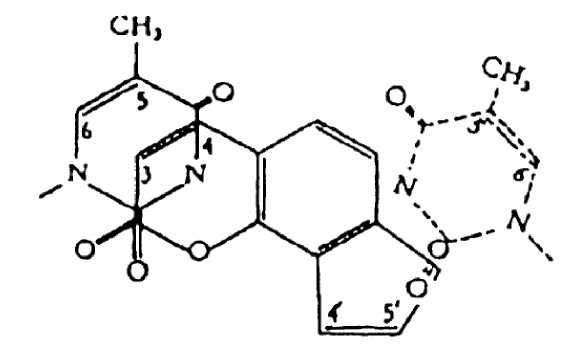
Abb. 1:
Strukturformel von Methoxsalen mit Schema der Bindungsreaktion an DNA
5.2 Pharmakokinetische Eigenschaften
Methoxsalen wird nach oraler Applikation rasch und vollständig im Dünndarm resorbiert. Die gleichzeitige Nahrungsaufnahme mit der Einnahme von Methoxsalen spielt offenbar keine Rolle für die Resorption und Plasmakinetik des Medikamentes. Der klinische Effekt wird nicht beeinflusst.
Nach enteraler Aufnahme unterliegt Methoxsalen einem ausgeprägten, sättigbaren FirstPass-Effekt.
Der Zeitpunkt und die Höhe der maximalen Serumkonzentration von Methoxsalen nach oraler Applikation unterliegen starken inter- und intraindividuellen Schwankungen. Im Allgemeinen ist die maximale Serumkonzentration nach zwei Stunden zu erwarten. Die Konzentration von Methoxsalen in der Haut korreliert gut mit dem Serumspiegel.
Mit steigendem Methoxsalen-Serumspiegel entwickelt sich eine zunehmende Verminderung der minimalen Erythemdosis (MED) für UVA. In der Regel laufen nach oraler Einnahme von Methoxsalen beide Prozesse zeitlich parallel ab, so dass zum Zeitpunkt der maximalen Serumkonzentration auch die niedrigste MED für UVA besteht.
Aus dem Gesagten ergibt sich, dass auch die Verminderung der MED in ihrem Zeitpunkt und in ihrer Ausprägung inter- und intraindividuellen Schwankungen unterliegt. Dieses Phänomen ist für solche Patienten von Bedeutung, bei denen die PUVA-Therapie nicht den gewünschten Erfolg zeigt. In solchen Fällen werden allgemein Blutspiegelkontrollen in kurzen zeitlichen Abständen nach der Methoxsalen-Einnahme empfohlen, um den jeweiligen zeitlichen Ablauf des Serumspiegels zu ermitteln.
5.3 Präklinische Daten zur Sicherheit
In vitro wurde Methoxsalen mit und ohne gleichzeitige UVA-Bestrahlung an verschiedensten Modellen toxikologisch überprüft. Für diese Versuche wurden Bakterienkulturen, Pilzkulturen, Kulturen verschiedener Säugerzellen, so z. B. die ZellLinie V 79 oder Hamster-Ovar-Zellen und auch menschliche Zellen, vor allem Fibroblasten verwendet.
Alle Untersuchungen zeigten, dass Methoxsalen oder UVA allein keine wesentlichen zytotoxischen oder mutagenen Effekte haben, während die Kombination von Methoxsalen und UVA die Rate an sister-chromatid-exchanges und ChromosomenAberration erhöht. Insgesamt ist nicht nur eine deutliche dosisabhängige Mutagenität, sondern auch eine dosisabhängige Zytotoxitizät von PUVA mit diesem Versuchsaufbau festzustellen.
Lediglich bei der in-vitro-Bestrahlung von menschlichen polymorphkernigen Leukozyten, die zuvor mit Methoxsalen inkubiert worden waren, war keine wesentliche Beeinträchtigung der Zell-Vitalität und auch der chemotaktischen Aktivität festzustellen. Offenbar scheinen also diese sich nicht mehr teilenden Zellen relativ unempfindlich gegen PUVA zu sein. Auf isolierte menschliche Monozyten hingegen wirkt UVA allein und in noch stärkerem Maße PUVA letal.
In einer Langzeituntersuchung an Ratten, denen bis zu 400 mg/kg KG Methoxsalen verfüttert wurde, zeigten sich ohne UVA-Bestrahlung folgende toxische Effekte überwiegend bei hohen Dosen (200 und 400 mg/kg KG): Mortalität, Gewichtsverlust, histologische Veränderungen an Leber, Testes und Nebennieren. Im Vergleich zu klinisch üblichen Dosierungen wurden jedoch relativ hohe Dosen (bis 100 mg/kg KG) insgesamt noch problemlos vertragen.
Akute Toxizität
Über die akute Toxizität beim Menschen liegt nur die Kasuistik einer Patientin vor, die in suizidaler Absicht 850 mg Methoxsalen einnahm. Es stellten sich Schwindel, Übelkeit und Erbrechen ein, die Patientin war nach 36 Stunden wieder hergestellt.
Chronische Toxizität
Bei Langzeituntersuchungen an Psoriasis-Patienten unter systemischer PUVA-Therapie konnten lediglich geringfügige Veränderungen einzelner Laborparameter festgestellt werden; insgesamt ergab sich kein Anhalt für eine chronische systemische Toxizität.
Lokale Toxizität
In Biopsien aus gesunder Haut von Patienten, die wegen einer Psoriasis mit PUVA systemisch behandelt worden waren, zeigten sich zwei-, vier- und mehrkernige Epidermiszellen und zwei- und vierkernige dermale Fibroblasten. Kernschäden waren bis zu einer Tiefe von 700 gm in der Dermis nachweisbar. Eine “unscheduled” DNA-Synthese wurde jedoch nicht nachgewiesen. Zirkulierende Lymphozyten von Patienten, die unter PUVA-Therapie stehen, weisen keine erhöhte Rate von sister-chromatid-exchanges auf - im Gegensatz zu Lymphozyten, die in vitro mit PUVA behandelt wurden.
Im Tierversuch wurden unter PUVA reversible Hornhaut-Trübungen, irreversible Iris-Devaskularisationen und Katarakte beobachtet. Bei Untersuchungen an größeren Patientengruppen zeigten sich nach systemischer PUVA-Therapie, auch nach Langzeitbehandlung, keine Augenveränderungen. In Einzelfällen wurde jedoch die Entwicklung einer Katarakt beschrieben.
Mutagenität, Kanzerogenität, Teratogenität
Bei Nacktmäusen wurde im Tierversuch mit Methoxsalen oral und UVA-Bestrahlung eine erhöhte Aktivität der Ornithin-Decarboxylase, die als Marker der Kanzerogenität des Induktors gedeutet wird, nachgewiesen. Durch systemische Verabreichung von Methoxsalen und nachfolgende Bestrahlung mit UVA konnten Karzinome der Haut provoziert werden, wobei nicht unbedingt eine quantitative Korrelation zwischen den chromosomalen Veränderungen und der Tumor-Inzidenz festzustellen war. Eine Autorengruppe konnte auch bei Langzeitversuchen mit PUVA bei Nacktmäusen keine Malignome provozieren.
Langzeituntersuchungen an Kollektiven von Patienten, die unter systemischer PUVA-Therapie standen, ergaben insgesamt keine erhöhte Rate an malignen Haut-Tumoren; unter PUVA-Therapie änderte sich jedoch das Häufigkeitsverhältnis von Basaliomen zu Plattenepithel-Karzinomen von 3 : 1 in der Normalbevölkerung auf 1 : 4 bei PUVA-Patienten. In Untersuchungen an kleineren Kollektiven wurde über das Auftreten von Plattenepithel-Karzinomen, Keratoakanthomen und aktinischen Keratosen berichtet; außerdem wurde in Einzelfällen ein M. Bowen beobachtet. Relativ häufig traten sogenannte PUVA-Lentigines auf, Pigmentflecken an sonnengeschützten Körperstellen. Über das Auftreten von malignen Melanomen in Zusammenhang mit einer PUVA-Behandlung existieren nur kasuistische Mitteilungen, wobei der Zusammenhang zwischen der PUVA-Therapie und dem Auftreten des Tumors fraglich ist.
Bezüglich der Teratogenität liegt kaum wissenschaftliches Erkenntnismaterial vor: Seeigeleier, die mit Spermien befruchtet wurden, die zuvor mit PUVA behandelt worden waren, entwickelten sich nicht regelrecht. In einer Arbeit wurde das genetische Risiko für Männer durch PUVA abgeschätzt und als unerheblich bewertet.
Zur Mutagenität liegt kein wissenschaftliches Erkenntnismaterial vor.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Lactose, Magnesiumstearat (Ph.Eur.) , Maisstärke, Gelatine.
6.2 Inkompatibilitäten
Vor der Behandlung sind eventuell vorhandene Lichtschutzmittel gründlich abzuwaschen.
6.3 Dauer der Haltbarkeit
5 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich
6.5 Art und Inhalt des Behältnisses
Originalpackung mit 50 Tabletten.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. Inhaber der Zulassung
Galderma Laboratorium GmbH Georg-Glock-Str. 8 D-40474 Düsseldorf Telefon: (02 11) 5 86 01-04 Telefax: (02 11) 4 54 40 08 germany@galderma.com
8. Zulassungsnummer 17836.00.00
9. Datum der Erteilung der Zulassung / Verlängerung der Zulassung
29.12.1992 / 06.03.2003
10. Stand der Information
11/2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
10