Metformin Al 850
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
1. Bezeichnung des Arzneimittels
Metformin AL 500
Metforminhydrochlorid 500 mg pro Filmtablette Metformin AL 850
Metforminhydrochlorid 850 mg pro Filmtablette
2. Qualitative und quantitative Zusammensetzung
Metformin AL 500
1 Filmtablette enthält 500 mg Metforminhydrochlorid (entspr. 390 mg Metformin) Metformin AL 850
1 Filmtablette enthält 850 mg Metforminhydrochlorid (entspr. 662,9 mg Metformin)
Die vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1
3. Darreichungsform
Filmtablette Metformin AL 500
Weiße, runde, bikonvexe Filmtablette.
Metformin AL 850
Weiße, oblonge Filmtablette mit beidseitiger Bruchkerbe (Snap-Tab-Form).
Die Bruchkerbe dient nur zum Teilen der Tablette, um das Schlucken zu erleichtern, und nicht zum Teilen in gleiche Dosen.
4. Klinische Angaben
4.1 Anwendungsgebiete
Therapie des Diabetes mellitus Typ 2; insbesondere bei übergewichtigen Patienten, bei denen allein durch Diät und körperliche Betätigung keine ausreichende Einstellung des Blutzuckerspiegels erreicht wurde.
• Bei Erwachsenen kann Metformin AL in Form einer Monotherapie oder in Kombination mit anderen oralen Antidiabetika bzw. Insulin angewendet werden.
• Bei Kindern ab 10 Jahren und bei Jugendlichen kann Metformin AL in Form einer Monotherapie oder in Kombination mit Insulin angewendet werden.
Bei übergewichtigen erwachsenen Patienten mit Diabetes mellitus Typ 2 konnte nach Versagen diätetischer Maßnahmen eine Senkung der Häufigkeit von Diabetes bedingten Komplikationen unter Behandlung mit Metforminhydrochlorid als Therapie der ersten Wahl nachgewiesen werden (siehe Abschnitt 5.1).
4.2 Dosierung und Art der Anwendung
Erwachsene
Monotherapie und Kombination mit anderen oralen Antidiabetika Im Allgemeinen besteht die Initialdosis aus der Gabe von einer Filmtablette mit 500 mg bzw. 850 mg Metforminhydrochlorid 2- oder 3-mal täglich, unzerkaut während oder nach den Mahlzeiten.
Nach 10-15 Tagen sollte die Dosierung in Abhängigkeit von den Messungen des Blutzuckerspiegels angepasst werden. Eine allmähliche Erhöhung der Dosierung wirkt sich positiv auf die gastrointestinale Verträglichkeit des Medikaments aus.
Die maximale empfohlene Tagesdosis beträgt 3 g Metforminhydrochlorid täglich.
Bei der Umstellung von einem anderen oralen Antidiabetikum auf Metforminhydrochlorid sollte zunächst das bisherige Medikament abgesetzt und danach die Therapie mit Metforminhydrochlorid in der oben angegeben Dosierung begonnen werden.
Kombination mit Insulin
Metforminhydrochlorid und Insulin können kombiniert werden, um eine bessere Einstellung des Blutzuckerspiegels zu erreichen. Metforminhydrochlorid wird in der üblichen Anfangsdosierung von einer Filmtablette mit 500 mg bzw. 850 mg Metforminhydrochlorid 2-3-mal täglich gegeben, während sich die Insulindosis nach den gemessenen Blutzuckerwerten richtet.
Ältere Patienten
Bedingt durch die bei älteren Patienten häufig eingeschränkte Nierenfunktion sollte sich die Dosierung von Metforminhydrochlorid nach der Nierenfunktion richten. Aus diesem Grund ist die regelmäßige Messung der Nierenfunktion notwendig (siehe Abschnitt 4.4).
Kinder ab 10 Jahre und Jugendliche Monotherapie und Kombinationstherapie mit Insulin
Im Allgemeinen besteht die Initialdosis aus der Gabe von einer Filmtablette mit 500 mg oder 850 mg Metforminhydrochlorid 1-mal täglich, während oder nach der Mahlzeit.
Nach 10-15 Tagen sollte die Dosierung in Abhängigkeit von den Blutzuckerwerten angepasst werden. Eine allmähliche Erhöhung der Dosierung wirkt sich positiv auf die gastrointestinale Verträglichkeit des Medikaments aus. Die maximale empfohlene Tagesdosis beträgt 2 g Metforminhydrochlorid täglich, eingenommen in 2 oder 3 Einzeldosen.
Zusätzlich für Metformin AL 850
Metformin AL 850 Filmtabletten ermöglichen durch eine neue Tablettenform (Snap-Tab-Technologie) eine einfache und genaue Teilung der Filmtablette. Die Filmtabletten können wahlweise wie andere Tabletten auch mit 2 Händen oder durch Auflegen mit der kleineren Bruchkerbe nach unten auf eine harte, flache Unterlage mit gleichzeitigem Daumendruck rechts und links der Bruchkerbe zerteilt werden.
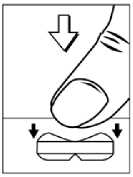
Falls die Filmtabletten zur Erleichterung der Einnahme geteilt werden sollten, sind die „Hälften" unverzüglich nacheinander einzunehmen!
Beträgt die notwendige Tagesdosis 2 oder mehr Filmtabletten, sollten diese auf 2 oder 3 Einzeldosen zu den Mahlzeiten verteilt werden. Die Aufteilung der Tagesdosis ist weniger für die gute Einstellung des Blutzuckers als für eine bessere Verträglichkeit von Bedeutung. Die Dauer der Anwendung richtet sich nach dem Verlauf der Erkrankung.
4.3 Gegenanzeigen
• Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
• Diabetische Ketoazidose, diabetisches Präkoma
• Nierenversagen oder Störung der Nierenfunktion (Kreatinin-Clearance <60 ml/min)
• akute Zustände, die zu einer Beeinträchtigung der Nierenfunktion führen können, z.B. Dehydratation, schwere Infektionen, Schock
• akute oder chronische Erkrankungen, die zu einer Gewebshypoxie führen können, z.B. kardiale oder respiratorische Insuffizienz, frischer Myokardinfarkt, Schock
• Leberinsuffizienz, akute Alkoholintoxikation, Alkoholismus.
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Laktatazidose
Bei der Laktatazidose handelt es sich um eine seltene, jedoch schwerwiegende (hohe Mortalität ohne schnelle Behandlung) metabolische Komplikation, die durch eine Akkumulation von Metformin verursacht werden kann. Die bisher bekannt gewordenen Fälle von Laktatazidose bei mit Metformin behandelten Patienten betrafen vor allem Diabetiker mit schwerer Niereninsuffizienz. Die Inzidenz der Laktatazidose kann und sollte durch die Erfassung von weiteren Risikofaktoren reduziert werden (z.B. schlecht eingestellter Diabetes, Ketonämie, längeres Fasten, übermäßiger Alkoholkonsum, Leberinsuffizienz und alle mit einer Hypoxie einhergehenden Zustände).
Diagnose
An das Risiko einer Laktatazidose muss beim Auftreten unspezifischer Symptome wie Muskelkrämpfe in Verbindung mit Verdauungsstörungen (wie Abdominalbeschwerden) sowie schwerer Asthenie in Betracht gezogen werden.
Laktatazidose ist gekennzeichnet durch eine azidotische Dyspnoe mit Abdominalbeschwerden und Hypothermie, gefolgt von Koma. Zu den für die Diagnose relevanten Laborparametern zählen ein erniedrigter pH-Wert des Blutes, Laktatspiegel im Plasma von über 5 mmol/l sowie eine Erhöhung der Anionenlücke und des Laktat/Pyruvat-Quotienten. Wenn der Verdacht auf das Vorliegen einer metabolischen Azidose besteht, sollte Metformin abgesetzt und der Patient sofort stationär aufgenommen werden (siehe Abschnitt 4.9).
Ärzte sollten ihre Patienten warnend auf die Risiken und Symptome einer Laktatazidose hinweisen.
Nierenfunktion
Da Metformin über die Nieren ausgeschieden wird, sollte vor Beginn der Behandlung sowie danach in regelmäßigen Abständen eine Kontrolle der Kreatinin-Clearance durchgeführt werden (diese kann auf Basis des Serumkreatininspiegels mit Hilfe der Cockroft-Gault-Formel berechnet werden):
• mindestens jährlich bei Patienten mit normaler Nierenfunktion
• mindestens zwei- bis viermal jährlich bei Patienten, deren Kreatinin-Clearance an der unteren Grenze des Normbereiches liegt, sowie bei älteren Patienten.
Eine verminderte Nierenfunktion ist bei älteren Patienten häufig und asymptomatisch. Besondere Vorsicht ist in Situationen angebracht, in denen es zu einer Einschränkung der Nierenfunktion kommen kann (z.B. bei Beginn einer Therapie mit Antihypertensiva oder Diuretika oder mit nichtsteroidalen Antiphlogistika; NsAr).
Gabe von jodhaltigen Kontrastmitteln
Die intravaskuläre Gabe von iodhaltigen Kontrastmitteln bei radiologischen Untersuchungen kann zu Niereninsuffizienz führen. Die kann zu einer
Akkumulation von Metformin führen und so das Risiko für eine Laktatazidose erhöhen. Metformin muss vor, während und bis 48 h nach der Untersuchung abgesetzt werden. Die Fortsetzung der Therapie darf erst erfolgen, wenn durch eine neuerliche Untersuchung eine normale Nierenfunktion festgestellt wurde (siehe Abschnitt 4.5).
Chirurgische Eingriffe
Metformin muss 48 Stunden vor elektiven chirurgischen Eingriffen unter Vollnarkose, Spinal- oder Periduralanästhesie abgesetzt werden. Die Fortsetzung der Therapie darf nicht früher als 48 Stunden nach dem Eingriff bzw. der Wiederaufnahme einer oralen Ernährung erfolgen und nur, wenn eine normale Nierenfunktion eindeutig festgestellt wurde.
Weitere Vorsichtsmaßnahmen
• Alle Patienten sollten ihre Diät weiterführen, wobei auf eine adäquate Verteilung der Kohlehydratzufuhr über den Tag zu achten ist.
Übergewichtige Patienten sollten ihre kalorienreduzierte Diät weiterführen.
• Die Routine-Laboruntersuchungen zur Überwachung des Diabetes mellitus sollten regelmäßig durchgeführt werden.
• Metformin alleine führt nicht zu Hypoglykämie, allerdings ist bei der Kombination mit Insulin oder anderen oralen Antidiabetika (z.B. Sulfonylharnstoffe oder Glinide) Vorsicht angebracht.
Kinder und Jugendliche
Die Diagnose eines Diabetes mellitus Typ 2 muss bestätigt sein, bevor eine Behandlung mit Metformin begonnen wird.
Während 1-jähriger kontrollierter klinischer Studien wurde keine Beeinflussung von Wachstum und Pubertät durch Metformin beobachtet, aber Langzeitergebnisse liegen zu diesen spezifischen Fragestellungen noch nicht vor. Deshalb wird eine sorgfältige Nachbeobachtung der Metforminwirkungen in Bezug auf diese Parameter bei mit Metformin behandelten Kindern, besonders vor der Pubertät, empfohlen.
Kinder zwischen 10 und 12 Jahren
Nur 15 Personen aus der Altersgruppe zwischen 10 und 12 Jahren waren in die kontrollierten klinischen Studien eingeschlossen, die mit Kindern und Jugendlichen durchgeführt wurden. Obwohl sich Wirksamkeit und Sicherheit von Metformin bei diesen Kindern nicht unterschieden von Wirksamkeit und Sicherheit bei älteren Kindern und Jugendlichen, wird besondere Vorsicht bei der Verordnung von Metformin für Kinder zwischen 10 und 12 Jahren empfohlen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Nicht zu empfehlende Kombinationen Alkohol
• Bei akuter Alkoholintoxikation besteht ein erhöhtes Risiko einer Laktatazidose, vor allem im Zusammenhang mit Fasten oder Mangelernährung.
• Leberinsuffizienz.
Alkoholkonsum und alkoholhaltige Arzneimittel sind zu meiden.
Iodhaltige Kontrastmittel
Durch die intravaskuläre Gabe von iodhaltigen Kontrastmitteln kann es zu Niereninsuffizienz und damit zu einer Akkumulation von Metformin kommen, sodass ein erhöhtes Risiko einer Laktatazidose besteht.
Metformin muss vor, während und bis 48 h nach der Untersuchung abgesetzt werden. Die Fortsetzung der Therapie darf erst erfolgen, wenn durch eine neuerliche Untersuchung eine normale Nierenfunktion festgestellt wurde (siehe Abschnitt 4.4).
Kombinationen, bei denen Vorsichtsmaßnahmen erforderlich sind
• Arzneimittel mit intrinsischer hyperglykämischer Aktivität (z.B. Glukokortikoide [systemische und lokale Anwendung] und Sympathomimetika). Vor allem zu Beginn der Therapie kann eine häufigere Messung der Blutzuckerspiegel erforderlich sein. Sofern notwendig, ist die Dosierung von Metformin während der Therapie mit dem betreffenden Arzneimittel anzupassen.
• Diuretika, insbesondere Schleifendiuretika, können aufgrund ihres Potenzials, die Nierenfunktion einzuschränken, das Risiko für die Entwicklung einer Laktatazidose erhöhen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Unkontrollierter Diabetes während der Schwangerschaft (gestationsbedingt oder vorbestehend) ist mit einem erhöhten Risiko für kongenitale Missbildungen und perinatale Mortalität verbunden.
Die begrenzten Daten zur Anwendung von Metformin bei schwangeren Frauen ergaben keine Hinweise auf ein erhöhtes Risiko für kongenitale Missbildungen. Tierexperimentelle Studien lassen nicht auf schädliche Wirkungen auf Schwangerschaft, embryonale und fetale Entwicklung, Geburt oder postnatale Entwicklung schließen.
Patientinnen mit Diabetes, die schwanger sind oder dies werden möchten, sollten nicht mit Metformin behandelt werden. Der Blutzuckerspiegel sollte in diesen Fällen durch Insulin so gut wie möglich auf normale Werte eingestellt werden, um das Risiko von fetalen Missbildungen zu senken.
Stillzeit
Metformin wird beim Menschen in die Muttermilch ausgeschieden. Bei gestillten Neugeborenen/Säuglingen wurden keine Nebenwirkungen beobachtet. Da
jedoch nur begrenzte Daten vorliegen, wird das Stillen während einer Behandlung mit Metformin nicht empfohlen. Die Entscheidung abzustillen, sollte unter Berücksichtigung des Nutzens des Stillens und des potenziellen Risikos für Nebenwirkungen für das Kind getroffen werden.
Fertilität
Die Fertilität von männlichen und weiblichen Ratten wurde durch Metformin nicht beeinträchtigt, wenn Dosen bis zu 600 mg/kg/Tag verabreicht wurden, dies entspricht ungefähr dem Dreifachen der maximal beim Menschen empfohlenen Tagesdosis, basierend auf Vergleichen der Körperoberfläche.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Eine Monotherapie mit Metformin führt nicht zu Hypoglykämie und hat daher keine Auswirkungen auf die Fahrtüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen. Die Patienten sollten jedoch darüber informiert werden, dass bei Kombination von Metformin und anderen Antidiabetika (Sulfonylharnstoffe, Insulin oder Glinide) das Risiko einer Hypoglykämie besteht.
4.8 Nebenwirkungen
Die nachfolgenden Nebenwirkungen können bei Behandlung mit Metformin auftreten. Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeiten zugrunde gelegt: sehr häufig (>1/10), häufig (>1/100 bis <1/10), gelegentlich (>1/1.000 bis <1/100), selten (>1/10.000 bis <1/1.000), sehr selten (<1/10.000), nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar).
Erkrankungen des Nervensystems Häufig: Geschmacksveränderung.
Erkrankungen des Gastrointestinaltrakts
Sehr häufig: Gastrointestinale Symptome wie Übelkeit, Erbrechen, Durchfall, Abdominalschmerzen und Appetitverlust. Diese Nebenwirkungen treten meist zu Therapiebeginn auf und verschwinden in den meisten Fällen spontan. Um sie zu verhindern, wird empfohlen, die Tagesdosis von Metformin auf 2 oder 3 Einnahmen während der oder nach den Mahlzeiten zu verteilen. Eine langsame Steigerung der Dosierung kann die gastrointestinale Verträglichkeit ebenfalls verbessern.
Erkrankungen der Haut und des Unterhautzellgewebes Sehr selten: Hautreaktionen wie Erythem, Pruritus und Urtikaria.
Stoffwechsel- und Ernährungsstörungen
Sehr selten: Laktatazidose (siehe Abschnitt 4.4). Senkung der Absorption von Vitamin B12 sowie eine Senkung der Serumspiegel bei langfristiger Behandlung mit Metformin. Dies sollte bei Patienten mit megaloblastärer Anämie als mögliche Ursache in Betracht gezogen werden.
Leber- und Gallenerkrankungen
Sehr selten: Einzelfälle mit Abnormalitäten der Leberfunktionstests oder Hepatitis, die nach Absetzen von Metformin reversibel sind.
Kinder und Jugendliche
In publizierten und Postmarketing-Daten und in 1-jährigen kontrollierten klinischen Studien an einer begrenzten Anzahl von Kindern und Jugendlichen im Alter zwischen 10 und 16 Jahren wurden Nebenwirkungen von der gleichen Art und Schwere gemeldet wie in den Studien mit Erwachsenen.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzuzeigen.
4.9 Überdosierung
Bei Dosierungen von bis zu 85 g Metforminhydrochlorid wurde keine Hypoglykämie beobachtet, auch wenn es unter diesen Umständen zu einer Laktatazidose kam. Bei starker Überdosierung von Metformin oder Vorhandensein von Begleitrisiken kann es zu einer Laktatazidose kommen. Dabei handelt es sich um einen medizinischen Notfall, der im Krankenhaus behandelt werden muss. Die wirksamste Methode zur Entfernung von Laktat und Metformin aus dem Körper ist die Hämodialyse.
5. Pharmakologische Eigenschaften
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Antidiabetika, exkl. Insuline ATC-Code: A10BA02
Metformin ist ein Biguanid mit blutzuckersenkender Wirkung und bewirkt eine Senkung sowohl des basalen als auch des postprandialen Blutzuckerspiegels. Es stimuliert nicht die Insulinsekretion und führt daher nicht zu Hypoglykämie.
Die Wirkung von Metformin beruht wahrscheinlich auf 3 Mechanismen:
1. Senkung der Glukoseproduktion in der Leber durch Hemmung der Glukoneogenese und der Glykogenolyse
2. Erhöhung der Insulinempfindlichkeit in der Muskulatur und damit Verbesserung der peripheren Glukoseaufnahme und -verwertung
3. Hemmung der intestinalen Glukoseabsorption.
Metformin stimuliert die intrazelluläre Glykogensynthese durch seine Wirkung auf die Glykogensynthase.
Metformin erhöht die Transportkapazität von allen bis jetzt bekannten membranständigen Transportproteinen für Glukose (GLUT).
Beim Menschen besitzt Metformin unabhängig von seiner Wirkung auf den Blutzuckerspiegel eine günstige Wirkung auf den Fettstoffwechsel. Dies wurde in therapeutischer Dosierung in kontrollierten mittelfristigen Studien und Langzeitstudien nachgewiesen. Metformin führt zu einer Senkung des Gesamtcholesterins, des LDL-Cholesterins und der Triglyceride.
Klinische Wirksamkeit
In einer prospektiven randomisierten Studie (UKPDS) wurde der langfristige Nutzen einer intensiven Kontrolle der Einstellung des Blutzuckerspiegels bei erwachsenen Typ 2-Diabetikern nachgewiesen.
Bei der Analyse der Resultate für übergewichtige Patienten, die nach dem Versagen von diätetischen Maßnahmen allein mit Metforminhydrochlorid behandelt wurden, kam man zu den folgenden Ergebnissen:
• signifikante Senkung des absoluten Risikos aller diabetesbedingten Komplikationen in der mit Metforminhydrochlorid behandelten Gruppe (29,8 Ereignisse/ 1000 Patientenjahre) gegenüber Diät allein (43,3 Ereignisse/ 1000 Patientenjahre), p=0,0023 sowie gegenüber den mit Sulfonylharnstoffen und mit Insulin allein behandelten Gruppen (40,1 Ereignisse/ 1000 Patientenjahre), p=0,0034
• signifikante Senkung des absoluten Risikos für diabetesbedingte Mortalität: Metforminhydrochlorid 7,5 Ereignisse/1000 Patientenjahre gegenüber Diät allein 12,7 Ereignisse/ 1000 Patientenjahre, p=0,017
• signifikante Senkung des absoluten Risikos für Mortalität insgesamt: Metforminhydrochlorid 13,5 Ereignisse/ 1000 Patientenjahre gegenüber Diät allein 20,6 Ereignisse/1000 Patientenjahre (p=0,011) und gegenüber den mit Sulfonylharnstoffen und mit Insulin allein behandelten Gruppen 18,9 Ereignisse/1000 Patientenjahre (p=0,021)
• signifikante Senkung des absoluten Risikos für Myokardinfarkt: Metforminhydrochlorid 11 Ereignisse/ 1000 Patientenjahre, Diät allein 18 Ereignisse/1000 Patientenjahre (p=0,01).
Bei Verwendung von Metforminhydrochlorid als Begleitmedikament in Verbindung mit einem Sulfonylharnstoff konnte kein Vorteil hinsichtlich des klinischen Resultats nachgewiesen werden.
Bei Typ 1-Diabetes wurde bei ausgewählten Patienten die Kombination aus Metforminhydrochlorid und Insulin eingesetzt, aber der klinische Vorteil dieser Kombination konnte nicht zweifelsfrei nachgewiesen werden.
Kontrollierte einjährige klinische Studien an einer begrenzten Zahl von Patienten im Alter zwischen 10 und 16 Jahren zeigten eine ähnliche Wirkung auf die Blutzuckereinstellung wie bei Erwachsenen.
5.2 Pharmakokinetische Eigenschaften
Resorption
Nach einer oralen Dosis Metforminhydrochlorid wird die maximale Konzentration (tmax) nach 2,5 Stunden erreicht. Die absolute Bioverfügbarkeit einer 500 mg oder 850 mg Filmtablette Metforminhydrochlorid beträgt bei gesunden Patienten ca. 50-60%. Nach einer oralen Dosis beträgt die nicht absorbierte und mit dem Stuhl ausgeschiedene Fraktion 20-30%.
Nach oraler Gabe ist die Absorption von Metforminhydrochlorid unvollständig und zeigt Sättigungscharakter. Man nimmt an, dass die Pharmakokinetik der Metforminabsorption nicht linear ist.
Bei der empfohlenen Dosierung und den gebräuchlichen Dosierungsintervallen wird der Gleichgewichtszustand hinsichtlich der Plasmakonzentrationen innerhalb von 24 bis 48 Stunden erreicht. Letztere betragen im Allgemeinen weniger als 1 gg/ml. In kontrollierten klinischen Studien überstiegen die maximalen Plasmakonzentrationen (Cmax) von Metformin selbst bei maximaler Dosierung nicht 4 gg/ml. Durch die Aufnahme von Nahrung wird die Absorption von Metformin verringert und leicht verzögert. Nach Gabe einer Dosis von 850 mg zeigte sich eine um 40% geringere maximale Plasmakonzentration, eine Senkung der AUC (area under the curve) um 25% und eine Verlängerung der Zeit bis zum Erreichen der maximalen Plasmakonzentration (tmax) um 35 Minuten. Die klinische Relevanz dieser Ergebnisse ist nicht bekannt.
Verteilung
Die Bindung an Plasmaproteine ist zu vernachlässigen. Metformin geht in die Erythrozyten über. Die maximale Konzentration im Vollblut ist geringer als im Plasma und stellt sich ungefähr zur selben Zeit ein. Die Erythrozyten stellen wahrscheinlich ein sekundäres Verteilungskompartiment dar. Das mittlere Verteilungsvolumen (Vd) schwankt zwischen 63 und 276 l.
Biotransformation
Metformin wird in unveränderter Form mit dem Urin ausgeschieden. Beim Menschen wurden bisher keine Abbauprodukte identifiziert.
Elimination
Die renale Clearance für Metformin beträgt > 400 ml/min, was darauf hinweist, dass Metformin durch glomeruläre Filtration und tubuläre Sekretion
ausgeschieden wird. Nach einer oralen Dosis beträgt die terminale Eliminationshalbwertszeit ungefähr 6,5 Stunden. Bei eingeschränkter Nierenfunktion sinkt die renale Clearance proportional zur Kreatininclearance, sodass die Eliminationshalbwertszeit verlängert wird und die Metforminkonzentration im Plasma steigt.
Kinder und Jugendliche
Einzeldosisstudie: Nach einer einzelnen Dosis von 500 mg Metforminhydrochlorid zeigten pädiatrische Patienten das gleiche pharmakokinetische Profil wie gesunde Erwachsene.
Mehrfachdosenstudie: Nach wiederholter Gabe von 2-mal täglich 500 mg Metformin für 7 Tage waren die mittlere maximale Plasmakonzentration (cmax) und die systemische Aufnahme (AUC) um ca. 33 bzw. 40% reduziert, im Vergleich zu erwachsenen Diabetikern, die 14 Tage lang wiederholte Dosen von 2-mal 500 mg erhielten. Da die Dosis abhängig von der Blutzuckerkontrolle individuell titriert wird, ist dies jedoch von begrenzter klinischer Relevanz.
5.3 Präklinische Daten zur Sicherheit
Nach den präklinischen Daten besteht aufgrund der konventionellen Studien hinsichtlich pharmakologischer Sicherheit, Toxizität von wiederholten Dosen, Genotoxizität, karzinogenes Potential und Reproduktionstoxizität keine besondere Gefahr für den Menschen.
6. Pharmazeutische Angaben
6.1 Liste der sonstigen Bestandteile
Hypromellose, Macrogol 6000, Magnesiumstearat (Ph.Eur), Povidon K25, Titandioxid (E171).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
5 Jahre.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Für dieses Arzneimittel sind keine besonderen Lagerungsbedingungen erforderlich.
6.5 Art und Inhalt des Behältnisses
PVC/Aluminium-Blisterpackung
Originalpackung mit 30, 120 und 180 Filmtabletten
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Nicht verwendetes Arzneimittel oder Abfallmaterial ist entsprechend den nationalen Anforderungen zu beseitigen.
7. Inhaber der Zulassung
ALIUD PHARMA® GmbH Gottlieb-Daimler-Straße 19 D-89150 Laichingen Telefon: 07333/9651-0 Telefax: 07333/9651-6004 info@aliud.de
8. Zulassungsnummern
38558.00. 00
38559.00. 00
9. Datum der Erteilung der Zulassung/Verlängerung der Zulassung
Metformin AL 500 07.01.1999/18.03.2003
Metformin AL 850 19.03.1998/18.03.2003
10. Stand der Information
Januar 2014
11. Verkaufsabgrenzung
Verschreibungspflichtig
12