Minoxidil Bio-H-Tin-Pharma 20 Mg/Ml Spray Zur Anwendung Auf Der Haut, Lösung
Seite 1
Fachinformation (Zusammenfassung der Merkmale des Arzneimittels/SPC)
BIO-H-TIN Pharma KG
Minoxidil BIO-H-TIN-Pharma 20mg/ml Spray
1. BEZEICHNUNG DES ARZNEIMITTELS
Minoxidil BIO-H-TIN-Pharma 20 mg/ml Spray zur Anwendung auf der Haut, Lösung
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 ml Lösung enthält 20 mg Minoxidil.
Sonstiger Bestandteil mit bekannter Wirkung: Propylenglycol.
Vollständige Auflistung der sonstigen Bestandteile, siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Spray zur Anwendung auf der Haut, Lösung
Klare, leicht gelbliche bis rosafarbene Lösung zur Anwendung auf der Kopfhaut
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete
Androgenetische Alopezie bei Frauen und Männern
Minoxidil BIO-H-TIN-Pharma ist nur für Erwachsene (18 - 65 Jahre) angezeigt.
4.2 Dosierung und Art der Anwendung
Dosierung
Erwachsene über 18 Jahre
Ausgehend von der Mitte der betroffenen Stelle wird zweimal täglich je 1 ml Minoxidil BIO-H-TIN-Pharma auf die Kopfhaut aufgetragen. Diese Dosierung ist ungeachtet der Größe der betroffenen Stelle einzuhalten. Die täglich applizierte Gesamtmenge darf 2 ml nicht übersteigen.
Klinischen Erfahrungen mit Minoxidil BIO-H-TIN-Pharma zufolge kann bei zweimal täglicher Applikation nach frühestens vier Monaten sichtbarer, neuer Haarwuchs erwartet werden.
Minoxidil BIO-H-TIN-Pharma ist zur äußerlichen Anwendung auf der trockenen Kopfhaut bestimmt. Die Anwendungshinweise sind unbedingt genau einzuhalten, eine Applikation auf andere Körperteile als die Kopfhaut soll unterbleiben.
Die entsprechende Dosis wird von der Mitte der betroffenen Stelle ausgehend auf die Kopfhaut aufgetragen. Haar und Kopfhaut müssen vollkommen trocken sein. Nach dem Auftragen sind die Hände gründlich zu waschen.
Kinder und Jugendliche
Die Sicherheit und Wirksamkeit bei Kindern und Jugendlichen unter 18 Jahren ist nicht erwiesen. Es liegen keine Daten vor.
Ältere Patienten
Aktuell wurden keine umfassenden klinischen Studien mit Minoxidil bei Patienten über 65 Jahre durchgeführt, so dass bei diesen Patienten keine Daten zur Sicherheit und Wirksamkeit von Minoxidil topischer Lösung vorliegen.
Art der Anwendung
Die Auftragungsmethode ist je nach Applikator verschieden: Sprühkopf - für großflächige Anwendung
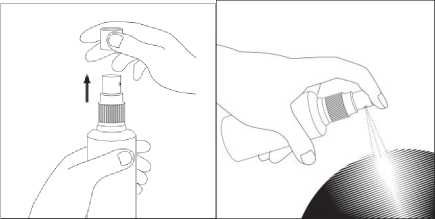
Abbildung 1 Abbildung 2
• Nehmen Sie die Kappe von dem Sprühkopf ab (Abbildung 1) und sprühen Sie direkt auf die Kopfhaut im Bereich des Haarverlusts (Abbildung 2). Sieben Pumpstöße ergeben 1 ml Lösung. Nach jedem Pumpvorgang die Flüssigkeit mit den Fingerspitzen auf der betroffenen Fläche verteilen. Vermeiden Sie dabei das Einatmen von Sprühdämpfen.
• Die Flasche nach jedem Gebrauch mit der Kappe verschließen.
Pumpsprühapplikator mit verlängerter Spitze - für kleinflächige Anwendung
|
1 |
t - |
l |
|
■ |
H |
m |
|
Aaa ±ng 1 |
Aööidüg 2 |
Aao 3jng 3 ’ |
|
WT* |
ÄöWdungA Aao-Arg5
• Die Kappe von der Flasche abnehmen (Abbildung 1). Den kleinen Sprühkopf abnehmen (Abbildung 2) und die verlängerte Spitze fest aufsetzen (Abbildung 3).
• Die verlängerte Spitze in eine 90° Position (Abbildung 4) drehen, so dass der Applikator bequem an dem zu behandelnden Bereich angewendet werden kann.
• Direkt auf die Kopfhaut im Bereich des Haarverlusts sprühen (Abbildung 5). Sieben Pumpstöße ergeben 1 ml Lösung. Nach jedem Pumpvorgang die Flüssigkeit mit den Fingerspitzen auf der betroffenen Fläche verteilen. Dabei das Einatmen von Sprühdämpfen vermeiden.
4.3 Gegenanzeigen
Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile.
Gleichzeitige Anwendung von anderen topischen Arzneimitteln auf der Kopfhaut.
Minoxidil BIO-H-TIN-Pharma darf nicht bei Patienten unter 18 Jahren angewendet werden.
Haarausfall nach einer Entbindung ist bis zu einem gewissen Grad normal. Daher sollte Minoxidil BIO-H-TIN-Pharma in diesem Fall nicht angewendet werden.
Bei plötzlich einsetzendem, starkem Haarausfall oder Alopezia areata ist eine diagnostische Abklärung vorliegender Grunderkrankungen erforderlich. Gegebenenfalls ist eine kausale Therapie einzuleiten.
Der Einsatz des Arzneimittels gegen Haarausfall ist nicht erforderlich:
• unter zytostatischer Therapie (U. U. kann es zu einem rascheren Nachwachsen der Haare kommen. Der Haarausfall selbst wird durch das Arzneimittel nicht verhindert).
• bei ernährungsbedingtem Haarausfall
• bei Haarausfall nach Absetzen hormoneller Kontrazeptiva- hier ist normalerweise
eine medikamentöse Therapie nicht erforderlich
• wenn die Kopfhaut durch Verbrennungen oder Vernarbungen geschädigt ist
• sofern der Haarausfall durch zu straffes Zusammenbinden der Haare verursacht wird (z.B. Pferdeschwanz)
• Schwangerschaft
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Minoxidil BIO-H-TIN-Pharma darf nur auf eine normale, gesunde Kopfhaut aufgetragen werden.
Ausgedehnte klinische Prüfungen erbrachten keinen Hinweis auf eine Minoxidilresorption, die zur Erzielung systemischer Wirkungen ausgereicht hätte. Eine geringe Menge des Wirkstoffes wird allerdings resorbiert, so dass ein Restrisiko systemischer Erscheinungen nicht auszuschließen ist (z. B. Salz- und Wasserretention, generalisierte und lokale Ödeme, Perikarderguss, Perikarditis, Tamponade, Tachykardie, Angina oder Verstärkung einer Guanethidin-bedingten orthostatischen Hypotension).
Beim Auftreten schwerer dermatologischer Nebenwirkungen ist das Arzneimittel abzusetzen.
Bei versehentlichem Augenkontakt verursacht Minoxidil BIO-H-TIN-Pharma Brennen und kann zu Reizungen führen. Auch das Benetzen empfindlicher Hautoberflächen (Schleimhäute, abgeschürfte Stellen) kann zu ähnlichen Erscheinungen führen. In solchen Fällen ist das Arzneimittel möglichst schnell mit reichlich Wasser abzuspülen.
Das Einatmen von Minoxidil BIO-H-TIN-Pharma soll vermieden werden.
Eine versehentliche Einnahme von Minoxidil BIO-H-TIN-Pharma kann zu schweren kardialen Nebenwirkungen führen. Das Arzneimittel muss unbedingt für Kinder unerreichbar aufbewahrt werden.
Es ist nicht bekannt, welche Auswirkungen eine Therapie mit Minoxidil BIO-H-TIN-Pharma bei Patienten mit bestehenden Hauterkrankungen bzw. Anwendern von Kortikosteroid- oder anderen dermatologischen Zubereitungen hat.
Die Bestrahlung mit künstlichem UV-Licht oder Sonnenlicht sollte vermieden werden.
Bei einigen Patienten veränderten sich nach der Therapie mit Minoxidil Haarfarbe und Haarbeschaffenheit.
Patienten mit bekannten Herz-Kreislauf-Erkrankungen oder Herzrhythmusstörungen sollten vor der Anwendung von Minoxidil BIO-H-TIN-Pharma den Arzt befragen.
Bei Auftreten von Blutdruckerniedrigung, Brustschmerzen, beschleunigtem Herzschlag, Schwäche- oder Schwindelgefühl, plötzlicher unerklärlicher Gewichtszunahme, geschwollenen Händen oder Füßen, anhaltender Rötung oder Reizung der Kopfhaut, sollte die Anwendung abgebrochen und ein Arzt aufgesucht werden.
Propylenglycol kann Hautreizungen hervorrufen.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Bisher sind keine Arzneimittelinteraktionen mit Minoxidil bekannt. Die Resorption von topischem Minoxidil wird vom Stratum corneum kontrolliert und mengenmäßig limitiert. Daher könnten topische Arzneimittel mit Einfluss auf die Stratum corneum Barriere -wie z. B. Tretinoin und Anthralin - bei gleichzeitiger Anwendung zu einer gesteigerten Resorption von topisch appliziertem Minoxidil führen. Die Applikation sollte daher nicht zusammen mit anderen topischen Zubereitungen erfolgen.
Theoretisch ist eine Wirkungsverstärkung von peripheren Vasodilatatoren nicht völlig auszuschließen.
4.6 Fertilität, Schwangerschaft und Stillzeit
Systemisch resorbiertes Minoxidil geht in die Muttermilch über.
Es gibt keine einschlägigen kontrollierten Studien an schwangeren Frauen.
Bei, im Vergleich zu therapeutischen Dosierungen, sehr hohen Gaben, zeigte sich in Tierstudien ein Risiko für den Fötus. Ein geringes Risiko fötaler Schädigungen ist somit beim Menschen nicht auszuschließen (siehe Abschnitt 5.3: Präklinische Daten zur Sicherheit).
Die topische Anwendung von Minoxidil in Schwangerschaft und Stillzeit sollte nur unter strenger Nutzen-Risiko-Abwägung für die Mutter einerseits und für den Fötus bzw. Säugling andererseits erfolgen.
Fertilität
Es wurden keine Studien zur Auswirkung auf die Fertilität durchgeführt.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Nicht zutreffend.
4.8 Nebenwirkungen
|
Systemorgan klassen |
Häufig (> 1/100 bis < 1/10) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (<1/10.000) |
|
Erkrankungen des Nervensystems |
Kopfschmerz, Neuritis, Schwindel, Benommenheit |
|
Systemorgan klassen |
Häufig (> 1/100 bis < 1/10) |
Selten (> 1/10.000 bis < 1/1.000) |
Sehr selten (<1/10.000) |
|
Herz erkrankungen |
Veränderungen des Blutdrucks bzw. der Herzfrequenz, Palpitationen In ausgedehnten klinischen Studien traten unerwünschte Wirkungen auf das HerzKreislaufsystem unter Minoxidil nicht häufiger als unter Placebo auf. | ||
|
Gefäß erkrankungen |
Blutdruckabfall | ||
|
Erkrankungen der Atemwege, des Brustraums und Mediastinums |
Allergische Rhinitis, Kurzatmigkeit, Ödeme, Schmerzen im Brustraum | ||
|
Erkrankungen der Haut und des Unterhautzell gewebes |
Leichte Dermatitis der Kopfhaut |
Lokale Hautreizungen einschließlich Hautrötung, Juckreiz, Schuppenbildung und Brennen, Hautirritationen, Hautausschlag, Dermatitis, unspezifische allergische Erscheinungen, Urtikaria, Gesichtsschwellung |
Hypertrichose an nicht mit Minoxidil behandelten Stellen (bei Frauen auch im Gesicht), allergische Kontaktdermatitis, Folliculitis, Alopezie, Seborrhoe |
Einige Patienten beobachteten nach Beginn der Behandlung mit Minoxidil BIO-H-TIN-Pharma eine Verstärkung des Haarausfalls. Dies ist vermutlich auf jene Minoxidilwirkung zurückzuführen, welche das Haar aus der ruhenden Telogen- in die wachsende Anagenphase überführt (alte Haare fallen aus und machen nachwachsenden Haaren Platz). Dieser vorübergehend verstärkte Haarausfall setzt meist 2 - 6 Wochen nach Anwendungsbeginn ein und verschwindet innerhalb einiger Wochen von selbst. Sollte dies länger als zwei Wochen anhalten, ohne dass eine Besserung feststellbar ist, sollte die Anwendung abgebrochen werden.
Einzelne Fälle mit gleichzeitigem Auftreten von Myalgien oder Arthralgien, Müdigkeit, Asthenie oder Gewichtsverlust sowie abnormen Leberfunktionswerten wurden beschrieben. Nach dem Absetzen von Minoxidil BIO-H-TIN-Pharma waren diese Veränderungen reversibel.
Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-RisikoVerhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger Allee 3, D-53175 Bonn, Website: www.bfarm.de anzuzeigen.
4.9 Überdosierung
Die versehentliche Einnahme oder eine übermäßige Anwendung können systemische Effekte auslösen, die mit der gefäßerweiternden Wirkung von Minoxidil zusammenhängen (5 ml Minoxidil BIO-H-TIN-Pharma 20 mg/ml enthalten 100 mg Minoxidil, also die für Erwachsene maximal empfohlene Dosierung zur Behandlung einer Hypertonie).
Symptome einer Überdosierung äußern sich meist im kardiovaskulären Bereich und werden von Flüssigkeitsretention und Tachykardie begleitet. Die Behandlung erfolgt durch Gabe eines geeigneten Diuretikums oder eines Betablockers. Bei symptomatischer Hypotonie sollte eine physiologische Kochsalzlösung intravenös verabreicht werden.
Sympathomimetika sind im Hinblick auf ihre starke herzstimulierende Wirkung zu vermeiden.
Ol Ol
. PHARMAKOLOGISCHE EIGENSCHAFTEN
.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Andere Dermatika ATC Code: D11AX01
Minoxidil ist eine gefäßerweiternde Substanz, die bei systemischer_Anwendung eine ausgeprägte Blutdrucksenkung hervorruft.
Die topische Applikation von Minoxidil führt bei Patienten mit einer androgenetischen Alopezie zur Stimulation des Haarwuchses.
Übermäßiger Haarausfall wird bei regelmäßiger Anwendung bereits nach wenigen Wochen gestoppt. Darüber hinaus kann es zu neuem Haarwuchs kommen. Dieser wird frühestens zirka vier Monate nach Therapiebeginn sichtbar.
Ein kosmetisch befriedigendes Nachwachsen von Terminalhaaren wurde bei bis zu 40 % der mit Minoxidil BIO-H-TIN-Pharma 20 mg/ml behandelten Patienten nach einem Jahr Behandlung beobachtet. Mit Minoxidil BIO-H-TIN-Pharma 50 mg/ml stieg die Erfolgsrate auf etwa 50 %.
Der Wirkungseintritt und der Grad der Verdichtung des Kopfhaares variiert je nach Patient. Insbesonders sprechen fortgeschrittene und seit mehr als 10 Jahren bestehende androgenetische Alopezien weniger gut auf Minoxidil BIO-H-TIN-Pharma 20 mg/ml an. Dies dürfte mit dem Fehlen der Haarwurzeln zusammenhängen, deren Vorhandensein für die Wirkung notwendig ist.
Mit dem Absetzen der Behandlung endet das Wachstum der neuen Haare und innerhalb von 3 - 4 Monaten entspricht der Zustand wieder jenem vor Therapiebeginn.
5.2 Pharmakokinetische Eigenschaften
Die Konzentration von Minoxidil im Serum nach topischer Anwendung von Minoxidil BIO-H-TIN-Pharma ist von der individuellen perkutanen Absorptionsrate abhängig. Topisch appliziertes Minoxidil wird von der intakten Kopfhaut im Mittel nur zu durchschnittlich 1,4 % resorbiert. Der Einfluss gleichzeitig bestehender Hauterkrankungen auf die Resorption ist nicht bekannt.
Die Minoxidil-Konzentrationen im Serum liegen nach topischer Anwendung weit unter den nach oraler Gabe erreichten Konzentrationen. Nach Therapieende werden ca. 95 % des systemisch aufgenommenen Minoxidils innerhalb von 4 Tagen hauptsächlich über die Niere ausgeschieden.
5.3 Präklinische Daten zur Sicherheit
Tierstudien haben gezeigt, dass ein Risiko für den Fötus besteht, wenn er einer im Vergleich zur therapeutischen Dosis, sehr hohen Konzentration ausgesetzt wird. Die systemisch verfügbare Menge an Minoxidil lag um das 569- bis 1139fache über der Menge, wie sie nach der Anwendung von 20 mg/ml Minoxidil erreicht wird. Beim Fehlen toxischer Anzeichen bei der Mutter wurde keine Gefahr für den Fötus beobachtet. Das Risiko für das ungeborene Kind ist deshalb gering, wenn Minoxidil topisch in der Schwangerschaft versehentlich angewendet wird.
6. PHARMAZEUTISCHE ANGABEN
6.1 Liste der sonstigen Bestandteile
Ethanol 96% (v/v)
Propylenglycol Gereinigtes Wasser
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Nicht über 25 °C lagern.
6.5 Art und Inhalt des Behältnisses und spezielles Zubehör für den Gebrauch, die Anwendung oder die Implantation
Polyethylen Flasche
Packungen mit 1 x 60 ml Lösung oder 3 x 60 ml Lösung.
Minoxidil BIO-H-TIN-Pharma 20 mg/ml enthält 2 Applikatoren: einen Sprühkopf und einen Applikator mit verlängerter Spitze.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung
Keine besonderen Anforderungen.
7. INHABER DER ZULASSUNG
BIO-H-TIN® Pharma GmbH & Co. KG Emil-Kemmer-Straße 33 D-96103 Hallstadt Telefon: 0951/6043-0 Telefax: 0951/604329
Vertrieb:
Dr. R. Pfleger Chemische Fabrik GmbH D-96045 Bamberg Telefon: (0951) 6043-0 Telefax: (0951) 6043-29 E-Mail; info@dr-pfleger. de
8. ZULASSUNGSNUMMER
87412.00.00
9. DATUM DER ERTEILUNG DER ZULASSUNG
26.06.2013
10. STAND DER INFORMATION
April 2014
11. VERKAUFSABGRENZUNG
Apothekenpflichtig