Mirena Intrauterinpessar Mit Hormonabgabe
alt informationenWortlaut der für die Packungsbeilage vorgesehenen Angaben
Hinweise zur Weitergabe an die Patientin
Vor der Anwendung dieses Arzneimittels wird Sie Ihre Ärztin/Ihr Arzt im Rahmen eines Einverständnisverfahrens über die Risiken bei der Anwendung aufklären. Dafür werden Ihnen ein spezieller Einverständnisbogen und die Gebrauchsinformation ausgehändigt. MIRENA wird bei Ihnen nur eingesetzt, wenn Sie den Aufklärungsbogen unterschrieben haben.
Gebrauchsinformation: Information für die Anwenderin MIRENA Intrauterinpessar mit Hormonabgabe, 52 mg
Wirkstoff: Levonorgestrel
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, weil sie wichtige Informationen darüber enthält, was bei der Anwendung dieses Arzneimittels zu beachten ist.
• Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
• Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
• Wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind, informieren Sie bitte Ihren Arzt oder Apotheker.
1. Was ist MIRENA und wofür wird es angewendet?
2. Was müssen Sie vor der Anwendung von MIRENA beachten?
3. Wie ist MIRENA anzuwenden?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist MIRENA aufzubewahren?
6. Weitere Informationen
1. WAS IST MIRENA UND WOFÜR WIRD ES ANGEWENDET?
MIRENA ist ein Intrauterinpessar („Spirale") mit Hormonabgabe.
MIRENA wird angewendet zur Empfängnisverhütung (Kontrazeption) und bei zu starker Regelblutung (Hypermenorrhoe).
2. WAS MÜSSEN SIE VOR DER ANWENDUNG VON MIRENA BEACHTEN?
MIRENA darf nicht angewendet werden,
- wenn Sie den Verdacht oder die Gewissheit haben, schwanger zu sein
- bei Vorliegen oder Verdacht auf Geschlechtshormon-abhängige Tumoren (z. B. Brustkrebs)
- bei gerade bestehenden oder wiederkehrenden entzündlichen Erkrankungen des kleinen Beckens (PID)
- wenn Sie eine Gebärmutterhalsentzündung haben
- wenn Sie eine Entzündung der inneren oder äußeren Geschlechtsorgane haben
- wenn Sie nach einer Entbindung eine Entzündung der Gebärmutterschleimhaut haben
- wenn Sie nach einer Fehlgeburt eine Entzündung der Gebärmutterschleimhaut hatten (innerhalb der letzten drei Monate)
- bei Erkrankungen und Zuständen, die mit einem höheren Entzündungsrisiko verbunden sind (z. B. Behandlung mit Medikamenten, die das Immunsystem beeinträchtigen)
- bei krankhaften Veränderungen von Zellen im Bereich des Gebärmutterhalses (Zervixdysplasie)
- wenn Sie eine bösartige Erkrankung der Gebärmutter oder des Gebärmutterhalses haben oder ein Verdacht darauf besteht
- wenn Sie unregelmäßige Gebärmutterblutungen unbekannter Ursache haben
- bei angeborener oder erworbener Fehlbildung der Gebärmutter einschließlich gutartiger Muskelgeschwülste in der Gebärmutter (Myome), wenn sie die Gebärmutterhöhle verformen
- bei akuten Lebererkrankungen oder Lebertumoren
- wenn Sie überempfindlich (allergisch) gegen Levonorgestrel oder einen der sonstigen Bestandteile von MIRENA sind.
Besondere Vorsicht bei der Anwendung von MIRENA ist erforderlich,
wenn bei Ihnen bestimmte Grunderkrankungen vorliegen. Auch möchten wir Sie in diesem Absatz mit einigen wichtigen Informationen zu MIRENA vertraut machen.
MIRENA sollte nur nach strenger Prüfung durch den Arzt angewendet oder ggf. entfernt werden, wenn folgende Erkrankungen bei Ihnen vorliegen oder erstmals auftreten:
- Migräne, Verstärkung einer Migräne oder von einer Stelle ausgehende (fokale) Migräne mit unterschiedlichem (asymmetrischem) Sehverlust der Augen
- andere Beschwerden, die auf eine vorübergehende mangelnde Durchblutung der Hirngefäße (zerebrale Ischämie) hindeuten
- außergewöhnlich starke Kopfschmerzen
- Gelbsucht
- eine deutliche Blutdrucksteigerung
- schwere arterielle Gefäßerkrankungen wie z. B. Schlaganfall oder Herzinfarkt
- akute venöse Erkrankungen wie z. B. tiefe Beinvenenthrombose
- Zustände, die zu einer sehr starken Vermehrung von Bakterien im Blut führen oder diese begünstigen können (z. B. angeborene Herzkrankheiten, Herzklappenfehler).
Beeinflussung des Zuckerstoffwechsels
Klinische Erfahrungen mit Diabetikerinnen liegen nur begrenzt vor. Der Blutzuckerspiegel sollte deshalb bei Diabetikerinnen, die MIRENA anwenden, insbesondere in der Anfangsphase streng überwacht werden. Von der Verhütung mit der „Pille" ist bekannt, dass die Blutzuckerempfindlichkeit selbst bei niedriger Dosierung von Levonorgestrel beeinflusst werden kann. Im Allgemeinen ist jedoch eine Anpassung der Dosierung bei Diabetikerinnen, die MIRENA anwenden, nicht erforderlich.
Unregelmäßige Blutungen
Unregelmäßige Blutungen könnten Anzeichen für Geschwülste der Gebärmutter oder Gebärmutterkrebs überdecken. In Verdachtsfällen ist eine diagnostische Abklärung in Erwägung zu ziehen.
Parität
Die Verhütung mit einem Pessar in der Gebärmutter kommt bevorzugt zur Anwendung bei Frauen, die bereits geboren haben. Sie ist bei Frauen, die noch nicht geboren haben, nicht als die Methode der ersten Wahl anzusehen und sollte nur dann in Betracht gezogen werden, wenn andere zuverlässige Methoden nicht eingesetzt werden können.
MIRENA ist nicht zur Empfängnisverhütung nach einem ungeschützten Geschlechtsverkehr (postkoitale Kontrazeption) geeignet.
Seltene Regelblutung / Ausbleiben der Regelblutung
Seltene Regelblutung (Oligomenorrhoe) oder Ausbleiben der Regelblutung (Amenorrhoe) stellt sich bei etwa 20 % der Anwenderinnen ein. Spätestens 6 Wochen nach dem erstmaligen Ausbleiben der Periodenblutung bzw. beim plötzlichen Ausbleiben oder Wiederauftreten menstruationsstarker Blutungen muss an eine Schwangerschaft gedacht und dies überprüft werden. Wiederholte Schwangerschaftstests sind bei ausbleibender Regelblutung nicht notwendig, es sei denn, die Tests sind aufgrund von anderen Beschwerden indiziert.
Entzündungen des kleinen Beckens
Das Einführungsröhrchen schützt MIRENA vor einer Verunreinigung mit Keimen während des Einlegens, und die Einlegevorrichtung wurde so gestaltet, um das Risiko für eine Entzündung möglichst gering zu halten. Trotzdem kann es in engem zeitlichen Zusammenhang mit der Einlage, aber auch zu jedem späteren Zeitpunkt zu einer aufsteigenden Entzündung (Infektion) des kleinen Beckens kommen, die durch Fieber und Unterbauchschmerzen gekennzeichnet ist. Bekannte Risikofaktoren für entzündliche Beckenerkrankungen sind wechselnde Sexualpartner. Das Risiko einer Entzündung (Infektion) mit sexuell übertragbaren Krankheiten kann durch Verwendung von Kondomen reduziert werden. Eine Beckenentzündung muss sofort behandelt werden.
Eine Beckenentzündung kann schwerwiegende Folgen mit sich bringen und so zum Beispiel die Fruchtbarkeit einschränken bzw. das Risiko für eine Bauchhöhlenschwangerschaft erhöhen.
Äußerst selten kann in engem zeitlichen Zusammenhang mit der Einlage eines Intrauterinpessars eine schwerwiegende Infektion oder Sepsis (sehr schwerwiegende Allgemeininfektion, die tödlich verlaufen kann) auftreten.
Bei wiederholtem Auftreten einer Entzündung der Gebärmutterschleimhaut (Endometritis) oder Entzündung (Infektion) des kleinen Beckens, oder bei einer akuten schweren oder nicht auf Antibiotika innerhalb weniger Tage ansprechenden Entzündung, muss MIRENA durch Ihre Frauenärztin / Ihren Frauenarzt entfernt werden.
Suchen Sie bitte sofort Ihre Ärztin / Ihren Arzt auf, wenn Sie folgende Beschwerden haben: Länger anhaltende Schmerzen im Unterbauch, Fieber, Schmerzen beim Geschlechtsverkehr oder unregelmäßige Blutungen. Starke Schmerzen oder Fieber, die kurz nach der Einlage auftreten, können bedeuten, dass Sie eine schwerwiegende Infektion haben, die sofort behandelt werden muss.
Ausstoßung von Intrauterinpessaren
Symptome einer teilweisen oder kompletten Ausstoßung eines Intrauterinpessars können Blutungen oder Schmerzen sein. Das Intrauterinpessar kann jedoch auch ausgestoßen werden, ohne dass Sie es merken und damit zum Verlust der empfängnisverhütenden Wirkung führen. Bei einer teilweisen Ausstoßung kann die Wirkung von MIRENA vermindert sein. Da MIRENA eine schwächere Regelblutung bewirkt, kann eine verstärkte Regelblutung Zeichen für eine Ausstoßung sein. Eine nicht mehr am richtigen Ort sitzende MIRENA sollte von Ihrer Ärztin / Ihrem Arzt entfernt und ggf. durch eine neue ersetzt werden.
Sie sollten sich von dem Vorhandensein der Rückholfäden des Pessars vor dem Muttermund regelmäßig, am besten jeweils direkt nach der Regel, mittels Selbstuntersuchung überzeugen.
Durchstoßung (Perforation) der Gebärmutter
Selten vorkommende Durchstoßungen der Gebärmutter bei der Pessareinlage machen sich im Allgemeinen durch sofortige Unterbauchschmerzen bemerkbar, können ausnahmsweise aber auch ohne Beschwerden verlaufen. Dadurch kann die Wirkung von MIRENA vermindert sein. Im Falle einer schwierig verlaufenden Pessareinlage bzw. bei außergewöhnlichen Schmerzen oder Blutungen während oder nach der Einlage, sollten Sie umgehend durch Ihre behandelnde Ärztin / Ihren behandelnden Arzt eine frauenärztliche Untersuchung und einen Ultraschall durchführen lassen, um eine Durchstoßung der Gebärmutter auszuschließen. Ein Intrauterinpessar, das die Gebärmutter durchstoßen hat, sollte unverzüglich entfernt werden.
Wanderungen des Pessars durch die Gebärmutterwand bzw. durch die Eileiter können aber auch noch viele Monate nach der Einlage auftreten. Wenn Sie im Verdachtsfall die Rückholfäden im Bereich des Muttermunds nicht mehr tasten können, sollten Sie ohne Verzug einen Arzt aufsuchen.
Das Risiko einer Verletzung oder Durchstoßung der Gebärmutter bei der Einlage ist bei stillenden Frauen erhöht und kann erhöht sein bei Frauen mit Lageanomalie der Gebärmutter (z. B. bei nach hinten gerichteter Gebärmutter) sowie bei einer Einlage nach einer Entbindung. Die Einlage nach einer Entbindung darf daher nur dann erfolgen, wenn sich die Gebärmutter vollständig zurückgebildet hat. Frühestens darf eine Einlage sechs Wochen nach der Entbindung erfolgen. Es sollte durch den behandelnden Arzt in Betracht gezogen werden, MIRENA erst zwölf Wochen nach der Entbindung einzulegen.
Brustkrebs
Frauen, die die „Pille" (Verhütungsmittel) einnehmen, haben ein leicht erhöhtes Brustkrebsrisiko. Dieses geht innerhalb von 10 Jahren nach Absetzen der „Pille" wieder auf das altersentsprechende Grundrisiko zurück. Da MIRENA ebenfalls ein hormonelles Verhütungsmittel ist, kann aber davon ausgegangen werden, dass ein solches Brustkrebsrisiko auch bei der Anwendung von MIRENA besteht.
Wenn bei Ihnen bereits eine Geschlechtshormon-abhängige Krebserkrankung (z. B. Brustkrebs) bekannt ist oder vermutet wird, darf Ihnen MIRENA nicht eingelegt werden. Falls bei Ihnen während der Anwendung von MIRENA eine solche Krebserkrankung festgestellt wird, muss MIRENA durch Ihre behandelnde Ärztin / Ihren behandelnden Arzt entfernt werden.
Schwangerschaften und Bauchhöhlenschwangerschaft bei liegendem Pessar
Rechnerisch werden 2 von 1.000 Frauen, die MIRENA im ersten Jahr anwenden, ungewollt schwanger. Gerechnet über die gesamte Liegezeit von 5 Jahren sind es etwa 7 von 1.000 Frauen.
Besonders gefährdet für eine Bauchhöhlenschwangerschaft sind Frauen mit vorangegangener Bauchhöhlenschwangerschaft, Operation der Eileiter oder Entzündungen des kleinen Beckens. Treten während der Tragzeit eines Intrauterinpessars bei Ihnen Unterleibsschmerzen auf, insbesondere in Verbindung mit dem Ausbleiben der Regel bzw. mit einer plötzlichen Blutung nach längerem blutungsfreien Intervall bzw. in Verbindung mit den typischen Symptomen einer Frühschwangerschaft, dann muss die Möglichkeit einer Bauchhöhlenschwangerschaft in Betracht gezogen werden.
Das absolute Risiko einer Eileiter- oder Bauchhöhlenschwangerschaft bei MIRENA-Anwenderinnen ist aufgrund einer insgesamt geringen Wahrscheinlichkeit für eine Schwangerschaft bei MIRENA-Anwenderinnen im Vergleich zu Frauen, die keine Verhütungsmittel anwenden, niedrig.
Bei etwa 1 von 1.000 Frauen im Jahr tritt bei korrekter Anwendung von MIRENA eine Bauchhöhlenschwangerschaft auf. Diese Rate ist niedriger als bei Frauen, die keine Empfängnisverhütung (Kontrazeption) anwenden (etwa 3 bis 5 von 1.000 Frauen im Jahr).
Wenn eine Frau jedoch unter Anwendung von MIRENA schwanger wird, ist die relative Wahrscheinlichkeit, dass sich eine Eileiter- oder Bauchhöhlenschwangerschaft entwickelt, erhöht.
Rückholfäden
Das Vorhandensein der Rückholfäden des Pessars vor dem Muttermund sollten Sie regelmäßig, am besten jeweils direkt nach der Regel, mittels Selbstuntersuchung überprüfen.
Ihre Frauenärztin / Ihr Frauenarzt sollte Ihnen zeigen, wie Sie das Vorhandensein der Rückholfäden selbst kontrollieren können. Wenn die Rückholfäden bei einer Kontrolluntersuchung nicht in der Scheide sichtbar sind, muss die korrekte Lage von Mirena sonographisch überprüft und ggf. eine Schwangerschaft ausgeschlossen werden.Liegt keine Schwangerschaft vor, so kann Ihre Frauenärztin / Ihr Frauenarzt die Lage der Fäden meist durch vorsichtiges Sondieren feststellen. Die Rückholfäden können sich in die Gebärmutter oder in den Gebärmutterhalskanal zurückgezogen haben und bei der nächsten Menstruation wieder sichtbar werden. Sind die Fäden nicht auffindbar, wurde das Intrauterinpessar möglicherweise ausgestoßen oder hat die Gebärmutterwand durchdrungen. In diesem Fall sollte Ihre Ärztin / Ihr Arzt die Position von MIRENA durch eine Ultraschall- oder Röntgenuntersuchung überprüfen.
Vergrößerte Follikel (funktionelle Eierstockzysten)
MIRENA hemmt in der Regel nicht den Eisprung. In den Fällen, in denen es nach Einlage von MIRENA zu einer Follikelreifung kommt, kann es gelegentlich zu einer verzögerten Follikelrückbildung kommen. Solche vergrößerten Follikel sind klinisch nicht von Eierstockzysten zu unterscheiden. Eierstockzysten wurden bei etwa 7 % der MIRENA-Anwenderinnen festgestellt. Meistens verursachen diese Follikel keine Beschwerden, können jedoch in einigen Fällen zu Schmerzen im Unterbauch oder beim Geschlechtsverkehr führen. In den meisten Fällen haben solche Eierstockzysten keine klinische Bedeutung und bilden sich im Verlauf eines 2- bis 3-monatigen Beobachtungszeitraumes zurück. Sollte dies nicht der Fall sein, sind fortlaufende Ultraschallkontrollen sowie ggf. auch andere diagnostische oder therapeutische Maßnahmen zu empfehlen. In seltenen Fällen kann ein chirurgischer Eingriff erforderlich sein.
Zusätzliche Hinweise zu besonderen Patientengruppen
Ältere Patientinnen (65 Jahre oder älter)
Für die Anwendung von MIRENA bei postmenopausalen Frauen gibt es keine Indikation.
Patientinnen mit eingeschränkter Leberfunktion
MIRENA ist bei Frauen mit akuten Lebererkrankungen oder Lebertumoren kontraindiziert (siehe Abschnitt 2. „Was müssen Sie vor der Anwendung von MIRENA beachten?").
Patientinnen mit eingeschränkter Nierenfunktion
Die Anwendung von MIRENA bei Frauen mit eingeschränkter Nierenfunktion wurde nicht untersucht.
Bei Anwendung von MIRENA mit anderen Arzneimitteln
Die Wirkungen mancher Arzneimittel können durch gleichzeitige Anwendung anderer Mittel beeinflusst werden. Fragen Sie daher Ihren Arzt, wenn Sie andere Mittel ständig anwenden, bis vor kurzem angewendet haben oder gleichzeitig mit dem hier vorliegenden Arzneimittel anwenden wollen. Ihr Arzt kann Ihnen sagen, ob unter diesen Umständen mit Unverträglichkeiten zu rechnen ist, oder ob besondere Maßnahmen, wie z. B. eine neue Dosisfestsetzung erforderlich sind, wenn Sie dieses Arzneimittel anwenden.
Welche anderen Arzneimittel beeinflussen die Wirkung von MIRENA?
Es liegen keine Erkenntnisse über den Einfluss anderer Arzneimittel auf die Wirksamkeit von MIRENA vor. Da diese hauptsächlich durch die örtliche Wirkung in der Gebärmutter bestimmt wird, ist eine Beeinträchtigung der empfängnisverhütenden Wirkung durch Arzneimittel, die die Aktivität von
Leberenzymen beeinflussen (z. B. Phenobarbital, Phenytoin, Carbamazepin, Rifampicin, Rifabutin, Nevirapin, Efavirenz), als unwahrscheinlich anzusehen.
Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
MIRENA ist während einer bestehenden oder vermuteten Schwangerschaft kontraindiziert (siehe Abschnitt 2. „Was müssen Sie vor der Anwendung von MIRENA beachten?").
Tritt unter liegendem Pessar eine Schwangerschaft auf, sollten Sie umgehend Ihre Frauenärztin / Ihren Frauenarzt informieren, und das Pessar sollte entfernt werden. Das Entfernen von MIRENA oder die Untersuchung der Gebärmutter kann zur vorzeitigen Beendigung der Schwangerschaft führen. Ist eine Entfernung des Pessars nicht möglich, wird Ihre Frauenärztin / Ihr Frauenarzt Sie über das erhöhte Risiko einer möglichen Fehlgeburt oder vorzeitiger Wehentätigkeit bei liegenden Intrauterinpessaren informieren und darauf hinweisen, alle Symptome einer Schwangerschaftskomplikation, wie Bauchkrämpfe mit Fieber, zu berichten. Wird die Schwangerschaft fortgesetzt bzw. kann MIRENA nicht entfernt werden, sollte der Schwangerschaftsverlauf zusätzlich sehr engmaschig überwacht werden. Das Vorliegen einer Bauchhöhlenschwangerschaft muss ausgeschlossen werden.
Klinische Erfahrungen über Schwangerschaften mit einem liegenden Intrauterinpessar mit Hormonabgabe sind aufgrund der hohen empfängnisverhütenden Sicherheit von MIRENA begrenzt. Bislang gibt es keine Hinweise auf Schädigungen des Kindes verursacht durch ein liegendes MIRENA. Ein mögliches Auftreten einer Vermännlichung weiblicher Feten muss aufgrund der Lage in der Gebärmutter und des lokalen Hormoneinflusses in Betracht gezogen werden.
Stillzeit
Die tägliche Levonorgestrel-Dosis und die Konzentration von Levonorgestrel im Blut sind unter Anwendung von MIRENA niedriger als bei allen anderen hormonalen Kontrazeptiva. Dennoch wurde Levonorgestrel bei Anwenderinnen von MIRENA in der Muttermilch nachgewiesen.
Ungefähr 0,1 % der Levonorgestreldosis nimmt ein Kind während des Stillens auf. Allerdings ist es auf Grund von epidemiologischen Daten zu Levonorgestrel-haltigen Präparaten nicht wahrscheinlich, dass die von MIRENA nach dem Einlegen in die Gebärmutterhöhle freigesetzte Dosis ein Risiko für das Kind mit sich bringt.
Es gibt keine Hinweise auf schwerwiegende negative Auswirkungen auf das Wachstum bzw. die Entwicklung des Kindes, wenn MIRENA zur Verhütung sechs Wochen nach einer Entbindung zur Anwendung kommt. Methoden, die auf den Einsatz von Gestagen-haltigen Medikamenten beruhen, haben nach derzeit vorliegenden Daten keinen nachteiligen Einfluss auf die Menge bzw. die Qualität der Muttermilch. In seltenen Fällen ist über Gebärmutterblutungen bei Frauen berichtet worden, die MIRENA während der Stillzeit angewendet haben.
Fertilität
Nach Entfernung von MIRENA erreichen Frauen wieder die gleiche Fertilität (Fruchtbarkeit) wie zuvor.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen:
Es wurden keine Studien zur Erfassung von Wirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
3. WIE IST MIRENA ANZUWENDEN?
MIRENA wird vom Arzt in die Gebärmutter eingelegt. Die Liegedauer beträgt maximal 5 Jahre. Während dieses Zeitraumes beträgt die Levonorgestrelfreisetzung initial um 20 pg pro Tag, später nicht weniger als 10 pg pro Tag, im 5-Jahresdurchschnitt 14 pg pro Tag.
Medizinische Untersuchungen
Vor dem Einlegen von MIRENA sollten Sie eine frauenärztliche Untersuchung einschließlich der Entnahme eines zytologischen Abstrichs und eine Untersuchung der Brust vornehmen, sowie eine Schwangerschaft ausschließen lassen. Ebenso sollten Entzündungen und Tumoren der Gebärmutter und ihrer Anhangsorgane ausgeschlossen sein. Die Lage der Gebärmutter und die Größe der Gebärmutterhöhle sollten vor der Einlage bestimmt werden. Die fundusnahe Lage von MIRENA ist besonders wichtig, um eine gleichbleibende Wirkung des Levonorgestrels auf die Gebärmutterschleimhaut zu gewährleisten, das Risiko einer Ausstoßung des Intrauterinpessars zu verhindern und eine maximale Wirksamkeit zu erreichen.
Bei der Einlage und dem Entfernen von MIRENA kann es zu Schmerzen und Blutungen kommen. Infolge einer Kreislaufstörung kann ein kurzzeitiger Bewusstseinsverlust (Ohnmacht) eintreten. Bei Epileptikerinnen kann ein Anfall ausgelöst werden.
Sie sollten 4 - 12 Wochen nach der Einlage von Ihrem Arzt nachuntersucht werden. Danach werden einmal jährliche oder bei Auftreten von Beschwerden häufigere Nachuntersuchungen empfohlen.
Bei erstmaliger Anwendung sollte MIRENA innerhalb von 7 Tagen nach Beginn der Menstruation eingelegt werden. Die empfängnisverhütende Wirkung besteht dann sofort. MIRENA kann umgehend nach einer Fehlgeburt im ersten Drittel der Schwangerschaft eingelegt werden. Nach einer Geburt sollte das Einlegen frühestens nach 6 Wochen erfolgen.
Die Liegedauer von MIRENA beträgt maximal 5 Jahre. Generell sollten Sie sich bereits rechtzeitig vor der Entfernung von MIRENA die Art der Folgeverhütungsmethode überlegen und mit Ihrem Arzt besprechen, wenn bei Ihnen der Wunsch nach einer ununterbrochenen Empfängnisverhütung besteht. Wenn Sie keine Schwangerschaft wünschen, sollte MIRENA während der Regelblutung entfernt werden, sofern ein Zyklus zu bestehen scheint. Wenn MIRENA in der Mitte eines Zyklus entfernt wird und Sie in der vorausgegangenen Woche Geschlechtsverkehr hatten, besteht das Risiko einer Schwangerschaft, sofern nicht sofort nach der Entfernung eine neue MIRENA eingelegt wird.
Entfernen von MIRENA
MIRENA darf nur vom Arzt entfernt werden.
4. WELCHE NEBENWIRKUNGEN SIND MÖGLICH?
Arzneimittel können neben den erwünschten Hauptwirkungen auch unerwünschte Wirkungen, sogenannte Nebenwirkungen haben. Nebenwirkungen, die im zeitlichen Zusammenhang mit der Anwendung von MIRENA beobachtet wurden, jedoch nicht bei jeder Patientin auftreten müssen, werden im Folgenden genannt.
Nebenwirkungen treten häufiger während der ersten Monate nach dem Einlegen auf und klingen bei längerer Anwendung in der Regel ab. Zusätzlich zu den in Abschnitt „Besondere Vorsicht bei der Anwendung von MIRENA ist erforderlich“ aufgeführten unerwünschten Wirkungen wurde bei Frauen, die MIRENA anwenden, über die nachstehenden Nebenwirkungen berichtet.
Zu den sehr häufigen Nebenwirkungen (werden bei mehr als 10 % der Anwenderinnen beobachtet) gehören Gebärmutter- und Scheidenblutungen, einschließlich Schmierblutungen, sowie seltene Blutungen (Oligomenorrhoe), völliges Ausbleiben der Regelblutungen (Amenorrhoe) und gutartige Eierstockzysten (Ovarialzysten).
Bei allen Frauen, die MIRENA anwenden, treten unterschiedliche Arten von Veränderungen bei der Menstruationsblutung (häufige, verlängerte, verkürzte oder starke Blutungen, Zwischen- bzw. Schmierblutungen, aber auch seltenere Blutungen oder völliges Ausbleiben der Regelblutungen) auf. Bei fertilen Frauen sinkt die durchschnittliche Anzahl der Tage/Monate, an denen eine Zwischenblutung auftritt, in den ersten sechs Monaten der Anwendung allmählich von neun auf vier Tage. Der Anteil der Frauen mit einer länger anhaltenden Blutung (mehr als acht Tage) geht in den ersten drei Monaten der Anwendung von 20 % auf 3 % zurück. Im Rahmen von klinischen Studien zeigte sich im ersten Jahr der Anwendung bei 17 % der Frauen ein völliges Ausbleiben der Regelblutungen (Amenorrhoe) mit einer Dauer von mindestens drei Monaten.
Nachfolgend listen wir mögliche Nebenwirkungen auf, wenn MIRENA zur Empfängnisverhütung (Kontrazeption) oder bei zu starker Regelblutung (Hypermenorrhoe) angewendet wird.
Bei der Bewertung von Nebenwirkungen werden folgende Häufigkeitsangaben zugrunde gelegt:
|
Sehr häufig: |
mehr als 1 Anwenderin von 10 |
|
Häufig: |
1 bis 10 Anwenderinnen von 100 |
|
Gelegentlich: |
1 bis 10 Anwenderinnen von 1.000 |
|
Selten: |
1 bis 10 Anwenderinnen von 10.000 |
|
Nicht bekannt: |
Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar |
|
Organsystem |
Sehr häufige Nebenwirkungen |
Häufige Nebenwirkun gen |
Gelegentliche Nebenwirkungen |
Seltene Neben wirkungen |
Nicht bekannt* |
|
Erkrankungen des Immunsystems |
Überempfind lichkeitsreak tionen einschließlich Hautausschlag, |
|
Nesselsucht (Urtikaria) und plötzlich auftretende Schwellungen der Haut oder Schleimhäute (Angioödem) | |||||
|
Psychiatrische Erkrankungen |
Depressive Stimmung / Depression | ||||
|
Erkrankungen des Nervensystems |
Kopfschmer zen |
Migräne | |||
|
Erkrankungen des Gastrointestinaltrakts |
Bauchschmerzen / Schmerzen im Becken |
Übelkeit | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne, Übermäßiger Haarwuchs mit männlichem Verteilungsmuster (Hirsutismus) |
Haarausfall (Alopezie), Verfärbung der Haut, insbesondere im Gesicht und am Hals, so genannte Schwangerschaftsflecken (Chloasma)/ Verstärkte Pigmentierung der Haut | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochenerkrankungen |
Rücken schmerzen | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Veränderung des Blutungsmusters einschließlich verstärkter Blutung (Hypermenorrhoe) und verminderter Blutung (Hypomenor-rhoe). Schmierblu tungen, unregelmäßige Blutungen (Oligomenorrhoe) und Ausbleiben der Monatsblutung (Amenorrhoe), Entzündung der Vagina |
Infektionen des oberen Geschlechtstraktes (Genitaltraktes), Eierstock zysten, Regelschmer zen (Dysmenor rhoe), Schmerzen in der Brust, Ausstoßung von MIRENA (vollständig oder teilweise) |
Durch-stoßung der Gebärmutter |
|
(Scheide) und der Vulva (äußeres Genital) (Vulvovaginitis), Scheidenaus fluss (Vaginalaus fluss) | |||||
|
Untersuchungen |
Erhöhter Blutdruck |
*: Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
Beschreibung ausgewählter Nebenwirkungen
Möglicherweise sind die Rückholfäden für den Partner während des Geschlechtsverkehrs spürbar.
Sollten Sie bei liegender MIRENA schwanger werden, ist die Wahrscheinlichkeit, dass sich eine Eileiter- oder Bauchhöhlenschwangerschaft entwickelt, erhöht (siehe im Abschnitt 2. unter „Schwangerschaften und Bauchhöhlenschwangerschaft bei liegendem Pessar").
Das Risiko einer Durchstoßung der Gebärmutter ist bei stillenden Frauen erhöht.
Nach dem Einlegen des Intrauterinpessars wurden über Fälle einer Sepsis (sehr schwerwiegende Allgemeininfektion, die tödlich verlaufen kann) berichtet.
Es wurde über Fälle von Brustkrebs berichtet (Häufigkeit nicht bekannt, siehe im Abschnitt 2. unter „Brustkrebs").
Die folgenden Nebenwirkungen sind in Verbindung mit der Einlage oder dem Entfernen von MIRENA beobachtet worden:
Schmerzen, Blutungen, Kreislaufstörungen mit Schwindel oder kurzzeitiger Bewusstlosigkeit (Synkope) während der MIRENA-Einlage. Bei Epileptikerinnen kann ein Krampfanfall ausgelöst werden.
Informieren Sie bitte Ihren Arzt oder Apotheker, wenn eine der aufgeführten Nebenwirkungen Sie erheblich beeinträchtigt oder Sie Nebenwirkungen bemerken, die nicht in dieser Gebrauchsinformation angegeben sind.
5. WIE IST MIRENA AUFZUBEWAHREN?
Arzneimittel für Kinder unzugänglich aufbewahren.
Sie dürfen das Arzneimittel nach dem auf der Faltschachtel und der Folienpackung nach „Verwendbar bis" angegebenen Verfallsdatum nicht mehr verwenden. Das Verfallsdatum bezieht sich auf den letzten Tag des Monats.
Aufbewahrungsbedingungen:
MIRENA im Umkarton aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen.
6. WEITERE INFORMATIONEN
Was MIRENA enthält:
Der Wirkstoff ist Levonorgestrel.
1 MIRENA Intrauterinpessar mit Hormonabgabe enthält 52 mg Levonorgestrel
(Levonorgestrelfreisetzung initial um 20 pg pro Tag, später nicht weniger als 10 pg pro Tag, im 5-Jahresdurchschnitt 14 pg pro Tag).
Die sonstigen Bestandteile sind:
Hormonreservoir aus Polydimethylsiloxan Elastomer, T-Körper aus Polyethylen mit Bariumsulfat (32 mm lang, 32 mm breit), Rückholfaden aus Polyethylen mit Eisenoxiden und -hydroxiden (E 172)
Wie MIRENA aussieht und Inhalt der Packung:
MIRENA ist ein Intrauterinpessar (Spirale) mit Hormonabgabe (Sexualhormon). Packung :1 Intrauterinpessar mit Hormonabgabe und 1 Applikator Packung: 5 Intrauterinpessare mit Hormonabgabe und 5 Applikatoren
Pharmazeutischer Unternehmer
Jenapharm GmbH & Co.KG Otto-Schott-Straße 15 07745 Jena
Telefon: (03641) 648888 Telefax: (03641) 648889
E-Mail-Adresse: frauengesundheit@jenapharm.de
Hersteller
Bayer Oy, Pansiontie 47, 20210 Turku, Finnland
Diese Gebrauchsinformation wurde zuletzt überarbeitet im September 2014.
Die folgenden Informationen sind nur für Ärzte bzw. medizinisches Fachpersonal bestimmt:
Inserter (ohne sichtbare Fäden):1
Insertionsanleitung
MIRENA® Intrauterinpessar mit Hormonabgabe
Darf nur von einem Arzt/einer Ärztin unter aseptischen Bedingungen eingesetzt werden.
MIRENA wird in einem Inserter in einer sterilen Verpackung, die erst unmittelbar vor der Insertion geöffnet werden darf, abgegeben.
MIRENA darf nicht resterilisiert werden. MIRENA ist nur zum einmaligen Gebrauch bestimmt. Nicht verwenden, wenn die innere Verpackung beschädigt oder geöffnet ist. MIRENA darf nicht nach dem auf der Verpackung angegebenen Verfallsdatum (Monat, Jahr) eingelegt werden.
Informationen zum Zeitpunkt der Einlage von MIRENA sind in der Fachinformation im Abschnitt 4.2 sowie in der Gebrauchsinformation im Abschnitt 3 „Wie ist MIRENA anzuwenden?“ zu finden.
Vorbereitung der Insertion
• Untersuchen Sie die Patientin, um die Größe und Lage des Uterus zu bestimmen, akute genitale Infektionen oder andere Kontraindikationen für die Insertion von MIRENA festzustellen und eine Schwangerschaft auszuschließen.
• Führen Sie ein Spekulum ein, stellen Sie die Zervix dar und desinfizieren Sie anschließend sorgfältig Zervix und Vagina mit einer geeigneten antiseptischen Lösung.
• Wenn notwendig, lassen Sie sich von einem Assistenten/ einer Assistentin unterstützen.
• Ergreifen Sie die vordere Muttermundslippe mit einer Kugelzange oder einer anderen Fasszange, um den Uterus zu stabilisieren. Wenn ein retrovertierter Uterus vorliegt, kann es sinnvoller sein, die hintere Muttermundslippe zu ergreifen. Die Zange sollte in Position und der Zervikalkanal durch leichten Gegenzug während der Insertion gestreckt gehalten werden.
• Schieben Sie eine Uterussonde vorsichtig durch den Zervikalkanal bis zum Fundus uteri, um die Länge und die Richtung des Cavum uteri zu bestimmen und etwaige intrauterine Anomalien (z. B. ein Septum, submuköse Myome) oder ein früher eingelegtes intrauterines Kontrazeptivum, das nicht entfernt wurde, auszuschließen. Erwägen Sie gegebenenfalls eine Dilatation des Zervikalkanals. Ist eine Zervixdilatation erforderlich, ist der Gebrauch von Analgetika und/oder eine Parazervikalblockade in Erwägung zu ziehen.
Insertion
1. Öffnen Sie zuerst die sterile Packung vollständig (Abb. 1). Benutzen Sie dann sterile Handschuhe und führen Sie das Insertionsverfahren unter sterilen Kautelen durch.
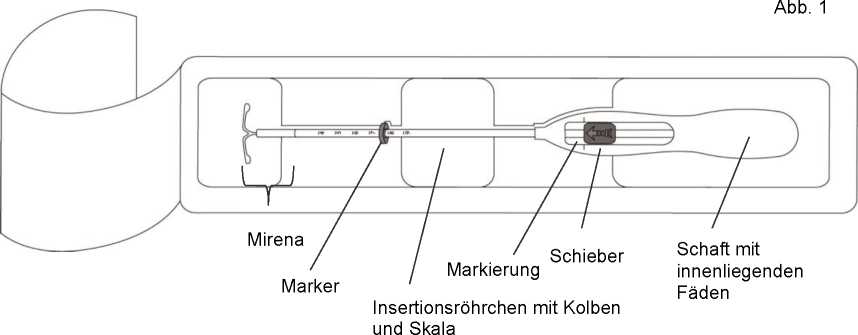
2. Drücken Sie den Schieber in Pfeilrichtung bis zur äußersten Position nach vorne, um MIRENA in das Insertionsröhrchen zu laden (Abb. 2).
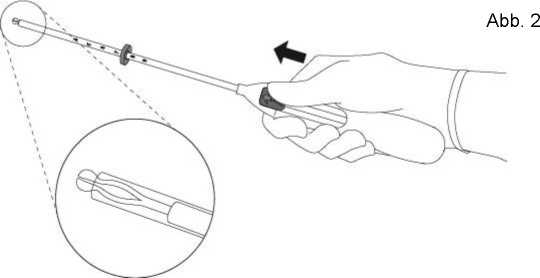
WICHTIG! Ziehen Sie den Schieber nicht zurück, da dies eine vorzeitige Freisetzung von Mirena zur Folge haben kann. Einmal freigesetzt, kann MIRENA nicht erneut geladen werden.
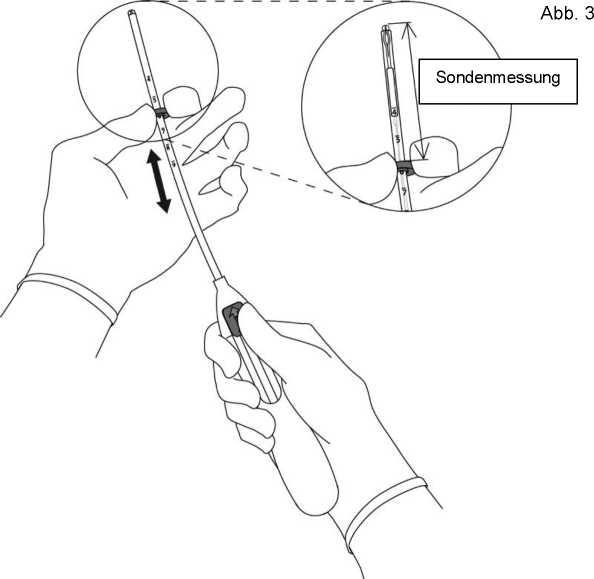
3. Halten Sie den Schieber in der äußersten Position und stellen Sie den oberen Rand des Markers auf die mit der Sonde gemessenen Länge des Cavum uteri ein (Abb. 3).
4. Während Sie den Schieber in der äußersten Position halten, führen Sie das Insertionsröhrchen vorsichtig durch die Zervix ein, bis der Marker ca. 1,5-2 cm von der Portio entfernt ist (Abb. 4).
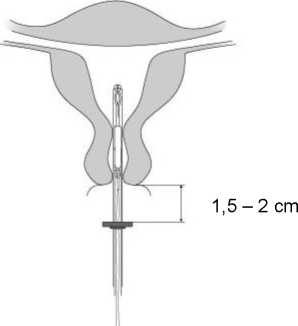
Abb. 4
WICHTIG! Das Insertionsröhrchen nicht mit Gewalt einführen. Dilatieren Sie den Zervikalkanal, wenn nötig.
5. Während Sie den Inserter ruhig in seiner Position halten, ziehen Sie den Schieber bis zur Markierung herunter, um die horizontalen Arme von MIRENA zu entfalten (Abb. 5). Warten Sie 5 - 10 Sekunden, damit sich die horizontalen Arme vollständig entfalten können.
6.
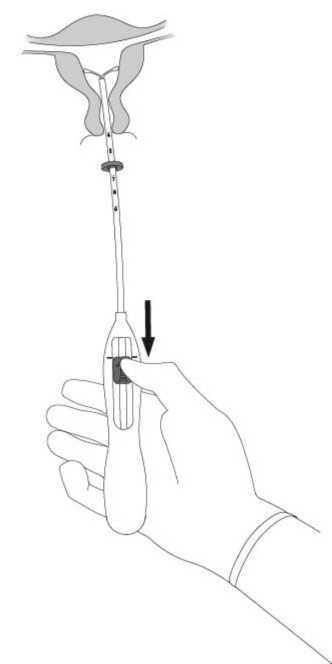
Abb. 5
Schieben Sie den Inserter sanft in Richtung Fundus uteri vor bis der Marker die Portio berührt. MIRENA ist nun in fundusnaher Position. (Abb. 6)
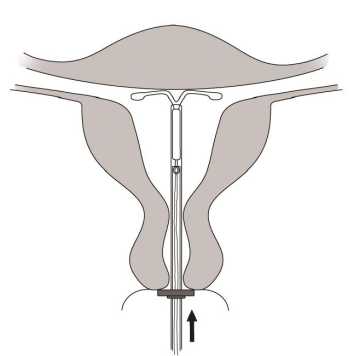
Abb. 6
7. Halten Sie weiterhin den Inserter ruhig in Position und setzen Sie MIRENA frei, indem Sie den Schieber vollständig hinunterziehen (Abb. 7). Während Sie den Schieber hinuntergezogen halten, entfernen Sie den Inserter durch vorsichtiges Herausziehen. Schneiden Sie die Fäden so ab, dass sie ca. 2 -3 cm außerhalb der Zervix sichtbar sind.
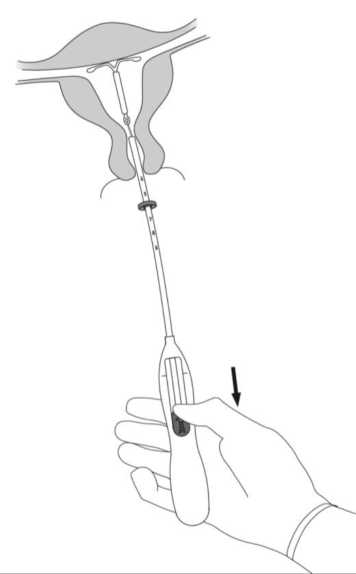
Abb. 7
WICHTIG!
Sollten Sie vermuten, dass sich das System nicht in korrekter Position befindet, überprüfen Sie die Lage von MIRENA (z. B. mit Ultraschall). Zu beachten ist, dass sich MIRENA sonographisch anders als ein Kupferpessar darstellt: Fadenöse und Abgang der Seitenarme stellen sich als echoreiche Punkte dar, der Hormonzylinder ist nur indirekt an seinem dorsalen Schallschatten zu erkennen. Entfernen Sie das System, wenn es nicht korrekt im Cavum uteri liegt. Ein entferntes System darf nicht wieder eingesetzt werden.
ENTFERNEN / WECHSEL VON MIRENA
Informationen zum Entfernen bzw. Einsetzen einer Folge-MIRENA sind in der Fachinformation im Abschnitt 4.2 sowie in der Gebrauchsinformation im Abschnitt 3 „Wie ist MIRENA anzuwenden?“ zu finden.
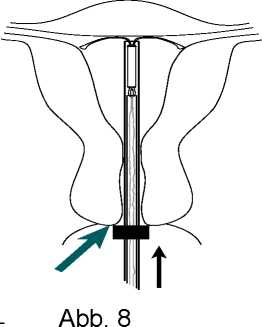
MIRENA wird durch Ziehen an den Rückholfäden mittels einer Zange entfernt (Abb. 8). Eine neue MIRENA kann unmittelbar nach dem Entfernen eingelegt werden.
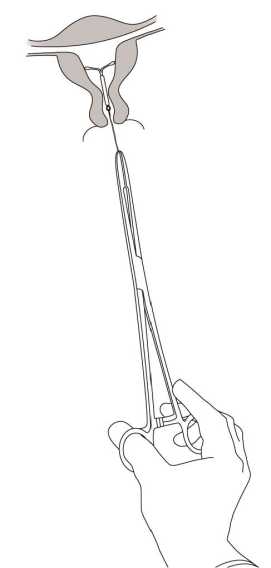
Abb. 8
Wenn kein Kinderwunsch besteht, sollte MIRENA bei einer sexuell aktiven Frau nicht nach dem 7. Zyklustag entfernt werden. Ansonsten sollten ab dem 7. Tag vor dem Entfernen andere Methoden der Kontrazeption (z. B. Kondome) verwendet werden. Kann der Zyklustag aufgrund der Blutungsfreiheit nicht sicher bestimmt werden, sollten ebenfalls Barrieremethoden ab dem 7. Tag vor dem Entfernen angewandt werden.
Hersteller:
Bayer Oy Pansiontie 47 20210 Turku Finnland
Inhaber der Zulassung:
Jenapharm GmbH & Co.KG Otto-Schott-Straße 15 07745 Jena
Telefon: (03641) 648888 Telefax: (03641) 648889
E-Mail-Adresse: frauengesundheit@jenapharm.de
Bisheriger Standardinserter (mit sichtbaren Fäden):* Insertionsanleitung
MIRENA ist sterilisiert (Ethylenoxidsterilisation). Darf nicht resterilisiert werden. Nur zum einmaligen Gebrauch. Nicht verwenden, wenn die innere Verpackung beschädigt oder offen ist. MIRENA muss bis zu dem auf dem Etikett angegebenen Datum eingelegt werden.
Jenapharm GmbH & Co.KG Otto-Schott-Straße 15 07745 Jena
Telefon: (03641) 648888 Telefax: (03641) 648889
E-Mail-Adresse: frauengesundheit@jenapharm.de
* Abhängig vom tatsächlich im Markt befindlichen Insertertyp wird die entsprechende Insertionsanleitung in die Faltschachtel gegeben.
Anleitung für den Arzt zum Einlegen des Intrauterinpessars mit Hormonabgabe
Bei erstmaliger Anwendung sollte MIRENA innerhalb von 7 Tagen nach Beginn der Menstruation eingelegt werden. MIRENA kann umgehend nach einem Abort im 1. Drittel der Schwangerschaft eingelegt werden.
Der Austausch gegen ein neues MIRENA kann zu jeder Zeit des Zyklus vorgenommen werden.
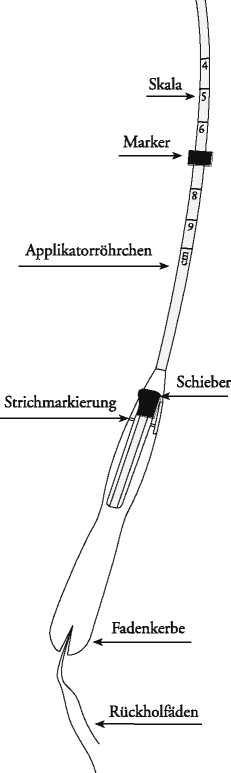
Abb. 1
Vorbereitung
• Vor dem Einlegen von MIRENA ist eine gynäkologische Untersuchung durchzuführen, um die Größe und Lage des Uterus zu bestimmen und eine Schwangerschaft, Infektionen des Genitales oder andere Kontraindikationen auszuschließen.
• Das Einlegen muss unter sterilen Bedingungen stattfinden. Auf eine gründliche Desinfektion der Vagina ist unbedingt zu achten.
• Nach Einstellung der Zervix mit Spekula ist nochmals unter Sicht eine gründliche Desinfektion der Vagina und der Portio durchzuführen. Die vordere Muttermundslippe wird mit einer Kugelzange erfasst. Unter leichtem Zug kommt es zur Abflachung des Winkels zwischen dem Zervikalkanal und dem Corpus uteri, wodurch das Einführen einer Sonde erleichtert wird. Die Kugelzange sollte während der Insertion von MIRENA in dieser Position verbleiben, um einen konstanten Zug aufrechtzuerhalten, der den Schiebekräften bei der Einführung entgegengerichtet ist.
• Mit Hilfe der Sonde wird der Verlauf des Zervikalkanals sowie die Lage und Länge des Cavum uteri bestimmt. Eine Verlegung der Gebärmutterhöhle, z. B. durch submuköse Myomknoten, sollte ausgeschlossen werden. Sollte der Zervikalkanal zu eng sein, so ist nach entsprechender Analgesie bzw. Anästhesie (z. B. Parazervikalblockade) eine vorsichtige Dilatation in Betracht zu ziehen. Der Durchmesser des Applikators beträgt 4,8 mm.
Insertion 1.
• Öffnen Sie vollständig die sterile Verpackung (Abb. 2a). Ziehen Sie dann sterile Handschuhe an.
• Greifen Sie den Inserter und drehen Sie ihn so, dass die Zentimeterangabe auf dem Einführungsröhrchen nach oben zeigt.
• Lösen Sie die Rückholfäden.
• Vergewissern Sie sich, dass der Schieber komplett in die von Ihnen abgewandte Richtung geschoben ist (Abb. 2a).
• Stellen Sie sicher, dass sich die Seitenarme in horizontaler Position befinden, siehe Abb. 2b. Evt. auf steriler Unterlage horizontal ausrichten.
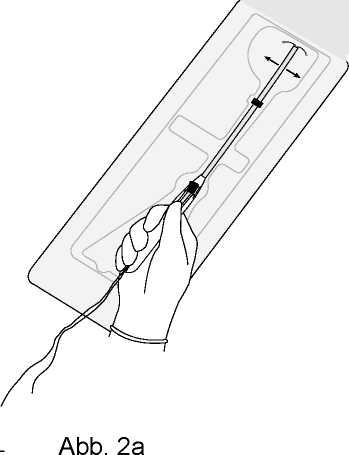
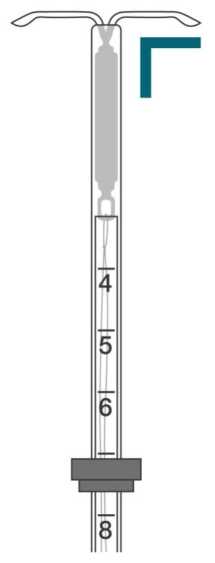
Abb. 2b 2.
• Den Schieber so weit wie möglich von sich entfernt haltend, ziehen Sie MIRENA mit Hilfe beider Rückholfäden in das Applikatorröhrchen (Abb. 3a).
• Die Endknöpfchen verschließen jetzt die Öffnung des Applikatorröhrchens (Abb. 3b).
• Sollten die Seitenarme evtl. nicht horizontal ausgerichtet sein, Seitenarme durch Herunterziehen des Schiebers bis zur Strichmarkierung (siehe Abb. 7b) wieder entfalten. Seitenarme auf steriler Unterlage ausrichten (Abb. 2b), Schieber in Ausgangsposition bringen und Vorgang wiederholen.
5
Abb. 3b
3.
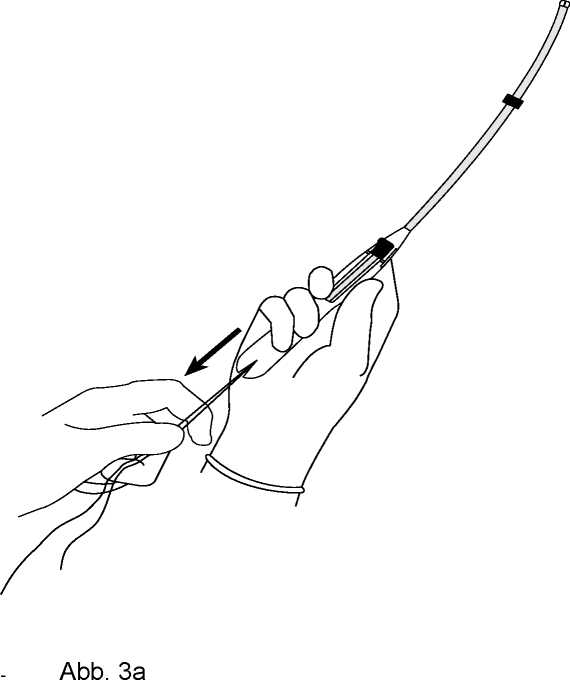
• Rückholfäden in der Fadenkerbe einklemmen (Abb. 4).
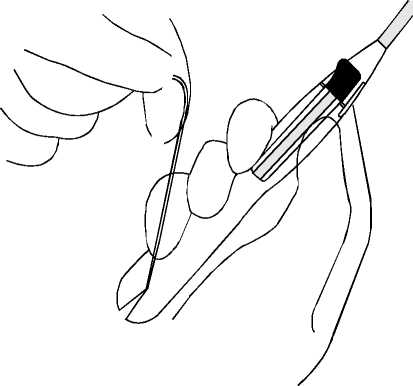
Abb. 4
• Sondenlänge, wie in Abb. 5 gezeigt, einstellen (obere Kante des grünen Markers zeigt die Sondenlänge an).
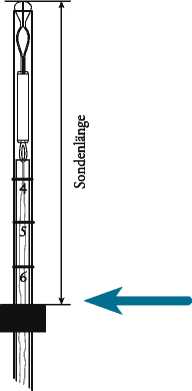
Abb. 5
5.
• MIRENA kann jetzt eingesetzt werden.
• Griff in die Hand nehmen und Schieber mit Daumen oder Zeigefinger in oberster Position fixieren.
• Applikatorröhrchen vorsichtig durch den Zervixkanal einführen bis der grüne Marker ca. 1,5-2 cm von der Portio entfernt ist (Abb. 6). Der Griff muss sich in der Horizontalen befinden, um die korrekte Entfaltung der Seitenarme zu gewährleisten. Cave: Das Applikatorröhrchen nicht mit Gewalt einführen. Wenn nötig, den Zervikalkanal dilatieren.
• Inserter ruhig halten und Seitenarme durch Herunterziehen des Schiebers bis zur Strichmarkierung entfalten (Abbildung 7a). Schieber mit Daumen oder Zeigefinger in dieser Position fixieren (Abbildung 7b). Warten Sie 5 - 7 Sekunden, damit die Arme sich in eine horizontale Position entfalten können.
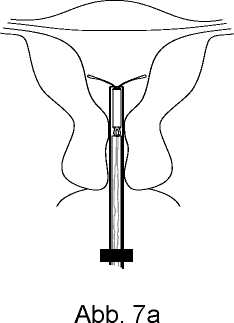
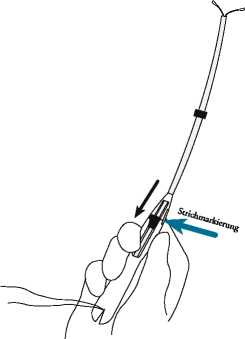
Abb. 7b
7.
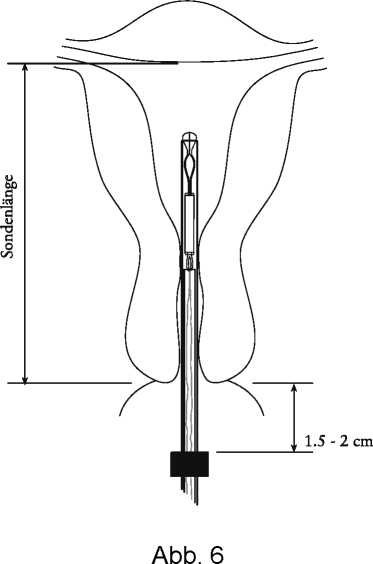
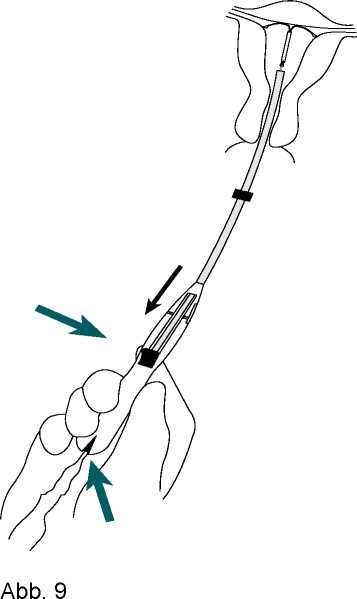
• Inserter vorsichtig hochschieben, bis der grüne Marker die Portio berührt. MIRENA befindet sich jetzt in fundusnaher Position (Abb. 8).
• Inserter ruhighalten. MIRENA aus dem Applikatorröhrchen freisetzen, indem der Schieber bis ganz nach unten gezogen wird.
Die Rückholfäden lösen sich automatisch aus ihrer Befestigung (Abb. 9). Bevor Sie den Applikator ganz hinaus ziehen, überprüfen Sie, ob die Rückholfäden frei heraushängen.
• Inserter vorsichtig herausziehen. Rückholfäden auf eine intravaginale Fadenlänge von ca. 2 cm kürzen (Abbildung 10).
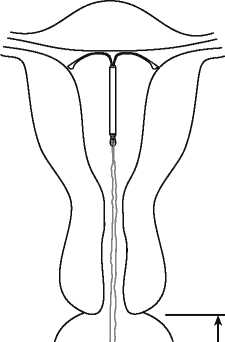
ca. 2 cm
Abb. 10
Wichtig!
Bei Verdacht auf Dislokation ermöglicht die sonographische Kontrolluntersuchung eine Überprüfung der Position von MIRENA. Zu beachten ist, dass sich MIRENA sonographisch anders als ein Kupferpessar darstellt: Fadenöse und Abgang der Seitenarme stellen sich als echoreiche Punkte dar, der Hormonzylinder ist nur indirekt an seinem dorsalen Schallschatten zu erkennen. Bei unkorrekter Lage sollte MIRENA entfernt und durch ein neues steriles Intrauterinpessar mit Hormonabgabe ersetzt werden.
Entfernen von MIRENA
MIRENA wird entfernt, indem mit einer Zange ein konstanter Zug auf beide Rückholfäden ausgeübt wird.
Wenn kein Kinderwunsch besteht, sollte MIRENA bei einer sexuell aktiven Frau nicht nach dem 7. Zyklustag entfernt werden. Ansonsten sollten ab dem 7. Tag vor dem Entfernen andere Methoden der Kontrazeption (z. B. Kondome) verwendet werden. Kann der Zyklustag aufgrund der Blutungsfreiheit nicht sicher bestimmt werden, sollten ebenfalls Barrieremethoden ab dem 7. Tag vor dem Entfernen angewandt werden.
Nach dem Entfernen der MIRENA sollte die Intaktheit des Systems überprüft werden. Bei schwierigem Entfernen der MIRENA wurde vereinzelt ein Verschieben des Hormonzylinders über die horizontalen Arme berichtet. Die Arme sind somit nicht mehr sichtbar. In diesem Fall sind keine weiteren Maßnahmen erforderlich, solange die Vollständigkeit des Systems sichergestellt ist. Die Knöpfchen am Ende der horizontalen Arme verhindern normalerweise eine komplette Loslösung des Zylinders vom T-Körper.
Wird direkt nach dem Entfernen ein neues MIRENA eingelegt, sind keine zusätzlichen Maßnahmen erforderlich.
Hersteller:
Bayer Oy Pansiontie 47 20210 Turku Finnland
31
Abhängig vom tatsächlich im Markt befindlichen Insertertyp wird die entsprechende Insertionsanleitung in die Faltschachtel gegeben.