Mirena
F achinform ation
Vor der Anwendung dieses Arzneimittels muss die Patientin im Rahmen eines Einverständnisverfahrens über die Risiken bei der Anwendung aufgeklärt werden. Im Rahmen dieser Aufklärung muss der Patientin ein spezieller Einverständnisbogen und die Gebrauchsinformation ausgehändigt werden. Der Einverständnisbogen muss von der Patientin und dem Arzt vor der Insertion von Mirena unterschrieben werden (siehe Einverständnisbogen).
1. BEZEICHNUNG DES ARZNEIMITTELS
Mirena®, 52 mg, Intrauterinpessar mit Hormonabgabe
2. QUALITATIVE UND QUANTITATIVE ZUSAMMENSETZUNG
1 Mirena Intrauterinpessar mit Hormonabgabe enthält 52 mg Levonorgestrel (Levonorgestrelfreisetzung initial um 20 pg/24 h, später nicht weniger als 10 pg/24 h, im 5-Jahresdurchschnitt 14 pg/24 h).
Vollständige Auflistung der sonstigen Bestandteile siehe Abschnitt 6.1.
3. DARREICHUNGSFORM
Intrauterinpessar (IUP) mit Gestagen
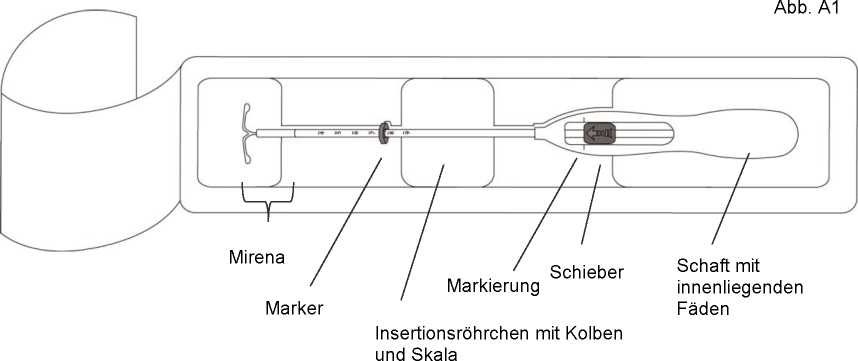
Das Produkt besteht aus einem weißen bzw. fast weißen, mit einer undurchsichtigen Membran umhüllten Arzneikern, der um den vertikalen Schaft eines T-förmigen Körpers befestigt ist. An dem einen Ende des vertikalen Schafts des T-förmigen Körpers befindet sich eine Öse, am anderen zwei horizontale Arme. An der Öse sind Rückholfäden befestigt. Der vertikale Schaft des IUP befindet sich im Insertionsröhrchen an der Spitze der Insertionsvorrichtung. IUP und Insertionsvorrichtung sind im Wesentlichen frei von sichtbaren Verunreinigungen.
4. KLINISCHE ANGABEN
4.1 Anwendungsgebiete Kontrazeption, Hypermenorrhoe
4.2 Dosierung und Art der Anwendung
Es wird dringend empfohlen, dass die Insertion von Mirena nur von Ärzten durchgeführt wird, die in der Insertion von Mirena erfahren sind und/oder ausreichend für eine Insertion von Mirena geschult wurden.
Mirena wird intrauterin eingelegt (siehe “Insertionsanleitung”). Die Liegedauer beträgt maximal 5 Jahre. Während dieses Zeitraumes beträgt die Levonorgestrelfreisetzung initial ca. 20 pg/24 h, später nicht weniger als 10 pg/24 h, im 5-Jahresdurchschnitt 14 pg/24 h.
Die Versagerrate bei Mirena, eine korrekte Insertion gemäß der Insertionsanleitung vorausgesetzt, liegt bei ca. 0,2% nach einem Jahr. Die kumulative Versagerrate liegt bei ca. 0,7% nach 5 Jahren.
Bei erstmaliger Anwendung sollte Mirena innerhalb von 7 Tagen nach Beginn der Menstruation eingelegt werden. Die kontrazeptive Wirkung besteht dann sofort. Mirena kann umgehend nach einem Abort im ersten Drittel der Schwangerschaft eingelegt werden.
Postpartal sollte die Insertion erst nach vollständiger Rückbildung der Gebärmutter erfolgen. Da das Risiko einer Uterusperforation bei postpartaler Einlage möglicherweise erhöht ist (siehe “Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“), sollte in Betracht gezogen werden, eine Insertion erst nach der 12. postpartalen Woche durchzuführen. Frühestens sollte eine Insertion 6 Wochen postpartal erfolgen.
Im Falle einer schwierig verlaufenden Insertion bzw. bei außergewöhnlichen Schmerzen oder Blutungen während oder nach der Insertion, sollten umgehend eine gynäkologische Untersuchung und ein Ultraschall durchgeführt werden, um eine Perforation auszuschließen.
Eine rein körperliche Untersuchung (inklusive einer Überprüfung der Rückholfäden) ist möglicherweise nicht ausreichend, um eine Teilperforation auszuschließen.
Das Pessar wird entfernt, indem man mit einer Zange vorsichtig an den Rückholfäden zieht. Falls die Fäden nicht sichtbar sind und das IUP sich in der Uterushöhle befindet, kann es auch mit Hilfe eines feinen Instrumentes herausgezogen werden. Möglicherweise ist hierfür eine Zervixdilatation oder andere chirurgische Maßnahmen erforderlich.
Mirena sollte nach 5 Jahren entfernt werden. Wenn die Patientin nach Ablauf der Liegedauer diese Methode fortsetzen möchte, kann nach der Entfernung des Intrauterinpessars mit Hormonabgabe sofort ein neues eingesetzt werden. Generell sollte bereits vor der Entfernung von Mirena rechtzeitig die Art der Folgekontrazeptionsmethode überlegt werden, wenn weiterhin der Wunsch einer kontinuierlichen Kontrazeption besteht. Wenn eine Schwangerschaft nicht gewünscht wird, sollte die Entfernung von Mirena während der Menstruation erfolgen, sofern ein Menstruationszyklus zu bestehen scheint. Wenn Mirena in der Mitte eines Zyklus entfernt wird und die Anwenderin in der vorausgegangenen Woche Geschlechtsverkehr gehabt hatte, besteht das Risiko einer Schwangerschaft, sofern nicht sofort nach der Entfernung eine neue Mirena eingelegt wird. Im Zweifelsfall sollten ab dem 7. Tag vor dem Entfernen Barrieremethoden angewandt werden.
Nach dem Entfernen der Mirena sollte die Intaktheit des Systems überprüft werden. Bei schwierigem Entfernen der Mirena wurde vereinzelt ein Verschieben des Hormonzylinders über die horizontalen Arme berichtet. Die Arme sind somit nicht mehr sichtbar. In diesem Fall sind keine weiteren Maßnahmen erforderlich, solange die Vollständigkeit des Systems sichergestellt ist. Die Knöpfchen am Ende der horizontalen Arme verhindern normalerweise eine komplette Loslösung des Zylinders vom T-Körper.
Zusätzliche Hinweise zu besonderen Patientengruppen
Ältere Patientinnen
Für die Anwendung von Mirena bei postmenopausalen Frauen gibt es keine Indikation.
Patientinnen mit eingeschränkter Leberfunktion
Mirena ist bei Frauen mit akuten Lebererkrankungen oder Lebertumoren kontraindiziert (siehe Abschnitt 4.3).
Patientinnen mit eingeschränkter Nierenfunktion
Die Anwendung von Mirena bei Frauen mit eingeschränkter Nierenfunktion wurde nicht untersucht.
Insertionsanleitung
Mirena darf nur von einem Arzt/einer Ärztin unter aseptischen Bedingungen eingesetzt werden.
Für weitere Hinweise zur Handhabung siehe auch Abschnitt 6.6.
Vorbereitung der Insertion
Untersuchen Sie die Patientin, um die Größe und Lage des Uterus zu bestimmen, akute genitale Infektionen oder andere Kontraindikationen für die Insertion von Mirena festzustellen und eine Schwangerschaft auszuschließen.
Führen Sie ein Spekulum ein, stellen Sie die Zervix dar und desinfizieren Sie anschließend sorgfältig Zervix und Vagina mit einer geeigneten antiseptischen Lösung.
Wenn notwendig, lassen Sie sich von einem Assistenten/einer Assistentin unterstützen.
Ergreifen Sie die vordere Muttermundslippe mit einer Kugelzange oder einer anderen Fasszange, um den Uterus zu stabilisieren. Wenn ein retrovertierter Uterus vorliegt, kann es sinnvoller sein, die hintere Muttermundslippe zu ergreifen. Die Zange sollte in Position und der Zervikalkanal durch leichten Gegenzug während der Insertion gestreckt gehalten werden.
Schieben Sie eine Uterussonde vorsichtig durch den Zervikalkanal bis zum Fundus uteri, um die Länge und die Richtung des Cavum uteri zu bestimmen und etwaige intrauterine Anomalien (z. B. ein Septum, submuköse Myome) oder ein früher eingelegtes intrauterines Kontrazeptivum, das nicht entfernt wurde, auszuschließen. Erwägen Sie gegebenenfalls eine Dilatation des Zervikalkanals. Ist eine Zervixdilatation erforderlich, ist der Gebrauch von Analgetika und/oder eine Parazervikalblockade in Erwägung zu ziehen.
Insertion
Die in der Mirena-Packung beigefügte Insertionsanleitung ist unbedingt zu beachten.
1. Öffnen Sie zuerst die sterile Packung vollständig (Abb. A1). Benutzen Sie dann sterile Handschuhe und führen Sie das Insertionsverfahren unter sterilen Kautelen durch.
2. Drücken Sie den Schieber in Pfeilrichtung bis zur äußersten Position nach vorne, um Mirena in das Insertionsröhrchen zu laden (Abb. A2).
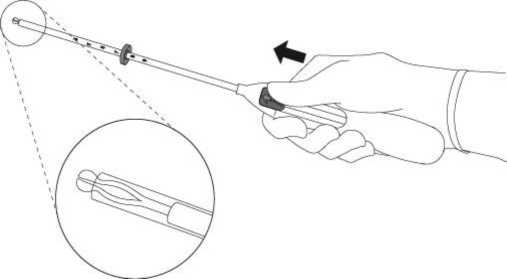
Abb. A2
Wichtig! Ziehen Sie den Schieber nicht zurück, da dies eine vorzeitige Freisetzung von Mirena zur Folge haben kann. Einmal freigesetzt, kann Mirena nicht erneut geladen werden.
3. Halten Sie den Schieber in der äußersten Position und stellen Sie den oberen Rand des Markers auf die mit der Sonde gemessenen Länge des Cavum uteri ein (Abb. A3).
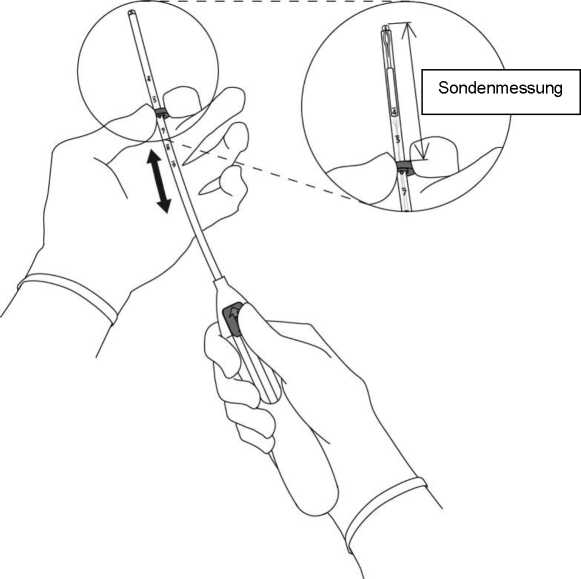
Abb. A3
4. Während Sie den Schieber in der äußersten Position halten, führen Sie das Insertionsröhrchen vorsichtig durch die Zervix ein, bis der Marker ca. 1,5-2 cm von der Portio entfernt ist (Abb. A4).
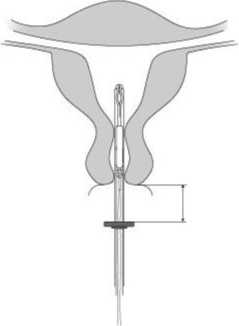
1,5 - 2 cm
Abb. A4
Wichtig! Das Insertionsröhrchen nicht mit Gewalt einführen. Dilatieren Sie den Zervikalkanal, wenn nötig.
5. Während Sie den Inserter ruhig in seiner Position halten, ziehen Sie den Schieber bis zur
Markierung herunter, um die horizontalen Arme von Mirena zu entfalten (Abb. A5). Warten Sie 5 - 10 Sekunden, damit sich die horizontalen Arme vollständig entfalten können.
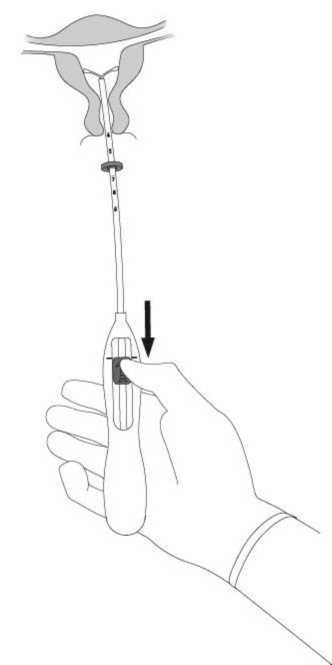
Abb. A5
Schieben Sie den Inserter sanft in Richtung Fundus uteri vor bis der Marker die Portio berührt. Mirena ist nun in fundusnaher Position. (Abb. A6)
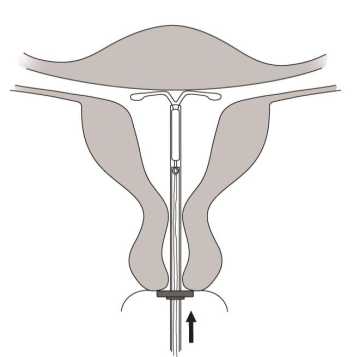
Abb. A6
7. Halten Sie weiterhin den Inserter ruhig in Position und setzen Sie Mirena frei, indem Sie den Schieber vollständig hinunterziehen (Abb. A7). Während Sie den Schieber hinuntergezogen halten, entfernen Sie den Inserter durch vorsichtiges Herausziehen. Schneiden Sie die Fäden so ab, dass sie ca. 2 -3 cm außerhalb der Zervix sichtbar sind.
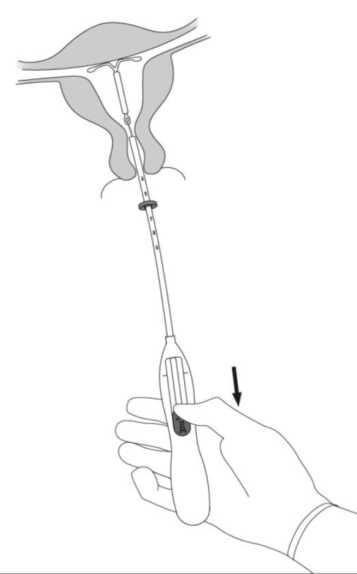
Abb. A7
Wichtig!
Sollten Sie vermuten, dass sich das System nicht in korrekter Position befindet, überprüfen Sie die Lage von Mirena (z. B. mit Ultraschall). Zu beachten ist, dass sich Mirena sonographisch anders als ein Kupferpessar darstellt: Fadenöse und Abgang der Seitenarme stellen sich als echoreiche Punkte dar, der Hormonzylinder ist nur indirekt an seinem dorsalen Schallschatten zu erkennen. Entfernen Sie das System, wenn es nicht korrekt im Cavum uteri liegt. Ein entferntes System darf nicht wieder eingesetzt werden.
Entfernen / Wechsel von Mirena
Mirena wird durch Ziehen an den Rückholfäden mittels einer Zange entfernt. Eine neue Mirena kann unmittelbar nach dem Entfernen eingelegt werden.
4.3 Gegenanzeigen
- Überempfindlichkeit gegen den Wirkstoff oder einen der in Abschnitt 6.1 genannten sonstigen Bestandteile
- Vermutete oder bestätigte Schwangerschaft
- Vorliegen oder Verdacht auf Gestagen-abhängige Tumoren, z. B. Mammakarzinom
- Akute oder rezidivierende PID (Entzündliche Erkrankungen des kleinen Beckens)
- Zervizitis
- Infektionen des inneren und äußeren Genitales
- Postpartale Endometritis
- Septischer Abort in den letzten 3 Monaten
- Erkrankungen und Zustände, die mit einem höheren Infektionsrisiko verbunden sind
- Zervixdysplasie
- Nachweis oder Verdacht auf maligne Erkrankungen des Corpus oder der Zervix uteri
- Irreguläre uterine Blutungen unbekannter Genese
- Angeborene oder erworbene Fehlbildungen des Uterus einschließlich Uterusmyome, wenn sie das Cavum uteri verformen
- Akute Lebererkrankungen oder Lebertumoren
4.4 Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung
Mirena sollte nur unter strenger Indikationsstellung angewendet oder ggf. entfernt werden, wenn folgende Erkrankungen vorliegen oder erstmals auftreten:
- Migräne, Verstärkung einer Migräne, fokale Migräne mit asymmetrischem Sehverlust oder andere Symptome, die auf eine vorübergehende zerebrale Ischämie hindeuten
- Außergewöhnlich starke Kopfschmerzen
- Gelbsucht
- Deutliche Blutdrucksteigerung
- Schwere arterielle Gefäßerkrankungen wie z. B. Schlaganfall oder Myokardinfarkt
- Akute venöse Thromboembolien.
Mirena sollte nur unter strenger Indikationsstellung angewendet werden, wenn folgende Erkrankungen vorliegen:
- angeborene Herzkrankheiten oder Herzklappenfehler, die zu einer bakteriellen Endokarditis führen können.
Beeinflussung des Kohlenhydratstoffwechsels
Klinische Erfahrungen mit Diabetikerinnen liegen nur begrenzt vor. Der Blutzuckerspiegel sollte deshalb bei Diabetikerinnen, die Mirena anwenden, insbesondere in der Anfangsphase streng überwacht werden. Von der oralen Kontrazeption her ist bekannt, dass die Glucosetoleranz selbst bei niedriger Dosierung von Levonorgestrel beeinflusst werden kann. Im Allgemeinen ist jedoch eine Anpassung der Dosierung bei Diabetikerinnen, die Mirena anwenden, nicht erforderlich.
Irreguläre Blutungen
Irreguläre Blutungen könnten manche Symptome oder Anzeichen für Korpuspolypen oder ein Endometriumkarzinom verbergen. In Verdachtsfällen ist eine diagnostische Abklärung in Erwägung zu ziehen.
Parität
Die intrauterine Kontrazeption kommt bevorzugt bei Frauen, die bereits geboren haben, zur Anwendung. Sie ist bei jungen nulliparen Frauen nicht als die Methode der ersten Wahl anzusehen und sollte nur dann in Betracht gezogen werden, wenn andere zuverlässige Methoden nicht eingesetzt werden können.
Mirena ist nicht zur postkoitalen Kontrazeption geeignet.
Medizinische Untersuchungen/Konsultationen
Vor der Einlage muss die Patientin über Wirksamkeit, Risiken - inklusive der Anzeichen und Symptome dieser Risiken, wie sie in der Gebrauchsinformation beschrieben sind - und die Nebenwirkungen von Mirena informiert werden. Es sollte eine körperliche Untersuchung einschließlich Becken und Mammae sowie ein Zervikalabstrich durchgeführt werden. Eine Schwangerschaft und sexuell übertragbare Krankheiten sind auszuschließen. Genitalinfektionen müssen vor der Einlage erfolgreich behandelt werden. Die Lage des Uterus und die Größe des Cavum uteri sollten bestimmt werden. Die fundusnahe Lage von Mirena ist besonders wichtig, um eine gleichbleibende Wirkung des Gestagens auf das Endometrium zu gewährleisten, das Risiko einer Expulsion zu verhindern und die Wirksamkeit zu maximieren. Die Anleitung zur Insertion sollte daher genau befolgt werden.
Da sich die Insertionstechnik von anderen Intrauterinsystemen unterscheidet, sollte dem Training der korrekten Insertionstechnik besondere Beachtung geschenkt werden.
Bei der Insertion und der Entfernung kann es zu Schmerzen und Blutungen kommen. Infolge einer vasovagalen Reaktion kann Ohnmacht eintreten. Bei Epileptikerinnen kann ein Anfall ausgelöst werden.
Die Patientin sollte 4 - 12 Wochen nach der Insertion nachuntersucht werden. Danach werden einmal jährliche oder bei klinischer Indikation häufigere Nachuntersuchungen empfohlen.
Da unregelmäßige Blutungen/Schmierblutungen häufig während der ersten Monate der Anwendung auftreten, sind pathologische Veränderungen des Endometriums vor Einlage der Mirena auszuschließen. Sollten nach einer längeren Anwendungsdauer Blutungsunregelmäßigkeiten auftreten, müssen geeignete diagnostische Maßnahmen ergriffen werden.
Oligo-/ Amenorrhoe
Oligo-/Amenorrhoe stellt sich bei etwa 20% der Patientinnen nach und nach ein. Spätestens 6 Wochen nach dem erstmaligem Ausbleiben der Periodenblutung oder Wiederauftreten menstruationsstarker Blutungen ist die Möglichkeit einer Schwangerschaft in Betracht zu ziehen und gegebenenfalls diagnostisch abzuklären. Wiederholte Schwangerschaftstests sind bei amenorrhoischen Patientinnen nicht notwendig, es sei denn die Tests sind aufgrund anderer Symptome indiziert.
Infektionen des kleinen Beckens
Das Einführungsröhrchen schützt Mirena vor mikrobieller Kontamination während des Einlegens, und der Mirena-Inserter wurde so konzipiert, um das Infektionsrisiko möglichst gering zu halten. Bei Anwenderinnen von Kupfer-Intrauterinpessaren (IUS) ist die Häufigkeitsrate entzündlicher Beckenerkrankungen im ersten Monat nach der Insertion am höchsten und nimmt danach ab.
Trotzdem kann es in engem zeitlichen Zusammenhang mit der Insertion, aber auch zu jedem späteren Zeitpunkt zu einer aufsteigenden Infektion des kleinen Beckens kommen, die durch Fieber und Unterbauchschmerzen gekennzeichnet ist. Bekannte Risikofaktoren für entzündliche Beckenerkrankungen sind wechselnde Sexualpartner. Das Risiko einer Infektion mit sexuell übertragbaren Krankheiten kann durch Verwendung von Kondomen reduziert werden.
Eine Beckeninfektion kann schwerwiegende Folgen mit sich bringen und so zum Beispiel die Fruchtbarkeit einschränken bzw. das Risiko für eine Extrauteringravidität erhöhen.
Wie bei anderen gynäkologischen oder operativen Maßnahmen kann, wenn auch äußerst selten, nach einer IUP-Insertion eine schwere Infektion oder Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) auftreten.
Bei rezidivierender Endometritis oder Infektionen des kleinen Beckens, oder bei einer akuten schweren oder nicht auf Antibiotika innerhalb weniger Tage ansprechenden Infektion, muss Mirena entfernt werden.
Auch bei nur schwachen Symptomen, die auf eine Infektion hinweisen, sind bakteriologische Untersuchungen angezeigt. In diesem Falle wird eine Beobachtung der Patientin empfohlen.
Expulsion
Symptome einer partiellen oder kompletten Expulsion von Mirena können Blutungen oder Schmerzen sein. Das Intrauterinpessar mit Hormonabgabe kann jedoch auch ausgestoßen werden, ohne dass es die Patientin bemerkt, und damit zum Verlust der kontrazeptiven Wirkung führen. Bei einer partiellen Expulsion kann die Wirkung von Mirena vermindert sein. Da es bei der Anwendung von Mirena zu einer Oligo-/Amenorrhoe kommt, kann eine plötzlich auftretende verstärkte Menstruationsblutung ein Hinweis auf eine Expulsion sein. Ein disloziertes Mirena sollte entfernt und ggf. durch ein neues ersetzt werden.
Die Patientin sollte beraten werden, wie sie das Vorhandensein der Rückholfäden des Pessars regelmäßig, am besten jeweils direkt nach der Regel, bei sich überprüfen kann.
Perforationen
Perforationen oder Penetrationen des Gebärmutterkörpers oder der Zervix können durch ein intrauterines Kontrazeptivum verursacht werden. Meistens geschieht dies bei der Insertion, obwohl dies möglicherweise erst einige Zeit später festgestellt wird. Dadurch kann die Wirkung von Mirena reduziert sein. Mirena ist in solchen Fällen unverzüglich zu entfernen. Ein chirurgischer Eingriff kann erforderlich sein.
In einer groß angelegten prospektiven vergleichenden nicht-interventionellen Kohortenstudie bei IUS-Anwenderinnen (N=61.448 Frauen) lag die Perforations-Inzidenz bei 1,3 (95% CI: 1,1 - 1,6) per 1.000 Insertionen in der gesamten Studien-Kohorte; 1,4 (95% CI: 1,1 - 1,8) per 1.000 Insertionen in der Mirena-Kohorte und 1,1 (95% CI: 0,7 - 1,6) per 1.000 Insertionen in der Kupfer-IUP-Kohorte.
Die Studie zeigte, dass das Risiko einer Perforation sowohl bei stillenden Frauen zum Zeitpunkt der Insertion als auch bei Frauen bis 36 Wochen nach einer Entbindung erhöht ist (siehe Tabelle 1). Diese Risikofaktoren waren unabhängig vom Typ des eingesetzten IUD.
Tabelle 1: Perforations-Inzidenz per 1.000 Insertionen für die gesamte Studien-Kohorte, gegliedert nach zum Zeitpunkt der Insertion stillende/nichtstillende Frauen und der Zeitspanne zwischen Entbindung und Insertion (Frauen nach der Entbindung)
|
Stillende Frauen zum Zeitpunkt der Insertion |
Nicht stillende Frauen zum Zeitpunkt der Insertion | |
|
Insertion < 36 Wochen nach Entbindung |
5,6 (95% CI 3,9 - 7,9; n=6.047 Insertionen) |
1,7 (95% CI 0,8 - 3,1; n=5.927 Insertionen) |
|
Insertion > 36 Wochen nach Entbindung |
1,6 (95% CI 0,0 - 9,1; n=608 Insertionen) |
0,7 (95% CI 0,5 - 1,1; n=41.910 Insertionen) |
Das Risiko einer Perforation kann bei Frauen mit fixiertem retrovertierten Uterus erhöht sein. Nachuntersuchungen nach der Insertion sollten der Anleitung im Abschnitt „Medizinische Untersuchungen/Konsultationen“ folgend vorgenommen werden, können jedoch, wie klinisch angezeigt, bei Patientinnen mit Risikofaktoren für eine Perforation, angepasst werden.
Brustkrebs
Für Frauen, die derzeit kombinierte orale Kontrazeptiva (KOK) anwenden (hauptsächlich Estrogen-Gestagen-Präparate), hat eine Metaanalyse 54 epidemiologischer Studien ein leicht erhöhtes relatives Brustkrebsrisiko (RR = 1,24) ergeben. Innerhalb von 10 Jahren nach Absetzen der KOK geht das erhöhte Risiko allmählich wieder auf das altersentsprechende Grundrisiko zurück.
Da Brustkrebs bei Frauen unter 40 Jahren relativ selten auftritt, ist die Anzahl zusätzlicher Brustkrebsfalle bei ehemaligen oder momentanen Anwenderinnen oraler Kontrazeptiva klein im Vergleich zum Gesamtrisiko für Brustkrebs.
Das Brustkrebsrisiko bei Anwenderinnen von Gestagen-only-Kontrazeptiva liegt möglicherweise in der gleichen Größenordnung wie bei Anwenderinnen von KOK. Jedoch ist es schwieriger, diese Aussage mit Daten zu belegen, da es sich hier um eine kleinere Anwenderinnenzahl handelt.
Falls bei Anwenderinnen von Mirena ein Geschlechtshormon-abhängiger Tumor (z. B. Brustkrebs) diagnostiziert wird, muss Mirena entfernt werden.
Schwangerschaften und Ektopische Schwangerschaft bei liegendem Pessar
Die Versagerrate bei Mirena, eine korrekte Insertion gemäß der Insertionsanleitung vorausgesetzt, liegt bei ca. 0,2% nach einem Jahr. Die kumulative Versagerrate liegt bei ca. 0,7% nach 5 Jahren.
Frauen mit vorausgegangener Bauchhöhlenschwangerschaft, Operation der Tuben oder Infektionen des kleinen Beckens sind besonders gefährdet für eine ektopische Schwangerschaft. Treten bei liegendem Intrauterinpessar Unterbauchschmerzen auf, insbesondere in Verbindung mit dem Ausbleiben der Periodenblutung oder mit dem Auftreten einer plötzlichen Blutung nach längerem blutungsfreien Intervall bzw. in Verbindung mit den typischen Symptomen einer Frühschwangerschaft, dann muss die Möglichkeit einer Extrauterinschwangerschaft in Betracht gezogen werden.
Das absolute Risiko einer Extrauteringravidität bei Mirena-Anwenderinnen ist aufgrund einer insgesamt geringen Wahrscheinlichkeit für eine Schwangerschaft bei Mirena-Anwenderinnen im Vergleich zu Frauen, die keine Verhütungsmittel anwenden, niedrig.
In einer groß angelegten prospektiven vergleichenden nicht-interventionellen Kohortenstudie betrug die Rate ektopischer Schwangerschaften bei Mirena-Anwenderinnen 0,02% innerhalb des Beobachtungszeitraumes von 1 Jahr.
In klinischen Studien betrug die absolute Rate extrauteriner Schwangerschaften bei Mirena-Anwenderinnen ca. 0,1% im Jahr, verglichen mit ca. 0,3-0,5% im Jahr bei Frauen, die nicht verhüten.
Wenn eine Frau jedoch unter Anwendung von Mirena schwanger wird, ist die relative Wahrscheinlichkeit einer Extrauteringravidität erhöht.
Nicht auffindbare Fäden
Die Aufklärung und Unterweisung der Patientin zur Kontrolle der Rückholfäden durch Selbstuntersuchung wird empfohlen. Wenn die Rückholfäden bei einer Kontrolluntersuchung nicht in der Vagina sichtbar sind, muss die korrekte, intrauterine Lage von Mirena sonographisch überprüft werden und ggf. eine Schwangerschaft ausgeschlossen werden. Die Rückholfäden können sich in die Gebärmutter oder in den Zervixkanal zurückgezogen haben und bei der nächsten Menstruation wieder sichtbar werden. Liegt keine Schwangerschaft vor, so lassen sich die Fäden meist durch vorsichtiges Sondieren lokalisieren. Sind die Fäden nicht auffindbar, sollten die Möglichkeiten, dass das IUP ausgestoßen wurde (Expulsion) oder die Gebärmutterwand durchstoßen hat (Perforation) in Betracht gezogen werden. In diesem Fall sollte die Position von Mirena durch eine Ultraschall- oder Röntgenuntersuchung überprüft werden.
Ovarialzysten
Da die empfängnisverhütende Wirkung von Mirena hauptsächlich auf lokalen Wirkungen im Uterus beruht, kommt es in der Regel zu keiner Veränderung der ovariellen Funktion, einschließlich der Ovulation bei Frauen im gebärfähigen Alter. Manchmal kann es bei der Follikelreifung zu einer verzögerten Follikelatresie und damit zu einer weiteren Größenzunahme des entsprechenden Follikels kommen. Solche vergrößerten Follikel sind klinisch nicht von Ovarialzysten zu unterscheiden. Ovarialzysten wurden bei etwa 7% der Mirena-Anwenderinnen festgestellt. Meistens verursachen diese Follikel keine Beschwerden, können jedoch in einigen Fällen zu Schmerzen im Unterbauch oder beim Geschlechtsverkehr führen. In den meisten Fällen haben solche Ovarialzysten keine klinische Bedeutung und bilden sich im Verlauf eines 2-3 monatigen Beobachtungszeitraumes zurück. Sollte dies nicht der Fall sein, sind fortlaufende Ultraschallkontrollen sowie ggf. auch andere diagnostische oder therapeutische Maßnahmen zu empfehlen. In seltenen Fällen kann ein chirurgischer Eingriff erforderlich sein.
4.5 Wechselwirkungen mit anderen Arzneimitteln und sonstige Wechselwirkungen
Der Metabolismus von Gestagenen kann durch die gleichzeitige Anwendung von Substanzen verstärkt werden, die Arzneimittel-metabolisierende Enzyme, vor allem die Cytochrom-P450-Enzyme, induzieren; zu diesen Substanzen gehören Antikonvulsiva (z. B. Phenobarbital, Phenytoin, Carbamazepin) und Antiinfektiva (z. B. Rifampicin, Rifabutin, Nevirapin, Efavirenz). Der Einfluss dieser Substanzen auf die kontrazeptive Wirksamkeit von Mirena ist nicht bekannt, aufgrund des lokalen Wirkmechanismus wird aber nicht angenommen, dass dieser von großer Bedeutung ist.
4.6 Fertilität, Schwangerschaft und Stillzeit
Schwangerschaft
Mirena ist während einer bestehenden oder vermuteten Schwangerschaft kontraindiziert (siehe Abschnitt 4.3).
Tritt unter Mirena in situ eine Schwangerschaft ein, sollte Mirena entfernt werden, da bei allen intrauterinen Kontrazeptiva ein erhöhtes Risiko eines Spontanabortes oder vorzeitiger Wehentätigkeit besteht. Das Entfernen von Mirena oder die Manipulation des Uterus kann zur vorzeitigen Beendigung der Schwangerschaft führen. Falls kein schonendes Entfernen der Mirena möglich ist, z. B. aufgrund hochgezogener Fäden, kann ein Abbruch der Schwangerschaft in Erwägung gezogen werden. Falls seitens der Anwenderin der Wunsch nach Fortsetzung der Schwangerschaft besteht und das System nicht entfernt werden kann, sollte sie über die Risiken und möglichen Konsequenzen einer vorzeitigen Geburt für den Säugling informiert werden.
Der Verlauf einer solchen Schwangerschaft sollte engmaschig überwacht werden.
Das Vorliegen einer ektopischen Schwangerschaft muss ausgeschlossen werden.
Die Patientin sollte angewiesen werden, alle Symptome einer möglichen Schwangerschaftskomplikation, wie Bauchkrämpfe und/oder Fieber dem Arzt zu berichten.
Klinische Erfahrungen über den Verlauf von Schwangerschaften bei liegender Mirena sind aufgrund der hohen kontrazeptiven Sicherheit von Mirena begrenzt. Bislang gibt es keine Hinweise auf Schädigungen des Kindes verursacht durch eine liegende Mirena. Ein mögliches Auftreten virilisierender Effekte beim Feten muss aufgrund der intrauterinen Verabreichung von Levonorgestrel und der lokalen Hormonexposition in Betracht gezogen werden.
Stillzeit
Die tägliche Levonorgestrel-Dosis und die Serumkonzentrationen von Levonorgestrel sind unter Anwendung von Mirena niedriger als bei allen anderen hormonalen Kontrazeptiva. Dennoch wurde Levonorgestrel bei Anwenderinnen von Mirena in der Muttermilch nachgewiesen.
Ungefähr 0,1% der Levonorgestreldosis nimmt ein Kind während des Stillens auf. Allerdings ist es auf Grund von epidemiologischen Daten zu Levonorgestrel-haltigen Präparaten nicht wahrscheinlich, dass die von Mirena nach dem Einlegen in die Gebärmutterhöhle freigesetzte Dosis ein Risiko für das Kind mit sich bringt.
Es gibt keine Hinweise auf schwerwiegende negative Auswirkungen auf das Wachstum bzw. die Entwicklung des Kindes, wenn Mirena zur Verhütung sechs Wochen postpartum zur Anwendung kommt. Methoden, die auf den Einsatz von Gestagen-haltigen Medikamenten beruhen, haben nach
derzeit vorliegenden Daten keinen nachteiligen Einfluss auf die Quantität bzw. die Qualität der Muttermilch. In seltenen Fällen ist über Gebärmutterblutungen bei Frauen berichtet worden, die Mirena während der Stillzeit angewendet haben.
Fertilität
Nach Entfernung von Mirena erreichen Frauen wieder die gleiche Fertilität wie zuvor.
4.7 Auswirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen
Es wurden keine Studien zur Erfassung von Wirkungen auf die Verkehrstüchtigkeit und die Fähigkeit zum Bedienen von Maschinen durchgeführt.
4.8 Nebenwirkungen
Bei den Häufigkeitsangaben zu Nebenwirkungen werden folgende Kategorien zugrunde gelegt: Sehr häufig (> 1/10)
Häufig (> 1/100 bis < 1/10)
Gelegentlich (> 1/1.000 bis < 1/100)
Selten (> 1/10.000 bis < 1/1.000)
Nicht bekannt (Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar)
Nebenwirkungen treten häufiger während der ersten Monate nach dem Einlegen auf und klingen bei längerer Anwendung in der Regel ab. Zusätzlich zu den in Abschnitt 4.4 "Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung" aufgeführten unerwünschten Wirkungen wurde bei Frauen, die Mirena anwenden, über die nachstehenden Nebenwirkungen berichtet.
Zu den sehr häufigen unerwünschten Wirkungen (bei über 10% der Anwenderinnen) gehören Uterus-und Vaginalblutungen, einschließlich Schmierblutungen, sowie Oligomenorrhoe und Amenorrhoe. Zu den häufigen Nebenwirkungen gehören gutartige Ovarialzysten.
Bei allen Frauen, die Mirena anwenden, treten unterschiedliche Arten von Veränderungen bei der Menstruationsblutung (häufige, verlängerte, verkürzte oder starke Blutungen, Zwischen- bzw. Schmierblutungen, Oligomenorrhoe, Amenorrhoe, Dysmenorrhoe) auf. Bei fertilen Frauen sinkt die durchschnittliche Anzahl der Tage /Monate, an denen eine Zwischenblutung auftritt, in den ersten sechs Monaten der Anwendung allmählich von neun auf vier Tage. Der Anteil der Frauen mit einer länger anhaltenden Blutung (mehr als acht Tage) geht in den ersten drei Monaten der Anwendung von 20% auf 3% zurück. Im Rahmen von klinischen Studien zeigte sich im ersten Jahr der Anwendung bei 17% der Frauen eine Amenorrhoe mit einer Dauer von mindestens drei Monaten.
Liste der Nebenwirkungen
In der nachfolgenden Tabelle werden die Häufigkeiten der Nebenwirkungen im Zusammenhang mit Mirena nach MedDRA SOCs aufgeführt. Die Häufigkeiten sind grobe Inzidenzen von Ereignissen, die im Rahmen klinischer Studien zu den Indikationen Kontrazeption und Hypermenorrhoe beobachtet wurden und 5.091 Frauen bzw. 12.101 Frauenjahre einschlossen.
|
Organsystem |
Sehr häufige Nebenwirkungen (> 1/10) |
Häufige Nebenwirkungen (> 1/100 bis < 1/10) |
Gelegentliche Nebenwirkungen (> 1/1.000 bis < 1/100) |
Seltene Nebenwirkungen (> 1/10.000 bis < 1/1.000) |
Nicht bekannt* |
|
Erkrankungen des Immunsystems |
Überempfindlichkeitsreaktionen einschließlich Hautausschlag, Urtikaria und |
|
Angioödem | |||||
|
Psychiatrische Erkrankungen |
Depressive Stimmung/ Depression | ||||
|
Erkrankungen des Nervensystems |
Kopfschmerzen |
Migräne | |||
|
Erkrankungen des Gastrointestinaltrak ts |
Bauch-schmerzen/ Schmerzen im Becken |
Übelkeit | |||
|
Erkrankungen der Haut und des Unterhautzellgewebes |
Akne, Hirsutismus |
Alopezie, Chloasma /Hyperpigmen -tierung der Haut | |||
|
Skelettmuskulatur-, Bindegewebs- und Knochen-erkankungen |
Rücken schmerzen | ||||
|
Erkrankungen der Geschlechtsorgane und der Brustdrüse |
Veränderung des Blutungsmusters einschließlich Hypermenorrhoe und Hypomenorrhoe , Schmier blutungen, Oligomenorrhoe und Amenorrhoe, Vulvovaginitis, Genitalausfluss |
Infektionen des oberen Genitaltraktes, Ovarialzy- sten, Dysmenor rhoe, Schmerzen in der Brust, Expulsion des Intrauterinpessars (vollständig und partiell ) |
Uterus perforation** | ||
|
Untersuchungen |
Erhöhter Blutdruck |
Der geeignetste MedDRA-Begriff wurde verwendet, um eine bestimmte Reaktion und ihre Synonyme und in Zusammenhang stehende Erkrankungen zu beschreiben.
* Häufigkeit auf Grundlage der verfügbaren Daten nicht abschätzbar
** Diese Häufigkeit basiert auf klinischen Studien, in denen stillende Frauen ausgeschlossen waren. In einer groß angelegten prospektiven vergleichenden nicht-interventionellen Kohortenstudie bei IUP-Anwenderinnen, war die Häufigkeit von Perforationen bei Frauen, die stillten oder bei denen eine Insertion bis zu 36 Wochen nach der Entbindung vorgenommen wurde, „gelegentlich“ (siehe Abschnitt 4.4).
Beschreibung ausgewählter Nebenwirkungen
Infektionen
Nach einer IUD-Insertion wurden Fälle von Sepsis (einschließlich einer Sepsis mit Streptokokken der Gruppe A) berichtet (siehe Abschnitt 4.4 „Besondere Warnhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Schwangerschaft, Wochenbett und perinatale Erkrankungen
Wenn eine Frau unter Anwendung von Mirena schwanger wird, ist die relative Wahrscheinlichkeit einer Extrauteringravidität erhöht.
Erkrankungen der Geschlechtsorgane und der Brustdrüse
Es wurde über Fälle von Brustkrebs berichtet (Häufigkeit nicht bekannt, siehe Abschnitt 4.4 „Besondere Wamhinweise und Vorsichtsmaßnahmen für die Anwendung“).
Verletzung, Vergiftung und durch Eingriffe bedingte Komplikationen
Die folgenden Nebenwirkungen sind in Verbindung mit der Insertion oder der Entfernung von Mirena beobachtet worden:
Schmerzen, Blutungen, vasovagale Reaktionen mit Schwindel oder Synkope während der Insertion. Bei Patientinnen mit Epilepsie kann ein Krampfanfall ausgelöst werden.
Möglicherweise sind die Rückholfäden für den Partner während des Geschlechtsverkehrs spürbar. Meldung des Verdachts auf Nebenwirkungen
Die Meldung des Verdachts auf Nebenwirkungen nach der Zulassung ist von großer Wichtigkeit. Sie ermöglicht eine kontinuierliche Überwachung des Nutzen-Risiko-Verhältnisses des Arzneimittels. Angehörige von Gesundheitsberufen sind aufgefordert, jeden Verdachtsfall einer Nebenwirkung dem Bundesinstitut für Arzneimittel und Medizinprodukte, Abt. Pharmakovigilanz, Kurt-Georg-Kiesinger-Allee 3, D-53175 Bonn, Website: http://www.bfarm.de anzuzeigen.
4.9 Überdosierung
Entfällt.
5. PHARMAKOLOGISCHE EIGENSCHAFTEN
5.1 Pharmakodynamische Eigenschaften
Pharmakotherapeutische Gruppe: Plastik-IUP mit Gestagen ATC-Code: G02BA03
Der kontrazeptive und therapeutische Effekt von Mirena beruht auf der lokalen intrauterinen Wirkung des Levonorgestrels.
Die hohen lokalen Levonorgestrelspiegel vermindern die Estrogen-Rezeptor-Synthese und Progesteron-Rezeptor-Synthese mit starkem antiproliferativen Effekt am Endometrium.
Morphologisch zeigt sich eine Dezidualisierung des Endometriums mit schwacher, partieller Fremdkörperreaktion.
Die Viskosität des Zervixschleims nimmt zu und erschwert die Passage der Spermien.
Unter Levonorgestrel-Einfluss verändert sich das utero-tubare Milieu und beeinträchtigt Motilität und Funktion der Spermien.
Die beiden letztgenannten Faktoren verhindern die Befruchtung der Eizelle. Bei einigen Frauen lässt sich zusätzlich eine Anovulation, bzw. eine beeinträchtigte Follikelreifung nachweisen.
Die kontrazeptive Wirkung von Mirena wurde in 5 großen klinischen Studien mit 3.330 Mirena-Anwenderinnen untersucht. Die Versagerrate (Pearl Index) lag bei ca. 0,2% im ersten Jahr und die kumulative Versagerrate nach 5 Jahren lag bei ca. 0,7%. Die Versagerrate enthält auch Schwangerschaften, die durch unentdeckte Expulsion oder Perforation aufgetreten sind. Eine ähnliche kontrazeptive Wirksamkeit wurde in einer großen Anwendungsbeobachtung mit mehr als 17.000 Mirena-Anwenderinnen beobachtet. Da man bei Mirena nicht an eine tägliche Einnahme denken muss, ist die Schwangerschaftsrate bei der typischen Anwendung identisch mit der Anwendung in kontrollierten klinischen Studien („perfekte Anwendung“).
Bei Frauen, die eine Hypermenorrhoe aufweisen, reduzierte sich der menstruelle Blutverlust nach dreimonatiger Anwendung um 62-94% und um 71-95% nach sechsmonatiger Anwendung. Im Vergleich zur Endometriumablation oder -resektion zeigte Mirena vergleichbare Wirksamkeit hinsichtlich der Verringerung des menstruellen Blutverlustes über eine Dauer von bis zu zwei Jahren. Die Verminderung des Blutverlustes führt zu einem Anstieg des Hämoglobingehaltes. Eine Hypermenorrhoe, die durch submuköse Myome verursacht wird, spricht weniger gut auf die Behandlung mit Mirena an.
5.2 Pharmakokinetische Eigenschaften
Mirena besteht aus einem T-Körper aus Polyethylen (32 mm lang, 32 mm breit), dessen vertikaler Arm zylindrisch von einer Mischung aus Polydimethylsiloxan und Levonorgestrel umhüllt und von einer äußeren Membran aus Polydimethylsiloxan umschlossen ist, welche die Freisetzung von Levonorgestrel reguliert.
Der Wirkstoff von Mirena ist Levonorgestrel. Levonorgestrel wird direkt in das Cavum uteri abgesondert. Die in-vivo-Freisetzungsrate von Levonorgestrel beträgt initial ca. 20 pg/24 h und verringert sich auf 10 pg/24 h nach 5 Jahren. Die Freisetzung direkt am Zielorgan ist Voraussetzung für die niedrige Dosierung und den damit verbundenen sehr geringen Übergang in die allgemeine Zirkulation.
Resorption
Nach dem Einsetzen von Mirena wird Levonorgestrel sofort in das Cavum uteri freigesetzt. Dies beruht auf Messungen der Serumkonzentrationen.
Verteilung
1 Stunde nach Einsetzen der Mirena ist Levonorgestrel im Serum nachweisbar. Die maximale Serumkonzentration wird innerhalb von 2 Wochen nach dem Einsetzen erreicht. Entsprechend der abnehmenden Freisetzungsrate sinkt die mittlere Serum-Levonorgestrel-Konzentration von 206 pg/ml (25ste bis 75ste Perzentile: 151 pg/ml - 264 pg/ml) nach 6 Monaten auf 194 pg/ml (146 pg/ml -266 pg/ml) nach 12 Monaten, und nach 60 Monaten werden im Mittel 131 pg/ml (113 pg/ml -161 pg/ml) bei Frauen im gebärfähigem Alter mit einem Gewicht über 55 kg bestimmt. Diese Spiegel sind niedriger als bei anderen etablierten Anwendungen von Levonorgestrel. Deshalb sind nur geringe Wirkungen auf den Stoffwechsel zu verzeichnen.
Körpergewicht und SHBG-Serumkonzentration beeinflussen die systemische Levonorgestrelkonzentration. Ein geringes Körpergewicht und/oder hohe SHBG-Konzentrationen führen zu einer Erhöhung der Levonorgestrelkonzentration. Bei Frauen im gebärfähigem Alter mit einem niedrigen Körpergewicht (37 bis 55 kg) liegt die mittlere Levonorgestrelkonzentration um das 1,5 fache höher.
Levonorgestrel ist unspezifisch an Serumalbumin und spezifisch an das sexualhormonbindende Globulin (SHBG) gebunden. Die relative Verteilung (frei, albumingebunden, SHBG-gebunden) hängt von der SHBG-Konzentration im Serum ab. Nur etwa 1-2% der gesamten Serum-ArzneimittelKonzentrationen liegen in Form von freien Steroiden vor, etwa 42% - 62% sind an SHBG gebunden. Während der Anwendung von Mirena sinkt die Konzentration an SHBG. Entsprechend sinkt der Anteil des gebundenen Levonorgestrels und der freie Anteil steigt.
Das durchschnittliche scheinbare Verteilungsvolumen von Levonorgestrel beträgt ca. 106 l. Metabolisierung
Levonorgestrel wird weitgehend metabolisiert. Die Hauptmetaboliten im Serum sind unkonjugierte und konjugierte Formen des 3a, 5ß-Tetrahydrolevonorgestrels. Basierend auf in-vitro- und in-vivo-Studien ist CYP3A4 das Hauptenzym der Metabolisierung von Levonorgestrel. CYP2E1, CYP2C19 und CYP2C9 sind zu einem geringeren Ausmaß am Stoffwechsel beteiligt.
Die metabolische Clearance von Levonorgestrel im Serum beträgt ungefähr 1,0 ml/min/kg. Levonorgestrel wird unverändert nur in Spuren ausgeschieden. Die Metaboliten werden mit den Faeces und Urin bei einem Exkretionsverhältnis von ungefähr 1 ausgeschieden. Die Halbwertszeit der Ausscheidung (hauptsächlich Metabolitenausscheidung) über Urin und Stuhl beträgt ungefähr 1 Tag.
Linearität / nicht-Linearität
Die Pharmakokinetik von Mirena hängt von der SHBG-Konzentration ab, die wiederum durch Estrogene und Androgene beeinflusst wird. Unter der Anwendung von Mirena wurde eine durchschnittliche SHBG-Abnahme von ca. 30% beobachtet, was zu einem Rückgang von Levonorgestrel im Serum führt. Dies deutet auf eine zeitbezogene nicht-lineare Pharmakokinetik von Levonorgestrel hin. Aufgrund der vorwiegend lokalen Wirkung ist kein Einfluss auf die Wirksamkeit von Mirena zu erwarten.
5.3 Präklinische Daten zur Sicherheit
a) Akute Toxizität
Die akute Toxizität von Gestagenen ist gering. Bei Ratten und Mäusen wurden nach oraler, subkutaner oder intraperitonealer Gabe von Levonorgestrel LD50-Werte > 4 g/kg bestimmt. Bei der Anwendung von Mirena ist nicht mit einer akuten LNG-Toxizität zu rechnen.
b) Chronische Toxizität
Nach oraler Gabe von Gestagenen wie Levonorgestrel wurden tierexperimentell - insbesondere bei Hunden - Erhöhungen des Blutzuckers, Verminderungen der Glukosetoleranz, Insulinresistenz bis hin zur Entwicklung eines Diabetes beschrieben. Ebenso wurden Verminderungen des Serumcholesterins und der Triglyzeride tierexperimentell mit Gestagenen und unabhängig vom Applikationsweg beobachtet.
c) Reproduktionstoxizität
Bei Ratten wurde nach sc-Verabreichung von 0,03 - 10 mg d,l-Norgestrel vom 15. oder 17. bis zum 20. Tag der Trächtigkeit eine dosisabhängige Verlängerung des Anogenitalabstandes weiblicher Feten beobachtet. Nach sc-Gabe an trächtige Ratten wurden ab 0,4 mg/kg Levonorgestrel Virilisierungserscheinungen weiblicher Rattenfeten berichtet. Die virilisierenden Eigenschaften von 19-Nortestosteronen wie Norgestrel und Norethisteron werden auf ihre androgene Teilwirkung zurückgeführt. Fälle von weiblichem Pseudohermaphroditismus wurden auch nach GestagenApplikation in der Schwangerschaft beim Menschen berichtet. Teratogene Effekte von Levonorgestrel sind auch an anderen Organsystemen nicht zu erwarten. Nach oraler Gabe von Levonorgestrel wurde eine erhöhte Fruchtresorption bei Ratten ab 25 mg/kg und bei Mäusen ab 0,1 mg/kg beobachtet, die Fertilität war ebenfalls eingeschränkt. Dosen bis 60 pg/kg hatten keinen Einfluss auf die Resorptionsrate, die Aufzucht, die Entwicklung und Fortpflanzungsfähigkeit der F1- und F2-Generation. Bei intrauteriner Freisetzung von Levonorgestrel bei Kaninchen wurde keinerlei embryotoxische Wirkung festgestellt. Levonorgestrel wird bei Frauen in geringen Mengen in die Muttermilch ausgeschieden.
d) Mutagenes und tumorerzeugendes Potential
Bisherige in-vivo- und in-vitro-Untersuchungen lassen keine relevanten mutagenen oder sonstigen genotoxischen Eigenschaften von Levonorgestrel erkennen. Vorliegende in-vivo- und in-vitro-Untersuchungen ergeben keine Hinweise auf relevante mutagene Eigenschaften von Mirena.
Nach oraler Gabe hoher Dosen von d,l-Norgestrel an Mäuse und Ratten wurden vereinzelt Leberkarzinome, Phäochromozytome, Inselzelladenome des Pankreas sowie Hypophysenadenome registriert. Basierend auf den konventionellen Studien zur Sicherheitspharmakologie, Toxizität bei wiederholter Gabe, Reproduktionstoxizität, Genotoxizität und zum kanzerogenen Potential lassen die präklinischen Daten keine besonderen Gefahren für den Menschen erkennen.
PHARMAZEUTISCHE ANGABEN
6.
6.1 Liste der sonstigen Bestandteile
Hormonreservoir aus Polydimethylsiloxan Elastomer, T-Körper aus Polyethylen mit Bariumsulfat (32 mm lang, 32 mm breit), Rückholfaden aus Polyethylen mit Eisenoxiden und -hydroxiden (E 172).
6.2 Inkompatibilitäten
Nicht zutreffend.
6.3 Dauer der Haltbarkeit
3 Jahre in der ungeöffneten Verpackung.
6.4 Besondere Vorsichtsmaßnahmen für die Aufbewahrung
Arzneimittel sind sorgsam und für Kinder unzugänglich aufzubewahren.
Sterile Mirena Verpackung im Umkarton aufbewahren, um den Inhalt vor Licht und Feuchtigkeit zu schützen.
6.5 Art und Inhalt des Behältnisses
Packung mit 1 Intrauterinpessar und 1 Applikator
Packung mit 5 Intrauterinpessaren und 5 Applikatoren
Das Produkt wird einzeln in eine Tiefziehpackung mit Siegelfolie verpackt.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
6.6 Besondere Vorsichtsmaßnahmen für die Beseitigung und sonstige Hinweise zur Handhabung
Mirena ist in einer sterilen Verpackung erhältlich, die erst kurz vor dem Einlegen geöffnet werden sollte. Mirena darf nicht resterilisiert werden. Mirena ist nur zum einmaligen Gebrauch bestimmt. Beim Umgang mit dem ausgepackten Produkt ist auf die Einhaltung aseptischer Bedingungen zu achten. Falls der Verschluss der sterilen Verpackung beschädigt ist, wird empfohlen, das IUP als medizinischen Abfall zu entsorgen. In gleicher Weise sollte ein entferntes IUP als medizinischer Abfall behandelt werden, da es hormonelles Restmaterial enthalten könnte. Es wird empfohlen, die Einlegevorrichtung als Krankenhausabfall zu behandeln. Der äußere Umkarton sowie die darin befindliche Blisterpackung können wie Haushaltsabfall beseitigt werden. Spezielle Hinweise mit Hinblick auf das Einlegen sind der Verpackung beigefügt.
Da sich das Einlegeverfahren von dem für andere Intrauterinpessare verwendeten unterscheidet, kommt einer Schulung zur fachgerechten Einlegetechnik besondere Bedeutung zu.
7. INHABER DER ZULASSUNG
Jenapharm GmbH & Co. KG Otto-Schott-Straße 15 07745 Jena
Telefon: (03641) 648888 Telefax: (03641) 648889
E-Mail-Adresse: frauengesundheit@jenapharm.de
8. ZULASSUNGSNUMMER(N)
30495.00. 00
41880.00. 00
9. DATUM DER ERTEILUNG DER ZULASSUNG/VERLÄNGERUNG DER ZULASSUNG
Datum der Erteilung der Zulassung: 30.09.1996 Datum der Verlängerung der Zulassung: 14.09.2009
Datum der Erteilung der Zulassung: 07.05.1998 Datum der Verlängerung der Zulassung: 26.06.2008
10. STAND DER INFORMATION
September 2015
11. VERKAUFSABGRENZUNG V erschreibungspflichtig.
Dieses Arzneimittel enthält einen Stoff, dessen Wirkungen bei intrauteriner Anwendung in der medizinischen Wissenschaft noch nicht allgemein bekannt sind.
19