Misodel 200 Mikrogramm Vaginales Wirkstofffreisetzungssystem
Gebrauchsinformation: Information für Anwender
MISODEL 200 Mikrogramm vaginales Wirkstofffreisetzungssystem
Misoprostol
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
1. Was ist MISODEL und wofür wird es angewendet?
2. Was sollten Sie vor der Anwendung von MISODEL beachten?
3. Wie wird MISODEL bei Ihnen angewendet?
4. Welche Nebenwirkungen sind möglich?
5. Wie ist MISODEL aufzubewahren?
6. Inhalt der Packung und weitere Informationen
1. Was ist MISODEL und wofür wird es angewendet?
MISODEL enthält den Wirkstoff Misoprostol.
MISODEL wird ab der 37. Schwangerschaftswoche zur Geburtseinleitung angewendet.
Misoprostol gehört zur Wirkstoffgruppe der Prostaglandine. Prostaglandine haben während der Geburt zwei Funktionen. Zum einen sorgen sie für einen weichen Muttermund, so dass die Geburt des Säuglings durch die Vagina erleichtert wird. Zum anderen lösen sie die Wehen aus, durch die der Säugling aus der Gebärmutter (Uterus) gepresst wird. Es könnte verschiedene Gründe geben, warum Sie Hilfe bei der Einleitung dieses Prozesses benötigen. Fragen Sie Ihren Arzt, wenn Sie mehr Informationen haben möchten.
2. Was sollten Sie vor der Anwendung von MISODEL beachten?
MISODEL darf nicht angewendet werden,
- wenn Sie allergisch gegen Misoprostol oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind,
- wenn die Wehen begonnen haben,
- wenn es Ihrem Kind nicht gut geht,
- wenn sie mit Oxytocin (Arzneimittel zur Unterstützung der Geburt) und/oder anderen Arzneimitteln zur Weheneinleitung behandelt werden (siehe unten: „Wamhinweise und Vorsichtsmaßnahmen“ und „Anwendung von MISODEL mit anderen Arzneimitteln“),
- wenn Sie bereits eine Operation an Gebärmutterhals (Zervix) oder Gebärmutter, einschließlich eines Kaiserschnitts, hatten,
- wenn Ihre Gebärmutter ungewöhnlich geformt ist (z.B. Uterus bicornis),
- wenn Ihr Mutterkuchen (Plazenta) den Geburtskanal blockiert (Placenta praevia), oder wenn Sie Vaginalblutungen ungeklärter Ursache ab der 25. Schwangerschaftswoche hatten,
- wenn Ihr Kind in der Gebärmutter falsch liegt, so dass eine natürliche Geburt nicht möglich ist (fetale Lageanomalie),
- wenn Sie Warnzeichen und Symptome für eine Infektion der Fruchthöhle, Plazenta, Eihäute (Chorioamnionitis) haben, außer wenn eine Behandlung bereits durchgeführt wurde,
- wenn Sie weniger als 36 Wochen schwanger sind.
Warnhinweise und Vorsichtsmaßnahmen
MISODEL sollte nur unter Aufsicht eines Spezialisten angewendet werden.
Ihr Arzt oder das medizinische Fachpersonal wird Ihre Gebärmutteraktivität, den Zustand Ihres Kindes und Veränderungen am Gebärmutterhals (Zervix) sorgfältig überwachen, nachdem MISODEL eingesetzt wurde.
MISODEL kann eine starke Stimulation der Gebärmutter verursachen, wenn es nach Einsetzen der Wehen nicht entfernt wird (siehe unten: „Wenn Sie eine größere Menge von MISODEL angewendet haben, als Sie sollten“).
Falls Ihre Wehen langanhaltend oder stark sind oder Ihr Arzt oder das medizinische Fachpersonal Sorge um Sie oder Ihr Kind hat, wird MISODEL entfernt. Wenn die Wehen nach der Entfernung von MISODEL anhalten, kann eine wehenhemmende Behandlung begonnen werden, die Ihre Wehen verlangsamen wird.
Die Wirkung von MISODEL wurde bei Frauen mit schwerer Präeklampsie nicht untersucht. Präeklampsie zeigt sich durch Bluthochdruck, Proteine im Urin und andere mögliche Komplikationen bei Schwangeren.
MISODEL wurde bei Frauen, deren Fruchtblase früher als 48 Stunden vor dem Einfuhren von MISODEL geplatzt ist, nicht untersucht. Bitte sprechen Sie mit Ihrem Arzt, wenn Sie der Meinung sind, dass Ihre Fruchtblase geplatzt ist (vorzeitiger Blasensprung).
Wenn Sie eine Infektion (B-Streptokokken) haben, die eine vorbeugende Behandlung mit Antibiotika erforderlich macht, sollten Sie diese entweder zeitgleich mit MISODEL oder vorher verabreicht bekommen, so dass Sie und Ihr Kind vor der Geburt behandelt werden. Wenn Sie wissen, dass Sie an einer Infektion leiden, sprechen Sie bitte mit Ihrem Arzt oder dem medizinischen Fachpersonal.
Wenn Ihr Arzt eine Behandlung mit Oxytocin (Wirkstoff zur Unterstützung der Geburt) beginnen möchte, muss MISODEL mindestens 30 Minuten vor der Verabreichung von Oxytocin vom Arzt oder dem medizinischen Fachpersonal entfernt werden (siehe oben: „MISODEL darf nicht angewendet werden...“ und siehe unten: „Anwendung von MISODEL zusammen mit anderen Arzneimitteln).
Eine zweite MISODEL-Dosis wird nicht empfohlen, da die Wirkung einer zweiten Dosis nicht untersucht wurde.
Unabhängig von der Methode wurde bei Frauen, deren Wehen eingeleitet wurden, ein erhöhtes Risiko für schwere Blutungen (disseminierte intravasale Gerinnung) nach der Geburt beschrieben.
Bei Frauen die mit mehr als einem Kind schwanger sind, gibt es keine Erfahrungen zur Anwendung von MISODEL zur Einleitung des Geburtsvorgangs. Es gibt keine Erfahrungen bei Frauen die mehr als 3 Kinder vaginal ab der 25. Schwangerschaftswoche geboren haben.
MISODEL wird nur aus medizinischen Gründen zur Einleitung des Geburtsvorgangs angewendet.
Anwendung von MISODEL zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder das medizinische Fachpersonal wenn Sie andere Arzneimittel einnehmen/anwenden, kürzlich andere Arzneimittel eingenommen/angewendet haben oder beabsichtigen andere Arzneimittel einzunehmen/anzuwenden. Einige andere Arzneimittel können die Wirkung von MISODEL beeinflussen.
MISODEL darf nicht gleichzeitig mit Oxytocin (Wirkstoff zur Unterstützung der Geburt) und/oder anderen Arzneimitteln zur Weheneinleitung angewendet werden (siehe oben: „MISODEL darf nicht angewendet werden“ und „Warnhinweise und Vorsichtsmaßnahmen“).
Schwangerschaft und Stillzeit
MISODEL wird zur Weheneinleitung ab der 37. Schwangerschaftswoche angewendet. MISODEL sollte in anderen Phasen der Schwangerschaft nicht angewendet werden.
Misoprostolsäure kann in das Kolostrum (Flüssigkeit, die in den ersten 3-4 Tagen nach der Geburt in den Brüsten gebildet wird) und die Muttermilch übergehen. Es wird angenommen, dass nur sehr geringe Mengen Misoprostolsäure für kurze Zeit in das Kolostrum und die Muttermilch übergehen. Deshalb sollte das Stillen nicht ausgeschlossen sein.
Gebärfähigkeit
Die Gebärfähigkeit wird bei der Anwendung von MISODEL zur Einleitung des Geburtsvorgangs ab der 37. Schwangerschaftswoche nicht beeinflusst.
MISODEL enthält Butylhydroxyanisol
MISODEL enthält Butylhydroxyanisol, das als Antioxidans dazu dient, das Arzneimittel zu konservieren. Es ist nur in Spuren enthalten. Butylhydroxyanisol kann örtlich begrenzt Hautreizungen (z.B. Kontaktdermatitis), Reizungen der Augen und Schleimhäute hervorrufen.
3. Wie wird MISODEL bei Ihnen angewendet?
Die empfohlene Dosis beträgt ein MISODEL vaginales Wirkstofffreisetzungssystem, das
200 Mikrogramm Misoprostol enthält. Der Wirkstoff Misoprostol wird mit einer mittleren Rate von
ca. 7 Mikrogramm pro Stunde über einen Zeitraum von 24 Stunden freigesetzt.
Ihr Arzt oder das medizinische Fachpersonal wird MISODEL in der Nähe Ihres Gebärmutterhalses (Zervix) in Ihre Vagina einführen. Sie werden dies nicht selbst tun. Vor dem Einführen kann Ihr Arzt oder das medizinische Fachpersonal eine kleine Menge Gleitgel auf MISODEL geben. MISODEL kann bei Bedarf einfach vom Arzt oder dem medizinischen Fachpersonal entfernt werden.
Sie werden während des Einführens liegen und anschließend weitere 30 Minuten liegenbleiben.
Nach dem Einführen in die Vagina nimmt MISODEL Feuchtigkeit auf und setzt langsam Misoprostol frei.
Achten Sie beim Gang zur Toilette darauf, dass MISODEL nicht versehentlich entfernt wird. Informieren Sie Ihren Arzt oder das medizinische Fachpersonal, falls MISODEL herausfällt.
Der Arzt oder das medizinische Fachpersonal werden abhängig vom Verlauf Ihrer Behandlung entscheiden, wie lange MISODEL eingeführt bleiben soll. MISODEL kann bis zu 24 Stunden eingeführt bleiben.
Ihr Arzt oder das medizinische Fachpersonal wird MISODEL entfernen,
- wenn die Wehen einsetzen,
- wenn Ihre Wehen zu stark oder übermäßig lang sind,
- wenn es Ihrem Kind nicht gut geht,
- wenn 24 Stunden nach dem Einführen vergangen sind.
Falls MISODEL herausfällt, wird es nicht wieder eingeführt.
Nach Entfernen aus der Vagina hat MISODEL das 2-3fache seiner ursprünglichen Größe und ist formbar.
Anwendung bei Kindern und Jugendlichen
MISODEL wurde bei Schwangeren unter 18 Jahren nicht untersucht.
Wenn Sie eine größere Menge von MISODEL angewendet haben, als Sie sollten
Wenn MISODEL nach Einsetzen aktiver Wehentätigkeit in der Vagina verbleibt, kann dies starke Wehen zur Folge haben oder dazu führen, dass es Ihrem Kind nicht gut geht. MISODEL wird dann sofort von Ihrem Arzt oder dem medizinischen Fachpersonal entfernt.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Häufig: betrifft 1 bis 10 Behandelte von 100:
• Veränderung der Zahl der Herzschläge pro Minute des ungeborenen Kindes während der Wehen (Veränderung der fetalen Herzfrequenz), die Anlass zu Bedenken geben kann
• Wehen in kurzen Abständen mit Einfluss auf die Zahl der Herzschläge pro Minute des ungeborenen Kindes (abnorme Wehentätigkeit mit Auswirkungen auf den Fetus), die Anlass zu Bedenken geben können
• das Kind setzt innerhalb der Gebärmutter Stuhlgang ab (Mekonium im Fruchtwasser), was Anlass zu Bedenken geben kann
• zu häufiges Zusammenziehen der Gebärmutter (abnorme Uteruskontraktionen), was Anlass zu Bedenken geben kann.
Gelegentlich: betrifft 1 bis 10 Behandelte von 1.000:
• Auswirkungen auf das Gehirn des Kindes durch Sauerstoffmangel (hypoxisch-ischämische Enzephalopathie)
• der Säugling hat kurz nach der Geburt Atembeschwerden (respiratorische Depression des Neugeborenen; Atemnotsyndrom des Neugeborenen; vorübergehende Tachypnoe des Neugeborenen)
• Übelkeit
• Erbrechen
• Hautausschlag
• unvorhergesehene vaginale Blutungen vor der Geburt (antepartale Blutungen)
• erhöhte Säurewerte im Blut des Kindes (fetale Azidose)
• starke vaginale Blutungen nach der Geburt (postpartale Blutung)
• die Plazenta löst sich vor der Geburt des Kindes von der Gebärmutterwand ab (vorzeitige Plazentaablösung)
• Wehen, die zu lange andauern und Anlass zu Bedenken geben können (uterine Hypertonie)
• Jucken im Genitalbereich (Genitalpruritus)
• reduzierter Allgemeinzustand des Neugeborenen während der Geburt (niedriger Apgar)
• erhöhter Blutdruck
• Reißen des Uterus (Uterusruptur)
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt dem
Bundesinstitut für Arzneimittel und Medizinprodukte Abt. Pharmakovigilanz Kurt-Georg-Kiesinger-Allee 3 D-53175 Bonn Website: www.bfarm.de
anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist MISODEL aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Im Gefrierschrank lagern (-10 °C bis -25 °C). Auftauen vor der Anwendung ist nicht erforderlich.
Sie dürfen dieses Arzneimittel nach dem auf dem Aluminiumbeutel und auf der Faltschachtel angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Ihr Arzt oder das medizinische Fachpersonal sollte Arzneimittel, die Sie nicht mehr verwenden, entsorgen. Diese Maßnahme hilft die Umwelt zu schützen.
6. Inhalt der Packung und weitere Informationen Was MISODEL enthält
- Der Wirkstoff ist Misoprostol.
Jedes vaginale Wirkstofffreisetzungssystem enthält 200 Mikrogramm Misoprostol, das mit einer mittleren Rate von ca. 7 Mikrogramm pro Stunde über 24 Stunden freigesetzt wird.
- Die sonstigen Bestandteile sind:
Quervernetztes Hydrogelpolymer (bestehend aus Macrogol 8000, Hexan- 1,2,6-triol und 4,4'-Methylendicyclohexyldiisocyanat), Butylhydroxyanisol (Ph.Eur.), Polyester-Rückholsystem (gewirktes Polyester-Garn).
Wie MISODEL aussieht und Inhalt der Packung
MISODEL enthält ein Reservoir mit 200 Mikrogramm Misoprostol. MISODEL ist ein rechteckiges Kunststoffteil, das sich in einem Gewebebeutel mit Rückholvorrichtung befindet. Der Kunststoff besteht aus einem Hydrogelpolymer, das in Gegenwart von Feuchtigkeit aufquillt und aus dem Misoprostol kontrolliert freigesetzt wird. Die Rückholvorrichtung hat ein langes Band, mit dem der Arzt oder das medizinische Fachpersonal MISODEL bei Bedarf entfernen kann.
1x200 Mikrogramm vaginales Wirkstofffreisetzungssystem 5x200 Mikrogramm vaginales Wirkstofffreisetzungssystem 5x200 Mikrogramm vaginales Wirkstofffreisetzungssystem (Multipack).
Jedes vaginale Wirkstofffreisetzungssystem ist einzeln in einem Beutel aus Trockenmitttel enthaltender Aluminium-Verbundfolie versiegelt und in einem Karton verpackt.
Pharmazeutischer Unternehmer
FERRING Arzneimittel GmbH Fabrikstraße 7 D-24103 Kiel Tel.: 0431/58 52 - 0 Fax.: 0431/58 52 - 74
Hersteller
Ferring Controlled Therapeutics Limited
1 Redwood Place
Peel Park Campus
East Kilbride, G74 5PB
Schottland
Dieses Arzneimittel ist in den Mitgliedstaaten des Europäischen Wirtschaftsraumes (EWR) unter den folgenden Bezeichnungen zugelassen:
Bulgarien, Dänemark, Deutschland, Finnland, Frankreich, Griechenland, Island, Lettland, Litauen, Niederlande, Norwegen, Österreich, Polen, Portugal, Rumänien, Schweden, Slowakei, Spanien, Tschechische Republik, Ungarn, Zypern: Misodel
Belgien, Estland, Irland, Italien, Luxemburg, Malta, Vereinigtes Königreich: Mysodelle Diese Packungsbeilage wurde zuletzt im Januar 2014 genehmigt.
MISODEL, FERRING und das FERRING-Logo sind Warenzeichen von Ferring B.V. © 2014 Ferring B.V.
Die folgenden Informationen sind für medizinisches Fachpersonal bestimmt:
MISODEL ist einzeln in Aluminiumbeuteln verpackt. Auf einer Seite des Aluminiumbeutels befindet sich eine Markierung zum Aufreißen der Verpackung. Öffnen Sie die Verpackung an der Markierung entlang der Oberseite des Beutels. Verwenden Sie dafür keine Schere oder andere scharfe Gegenstände, die die Rückholvorrichtung beschädigen könnten.
MISODEL wird tief in das hintere Scheidengewölbe eingeführt (Abb. a). Um sicherzustellen, dass MISODEL in situ verbleibt, sollte es um 90o gedreht werden, damit es quer im hinteren Scheidengewölbe liegt (Abb. b). Gegebenenfalls kann ein wasserlösliches Gleitmittel verwendet werden, um das Einführen zu erleichtern.
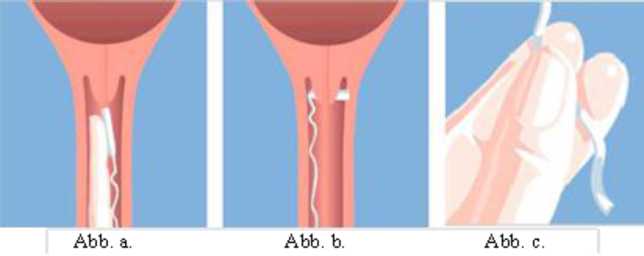
Nachdem das vaginale Wirkstofffreisetzungssystem eingeführt wurde, kann das Rückholband mit einer Schere soweit gekürzt werden, dass außerhalb der Vagina genügend Band zur Entfernung verbleibt.
Nach dem Einführen sollte die Patientin 30 Minuten liegen, danach darf sie aufstehen. Es ist darauf zu achten, dass MISODEL nicht versehentlich beim Gang zur Toilette oder bei den vaginalen Untersuchungen entfernt wird. MISODEL wird durch vorsichtiges Ziehen am Band der Rückholvorrichtung entfernt (Abb. c).
Das vaginale Wirkstofffreisetzungssystem sollte NIEMALS aus der Rückholvorrichtung genommen werden.
Nach dem Einführen quillt MISODEL auf das 2-3fache seiner ursprünglichen Größe auf und wird formbar. Bei der Entfernung ist darauf zu achten, dass das vollständige Produkt (Insert und Rückholvorrichtung) aus der Vagina entfernt wird.
Seite 7 von 7